El uso de tratamiento de superficie por plasma de vacío para mejorar la curación y regeneración ósea en la preservación de alvéolos y GBR: una serie de casos con análisis histológico
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Propósito: Evaluar los resultados clínicos e histológicos de pacientes que reciben coronas soportadas por implantes después del tratamiento de superficie con plasma al vacío (VPST) de biomateriales utilizados en la preservación de alvéolos (SP) y regeneración ósea guiada (GBR).
Materiales y métodos: Este estudio fue diseñado como una serie de casos. Se inscribieron pacientes que necesitaban extracción dental y preservación de alvéolos o regeneración ósea guiada. La técnica de preservación de alvéolos se realizó después de la extracción dental utilizando un injerto óseo de colágeno heterólogo y una xenomatriz de colágeno, ambos activados con plasma al vacío. Mientras tanto, se realizó una augmentación horizontal de cresta en dos etapas utilizando una malla de titanio personalizada y una mezcla de injertos óseos autólogos (no tratados) y heterólogos (tratados), junto con una membrana de colágeno tratada. Se utilizó ACTILINK Reborn con Universal Vortex Holder (Plasmapp Co., Ltd., Daejeon, República de Corea) para tratar todos los biomateriales. Las medidas de resultado fueron fallos de implantes y prótesis, complicaciones y examen histológico. Se recolectaron muestras de tejidos blandos y duros en el momento de la colocación del implante solo en pacientes tratados con SP.
Resultados: Un total de seis pacientes fueron tratados: tres con preservación del alvéolo y colocación de implantes retrasada, y tres con GBR escalonada. Ningún implante o prótesis falló. Una malla de titanio personalizada se rompió después del tratamiento con plasma, requiriendo reemplazo con una membrana de pericardio. No ocurrieron otras complicaciones. El análisis histológico a los tres meses post-cirugía reveló hueso recién formado bien vascularizado en diferentes etapas de maduración con partículas de injerto óseo integradas, mientras que el tejido blando parecía estar estructurado fisiológicamente.
Conclusión: VPST puede mejorar la hidrofobicidad de los biomateriales, apoyando resultados de curación favorables en SP y GBR. Se necesitan más ensayos controlados aleatorios con cálculos de tamaño de muestra apropiados para confirmar estos resultados preliminares.
Introducción
La implantología oral es reconocida como una metodología clínica segura y efectiva capaz de garantizar el éxito a largo plazo en la rehabilitación oral. Los orígenes de este campo médico se remontan a principios de la década de 1950, cuando el Dr. Per-Ingvar Brånemark, un cirujano ortopédico sueco, hizo descubrimientos innovadores mientras realizaba experimentos ortopédicos en patas de conejo. Desde entonces, el campo ha evolucionado rápidamente, impulsado por avances en biomateriales y técnicas quirúrgicas, lo que ha llevado a mejores resultados y mayor satisfacción del paciente.
Actualmente, un implante se considera osteointegrado cuando no hay movimiento relativo progresivo entre el implante y el hueso circundante, lo que indica contacto directo y estabilidad. La estabilidad primaria está influenciada en gran medida por el entrelazamiento mecánico entre la superficie del implante y el hueso del huésped, que depende de factores como la densidad ósea, el diseño del implante y la técnica quirúrgica.
Lograr y mantener la osteointegración a largo plazo es complejo y puede verse afectado por varios factores biológicos y mecánicos. Estos incluyen la salud sistémica del paciente, la calidad ósea local, las condiciones de carga del implante y las características de la superficie del implante. Estudios recientes sugieren que modificar las superficies de los implantes para mejorar su compatibilidad biológica puede mejorar significativamente los resultados de la osteointegración. Se han investigado e implementado numerosos métodos de tratamiento de superficies para mejorar las características biológicas de la superficie de los implantes, apoyando el proceso de osteointegración tanto para el éxito a corto como a largo plazo. Entre estos, la rugosidad de la superficie y la hidrofobicidad son particularmente significativas para lograr un alto contacto hueso-implante (BIC). Estas características de la superficie están diseñadas para proporcionar mejor estabilidad durante el proceso de curación y permitir una carga más rápida del implante al acelerar el mecanismo de osteointegración y promover una formación ósea más fuerte y rápida.
Para mejorar la osteoconductividad y osteoinductividad de los biomateriales para la regeneración ósea, se ha demostrado que la modificación de su superficie promueve la adhesión celular, la proliferación y la formación de nuevo hueso. Estos tratamientos incluyen modificaciones aditivas como recubrimientos o modificaciones sustractivas que incluyen grabado, chorro de arena y otros. Entre los diversos tratamientos de biomateriales destinados a mejorar la oseointegración, el tratamiento con plasma ha demostrado mejoras significativas en la adhesión celular al modificar la rugosidad de la superficie y la humectabilidad. La activación por plasma modifica la superficie al incorporar grupos funcionales, aumentar la energía superficial y mejorar la hidrofobicidad. Esto conduce a una reducción en el ángulo de contacto entre los fluidos biológicos y la superficie del implante, facilitando la difusión de células osteoblásticas sin dejar residuos después del tratamiento. Además, el tratamiento con plasma induce cambios en las propiedades fisicoquímicas, incluyendo la energía libre de la superficie, el contenido de hidrocarburos y la presencia de grupos hidroxilo funcionales. Los avances recientes en la tecnología de plasma han permitido el desarrollo de sistemas de plasma de baja presión capaces de tratar de manera uniforme geometrías de implantes complejas. Estos sistemas ofrecen un control preciso sobre los parámetros de tratamiento, como potencia, composición de gas y tiempo de exposición, permitiendo modificaciones de superficie personalizadas para mejorar la biocompatibilidad. Sin embargo, a pesar de los prometedores resultados in vitro, la evidencia clínica sobre los biomateriales tratados con plasma sigue siendo limitada, necesitando una investigación adicional. A pesar de los resultados prometedores de los estudios in vitro, la evidencia clínica sobre la efectividad de los biomateriales tratados con plasma sigue siendo limitada, lo que requiere una investigación adicional.
El objetivo de esta auditoría clínica es evaluar los resultados clínicos e histológicos de los pacientes que reciben coronas soportadas por implantes después de la VPST de biomateriales utilizados en la preservación del alvéolo (SP) y la regeneración ósea guiada (GBR). Los hallazgos de esta investigación están destinados a informar y potencialmente refinar los protocolos clínicos existentes, contribuyendo a un enfoque más preciso y predecible en la rehabilitación oral. Como tal, esta auditoría clínica puede servir como un estudio de prueba de concepto.
Materiales y Métodos
Este estudio fue diseñado como un estudio de serie de casos de fase IV, con materiales y dispositivos aprobados por la CE utilizados como parte de la práctica profesional habitual y sin riesgos adicionales. Todos los casos se realizaron en una clínica privada en Roma, Italia, y los datos fueron evaluados en el Departamento de Medicina, Cirugía y Farmacia, Universidad de Sassari, Italia. El estudio se adhirió a los principios de la Declaración de Helsinki de 2013 y a los principios de Buena Práctica Médica. Los datos médicos fueron anonimizados para que los pacientes no pudieran ser identificados, y se obtuvo la exención del comité de ética para el consentimiento de una serie de casos (Número de informe 41/1.6; emitido el 21 de mayo de 2025).
Los pacientes que necesitaban una extracción dental atraumática de un diente irremediable y un procedimiento de preservación del alvéolo, así como los pacientes que necesitaban un procedimiento de regeneración ósea guiada antes de la colocación de implantes, fueron incluidos en esta investigación.
Criterios de inclusión:
- Pacientes con al menos un diente irremediable en la mandíbula o maxilar, con alvéolo post-extracción intacto, capaces de entender y proporcionar consentimiento informado, fueron considerados elegibles para la inclusión en la preservación del alvéolo; o cualquier paciente que requiriera una restauración soportada por un solo implante y regeneración ósea guiada horizontal en etapas (defecto de clase IV según Cawed y Howell) en ambas, la mandíbula o el maxilar. Un diente irremediable se definió como un diente con daño estructural, periodontal o endodóntico severo que no podía ser tratado o mantenido de manera predecible y se recomendó su extracción. Los criterios comunes para clasificar un diente como irremediable incluyen: enfermedad periodontal severa con pérdida ósea ≥75%, movilidad (Grado III), o involucramiento de furcación de clase III; caries extensas o fracturas que hacen que el diente no sea restaurable; tratamiento endodóntico fallido con infección persistente; y trauma que conduce a raíces no viables o desplazamiento severo.
- Edad de 18 años o más y capaz de proporcionar consentimiento informado.
- Los fumadores se clasificaron como: (1) no fumadores; (2) fumadores moderados (fumando hasta 10 cigarrillos/día); y (3) fumadores empedernidos (fumando más de 11 cigarrillos/día). Los fumadores empedernidos fueron excluidos, solo se incluyeron las categorías 1 y 2 en este estudio.
- El biotipo se clasificó como: delgado (≤1 mm), medio (>1–<2 mm), o grueso (≥2 mm). Criterios de exclusión:
- Contraindicaciones generales para la cirugía de implantes.
- Pacientes irradiados en el área de cabeza y cuello.
- Pacientes inmunosuprimidos o inmunocomprometidos.
- Pacientes tratados o en tratamiento con amino-bisfosfonatos intravenosos.
- Pacientes con periodontitis no tratada.
- Pacientes con mala higiene oral y motivación.
- Diabetes no controlada.
- Fumadores empedernidos (más de 11 cigarrillos/día).
- Embarazo o lactancia.
- Abusadores de sustancias.
- Problemas psiquiátricos o expectativas poco realistas.
- Falta de dentición antagonista ocluyendo en el área destinada para la colocación del implante.
- Pacientes con infección y/o inflamación en el área destinada para la colocación del implante.
- Pacientes que participan en otros estudios si el presente protocolo no puede ser seguido adecuadamente.
- Pacientes referidos solo para la colocación de implantes y que no pueden ser seguidos en el centro de tratamiento.
- Pacientes incapaces de ser seguidos durante 5 años.
2.1. Procedimiento de Conservación del Alvéolo
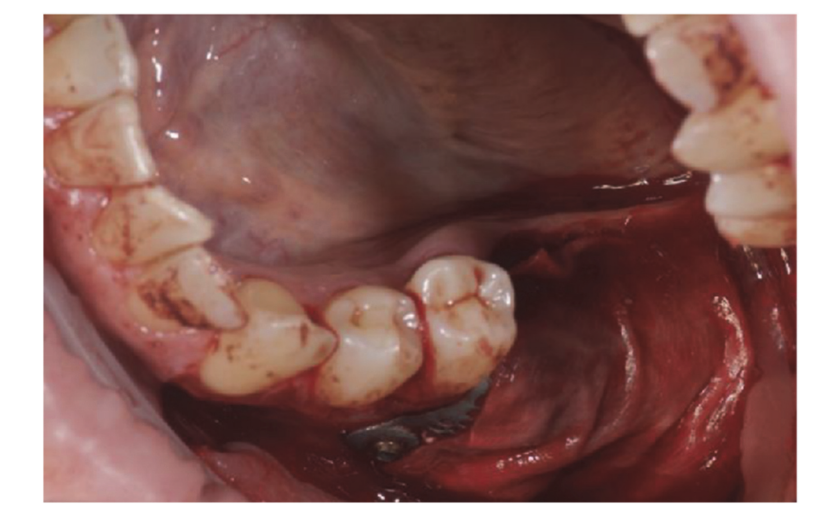
Los pacientes que cumplieron con los criterios de inclusión/exclusión (Figura 1) fueron examinados clínicamente de manera exhaustiva para la evaluación de caries dentales y salud periodontal. Antes del procedimiento de conservación del alvéolo, los pacientes se sometieron a una tomografía computarizada CBCT preoperatoria para cuantificar el volumen óseo. Una vez confirmada la elegibilidad y obtenido el consentimiento informado, se realizó un examen oral completo para evaluar la salud bucal general e identificar cualquier patología que requiriera tratamiento antes de la conservación del alvéolo y la rehabilitación con implantes. Aproximadamente 10 días antes de la conservación del alvéolo y la colocación del implante, todos los pacientes recibieron higiene oral profesional, incluyendo desbridamiento, según fuera necesario. La administración de antibióticos profilácticos incluyó 2 g de amoxicilina una hora antes de la cirugía, o 600 mg de clindamicina en casos de alergia a la penicilina. Los pacientes también enjuagaron con enjuague bucal de clorhexidina al 0.2% durante un minuto antes de cualquier procedimiento quirúrgico. Todas las intervenciones quirúrgicas se realizaron bajo anestesia local con articaína y adrenalina (1:100,000). La sedación intravenosa fue opcional. Se realizó una extracción dental atraumática sin elevación de colgajo, seguida de curetaje del alvéolo, evaluación de la integridad alveolar y conservación del alvéolo (Figura 2). Los alvéolos post-extracción se llenaron con un sustituto óseo heterólogo utilizando gránulos de hueso equino natural (Bioactiva, Arcugnano, Italia) y se cubrieron con XC Collagen Xenomatrix (Bioteck S.p.A, Vicenza, Italia). El tratamiento de superficie con plasma al vacío se realizó utilizando la máquina ACTILINK reborn (Activelink reborn, Plasmapp Co., Ltd., Daejeon, República de Corea) con un soporte personalizado (Figura 3), de acuerdo con un protocolo publicado. El tiempo de ciclo del tratamiento de superficie con plasma al vacío, denominado modo Vortex Plasma, fue de 30 s.
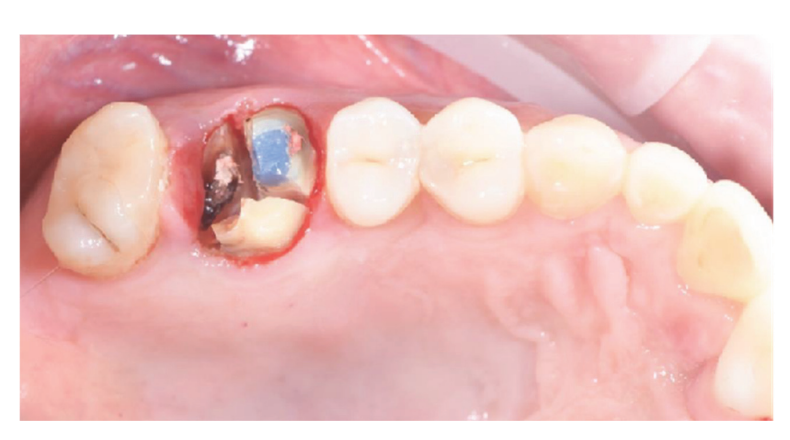

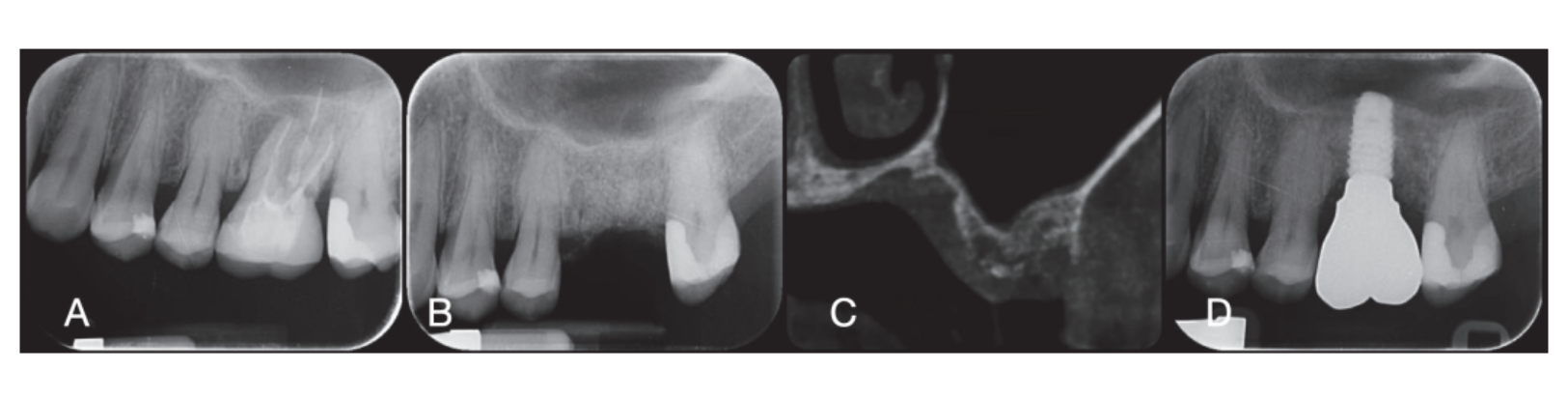
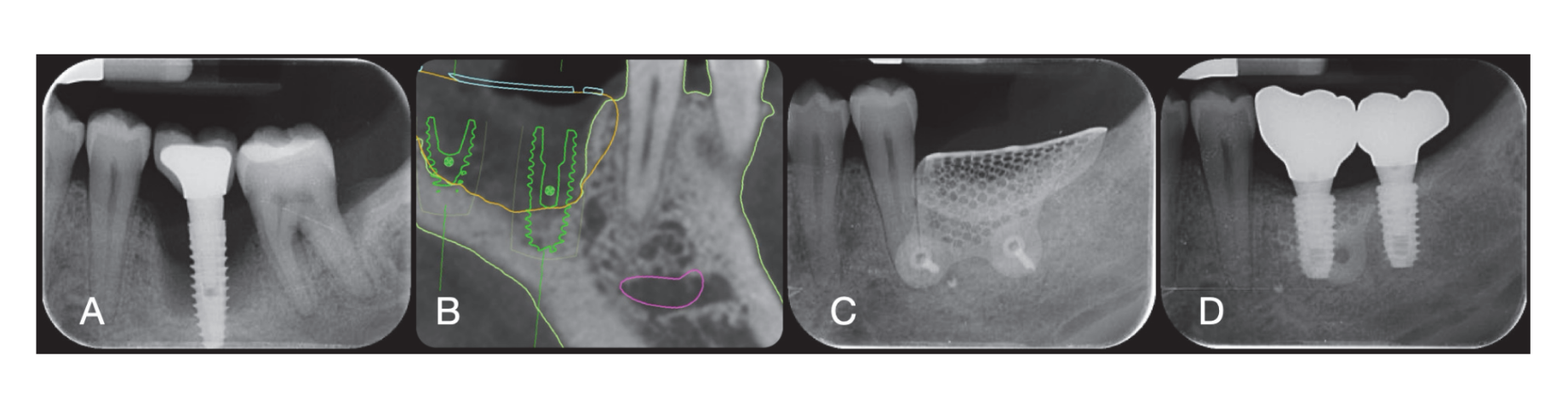
Los sitios quirúrgicos fueron cerrados con suturas simples de Vicryl 4.0 (Revello S.p.A, Verona, Italia) (Figura 4). Después de un período de curación de tres meses, se realizó la colocación del implante (Osstem Implant, Seúl, República de Corea) de acuerdo con las instrucciones del fabricante. Se recolectaron muestras de tejido histológico inmediatamente antes de la preparación del sitio del implante (ver Secciones 2.3 y 2.4). Los sitios del implante se prepararon a mano alzada, sin una plantilla quirúrgica, utilizando brocas de diámetro creciente. La calidad del hueso se categorizó subjetivamente como dura, media o blanda. El par motor se ajustó a 35 Ncm durante la inserción del implante. Los implantes se colocaron 1.5 mm por debajo del hueso bucal intacto, y se adoptó un protocolo de carga inmediata con un torque de inserción mínimo de 35 Ncm. Se prescribió tratamiento analgésico postquirúrgico con ibuprofeno 600 mg según fuera necesario. Todos los pacientes fueron estrictamente monitoreados para evaluar la curación completa. Tres a cuatro meses después de la carga inmediata, se tomaron impresiones definitivas, y dentro de un mes, se entregó una corona metálica libre, soportada por implantes y retenida por tornillo. Se obtuvieron radiografías periapicales en el momento de la colocación del implante (Figura 5).
2.2. Instrucciones Postquirúrgicas y Fase Protésica Después de la Conservación del Alvéolo
Se recomendó una dieta blanda durante 30 días en el caso de carga inmediata. Se prescribió ibuprofeno (400 mg) para tomar 2–4 veces al día durante las comidas, pero se instruyó a los pacientes que no lo tomaran en ausencia de dolor (en casos de alergia o problemas estomacales, se prescribió 1 g de paracetamol en su lugar). Además, se recomendó enjuague bucal de clorhexidina al 0.2% durante 1 min dos veces al día durante 14 días. No se permitió a los pacientes usar ninguna prótesis removible que pudiera haber cargado los implantes del estudio. Se retiraron los puntos de sutura después de 7 a 10 días, y se entregaron instrucciones de higiene oral.
En el momento de la inserción del implante, se entregaron restauraciones temporales de carga inmediata. Después de la oseointegración (8 semanas), las restauraciones temporales se modificaron de acuerdo con el manejo de los tejidos blandos. Después de 3 a 4 meses, se tomó una impresión definitiva, digital o analógica. Las restauraciones definitivas se entregaron dentro de un mes después de haber probado la estabilidad de los implantes individuales. La superficie oclusal estaba en ligero contacto con la dentición opuesta. Se tomaron radiografías periapicales y fotografías clínicas de los implantes del estudio (Figura 5). Si los niveles de hueso marginal peri-implantario no eran legibles, se tomó una nueva radiografía y se entregaron instrucciones de higiene oral.
2.3. Recuperación de Biopsia
Después de tres meses, se realizó la colocación del implante (Osstem Implant, Seúl, República de Corea) de acuerdo con las instrucciones del fabricante. Durante la preparación del sitio del implante, se obtuvieron biopsias de tejidos blandos y duros utilizando un mucotomo de 5 mm (diámetro exterior) para tejido blando y un taladro trepanador de 3.0 mm (diámetro exterior) para muestras óseas. Las muestras de tejido duro se fijaron en formalina tamponada neutra al 10% y los tejidos blandos en formalina tamponada neutra al 4% para examen histológico.
2.4. Procesamiento de Muestras y Análisis Histológico
Las muestras de tejido duro se deshidrataron utilizando una serie ascendente de etanol. Tras la deshidratación, las muestras se infiltraron con resina metacrilática y posteriormente se embebieron. Los bloques se cortaron utilizando una cuchilla de diamante y se redujeron a un grosor de aproximadamente 100 µm. Las secciones se montaron en portaobjetos de plástico, se pegaron y se tiñeron con Azul de Toluidina y Pironina Amarilla.
Las muestras de tejido blando fijadas en formalina fueron incrustadas en parafina. Se obtuvieron cortes histológicos y se tiñeron con Hematoxilina y Eosina, tricrómico de Mallory y Rojo Sirius. Los cortes fueron examinados cualitativamente bajo un microscopio óptico de campo claro (Nikon Eclipse 80i, Nikon, Tokio, Japón) y un escáner de alta resolución a diferentes aumentos (Hamamatzu NanoZoomer Series S60, Hamamatzu Photonics, Hamamatsu, Japón). Además, las muestras teñidas con Rojo Sirius fueron observadas bajo luz polarizada para evaluar la organización de las fibras de colágeno (Nikon Eclipse 80i, Nikon, Tokio, Japón).
2.5. Procedimiento de GBR
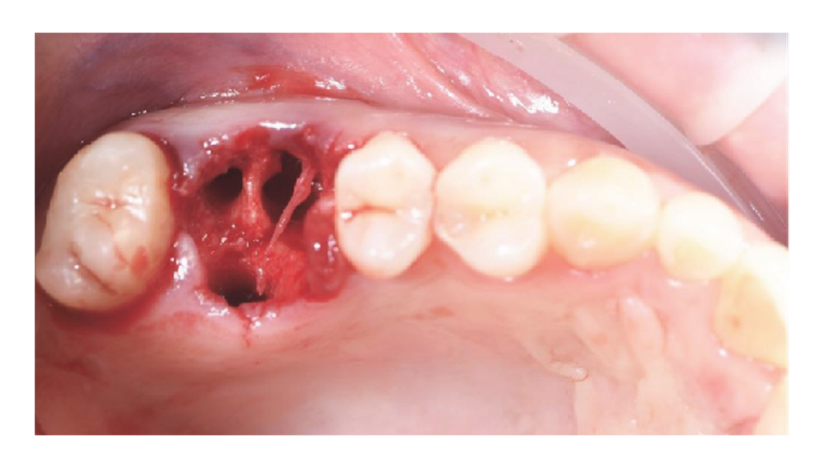
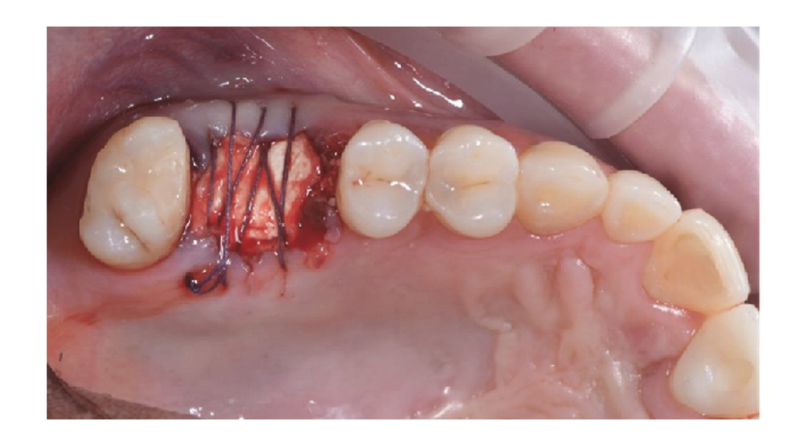
Se evaluó a los pacientes para determinar su elegibilidad para el estudio. Se obtuvo una tomografía computarizada (CBCT) preoperatoria para cada paciente con el fin de cuantificar el volumen óseo. Los pacientes que no contaban con suficiente volumen óseo para la colocación de implantes fueron informados sobre los detalles del estudio y firmaron el formulario de consentimiento informado para la investigación. Una vez confirmada la elegibilidad y obtenido el consentimiento informado, se realizó un examen oral exhaustivo para evaluar la salud general e identificar cualquier patología oral que requiriera tratamiento antes de la regeneración ósea guiada (GBR) y la rehabilitación con implantes. Diez días antes de la GBR y la colocación del implante, todos los pacientes se sometieron a procedimientos de higiene oral profesional, incluyendo desbridamiento, según fuera necesario. Los dientes fallidos en los sitios operativos fueron extraídos ocho semanas antes de la GBR y la colocación del implante. Los pacientes recibieron 2 g de amoxicilina (Zimox, Pfizer, Roma, Italia) una hora antes de la cirugía, seguidos de 1 g dos veces al día durante dos semanas. En casos de alergia a la penicilina, se administraron 600 mg de clindamicina con el mismo régimen postoperatorio. Inmediatamente antes de la cirugía, los pacientes enjuagaron con una solución de clorhexidina al 0.2% (Curasept, Curaden Healthcare, Saronno, Italia) durante un minuto. El procedimiento quirúrgico se realizó bajo sedación consciente (Diazepam, Hoffmann-La Roche, Basilea, Suiza) y anestesia local (Septanest con adrenalina 1/100,000, Septodont, Saint-Maur-des-Fossés, Francia). Se realizó una incisión media en la cresta (ligeramente avanzada bucalmente) en el tejido residual queratinizado utilizando una hoja quirúrgica n.º 15, seguida de dos incisiones verticales bilaterales a uno o dos dientes de distancia. Se elevó un colgajo de grosor total más allá de la unión mucogingival, al menos 5 mm más allá del defecto óseo, y se limpió a fondo el sitio receptor de restos de tejido blando. Se recolectó hueso autógeno del sitio del implante planificado o de la región retro-molar mandibular utilizando un recolector de hueso cortical mínimamente invasivo (Micross, Meta, Reggio Emilia, Italia). El defecto óseo se llenó luego con una mezcla 50:50 de hueso autógeno y sustituto óseo heterólogo (gránulos de hueso equino natural, Bioactiva, Arcugnano, Italia), pretratados con Plasma Vortex utilizando el soporte de material. Se colocó una malla de titanio tratada con plasma y diseñada por CAD/CAM (Exocad DentalCAD, Exocad, Darmstadt, Alemania), personalizada según el contorno y la forma de la región contralateral (New Ancorvis Srl, Bargellino, Calderara di Reno, Italia), para cubrir y proteger el sitio injertado. La malla de titanio personalizada se fijó con dos a tres tornillos óseos preplanificados y se cubrió con una membrana de pericardio tratada con plasma (Bioactiva, Arcugnano, Italia) (Figuras 6 y 7). Se logró un cierre de colgajo sin tensión utilizando suturas Vicryl 4.0. Postoperatoriamente, los pacientes recibieron 80 mg de ketoprofeno (Oki, Dompé, Milán, Italia) y 4 mg/día de betametasona (Bentelan, Glaxo, Verona, Italia) durante dos días. Se les indicó enjuagar con clorhexidina al 0.2% (Curasept) tres veces al día durante dos semanas y consumir solo alimentos blandos durante 30 días. Las suturas se retiraron después de 14 a 21 días. Se tomaron radiografías periapicales de referencia al final del procedimiento, durante la reapertura, en la entrega de la prótesis y anualmente a partir de entonces. Se utilizó el ACTILINK Reborn con Universal Vortex Holder (Plasmapp Co., Ltd., República de Corea) para tratar todos los biomateriales, como se informó anteriormente.

Seis meses después de GBR, se colocaron implantes siguiendo el protocolo estándar del fabricante. Después de la elevación del colgajo, se prepararon los sitios de los implantes utilizando brocas de diámetro creciente, con la calidad ósea categorizada subjetivamente como dura, media o blanda. El par motor se configuró en 25 Ncm durante la inserción del implante. Se colocaron implantes (Osstem TSIII SOI, Osstem Implant CO., LTD., Seúl, República de Corea) en posiciones planificadas prostéticamente. Dado que los implantes tenían una superficie activada, no se realizó ningún tratamiento adicional de Plasma Vortex. Los implantes se colocaron a nivel crestal o ligeramente por debajo, ya sea a mano alzada o utilizando una plantilla quirúrgica CAD/CAM. Cuatro meses después de la colocación del implante, se expusieron los implantes y se manejó el tejido blando según fuera necesario. Se tomaron impresiones digitales o analógicas, y se entregaron restauraciones temporales de acuerdo con los requisitos de manejo del tejido blando. De dos a cuatro meses después, se entregaron coronas definitivas de zirconia monolítica unidas a Ti-link después de confirmar la estabilidad individual del implante. Las superficies oclusales se diseñaron para estar en ligero contacto con la dentición opuesta. Se tomaron radiografías periapicales e imágenes clínicas en el procedimiento de GBR, colocación de implantes, etapas de restauración temporal y definitiva (Figura 8). Se proporcionaron instrucciones de higiene oral en cada visita de seguimiento. Se programó mantenimiento de higiene profesional cada seis meses después de la carga definitiva y según fuera necesario durante las fases protésicas. Se evaluó la oclusión dental en cada cita de seguimiento.
2.6. Medidas de Resultado
Los resultados primarios fueron:
- Fallo del implante definido como movilidad, infección, fractura y/o cualquier otro problema mecánico o biológico que determinara su extracción.
- El fallo de la prótesis se consideró en cualquier momento en que tuviera que ser reemplazada.
- Cualquier complicación biológica (por ejemplo, dolor resistente a medicamentos, hinchazón, MBL excesivo, supuración, etc.) y/o técnica (por ejemplo, fractura del material de recubrimiento y/o estructura, aflojamiento del tornillo, etc.) se registró durante el seguimiento.
El resultado secundario fue evaluar la regeneración ósea a través de un análisis histológico cualitativo evaluando el grado de mineralización ósea.
Resultados
3.1. Resultados Clínicos
Un total de seis pacientes fueron tratados. Tres pacientes con dientes irrecuperables y alvéolos intactos después de la extracción dental recibieron un procedimiento de preservación del alvéolo y colocación de implantes retrasada (tres meses), mientras que los otros tres pacientes con defectos horizontales de clase IV recibieron colocación de implantes en combinación con regeneración ósea guiada. Seis muestras histológicas en tres pacientes fueron recolectadas en el momento de la colocación del implante en el grupo de preservación del alvéolo. De cada paciente, se recolectaron tejidos blandos y duros tres meses después del procedimiento de preservación del alvéolo, al mismo tiempo de la cirugía de implante, como se describió. Se recolectaron un total de seis muestras y se enviaron para análisis histológico (tres muestras de tejido blando y tres muestras de hueso).
Un total de seis pacientes fueron tratados. Todas las pacientes eran mujeres con una edad media de 50 años (rango de 37 a 63). Ninguna de las pacientes era fumadora y todas estaban en buena salud (ASA 1). Todas las pacientes fueron seguidas durante al menos 1 año después de la entrega de la prótesis, sin abandonos.
No se reportaron fallos en implantes o prótesis hasta un año después de la colocación del implante. En un paciente que se sometió a regeneración ósea guiada, la malla de titanio se rompió después del tratamiento con plasma. En este paciente, se utilizó una membrana de pericardio que se fijó con etiquetas. No ocurrieron otras complicaciones biológicas o técnicas.
En un paciente del grupo de preservación de alvéolo, en el momento de la colocación del implante, la estabilidad primaria estaba alrededor de 15–20 Ncm. Sin embargo, el implante se osteointegró y se entregó la corona final.
3.2. Evaluación Histológica
Tres meses después de la cirugía de preservación de alvéolo, ninguna muestra histológica mostró signos de inflamación o necrosis.
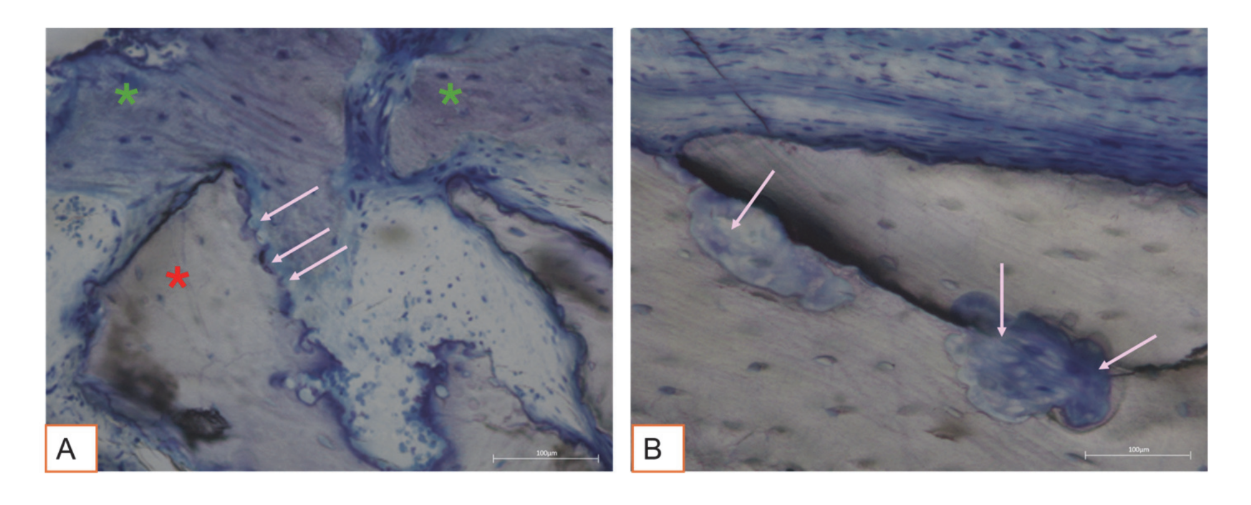
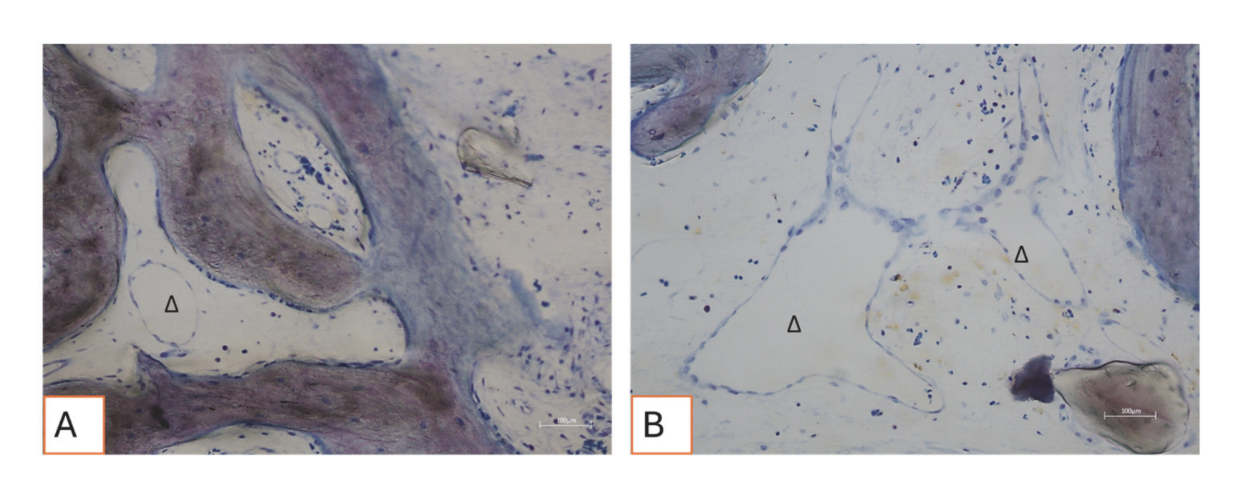
Todas las muestras de tejido duro evidenciaron hueso recién formado en proceso de mineralización en diferentes etapas (Figura 9) que rodeaba varias partículas de injerto óseo, caracterizadas por numerosas lagunas superficiales consistentes con lagunas de resorción osteoclástica (Figura 10). El hueso recién formado parecía estar rico en células óseas activas, a saber, células similares a osteoblastos, alineadas en líneas de deposición y secretando matriz osteoide, y células inmaduras similares a osteocitos habitando lagunas de hueso entrelazado (Figura 9). Se observó tejido conectivo laxo alrededor de las áreas de tejido duro y parecía estar rico en células y vasos sanguíneos (Figura 11).
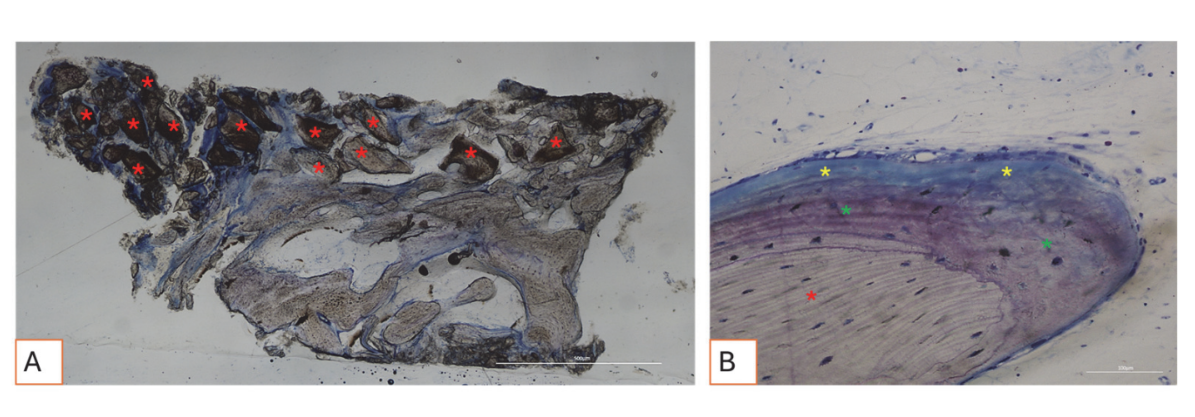
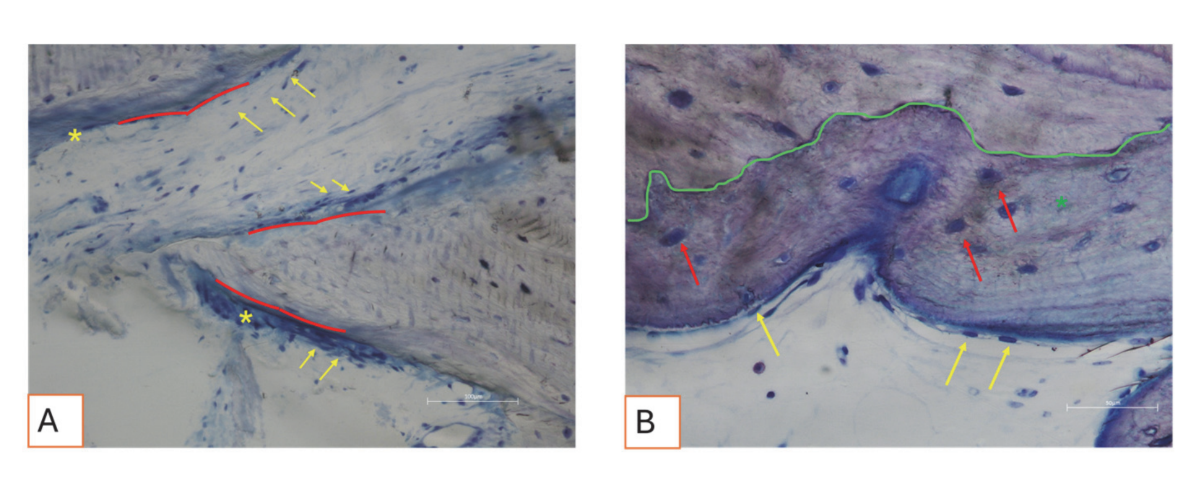
Los tejidos blandos exhibieron una morfología fisiológica. El componente conectivo estaba ligeramente fibroso, consistente con la curación postquirúrgica (Figuras 12 y 13).

Discusión
Este estudio investigó el impacto de VPST en biomateriales utilizados en procedimientos de SP y GBR, evaluando su influencia en la hidrofobicidad de la superficie y los resultados de la curación. Los resultados indican que el tratamiento con plasma mejora la compatibilidad biológica de los biomateriales, promoviendo una osseointegración efectiva y respuestas de curación favorables.
El análisis histológico a los tres meses no mostró signos de necrosis, inflamación o cicatrización. Tanto los tejidos blandos como los duros mostraron arquitecturas fisiológicas con buena vascularización. Los tejidos duros regenerados post-cirugía revelaron la presencia de células óseas activas secretando matriz osteoide y tejido óseo recién formado, consistente con el tiempo de curación esperado. Estos hallazgos se alinean con estudios previos que informan que la formación ósea temprana se caracteriza por la deposición de una matriz osteoide, que se mineraliza progresivamente con el tiempo. Las partículas del injerto óseo estaban bien integradas en el nuevo tejido óseo formado. Curiosamente, muchas de estas partículas mostraron lagunas superficiales compatibles con la resorción osteoclástica. Los osteoclastos humanos cultivados durante 21 días en la superficie de gránulos de hueso equino desproteinizado (DEBGs) y gránulos de hueso bovino desproteinizado (DBBGs) resorbieron los biomateriales, exhibiendo marcadores osteoclásticos típicos y características morfológicas más activamente en DEBGs que en DBBGs. Estos hallazgos sugieren que los DEBGs apoyan la diferenciación de osteoclastos y la actividad resorbente. Además, Di Stefano et al., en un estudio clínico e histomorfométrico realizado seis meses después del injerto de alvéolo, informaron que los DEBGs estaban asociados con una cantidad significativamente mayor de hueso recién formado y un porcentaje menor de biomaterial residual en comparación con los DBBGs. A la luz de nuestros hallazgos, la presencia de lagunas de resorción observadas en la superficie de los DEBGs podría atribuirse a las propiedades intrínsecas del material en sí, que parecen ser aún más mejoradas por el tratamiento con VPST. Además, VPST mejora la rugosidad de la superficie y la humectabilidad, promoviendo una mejor diferenciación celular y formación de apatita, que son cruciales para una regeneración ósea exitosa. El análisis del tejido duro, de hecho, reveló numerosas líneas de deposición ósea, caracterizadas por la presencia de células similares a osteoblastos secretando activamente matriz osteoide. La actividad secretora de los osteoblastos juega un papel crítico en la formación de nuevo hueso y en la integración exitosa del biomaterial dentro del tejido huésped. Estos hallazgos confirmaron que el tratamiento con VPST no perjudicó las propiedades osteoconductivas del injerto DEBG, apoyando así su compatibilidad con los procesos fisiológicos de regeneración ósea. Además, la acción simultánea de la deposición de matriz mediada por osteoblastos y la resorción mediada por osteoclastos forma la base del remodelado óseo fisiológico.
Este proceso dinámico está regulado de manera estricta a través de una compleja comunicación celular entre estos dos tipos de células.
En cuanto al tejido blando, el análisis histológico evidenció una arquitectura fisiológica con un componente conectivo ligeramente fibrótico, consistente con la curación postquirúrgica. Estos resultados se alinean con los de Pellegrini et al. que describieron la progresión de la curación del tejido blando tras procedimientos de injerto óseo en técnicas de preservación de alvéolos. La presencia de ligera fibrosis en el tejido conectivo puede interpretarse como parte de la fase normal de remodelación, donde los fibroblastos contribuyen a la deposición de matriz extracelular y a la maduración del tejido.
Clínicamente, no se registraron fallos de implantes o prótesis hasta un año después de la colocación del implante, subrayando la fiabilidad clínica de los biomateriales tratados con plasma. Esto es consistente con estudios previos que informaron sobre la mejora en la estabilidad de los implantes y las tasas de supervivencia asociadas con superficies activadas por plasma. La ausencia de complicaciones biológicas o técnicas, excepto por la rotura aislada de la malla de titanio, apoya aún más la seguridad clínica y la efectividad del protocolo de tratamiento propuesto. La interacción del plasma al vacío con objetos biológicos también puede tener efectos adversos que deben ser considerados. Una posible explicación para la rotura de la malla de titanio fue que la malla de titanio fue tratada inmediatamente después de ser probada en el defecto óseo. La presencia de fluidos biológicos puede haber causado una hiperactivación de la superficie.
A mejor conocimiento de los autores, este es el primer estudio que evalúa VPST en biomateriales. A pesar de estos resultados prometedores, este estudio tiene algunas limitaciones. El tamaño de muestra pequeño y la naturaleza de una auditoría clínica limitan la generalización de los hallazgos. Además, la falta de un grupo de control impide una comparación directa entre biomateriales tratados con plasma y no tratados. Los estudios futuros deberían incluir ensayos controlados aleatorios más grandes con seguimiento a largo plazo para validar estos hallazgos preliminares y establecer pautas clínicas sólidas.
Conclusiones
Considerando el tamaño de muestra limitado, esta serie de casos preliminares demuestra que VPST puede mejorar la compatibilidad biológica de los biomateriales utilizados en procedimientos de SP y GBR. Estos hallazgos preliminares pueden sugerir que el tratamiento con plasma podría integrarse de manera segura en los protocolos clínicos para potencialmente mejorar los resultados de la rehabilitación oral. Se necesitan más ensayos controlados aleatorios con cálculo del tamaño de muestra para confirmar estos resultados preliminares y explorar el impacto a largo plazo en la supervivencia de implantes y la satisfacción del paciente.
Marco Tallarico, Michele Troia, Milena Pisano, Silvio Mario Meloni, Dario Melodia, Claudia Della Via, Dolaji Henin, Francesco Mattia Ceruso, Carlotta Cacciò y Aurea Inmacolata Lumbau
Referencias
- Busenlechner, D.; Fürhauser, R.; Haas, R.; Watzek, G.; Mailath, G.; Pommer, B. Éxito a largo plazo de implantes en la Academia de Implantología Oral: seguimiento de 8 años y análisis de factores de riesgo. J. Periodontal Implant. Sci. 2014, 44, 102–108. [CrossRef] [PubMed]
- Kim, T.I. Un homenaje al Dr. Per-Ingvar Brånemark. J. Periodontal Implant. Sci. 2014, 44, 265. [CrossRef] [PubMed]
- Mavrogenis, A.F.; Dimitriou, R.; Parvizi, J.; Babis, G.C. Biología de la oseointegración del implante. J. Musculoskelet. Neuronal Interact. 2009, 9, 61–71.
- Gallucci, G.O.; Hamilton, A.; Zhou, W.; Buser, D.; Chen, S. Protocolos de colocación y carga de implantes en pacientes parcialmente edéntulos: una revisión sistemática. Clin. Oral Implant. Res. 2018, 29 (Suppl. S16), 106–134. [CrossRef]
- Wong, M.; Eulenberger, J.; Schenk, R.; Hunziker, E. Efecto de la topología de la superficie en la oseointegración de materiales de implante en hueso trabecular. J. Biomed. Mater. Res. 1995, 29, 1567–1575. [CrossRef]
- Wennerberg, A.; Albrektsson, T. Sobre las superficies de implantes: una revisión del conocimiento y opiniones actuales. Int. J. Oral Maxillofac. Implant. 2010, 25, 63–74.
- Wennerberg, A.; Albrektsson, T. Efectos de la topografía de la superficie de titanio en la integración ósea: una revisión sistemática. Clin. Oral Implant. Res. 2009, 20 (Suppl. S4), 172–184. [CrossRef]
- Kazimierczak, P.; Przekora, A. Modificaciones de superficie osteoconductivas y osteoinductivas de biomateriales para la regeneración ósea: una revisión concisa. Coatings 2020, 10, 971. [CrossRef]
- Canullo, L.; Genova, T.; Chinigò, G.; Iacono, R.; Pesce, P.; Menini, M.; Mussano, F. Dispositivo de tratamiento de plasma al vacío para mejorar la actividad de los fibroblastos en superficies de titanio mecanizadas y rugosas. Dent. J. 2024, 12, 71. [CrossRef] [PubMed]
- Shibata, Y.; Hosaka, M.; Kawai, H.; Miyazaki, T. El tratamiento de plasma de descarga de brillo en placas de titanio mejora la adhesión de células similares a osteoblastos a las placas a través del mecanismo mediado por integrinas. Int. J. Oral Maxillofac. Implant. 2002, 17, 771–777.
- Noro, A.; Kaneko, M.; Murata, I.; Yoshinari, M. Influencia de la topografía de la superficie y la físico-química de la superficie en la humectabilidad de la zirconia (zirconia tetragonal policristalina). J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 355–363. [CrossRef] [PubMed]
- Tallarico, M.; Meloni, S.M.; Troia, M.; Cacciò, C.; Lumbau, A.I.; Gendviliene, I.; Ceruso, F.M.; Pisano, M. El uso del tratamiento de superficie de plasma al vacío para mejorar la hidrofílicidad y humectabilidad de biomateriales: un estudio in vitro. Dent. J. 2025, 13, 141. [CrossRef] [PubMed]
- Canullo, L.; Pellegrini, G.; Canciani, E.; Heinemann, F.; Galliera, E.; Dellavia, C. Técnica de preservación del alvéolo: efecto del biomaterial en el patrón regenerativo óseo. Ann. Anat. Anat. Anz. 2016, 206, 73–79. [CrossRef] [PubMed]
- Lorusso, F.; Alla, I.; Gehrke, S.A.; Carmine, M.D.; Tari, S.R.; Scarano, A. Efecto de diferentes uniones protésicas de implantes dentales en la pérdida ósea marginal: hallazgos emergentes de un meta-análisis de red bayesiana (NMA) y revisión sistemática. Prosthesis 2024, 6, 186–205. [CrossRef]
- Udeabor, S.E.; Heselich, A.; Al-Maawi, S.; Alqahtani, A.F.; Sader, R.; Ghanaati, S. Conocimiento actual sobre la cicatrización del alvéolo de extracción: una revisión narrativa. Bioengineering 2023, 10, 1145. [CrossRef]
- Perrotti, V.; Nicholls, B.M.; Piattelli, A. Formación y actividad de osteoclastos humanos en un sustituto de hueso esponjoso equino. Clin. Oral Implant. Res. 2009, 20, 17–23. [CrossRef]
- Di Stefano, D.A.; Zaniol, T.; Cinci, L.; Pieri, L. Comparación química, clínica e histomorfométrica entre hueso equino fabricado mediante eliminación enzimática de antígenos y hueso bovino hecho no antigénico utilizando un proceso de alta temperatura en injertos de alvéolos post-extracción. Un estudio clínico retrospectivo comparativo. Dent. J. 2019, 7, 70. [CrossRef]
- Le, P.T.M.; Shintani, S.A.; Takadama, H.; Ito, M.; Kakutani, T.; Kitagaki, H.; Terauchi, S.; Ueno, T.; Nakano, H.; Nakajima, Y.; et al. Tratamiento de bioactivación con ácido mezclado y calor en implantes de titanio fabricados por fusión láser selectiva mejora la diferenciación de células preosteoblásticas. Nanomaterials 2021, 11, 987. [CrossRef]
- Pellegrini, G.; Rasperini, G.; Obot, G.; Farronato, D.; Dellavia, C. Cicatrización de tejidos blandos en la técnica de preservación del alvéolo: evaluaciones histológicas. Int. J. Periodontics Restor. Dent. 2014, 34, 531–539. [CrossRef]
- Kahm, S.H.; Lee, S.H.; Lim, Y.; Jeon, H.J.; Yun, K.I. Oseointegración de implantes dentales después del tratamiento de superficie de plasma al vacío in vivo. J. Funct. Biomater. 2024, 15, 278. [CrossRef]
- Pesce, P.; Menini, M.; Santori, G.; Giovanni, E.; Bagnasco, F.; Canullo, L. Activación foto y plasma de superficies de titanio de implantes dentales. Una revisión sistemática con meta-análisis de estudios preclínicos. J. Clin. Med. 2020, 9, 2817. [CrossRef] [PubMed]
- Scribante, A.; Ghizzoni, M.; Pellegrini, M.; Pulicari, F.; Manfredini, M.; Poli, P.P.; Maiorana, C.; Spadari, F. Mallas personalizadas totalmente digitales en procedimientos de regeneración ósea guiada: una revisión de alcance. Prosthesis 2023, 5, 480–495. [CrossRef]
- Berger, M.B.; Bosh, K.B.; Cohen, D.J.; Boyan, B.D.; Schwartz, Z. El tratamiento de plasma en banco de superficies de titanio mejora la respuesta celular. Dent. Mater. 2021, 37, 690–700. [CrossRef] [PubMed]
