Вплив ротаційного інструменту та однофайлового рециркуляційного інструменту на зменшення кількості бактерій у заражених кореневих каналах
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo).
Анотація
Мета: Порівняти зменшення бактерій, досягнуте за допомогою ротаційних та рециркуляційних систем під час підготовки кореневих каналів.
Методологія: Шістдесят дистобуккальних кореневих каналів верхніх молярів були забруднені культурою Enterococcus faecalis. Після інкубаційного періоду в 21 день були зібрані зразки бактерій та вирощені на агарових пластинах з m-Enterococcus. Кореневі канали були поділені на п'ять груп відповідно до системи, що використовувалася для інструментування: WaveOne, Reciproc, ProTaper, Mtwo та ручне інструментування. Негативні контролі складалися з п'яти незабруднених кореневих каналів, які піддавалися тому ж інструментуванню, що й кожна з експериментальних груп. Зразки бактерій були зібрані відразу ж і через 7 днів після інструментування. Статистичний аналіз проводився за допомогою парних t-тестів та тестів ANOVA.
Результати: У порівнянні з зразками до інструментування, кількість бактерій була значно зменшена після інструментування в усіх групах, без значної різниці у зменшенні кількості бактерій між рециркуляційними, ротаційними та ручними техніками. Однак зразки, протестовані через 7 днів після інструментування, показали значно вищу кількість бактерій, ніж зразки, протестовані відразу після інструментування.
Вступ
Присутність бактерій є основною причиною розвитку пародонтальної інфекції та апікальної пародонтиту (Kakehashi та ін. 1965). Серед різноманітних видів бактерій, виявлених в ендодонтичних інфекціях, Enterococcus faecalis виділяється своєю стійкістю, виживанням у середовищах з низьким вмістом поживних речовин та асоціацією з персистуючим апікальним пародонтитом (Sedgley та ін. 2005, Sakamoto та ін. 2007). Хоча хімічні агенти є важливими в інструментуванні кореневих каналів, деякі агенти не є повністю ефективними проти всіх видів бактерій у біоплівках (Pappen та ін. 2010). Більше того, зрілі біоплівки є більш стійкими до дії хімічних речовин (Shen та ін. 2011).
Механічне видалення за допомогою інструментування є особливо ефективним у порушенні бактеріальної біоплівки та зменшенні присутності бактерій у основному кореневому каналі (Aydin та ін. 2007, Machado та ін. 2010, Gorduysus та ін. 2011, Matos Neto та ін. 2012). Хоча ручне інструментування зазвичай використовується практиками, автоматизовані ротаційні системи мають кілька переваг у порівнянні з ручними техніками, включаючи швидші процедури (Guelzow та ін. 2005, Yin та ін. 2010), більш центровані підготовки (Taşdemir та ін. 2005, Aguiar та ін. 2009) та менше апікального викиду залишків (Madhusudhana та ін. 2010). Зокрема, системи ProTaper (Dentsply Maillefer, Ballaigues, Швейцарія) та Mtwo (VDW, Мюнхен, Німеччина) продемонстрували адекватну геометрію (Yang та ін. 2011) та значне зменшення бактерій у кореневому каналі (Machado та ін. 2010).
Нещодавно було запропоновано інструментування з використанням рециркуляційного однофайлового підходу. Системи, що використовують цей підхід, включають WaveOne (Dentsply Maillefer) та Reciproc (VDW), які в основному відрізняються за своїм перетином, але є схожими на ProTaper та Mtwo відповідно. Початкові дослідження показали, що використання Reciproc або Mtwo призводить до чистіших каналів в апікальній третині в порівнянні з використанням WaveOne або ProTaper (Bürklein et al. 2012). Більше того, було показано, що використання WaveOne зменшує морфологічні зміни каналу в порівнянні з використанням ProTaper (Berutti et al. 2012). Однак, небагато досліджень оцінювали механічну дію цих систем в інфікованих каналах.
Метою цього дослідження було порівняти зменшення кількості бактерій, досягнуте рециркуляційними та ротаційними системами в кореневих каналах, забруднених E. faecalis. Ручна техніка використовувалася як еталон для порівняння. Нульова гіпотеза, що перевірялася, полягала в тому, що немає різниць у зменшенні кількості бактерій, спричиненому рециркуляційними та ротаційними системами.
Матеріали та методи
Підготовка зразків
Схвалення для цього дослідження було отримано від Етичного комітету Школи стоматології Університету Сан-Паулу (194/2010). Шістдесят п’ять дистобукальних кореневих каналів верхніх молярів були стандартизовані до 12 мм і інструментовані до робочої довжини 11 мм до розміру 15 K-файлу (Dentsply Maillefer) під зрошенням дистильованою водою. Кореневі канали були заповнені 17% EDTA (Fórmula & Acão, Сан-Паулу, SP, Бразилія) на 3 хвилини для видалення слизового шару і промиті 5 мл дистильованої води. Апекс був покритий композитною смолою (3M, Сент-Пол, MN, США), а зовнішня поверхня кореня була герметизована епоксидною смолою (Araldite; Brascola, Жоинвіль, SC, Бразилія). Зразки були закріплені на 24-лункових полістиролових мікротитрових пластинах акриловою смолою і стерилізовані етіленоксидом (Acecil, Кампінас, SP, Бразилія).
Контамінація зразків
Приготували суспензію E. faecalis (ATCC 29212) у триптиковому соєвому бульйоні (TSB; Difco, Le Pont-de-Claix, RA, Франція) та стандартизували до 4 за шкалою МакФарланда. Шістдесят кореневих каналів були забруднені суспензією E. faecalis за допомогою інсулінового шприца. П'ять залишкових кореневих каналів були заповнені TSB. Зразки інкубували при 37 °C протягом 21 дня. Вміст кореневих каналів замінювали на свіжий TSB кожні 48 годин.
Після інкубаційного періоду кореневі канали заповнили дистильованою водою. Зразки (S1) були зібрані за допомогою трьох стерилізованих паперових точок розміру 15 (Dentsply Maillefer), які були вставлені в кореневі канали на 1 хвилину кожна. Точки зберігалися в трубках, що містять 500 мкл пептонного розчину, і були підготовлені серійні розведення. Різні розведення були висіяні в трьох екземплярах на середовище для культури м-ентерококів агар (Difco). Пластини інкубували при 37 °C протягом 48 годин, і кількість бактерій була виміряна (в CFU мЛ—1).
Інструментування зразків
Забруднені зразки були розділені на п'ять груп, як описано нижче.
- Група 1 була підготовлена з використанням файлу WaveOne Primary (розмір наконечника 25, 0.08 конусність) (Dentsply Maillefer). З мотором у реверсивному русі (Dentsply Maillefer) файл обережно вводився в шийкову третину і витягувався. Файл був введений у середню третину і витягнутий. Нарешті, файл був введений у апікальну третину до робочої довжини з рухом щітки проти стінок.
- Група 2 була підготовлена з використанням Reciproc R25 (розмір наконечника 25, 0.08 конусність) (VDW) аналогічно групі 1.
- Група 3 була підготовлена з використанням системи ProTaper (Dentsply Maillefer). Шийкова третина була розширена свердлами Gates-Glidden 1, 2 та 3 (Dentsply Maillefer), а потім інструментами SX та S2. Середня та апікальна третини були оброблені інструментами S1, S2, F1 та F2 (розмір наконечника 25, 0.08 конусність).
- Група 4 була підготовлена з використанням системи Mtwo (VDW). Шийкова третина була розширена свердлами Gates-Glidden 1, 2 та 3. Файли були введені безпосередньо до робочої довжини з легкими рухами вперед-назад, при цьому тиск в апікальному напрямку поступово збільшувався, а потім виконувалася дія щітки проти стінок. Послідовність файлів була розміром 10, 0.04 конусність, розміром 15, 0.05 конусність, розміром 20, 0.06 конусність та розміром 25, 0.06 конусність.
- Група 5 (позитивний контроль) була підготовлена за допомогою ручної техніки crown-down. Шийкова та середня третини були розширені свердлами Gates-Glidden 1, 2 та 3, а потім файл K-розміру 20 був обережно введений до робочої довжини з використанням чвертьобертових і шліфувальних рухів проти стінок. Цей рух повторювався, поки інструмент більше не зустрічав опору, і файл був вільним. Ці маневри потім повторювалися з файлами K-розміру 25, 30 та 35.
Негативні контролі складалися з п'яти неконтамінованих зразків, які були інструментовані відповідно до кожної групи.
Ірригація під час інструментування проводилася з використанням 10 мл дистильованої води за допомогою шприца та 29-гігової NaviTip (Ultradent Products, South Jordan, UT, USA), який вводився на 3 мм коротше робочої довжини з рухами вперед-назад для кращого потоку. У групах 1 та 2 ірригація та дослідження з використанням K-файлу розміру 15 виконувалися щоразу після вилучення інструмента. У групах 3, 4 та 5 ірригація повторювалася з кожною зміною інструмента.
Збір даних після інструментування
Щоб визначити кількість бактерій (в CFU мЛ—1) відразу після інструментування (S2), додатково було введено 5 мл дистильованої води після фінальної ірригації. Потім проводилося фрезерування з використанням Hedström файлу розміру 25, вводячи його в канал до робочої довжини з циркулярними фрезерувальними рухами по всіх поверхнях кореневого каналу. Файл був відрізаний нижче ручки і опущений у трубку, що містить 500 мкл пептонної води. Три стерилізовані паперові точки розміру 15 були вставлені в кореневий канал на 1 хвилину кожна і зберігалися в тій же трубці, що й файл.
Кореневі канали були заповнені TSB і інкубовані при 37°C протягом 7 днів. Третє взяття проби було проведено таким же чином, як для S2, щоб визначити кількість бактерій через 7 днів після інструментації (S3).
Статистичний аналіз
Кожна кількість бактерій була логарифмічно перетворена для статистичного аналізу. Для внутрішньогрупового аналізу використовувався парний t-тест, а для міжгрупового аналізу - аналіз дисперсії (ANOVA). Рівень значущості для всіх аналізів становив P < 0.05.
Результати
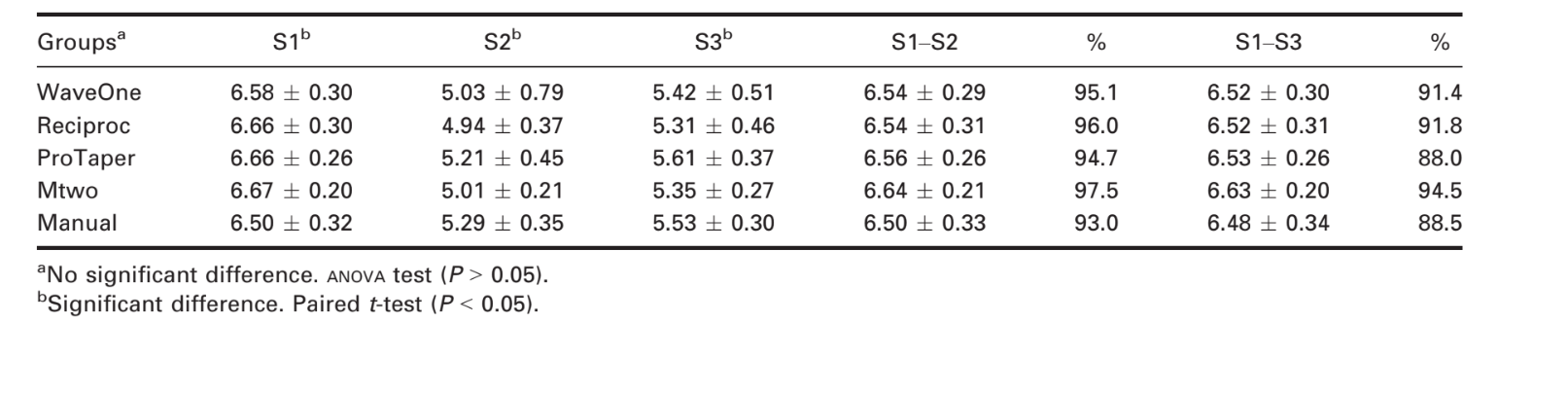
Таблиця 1 показує результати зниження кількості бактерій. Кількість бактерій у S2 і S3 була знижена в порівнянні з S1 для всіх груп (P < 0.0001 за допомогою t-тесту). Цей результат продемонстрував, що всі техніки підготовки були ефективними у зниженні кількості бактерій. Однак порівняння кількостей бактерій у S2 і S3 виявило ріст бактерій через 7 днів після інструментації (P < 0.01 за допомогою t-тесту). Негативний контроль не показав жодного росту бактерій, що вказує на те, що асептичні умови були дотримані під час експерименту. Реверсивні, ротаційні та ручні техніки мали подібні результати відразу ж і через 7 днів після інструментації (P = 0.78 та P = 0.76 відповідно, за допомогою ANOVA).
Обговорення
Мікробіологічне усунення є надзвичайно важливим у ендодонтичній терапії, оскільки наявність бактерій є основною причиною ендодонтичних невдач (Kakehashi та ін. 1965, Sakamoto та ін. 2007). Для вивчення цього поняття було використано багато методологій. У даному дослідженні були проаналізовані корені молярів. WaveOne Primary, Reciproc R25 та ProTaper F2 мають однаковий розмір наконечника та конусність, що є обмеженням з точки зору дезінфекції каналів великого діаметра. Ручне інструментування проводилося до розміру 35, 0.02 конусності K-файлу. Однак з мікробіологічної точки зору використання різних розмірів наконечників та конусностей було зафіксовано як таке, що призводить до подібних кількостей бактерій (Machado та ін. 2010).
Подібно до багатьох попередніх досліджень (Siqueira та ін. 1999, Aydin та ін. 2007, Machado та ін. 2010, Singla та ін. 2010, Siqueira та ін. 2010, Alves та ін. 2011, Gorduysus та ін. 2011, Alves та ін. 2012, Matos Neto та ін. 2012, Paranjpe та ін. 2012), був використаний метод пластинкової культури. Alves та ін. (2011) спостерігали подібні результати з технікою полімеразної ланцюгової реакції, як і з методом пластинкової культури. Хоча інші автори порівнювали ріст бактерій до та після інструментування кореневого каналу без обробки (Siqueira та ін. 1999, Machado та ін. 2010, Singla та ін. 2010, Gorduysus та ін. 2011, Matos Neto та ін. 2012), але обробка є необхідною через наявність шару забруднення, залишків біоплівки та необроблених ділянок, які можуть вплинути на порівняння між групами (Aydin та ін. 2007, Siqueira та ін. 2010, Alves та ін. 2011, 2012, Paranjpe та ін. 2012).
Третє взяття проби на 7 день (S3) було використано для перевірки бактеріального росту в кореневому каналі між прийомами (Siqueira та ін. 2007). Кількість бактерій показала значне зменшення бактерій у всіх техніках інструментування як на S2, так і на S3 у порівнянні з контролем. Однак порівняння між S2 і S3 виявило значний бактеріальний ріст у головному каналі. Це відкриття суперечить результатам, отриманим Siqueira та ін. (2007), які використовували внутрішньоканальну медикацію між прийомами. Залишкові бактерії в дентинних канальцях у нашому дослідженні могли розмножитися і потрапити в головний канал. Використання живильного бульйону в кореневому каналі протягом 7 днів очевидно сприяло бактеріальному росту.
Статистично значущих відмінностей між техніками та системами не спостерігалося, що узгоджується з результатами досліджень, які порівнюють ручні техніки з ротаційними системами (Dalton та ін. 1998, Siqueira та ін. 1999, Chuste-Guillot та ін. 2006, Matos Neto та ін. 2012). Попередні дослідження спостерігали середнє зменшення бактерій на 81.94% для ProTaper і 84.29% для Mtwo (P > 0.05) (Machado та ін. 2010). Хоча в даному дослідженні також не було виявлено різниці між цими системами, середні зменшення склали 94.71% для ProTaper і 97.43% для Mtwo.
У даному звіті жоден з зразків не був повністю вільний від бактерій. На відміну від цього, Coldero et al. (2002) спостерігали, що 81% зразків, підготовлених ручним методом, були вільні від бактерій. Цю різницю слід розглядати з урахуванням того, що дуже малий ріст бактерій не може бути виявлений традиційними культуральними методами (Siqueira & Rôcas 2005).
У даному дослідженні було досягнуто зменшення кількості бактерій на 95.1% відразу після та на 91.4% через 7 днів після інструментування за допомогою реверсивних систем без використання хімічних агентів. Ці результати були порівнянні з тими, що були отримані за допомогою традиційних технік (тобто 94.7% та 88% відповідно для ротаційних систем і 93% та 88.5% відповідно для ручних систем). Отже, системи з одним файлом реверсивного типу призвели до подібного зменшення бактерій у порівнянні з тими, що були отримані за допомогою ротаційних систем або ручного методу.
Висновок
Можна зробити висновок, що всі протестовані системи зменшили кількість бактерій до подібного рівня.
М. Е. Л. Мачадо, К. К. Набешима, М. Ф. П. Леонардо, Ф. А. С. Рейс, М. Л. Б. Бріто & С. Кай
Посилання:
- Агулар СМ, Мендес ДА, Камара АС, Фігейредо ЯП (2009) Оцінка здатності центрування ротаційної системи ProTaper Universal у вигнуті корені в порівнянні з файлами Nitiflex. Австралійський журнал ендодонтії 35, 174–9.
- Алвес ФРФ, Алмейда БМ, Невес МАС, Рокас ІН, Сікейра ЯФ-молодший (2011) Часозалежні антибактеріальні ефекти саморегульованого файлу, використаного з двома концентраціями натрію гіпохлориту. Журнал ендодонтії 37, 1451–5.
- Алвес ФРФ, Рокас ІН, Алмейда БМ, Невес МАС, Зоффолі Дж, Сікейра ЯФ-молодший (2012) Кількісний молекулярний та культурний аналізи усунення бактерій в овальних кореневих каналах за допомогою техніки однофайлової інструментації. Міжнародний журнал ендодонтії 45, 871–7.
- Айдин Ч, Тунка ЯМ, Сенсес З, Байсаллар М, Каяоглу Г, Øрставік Д (2007) Зниження бактерій при широкій та консервативній інструментації кореневих каналів in vitro. Акта одонтологічна скандинавська 65, 167–70.
- Берутті Е, Чіандуссі Дж, Паоліно ДС та ін. (2012) Формування каналу з ротаційними файлами WaveOne Primary та системою ProTaper: порівняльне дослідження. Журнал ендодонтії 38, 505–9.
- Бюрклейн С, Хіншицца К, Даммашке Т, Шефер Е (2012) Здатність формування та ефективність очищення двох однофайлових систем у сильно вигнутих кореневих каналах видалених зубів: Reciproc та WaveOne проти Mtwo та ProTaper. Міжнародний журнал ендодонтії 45, 449–61.
- Чусте-Гійот М-П, Бадет С, Пелі Ж-Ф, Перес Ф (2006) Вплив трьох технік ротаційних файлів з нікель-титаном на зменшення інфікованого кореневого дентину. Оральна хірургія, оральна медицина, оральна патологія, оральна радіологія та ендодонтія 102, 254–8.
- Колдеро ЛГ, МакГ'ю С, Маккензі Д, Сондерс ВП (2002) Зменшення внутрішньоканальних бактерій під час підготовки кореневих каналів з та без апікального розширення. Міжнародний журнал ендодонтії 35, 437–46.
- Далтон БК, Øрставік Д, Петтіет М, Тропе М (1998) Зменшення бактерій за допомогою ротаційної інструментації з нікель-титаном. Журнал ендодонтії 24, 763–7.
- Гордуйсус М, Наґас Е, Тору ОЙ, Гордуйсус О (2011) Порівняння трьох ротаційних систем та техніки ручної інструментації для усунення Enterococcus faecalis з кореневого каналу. Австралійський журнал ендодонтії 37, 128–33.
- Гельцоу А, Штамм О, Мартус П, Кільбасса АМ (2005) Порівняльне дослідження шести ротаційних систем з нікель-титаном та ручної інструментації для підготовки кореневих каналів. Міжнародний журнал ендодонтії 38, 743–52.
- Какехасі С, Стенлі ГР, Фіцджеральд РД (1965) Вплив хірургічних експозицій зубних пульп у безмікробних та звичайних лабораторних щурах. Оральна хірургія, оральна медицина, оральна патологія 20, 340–9.
- Мачадо МЕЛ, Сапія ЛАБ, Кай С, Мартінс ГХР, Набешима КК (2010) Порівняння двох ротаційних систем у підготовці кореневих каналів щодо дезінфекції. Журнал ендодонтії 36, 1238–40.
- Мадхусудхана К, Метью ВБ, Редді НМ (2010) Апікальне виведення залишків та іригантів за допомогою ручної та трьох ротаційних систем інструментації – in vitro дослідження. Сученна клінічна стоматологія 1, 234–6.
- Матос Нето М, Сантос ССФ, Леао МВП, Хабітант СМ, Родрігес ЖРДД, Жорже АОК (2012) Ефективність трьох систем інструментації для видалення Enterococcus faecalis з кореневих каналів. Міжнародний журнал ендодонтії 45, 435–8.
- Паппен ФГ, Шен Й, Цянь В, Леонардо МР, Джардіно Л, Хаапасало М (2010) In vitro антибактеріальна дія Tetraclean, MTAD та п'яти експериментальних розчинів для іригації. Міжнародний журнал ендодонтії 43, 528–35.
- Паранджпе А, Грегоріо С, Гонсалес АМ та ін. (2012) Ефективність системи саморегульованого файлу на очищення та формування овальних каналів: мікробіологічна та мікроскопічна оцінка. Журнал ендодонтії 38, 226–31.
- Сакамоно М, Сікейра ЯФ-молодший, Рокас ІН, Бенно Й (2007) Зменшення бактерій та їх стійкість після процедур ендодонтичного лікування. Оральна мікробіологія та імунологія 22, 19–23.
- Седжлі КМ, Леннан СЛ, Аппельбе ОК (2005) Життєздатність Enterococcus faecalis у кореневих каналах ex vivo. Міжнародний журнал ендодонтії 38, 735–42.
- Шен Й, Стойчич С, Хаапасало М (2011) Антимікробна ефективність хлоргексидину проти бактерій у біоплівках на різних стадіях розвитку. Журнал ендодонтії 37, 657–61.
- Сінгла М, Аггарвал В, Логані А, Шах Н (2010) Порівняльна оцінка ротаційних ProTaper, Profile та традиційної техніки зворотного кроку на зменшення колоній Enterococcus faecalis та вертикальної стійкості кореневих каналів до переломів. Оральна хірургія, оральна медицина, оральна патологія, оральна радіологія та ендодонтія 109, e105–10.
- Сікейра ЯФ-молодший, Рокас ІН (2005) Використання молекулярних методів для дослідження ендодонтичних інфекцій: частина 1: сучасні молекулярні технології для мікробіологічної діагностики. Журнал ендодонтії 31, 411–23.
- Сікейра ЯФ-молодший, Ліма КК, Магальяєш ФАК, Лопес ХП, Узеда М (1999) Механічне зменшення бактеріальної популяції в кореневому каналі за допомогою трьох технік інструментації. Журнал ендодонтії 25, 332–5.
- Сікейра ЯФ-молодший, Пайва ССМ, Рокас ІН (2007) Зменшення культивованої бактеріальної популяції в інфікованих кореневих каналах за допомогою антимікробного протоколу на основі хлоргексидину. Журнал ендодонтії 33, 541–7.
- Сікейра ЯФ-молодший, Алвес ФРФ, Алмейда БМ, Олівейра ЖКМ, Рокас ІН (2010) Здатність хімічно-механічної підготовки з ротаційними інструментами або саморегульованим файлом дезінфікувати овальні кореневі канали. Журнал ендодонтії 36, 1860–5.
- Ташдемір Т, Айдемір Х, Інан У, Юнал О (2005) Підготовка каналу з ротаційними Ni-Ti інструментами Hero 642 в порівнянні з ручними K-файлами з нержавіючої сталі, оцінена за допомогою комп'ютерної томографії. Міжнародний журнал ендодонтії 38, 402–8.
- Ян Г, Юань Г, Юн Х, Чжоу Х, Лю Б, У Х (2011) Впливи двох систем інструментів з нікель-титаном, Mtwo проти ProTaper universal, на геометрію кореневого каналу, оцінені за допомогою мікро-комп'ютерної томографії. Журнал ендодонтії 37, 1412–6.
- Ін Х, Чеунг ГС, Чжан Ц, Масуда ЙМ, Кімура Й, Мацуомото К (2010) Мікро-комп'ютерна томографічна порівняння ротаційних інструментів з нікель-титаном та традиційних інструментів у системі кореневого каналу у формі C. Журнал ендодонтії 36, 708–12.

/social-network-service/media/default/102339/cc73e2fd.png)