Влияние региональной анестезии блока сфенопалатинного ганглия на самооценку боли у пациентов с статусом мигрени
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo).
Предпосылки. Статус мигренозус (СМ) определяется как изнурительная мигренозная атака, продолжающаяся более 72 часов у пациентов, ранее страдающих от мигрени. Обычно эти атаки не поддаются лечению безрецептурными и абортивными препаратами. Сфеноидально-небный ганглий (СНГ) играет критическую роль в распространении как боли, так и автономных симптомов, обычно связанных с мигренью. Блокада СНГ с помощью трансназального лидокаина умеренно эффективна в снижении симптомов мигрени, но этот метод часто плохо переносится, и результаты непостоянны. Мы предложили, что блокада СНГ с использованием подхода супразигоматической инъекции будет безопасным и эффективным вариантом для прекращения или облегчения боли и автономных симптомов СМ.
Методы. В результате ретроспективного анализа записей мы выявили пациентов с хорошо установленным диагнозом мигрени на основе критериев Международного общества головной боли. Пациенты, отобранные для включения в исследование, были диагностированы с СМ, не ответили на 2 или более абортивных препаратов и получили блокаду СНГ с супразигоматическим подходом. Пациентов также попросили оценить свою боль по шкале Лайкерта от 1 до 10 как до, так и через 30 минут после инъекции.
Результаты. Восемьдесят восемь последовательных пациентов (20 мужчин и 68 женщин) прошли в общей сложности 252 процедуры блока SPG надскуловой области в амбулаторной клинике головной боли после того, как традиционные медикаменты не смогли остановить их СМ. Через 30 минут после инъекций наблюдалось снижение интенсивности боли на 67,2% (±26,6%) с медианным снижением на 5 баллов (IQR= −6 до −3) по шкале Лайкерта (от 1 до 10). В целом, пациенты испытали статистически значительное снижение интенсивности боли (P < .0001).
Заключение. Известно, что SPG играет важную роль в патофизиологии лицевой боли и тройничной автономной цефалгии, хотя его точная роль в генерации и поддержании мигрени остается неясной. Региональный анестезирующий блок SPG надскуловой области потенциально эффективен для немедленного облегчения СМ. Мы считаем, что процедура проста в выполнении и имеет минимальный риск.
Введение
Приблизительно 15% общего населения страдают от мигрени. Статус мигренозус (СМ) определяется как изнурительная мигренозная атака, продолжающаяся более 72 часов у пациентов, ранее известных как страдающие мигренью. Обычно эти атаки не поддаются стандартным безрецептурным препаратам, триптанам, внутривенным (IV) стероидам, парентеральным бензодиазепинам или нейролептическим препаратам, которые обеспечивают кратковременное облегчение, за которым обычно следует повторная головная боль в течение 24 часов. В Соединенных Штатах визиты в отделение неотложной помощи (ОНП) по поводу СМ обходятся примерно в 700 миллионов долларов в год. Эти пациенты часто госпитализируются. В 2010 году расходы на госпитализацию по поводу СМ составили примерно 375 миллионов долларов. В одном отчете средняя продолжительность пребывания в больнице для пациента с СМ составила 2,7 дня.
Сфеноидно-нёбный ганглий (СПГ) является крупнейшим экстракраниальным парасимпатическим ганглием в организме и является частью автономной нервной системы, которая может играть роль в терапевтическом лечении СМ. В частности, СПГ расположен в крылонёбной ямке, за носоглоткой, позади средней носовой раковины и ниже сфеноидной пазухи (Рис. 1). Поскольку СПГ анатомически расположен рядом с лицевыми сенсорными нервами и ветвями тройничного нерва, он может играть потенциальную роль в патофизиологии односторонней головной боли и идиопатической лицевой боли, опосредованной через тройнично-сосудистый комплекс.
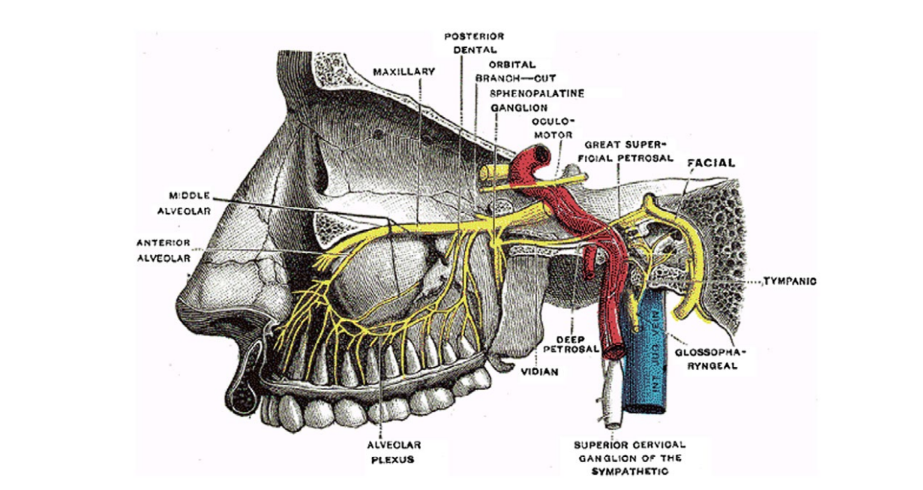
Региональная анестезия супразигоматического блока SPG (SSPGB) вероятно влияет на парасимпатический отток к краниальным сосудистым структурам, хотя механизм не полностью понятен. Когда возникает мигрень, активируется тройнично-автономный рефлекс. Афферентные тройничные нейроны стимулируют верхний слюноотделительный ядро через мост, увеличивая парасимпатический выход SPG через лицевой нерв. Отток SPG опосредует вазодилатацию церебральных кровеносных сосудов в пределах менинг, что затем облегчает экстравазацию воспалительных медиаторов, приводя к боли, испытываемой пациентами. Мигрень часто ассоциируется с автономными симптомами, включая фотофобию, фонофобию, тошноту и рвоту, а иногда и с заложенностью носа. Подобно кластерной головной боли, предполагается, что SPG играет ключевую роль в облегчении этих автономных симптомов, связанных с мигренью, и успешная блокада SPG может, следовательно, принести пользу в облегчении этих симптомов. Трансназальные блоки SPG с использованием пропитанных лидокаином тампонов доказали свою эффективность в снижении мигренозной боли, но часто плохо переносятся, а общие результаты снижения боли не впечатляют и непоследовательны. В последнее время трансназальная доставка анестетика к ножке SPG через устройство TX360 значительно улучшила этот подход, но изучалась только в условиях хронической мигрени с повторными применениями в течение 6 недель. В этом исследовании мы предположили, что SSPGB будет переносимым и эффективным в купировании боли при SM, состоянии, клинически более распространенном в общей популяции, чем хроническая мигрень.
Методы
Мы провели ретроспективное исследование, чтобы оценить влияние SSPGB на пациентов с SM, лечившихся в амбулаторной клинике головной боли крупной больницы третьего уровня в восточной Пенсильвании. Записи пациентов с января 2008 года по декабрь 2016 года были проанализированы для выявления пациентов с хорошо установленным диагнозом мигрени и SM, используя критерии Международного общества головной боли. Наш алгоритм лечения острых приступов головной боли при SM включает рутинное применение пероральных, интраназальных или подкожных триптанов в качестве первой линии терапии. У пациентов, не реагирующих на триптаны, используется эрготамин в виде назального спрея Migranal, перорального Cafergot или 1 мг внутримышечного дигидроэрготамина 45 (DHE). Пациентам рекомендуется принимать эти препараты на ранних стадиях развития мигрени. При головной боли, продолжающейся 3 дня и более, назначается постепенное снижение дозы дексаметазона в течение 3 дней, состоящее из 12, 8 и 4 мг в последовательные дни. Это сочетается с метергином 0,2 мг каждые 6 часов перорально в течение 3 дней. У пациентов, которые не могут переносить триптаны или терапию эрготамином, назначается изометептена/дихлорфеназона/ацетаминофена в качестве препарата первой линии с кодеином 30 мг, принимаемым перорально каждые 8 часов в качестве спасательной терапии, если первоначальная терапия была неэффективной. Пациенты с SM, не реагирующие на вышеописанный алгоритм, направлялись на блокаду SPG всеми неврологами в практике. Все пациенты оценивались последовательно, без исключений из анализа. Пациентов просили оценить свою боль по шкале Лайкерта от 1 до 10 как до, так и через 30 минут после процедуры инъекции. Процедура была подробно объяснена пациентам, и письменное информированное согласие было получено перед процедурой.
Критерии исключения включали системную антикоагуляцию, головную боль напряжения, кластерную головную боль, тройничную невралгию, головную боль после сотрясения, цервикогенную головную боль и новую ежедневную стойкую головную боль с мигренозными признаками. Пациенты, у которых была недостаточная реакция на блокаду SPG и которые оставались в сильной боли, обычно госпитализировались для внутривенной терапии, которая включала физиологический раствор, DHE 45, противорвотную терапию с метоклопрамидом, ондансетрон или хлорпромазин и магний. Внутривенный лидокаин использовался редко.
Это исследование не требовало одобрения этического комитета, так как эта процедура широко используется в челюстно-лицевой хирургии, и трансназальная и инфразигоматическая блокада SPG показали свою эффективность при мигрени. Наша группа следовала этическим рекомендациям, изложенным в Декларации Хельсинки. Это исследование было одобрено нашим институциональным ревью-комитетом, в который входят некоторые члены нашего этического комитета.
Процедура: региональная анестезия блока SPG
Блок SSPGB был выполнен с использованием 5 мл смеси дексаметазона (1 мл) и 0,5% ропивакаина (4 мл). С пациентом в положении на боку, игла 25-го калибра длиной 2 дюйма была введена под углом 45 градусов к черепу, направляя ее назад под углом 15 градусов от линии глазного канала к заднему мыщелку ветви нижней челюсти (Рис. 2).
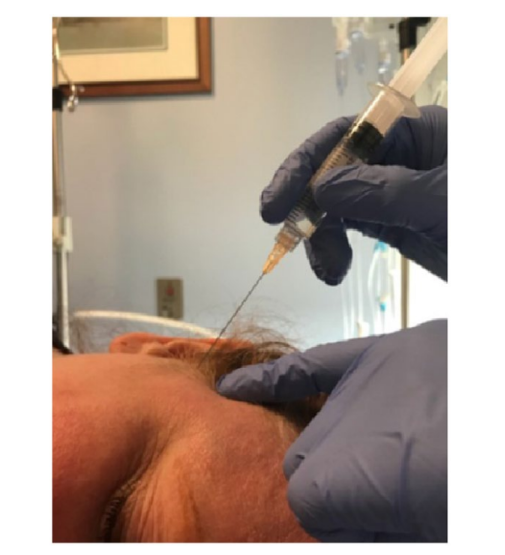
Точность этой процедуры определялась наличием онемения в задней части языка, а также в щеке. Кроме того, облегчение фоточувствительности и тошноты было еще одним показателем, подтверждающим точность инъекции.
Результаты и статистический анализ
Для всех переменных были сгенерированы описательные статистики. Среднее значение и стандартное отклонение представлены для непрерывных переменных. Если распределение непрерывных переменных было искажено, вместо этого представлены медиана и интерквартильный размах (IQR). Искажение оценивалось визуальной инспекцией гистограмм, а также статистикой искажения. Частоты и проценты используются для описания категориальных переменных.
В этом исследовании было 2 единицы анализа – пациент и процедура – из-за того, что у нескольких пациентов было выполнено более одной блока SPG в течение исследовательского периода. Для проверки гипотезы использовалась только первоначальная процедура, так как тест знаков Уилкоксона предполагает, что все пары независимы. Тем не менее, повторные процедуры все равно анализировались описательно. Процентное изменение в оценках боли рассчитывалось путем вычитания оценок до и после процедуры и деления разности на исходную оценку боли.
Для проверки нашей гипотезы был использован тест знаков Уилкоксона, из-за асимметрии распределений болевых оценок до и после процедуры, а также порядкового характера оценок. Все статистические тесты были двусторонними, и значение P .05 считалось статистически значимым. Анализ проводился с использованием SAS версии 9.3 (SAS Institute, Cary, NC, USA).
Результаты
В исследование были включены 88 пациентов-кавказцев, 20 мужчин и 68 женщин. Все пациенты были в возрасте от 24 до 76 лет. Пациенты прошли в общей сложности 252 процедуры SSPGB. В исследование вошли пациенты, у которых было 1 или более эпизодов невыносимой SM в разные моменты времени.
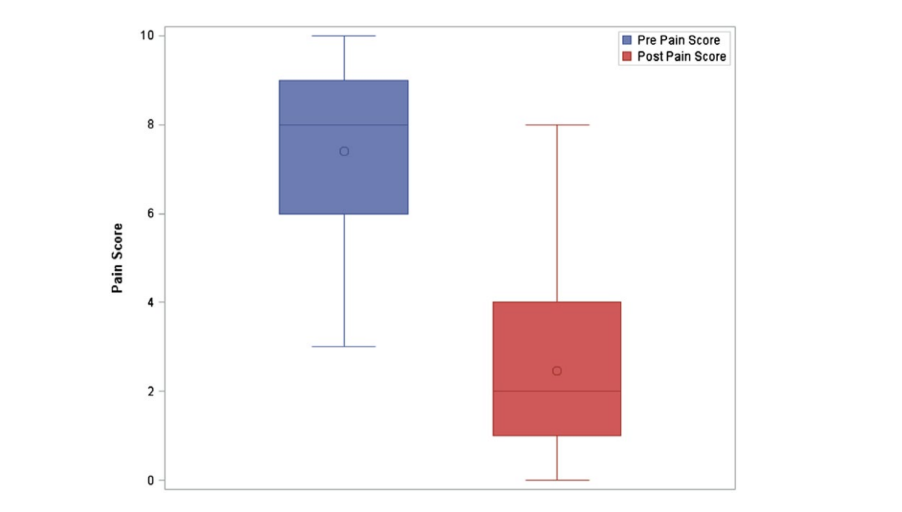
При анализе только первоначальной процедуры каждого пациента медианная оценка боли по шкале Ликерта до процедуры составила 8 (IQR = 6-9). Медианная оценка боли по шкале Ликерта после процедуры составила 2 (IQR = 1-4), что соответствует среднему снижению тяжести боли на 67.2% (±26.6%) среди всех пациентов для первоначальной процедуры SPG. Среднее улучшение по шкале боли Ликерта составило 5 баллов (IQR = 6-3). Через 30 минут после инъекции было зафиксировано статистически значительное снижение тяжести боли (P < .0001). На рисунке 3 показаны распределения болевых оценок до и после процедуры только для первоначальных процедур. Ящик с усами показывает, что болевые оценки до процедуры были выше, чем после процедуры. Кроме того, он показывает, что распределение болевых оценок до процедуры было смещено влево, в то время как болевые оценки после процедуры были смещены вправо.
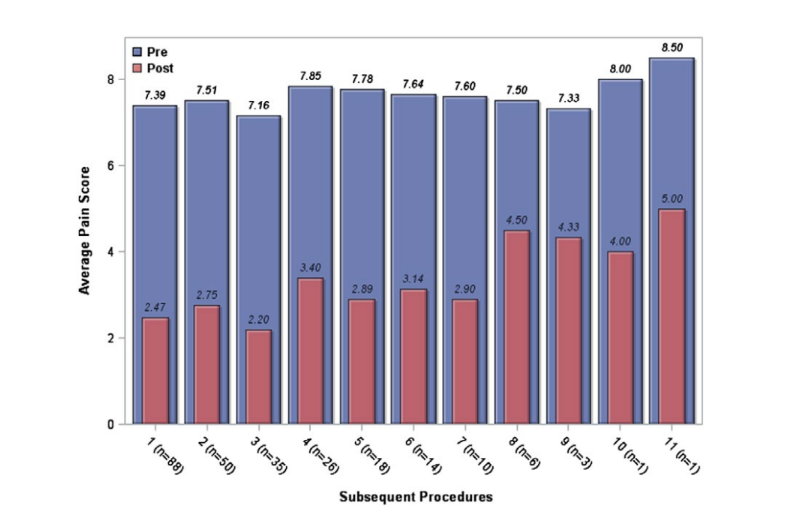
Большинство выборки (57%) получили как минимум 2 блока в течение периода исследования. Последующие SSPGB анализировались отдельно. При анализе результатов последующих процедур медиана оценки боли по шкале Ликер до процедуры в этой группе составила 8. Медиана оценки боли после процедуры составила 3 (IQR = 1‐4). Медиана улучшения по шкале боли Ликер составила 4 балла (IQR = −6 до −3), что привело к среднему улучшению боли на 64.1% (±27). Рисунок 4 показывает, что эффективность блока SPG не уменьшалась с повторными инъекциями. У пациентов наблюдалось сопоставимое снижение тяжести боли при повторных инъекциях.
Серьезных осложнений процедуры не было. У одного пациента развилась временная паралич шестой черепной нерва, который полностью разрешился примерно через 6 часов.
Обсуждение
Региональный анестезирующий блок SPG с использованием супразигоматического подхода представляет собой инновационный и важный вариант для прерывания SM у пациентов, которые не реагируют на стандартные рецептурные противомигренозные препараты. Известно, что SPG играет неотъемлемую роль в патофизиологии лицевой боли и тройничной автономной цефалгии, но его точная роль в мигрени не совсем понятна. В этом исследовании мы измеряли пред- и постпроцедурные показатели боли у пациентов с SM, которые получили SSPGB. Через 30 минут после лечения общее снижение боли среди пациентов было статистически значимым. Когда мы впервые начали выполнять SSPGB в нашей клинике головной боли, наши специалисты по головной боли отметили, что это немедленно стало методом выбора для пациентов с SM, устраняя необходимость в использовании услуг отделения неотложной помощи или стационарных услуг. Большинство пациентов испытали немедленное значительное облегчение боли и при повторных эпизодах SM возвращались в клинику для повторного лечения SSPGB.
Кэди и др. продемонстрировали, что повторная стимуляция SPG в течение 6 недель приводит к снижению тяжести и продолжительности мигрени у пациентов, страдающих хронической мигренью, с отличной от нашей исследования популяцией пациентов и болевым синдромом. Однако шесть недель - это длительный период для достижения терапевтического облегчения, особенно у пациентов с сильной болью.
При правильной идентификации ориентиров эта процедура может быть легко выполнена менее чем за 2 или 3 минуты. Этот подход хорошо зарекомендовал себя у челюстно-лицевых хирургов и используется в стоматологических процедурах. Кроме того, Раддер и коллеги отметили большую пользу от использования супразигоматического подхода для блока верхнечелюстного нерва при удалении зубов, чем при использовании инфразигоматического подхода. Большинство их пациентов не испытывали значительного дискомфорта с этим подходом. Инфразигоматический транскороной подход под флюороскопией использовался Теппером и коллегами при имплантации нейростимуляторов для лечения мигрени; однако пациенты испытывали значительный дискомфорт, и был рассмотрен альтернативный подход. Метод SSPGB, использованный в нашем исследовании, обеспечил быстрый, эффективный и безопасный региональный анестезирующий блок для SPG.
Шаффер и др. лечили пациентов с мигренью с помощью интраназального блока SPG в отделении неотложной помощи. Хотя исследование не показало значительного уменьшения боли по сравнению с плацебо, наблюдалось стойкое уменьшение боли через 24 часа после лечения. Это продемонстрировало, что анестезирующий блок SPG продолжал быть эффективным в снижении боли на период, превышающий период полураспада используемого агента. В сравнении, снижение боли в нашем исследовании достигло статистической значимости.
IV-DHE в настоящее время принимается сообществом как золотой стандарт для купирования SM. В оригинальном исследовании с IV-DHE 49 из 55 пациентов были полностью свободны от боли через 48 часов после лечения. Хотя эти данные могут свидетельствовать о том, что IV-DHE более эффективен, многие пациенты в нашей практике изначально не реагировали на DHE, а реагировали на лечение только при его проведении в течение 3-5 дней. В другом исследовании с использованием IV-DHE в отделении неотложной помощи для SM только 3 из 32 пациентов испытали облегчение симптомов после лечения, и 15 пациентов сообщили о стойкой сильной головной боли.
Средняя стоимость стационарного лечения варьируется от 5000 до 7000 долларов для педиатрических пациентов, леченных с помощью IV-DHE, что предполагается сопоставимым с таковой в взрослой популяции. Стоимость инъекции SSPGB в нашей клинике головной боли составляет примерно 160 долларов. У пациентов с сосудистыми, почечными, печеночными и сердечными заболеваниями DHE строго противопоказан, в то время как у SSPGB таких противопоказаний нет.
Основным ограничением нашего исследования является отсутствие данных о долгосрочном наблюдении за оценкой боли. Наше исследование оценивало только немедленные (через 30 минут после процедуры) эффекты блока SPG. Мы не оценивали долгосрочные данные о продолжительности облегчения боли и о том, испытывали ли эти пациенты рецидивирующую мигрень в дни и недели после процедуры. Это ретроспективное исследование было разработано для изучения безопасности и немедленной эффективности в обеспечении облегчения боли в условиях SM. Необходимо провести проспективное исследование для оценки долгосрочного эффекта блока SPG. Текущее исследование не контролировало никаких сопутствующих факторов, таких как автономные симптомы до процедуры.
Большинство пациентов сообщили о немедленном облегчении вегетативных симптомов после процедуры, даже до полного контроля боли. Поскольку SPG играет роль в медиировании тройнично-вегетативного рефлекса, блокада может потенциально облегчить вегетативные симптомы, что не было систематически оценено в нашем исследовании. Третьим ограничением является то, что наше исследование не имело плацебо-контроля.
Практикующим врачам следует проявлять осторожность при выполнении блокады SPG, так как существует несколько потенциальных осложнений, включая паралич абдукционного или лицевого нерва. Повреждение верхней челюстной артерии, которая анатомически расположена близко к SPG, не было зафиксировано в нашем исследовании. Раддер и коллеги сообщили, что риск повреждения верхнечелюстной артерии при использовании супразигоматического подхода отсутствует.
В нашем исследовании был зафиксирован один случай неблагоприятной реакции в виде временного паралича абдукционного нерва. В нашей клинике головной боли за последние 8 лет было выполнено почти 1000 блокад SPG, но данные о уровнях боли до и после процедуры у пациентов с SM были доступны только в 25% случаев, при этом ни паралича лицевого нерва, ни повреждения верхнечелюстной артерии в этой подгруппе не было зафиксировано. Неблагоприятные эффекты оценивались сразу после процедуры, через 30 минут и во время последующих визитов. Пациенты также были проинструктированы связаться с врачом и сообщить о любых неблагоприятных реакциях после выписки.
Мы не считаем, что это чрезмерно агрессивная или сложная процедура. Она не более сложная или болезненная для пациентов, чем блокада затылочного или ушно-височного нерва или протокол инъекций ботулинического токсина для лечения хронической мигрени. В этом исследовании частота пациентов, которые проходили повторные блокады, свидетельствует о том, что эта процедура хорошо переносится и приносит значительное облегчение боли. Большинство пациентов, которые испытали немедленное облегчение боли после процедуры, сообщили о длительном эффекте.
Мы планируем продолжить оценку этой техники с помощью проспективного, рандомизированного контролируемого исследования с плацебо для оценки длительного ответа на боль после SSPGB.
Заключение
Пациенты с СМ, которые получили SSPGB в нашей клинике головной боли, испытали статистически значительное снижение самооцененной боли в течение 30 минут. SSPGB может предоставить относительно недорогое, терапевтическое абортивное лечение для пациентов с СМ, что, в свою очередь, снизит количество посещений пациентов в отделении неотложной помощи и необходимость госпитализации. Отсутствие побочных реакций на это лечение также увеличивает соотношение пользы и риска. Дополнительные испытания необходимы для подтверждения этих выводов.
Дев Мехта, Меган С. Лири, Хуссам А. Якуб, Мохаммед Эль-Хунджул, Хоуп Кинкейд, Виталий Косс, Катрина Вахтер, Дон Малиция, Барри Глассман, Джон Е. Кастальдо
Ссылки
- Адельсманн А, Саккомани П, Дрейер Е, да Коста АЛ. Лечение статуса мигренозус с помощью общего наркоза: клинический случай. Braz J Anesthesiol. 2015;65:407‐410.
- Инсинга РП, Нг-Мак ДС, Хэнсон МЕ. Затраты, связанные с амбулаторным, экстренным и стационарным лечением мигрени в США. Cephalalgia. 2011;31:1570‐1575.
- Лукадо Дж, Паэз К, Эликсхаузер А. Агентство по исследованию и качеству здравоохранения. Головные боли в больницах и отделениях неотложной помощи США, 2008. Бетесда, Мэриленд: Проект затрат и использования в здравоохранении. Статистический краткий отчет #111. https://www.hcup-us. ahrq.gov/reports/statbriefs/sb111.pdf. Опубликовано в мае 2011 года. Доступ 14 марта 2018 года.
- Пиагку М, Деместиха Т, Трупис Т и др. Птеригопалатинный ганглий и его роль в различных болевых синдромах: от анатомии до клинической практики. PainPract. 2012;12:399‐412.
- Сиессере С, Витти М, Де Соуза ЛГ, Семприни М, Ийомаса ММ, Регало СК. Анатомическая вариация черепных парасимпатических ганглиев. Braz Oral Res. 2008;22:101‐105.
- Инь В. Радиочастотные поражения спенопалатинного ганглия в лечении лицевой боли. Tech Reg Anest Pain Manag. 2004;8:25‐29.
- Ярницкий Д, Гур-Ариэ И, Баджа ЗХ и др. Награда Вольфа 2003 года: возможные парасимпатические вклады в периферическую и центральную сенсибилизацию при мигрени. Headache. 2003;43:704‐714.
- Гоадсби ПДж, Липтон РБ, Феррари МД. Мигрень — текущее понимание и лечение. N Engl J Med. 2002;346:257‐270.
- Гоадсби ПДж, Холланд ПР, Мартинс-Оливейра М и др. Патофизиология мигрени: расстройство сенсорной обработки. Physiol Rev. 2017;97:553‐622.
- Майзелс М, Гейгер АМ. Интранозальный лидокаин для лечения мигрени: рандомизированное испытание и открытое наблюдение. Headache. 1999;39:543‐551.
- Кэди Р, Сапер Дж, Декстер К, Мэнли Х. Двойное слепое, контролируемое плацебо исследование повторной трансназальной блокады спенопалатинного ганглия с Tx360® в качестве острого лечения хронической мигрени. Headache. 2015;55:101‐116.
- GraphPad Software, Inc., Контрольный список анализа: парные выборки Уилкоксона. Получено из: https://www.graphpad.com/guides/prism/7/statistics/index.htm?the_results_of_a_wilcoxon_matched_pairs_ test.htm. Опубликовано в 2017 году. Доступ 14 марта 2018 года.
- Чионо Дж, Ро О, Бринжюе С и др. Двусторонняя блокада верхнечелюстного нерва для операции по исправлению заячьей губы у детей: проспективное, рандомизированное, двойное слепое исследование против плацебо. Anesthesiology. 2014;120:1362‐1369.
- Раддер К, Шах А, Фатима С, Котари С, Закаулла С, Сиддика А. Эффективность и целесообразность подхода через фронтозигоматический угол для экстраоральной блокады верхнечелюстного нерва в челюстно-лицевой хирургии: описательное клиническое испытание. J Maxillofac Oral Surg. 2014;13:231‐237.
- Теппер С, Резаи А, Нарузе С, Штайнер К, Мохаджер П, Ансариния М. Острое лечение не поддающейся терапии мигрени с помощью электрической стимуляции спенопалатинного ганглия. Headache. 2009;49:983‐989.
- Шаффер ДжТ, Хангер БР, Болл КМ, Уивер КС. Нев invasive блокада спенопалатинного ганглия для острого головной боли в отделении неотложной помощи: рандомизированное контролируемое плацебо испытание. Ann Emerg Med. 2015;65:503‐510.
- Нил Р. Повторное внутривенное дигидроэрготамин как терапия для не поддающейся терапии мигрени. Neurology. 1986;36:995‐997.
- Галлахер РМ. Экстренное лечение не поддающейся терапии мигрени. Headache. 1986;26:74‐75.
- Нельсон ГР, Бэйл ДжФ, Керр ЛМ. Результаты и стоимость стационарного лечения внутривенным дигидроэрготамином для лечения рефрактерной головной боли у детей. Pediatr Neurol. 2017;66:76‐81.
Para continuar aprendiendo y acceder a todos los demás artículos, entre o cree una cuenta
O inicie sesión / cree una cuenta aquí:

