Ácido hialurónico en la extracción dental: una revisión sistemática y metaanálisis de ensayos preclínicos y clínicos
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivos Evaluar si en animales o pacientes con ≥ 1 diente extraído, la aplicación de ácido hialurónico (HyA) resulta en una curación superior y/o en una mejor gestión de complicaciones en comparación con cualquier otro tratamiento o sin tratamiento.
Materiales y métodos Se buscaron tres bases de datos hasta abril de 2022. Los criterios de elegibilidad más relevantes fueron (1) aplicación local de HyA como complemento a la extracción dental o como tratamiento de osteítis alveolar, y (2) reporte de datos clínicos, radiográficos, histológicos o reportados por los pacientes. La formación de nuevo hueso y/o calidad se consideraron parámetros de resultado principales en estudios preclínicos, mientras que el dolor, la hinchazón y el trismo se definieron como parámetros de resultado principales en estudios clínicos.
Resultados Se incluyeron cinco estudios preclínicos y 22 estudios clínicos (1062 pacientes en la evaluación final). En ensayos preclínicos, se aplicó HyA en el alvéolo de extracción. Aunque se observó un efecto positivo de HyA en todos los estudios individuales sobre la formación ósea, este efecto no fue confirmado por el metaanálisis. En estudios clínicos, HyA se aplicó en el alvéolo de extracción o se utilizó como spray o enjuague bucal. La aplicación de HyA después de la extracción no quirúrgica de dientes normalmente erupcionados puede tener un efecto positivo en la curación de los tejidos blandos. Basado en metaanálisis, la aplicación de HyA después de la extracción quirúrgica de terceros molares inferiores (LM3) resultó en una reducción significativa en la percepción del dolor 7 días después de la operación en comparación con la falta de manipulación adicional de la herida o la aplicación de un placebo/portador. El dolor postoperatorio temprano, el trismo y la extensión de la hinchazón no se vieron afectados.
Conclusiones La aplicación de HyA puede tener un efecto positivo en la reducción del dolor después de la extracción de LM3, pero no después de la extracción de dientes que han erupcionado normalmente.
Relevancia clínica La aplicación de HyA puede tener un efecto positivo en la reducción del dolor después de la extracción quirúrgica de LM3, pero no parece tener ningún impacto en otras complicaciones o después de la extracción de dientes que han erupcionado normalmente. Además, parece no reducir la modelación del reborde alveolar post-extracción, aunque los estudios preclínicos muestran una formación ósea mejorada.
Introducción
Aunque el proceso de curación tras la extracción dental suele ser sin complicaciones, cualquier dolor posterior puede comprometer el bienestar de los pacientes, mientras que también pueden ocurrir complicaciones. Por ejemplo, la extracción quirúrgica de muelas del juicio semi/totalmente impactadas se asocia regularmente con un dolor significativo, hinchazón y trismo, que se agravan en caso de desarrollo de osteítis alveolar (OA), también llamada alveolo seco. La OA se considera una de las complicaciones más frecuentes de la extracción dental, ocurriendo en el 20 al 35% de los casos de extracción quirúrgica de muelas del juicio inferiores (LM3), y en el 1.4 al 5% de la extracción (no quirúrgica) de dientes que han erupcionado regularmente. Además de tales complicaciones tempranas, que afectan negativamente la calidad de vida de los pacientes, la curación comprometida del alvéolo de extracción también puede llevar a defectos significativos en el tejido duro, ya sea en el sitio de extracción o en los dientes vecinos. Por ejemplo, se ha informado que los defectos periodontales profundos, p. ej., profundidades de sondaje de bolsillo ≥ 7 mm, en el aspecto distal del segundo molar ocurren en casi uno de cada cuatro pacientes después de la extracción de LM3 impactadas.
Para reducir la morbilidad del paciente y mejorar la cicatrización de los tejidos blandos y duros de los alvéolos de extracción, así como para el tratamiento de complicaciones tempranas (por ejemplo, AO), se han probado varios materiales y/o técnicas quirúrgicas (por ejemplo, aplicación de esponjas de colágeno, geles, derivados sanguíneos, varios materiales de injerto). Recientemente se ha puesto una atención creciente en el ácido hialurónico (HyA), debido a sus propiedades antiinflamatorias y antibacterianas y sus efectos positivos en la cicatrización de tejidos blandos y duros. Específicamente, estudios preclínicos han demostrado un efecto positivo, histológicamente, en la cicatrización de defectos óseos y periodontales después de la aplicación de HyA. Basado en los resultados de los metaanálisis de una revisión sistemática de ensayos clínicos sobre la extracción quirúrgica de terceros molares, se informó una reducción significativa del dolor en el tercer y séptimo día postoperatorio, pero no en el trismo, en los grupos que recibieron productos a base de HyA. En este contexto, falta una evaluación integral de la evidencia preclínica y clínica disponible sobre el efecto de la aplicación de HyA en relación con la extracción dental en general, incluyendo la prevalencia, extensión y/o manejo de complicaciones. Por lo tanto, la presente revisión sistemática abordó la siguiente pregunta PICOS (población (P), intervención (I), comparación (C), resultados (O) y diseño del estudio (S)): “En animales/pacientes que tienen ≥ 1 diente extraído, ¿resulta la aplicación de HyA sola o combinada con otros productos/transportadores en una cicatrización de tejidos blandos/duros superior, morbilidad reducida, tasa de complicaciones reducida y/o mejor manejo de complicaciones en comparación con cualquier otro tratamiento o sin tratamiento?”.
Material y métodos
Protocolo del estudio y registro del estudio
El presente trabajo siguió las pautas disponibles para realizar revisiones sistemáticas de estudios preclínicos y clínicos (Elementos de Informe Preferidos para Revisiones Sistemáticas y Meta-análisis (PRISMA); Apéndice 1). Ambos protocolos fueron registrados en el registro internacional prospectivo de revisiones sistemáticas (PROSPERO), es decir, uno para el preclínico (CRD42021266190) y uno para los ensayos clínicos (CRD42021266183).
Fuentes de información, búsqueda de literatura y criterios de elegibilidad
La búsqueda de literatura se realizó en 3 bases de datos (es decir, Ovid (MEDLINE y CENTRAL), EMBASE y Pubmed) el 14 de octubre de 2021, y se actualizó el 7 de abril de 2022. Los detalles de la búsqueda, incluidos los términos clave, se presentan en el Apéndice 2. Después de eliminar los duplicados, los títulos y resúmenes fueron revisados para determinar la elegibilidad por 2 revisores (DD, TL) y se calcularon los valores kappa para los textos completos revisados y las publicaciones finalmente incluidas. Cualquier ambigüedad se resolvió en discusión con un tercer autor (KB). Independientemente del tipo de estudio, se incluyeron estudios si (a) estaban escritos en inglés o alemán, (b) el texto completo estaba disponible, y (c) se proporcionaron datos clínicos, radiográficos o histológicos. Los criterios adicionales de inclusión para los estudios preclínicos fueron (a) experimentos controlados aleatorios y no aleatorios, y (b) aplicación local de un producto a base de HyA solo o en combinación con otro producto en ≥ 1 de los grupos después de la extracción de ≥ 1 diente. Los criterios adicionales de inclusión para los estudios clínicos fueron (a) ensayo controlado aleatorio (RCT), ensayo controlado (CT) o series de casos con un mínimo de 10 pacientes, y (b) aplicación local de un producto a base de HyA solo o en combinación con otro producto en ≥ 1 de los grupos ya sea después de la extracción de ≥ 1 diente o como tratamiento de AO de ≥ 1 diente.
Recolección y extracción de datos
Dos autores (DD, KB) extrajeron los datos de forma independiente dos veces y cualquier desacuerdo se resolvió en discusión con un tercer autor (AS). De los estudios preclínicos, se extrajo la siguiente información: (a) primer autor, (b) año de publicación, (c) diseño del estudio, (d) modelo de tratamiento, (e) sitio de tratamiento, (f) especie, (g) forma de aplicación de HyA, (h) grupos de tratamiento, (i) período de seguimiento, (j) parámetros de resultado disponibles, y (k) detalles de financiación. De manera similar, se extrajo la siguiente información de los ensayos clínicos: (a) primer autor, (b) año de publicación, (c) diseño del estudio, (d) características del paciente (es decir, género, edad, estado de salud y de tabaquismo), (e) criterios de inclusión específicos del sitio, (f) número de sitios en la línea de base y en el último seguimiento, (g) grupos de tratamiento, (h) detalles del producto, (i) forma de aplicación, (j) período de seguimiento, (k) medicación postoperatoria, (l) parámetros de resultado disponibles, (m) entorno clínico (es decir, práctica privada o entorno universitario), y (n) detalles de financiación. Finalmente, se resumió toda la información disponible sobre los productos a base de HyA, es decir, (a) nombre comercial, (b) fabricante, (c) concentración, (d) forma química, y (e) forma de aplicación.
Evaluación del riesgo de sesgo
Para los ensayos preclínicos, se utilizó la herramienta de riesgo de sesgo (RoB) de SYRCLE. Como se sugirió, se evaluaron los siguientes criterios como “bajo”, “alto” o “poco claro” RoB: (1) generación de secuencias, (2) características basales, (3) ocultación de la asignación, (4) alojamiento aleatorio, (5) enmascaramiento de cuidadores o investigadores, (6) evaluación aleatoria de resultados, (7) enmascaramiento del evaluador de resultados, (8) datos de resultados incompletos, (9) informes selectivos de resultados y (10) otras fuentes de sesgo. Para cada estudio, se calcularon el número y el porcentaje de ítems puntuados positivamente (es decir, “puntuación de calidad”).
Para el ECA, se utilizó la herramienta RoB 2.0 de la Colaboración Cochrane. El RoB se juzgó como “bajo”, “alto” o “algunas” preocupaciones para cada uno de los siguientes criterios: (1) proceso de aleatorización, (2) desviaciones de las intervenciones previstas, (3) datos de resultados faltantes, (4) medición del resultado, (5) selección del resultado informado y (6) riesgo general de sesgo. Para los ensayos no aleatorizados, se utilizó la herramienta ROBINS-I. El riesgo de sesgo se juzgó como “bajo”, “moderado”, “grave”, “crítico” o “sin información” para los siguientes criterios: (1) confusión, (2) selección de participantes, (3) clasificación de intervenciones, (4) desviaciones de las intervenciones previstas, (5) datos de resultados faltantes, (6) medición del resultado, (7) selección del resultado informado y (8) riesgo general de sesgo.
La evaluación fue realizada por 2 revisores (DD, KB), y en caso de cualquier ambigüedad se alcanzó un consenso mediante discusión con un tercer autor (AS). Un autor repitió la evaluación (DD).
Síntesis de resultados y análisis estadístico
Para los estudios preclínicos, se consideraron la formación de nuevo hueso y el volumen óseo por volumen de tejido (BV/TV) como parámetros de resultado principales, mientras que para los estudios clínicos se definieron el dolor, el trismo y la hinchazón como parámetros de resultado principales. Los datos fueron extraídos del texto, tablas y figuras, calculados y/o se contactó a los autores de las publicaciones originales.
En caso de que se identificaran al menos 2 estudios aleatorizados con un diseño de estudio comparable (es decir, indicación de tratamiento, régimen de HyA, período de seguimiento, evaluación de resultados), se realizó un meta-análisis por pares. Los meta-análisis se limitaron a ECA, incluyendo así estudios de mayor calidad metodológica. Los grupos que aplicaban HyA fueron comparados ya sea con un grupo de control negativo (es decir, sin paso de tratamiento adicional) o con un grupo de control que aplicaba otro tratamiento, incluyendo un placebo o el material portador del grupo de prueba (“placebo/portador”). Se realizaron meta-análisis por pares para cada comparación separada así como en general. Se utilizó la máxima verosimilitud restringida para calcular la heterogeneidad (τ2) y el ajuste del error estándar de Knapp–Hartung para tener en cuenta el pequeño número de estudios. Se calculó la diferencia media entre el grupo de control y el grupo de prueba, el error estándar de la diferencia media y el intervalo de confianza (IC) del 95%. En estudios que utilizaban diseño de boca partida, los datos se trataron como dependientes al calcular el error estándar de la diferencia media estableciendo r = 0.5. Se utilizó la prueba de chi-cuadrado para evaluar la heterogeneidad, y un p-valor < 0.1 se consideró indicativo de heterogeneidad significativa. Además, se realizó la prueba I2 para homogeneidad para cuantificar la extensión de la heterogeneidad y en caso de al menos 3 estudios comparables se calculó adicionalmente el intervalo de predicción del 95%. El análisis estadístico se realizó con STATA/IC 17.0 para Mac.
Calidad de la evidencia (GRADE)
La certeza de la evidencia meta-analítica de los ensayos preclínicos y clínicos incluidos aquí fue resumida por el Grading of Recommendations Assessment, Development and Evaluation (GRADE). Para ambos ensayos preclínicos y clínicos, se utilizó el software GRADEpro GDT (Herramienta de Desarrollo de Guías, Universidad McMaster y Evidence Prime, 2022) para calificar la calidad de la evidencia de los resultados.
Resultados
Selección y características del estudio
La búsqueda de literatura se presenta en el Apéndice 3; se identificaron 147 referencias potenciales y, después de eliminar los duplicados, quedaron 90 estudios para la revisión de títulos y resúmenes. Se eliminaron un total de 57 estudios por diversas razones, dejando 33 estudios para el análisis del texto completo. Después de excluir otros 6 estudios en los que el tipo de producto no cumplía con los criterios de inclusión o el diseño del estudio era incorrecto, se incluyeron 5 estudios preclínicos y 22 estudios clínicos en la presente revisión sistemática. Ambos revisores coincidieron perfectamente en los estudios elegidos para la revisión del texto completo (kappa de Cohen = 1; 100% de acuerdo), mientras que se logró un acuerdo sustancial para la inclusión final de estudios (kappa de Cohen = 0.61; 84.9% de acuerdo).
En todos los ensayos preclínicos, se aplicó HyA en el alvéolo dental después de la extracción de dientes erupcionados regularmente. Los ensayos clínicos se dividieron en 3 grupos según la indicación de tratamiento: (1) extracción quirúrgica de LM3 (RCT (n = 10), CT (n = 1)), (2) extracción de dientes erupcionados regularmente (RCT (n = 7), estudio de boca partida no aleatorizado (n = 1), serie de casos prospectiva (n = 1)), y (3) tratamiento de AO (RCT (n = 1), serie de casos prospectiva (n = 1)).
Población del estudio
En cuanto a los estudios preclínicos, 2 estudios incluyeron de 5 a 11 ratas Holtzman o de 5 a 6 ratas Wistar en los diversos grupos, respectivamente, mientras que 3 estudios utilizaron perros beagle (20 perros en total). En los estudios con ratas, se aplicó HyA en el alvéolo de extracción en animales sanos o diabéticos, mientras que en los estudios con perros, se aplicó HyA en alvéolos de extracción infectados (Tabla 1).
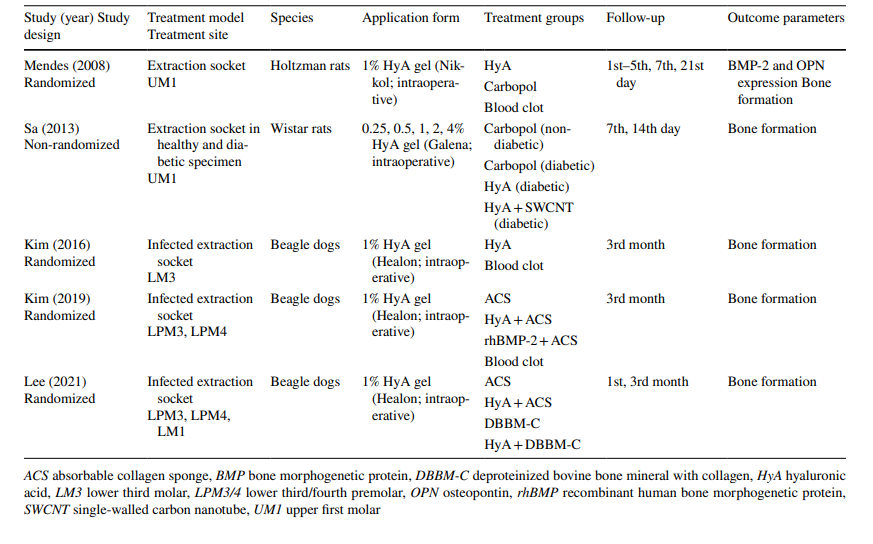
Los estudios clínicos sobre la extracción quirúrgica de LM3, la extracción de dientes erupcionados regularmente y el tratamiento de AO incluyeron en la evaluación final 603, 349 y 110 pacientes, respectivamente, contribuyendo con 306, 226 y 90 sitios tratados con HyA, y 370, 257 y 20 sitios de control/no tratados con HyA, respectivamente (Tabla 2). En la mayoría de los estudios, los pacientes eran sistemáticamente sanos, mientras que un estudio cada uno se refería a pacientes con enfermedad hepática crónica o diabéticos; 4 estudios no informaron sobre el estado de salud de los pacientes. El estado de tabaquismo se informó en 12 estudios; 8 estudios incluyeron solo no fumadores, 2 estudios incluyeron pacientes que fumaban ≤ 10 cigarrillos/día, y 2 estudios incluyeron ambos, es decir, no fumadores y fumadores. Diez estudios no proporcionaron ninguna información sobre el estado de tabaquismo.
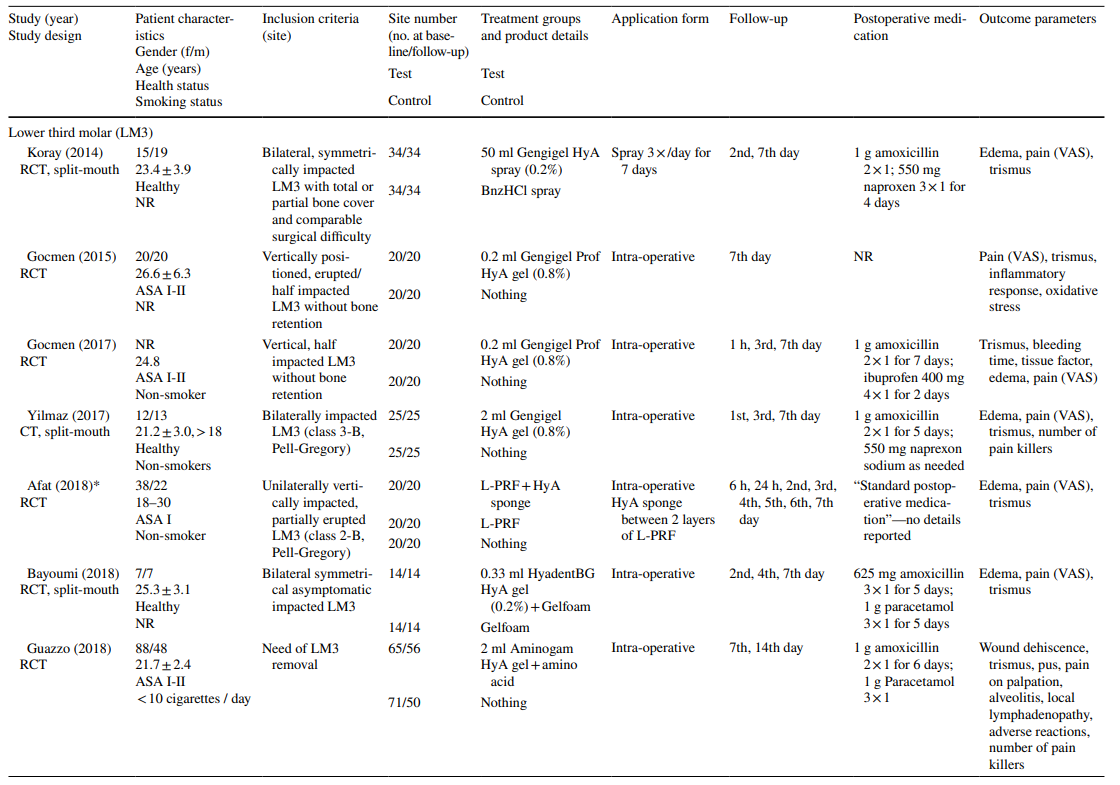
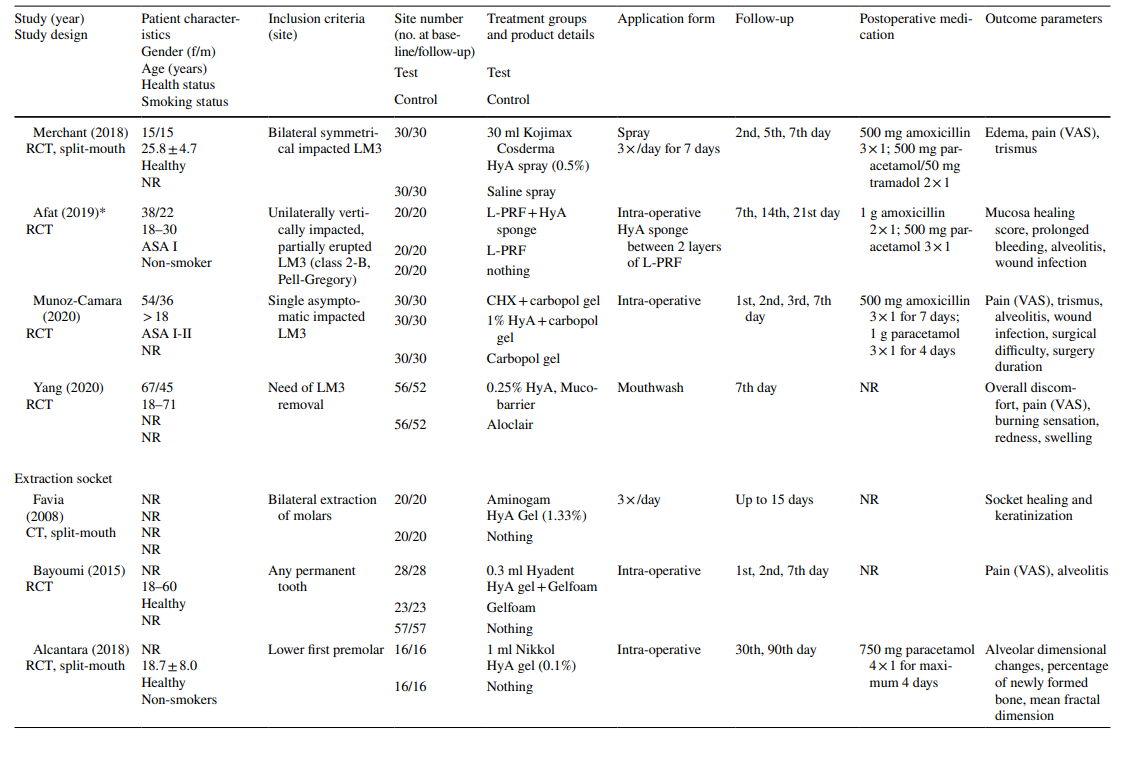
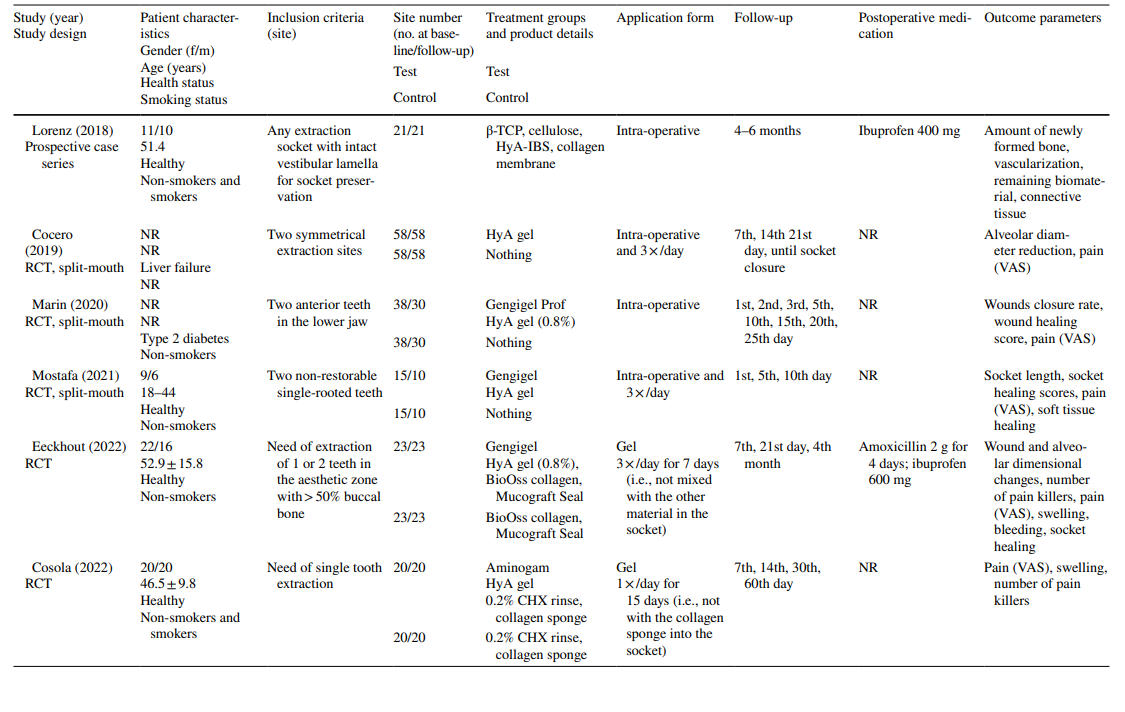
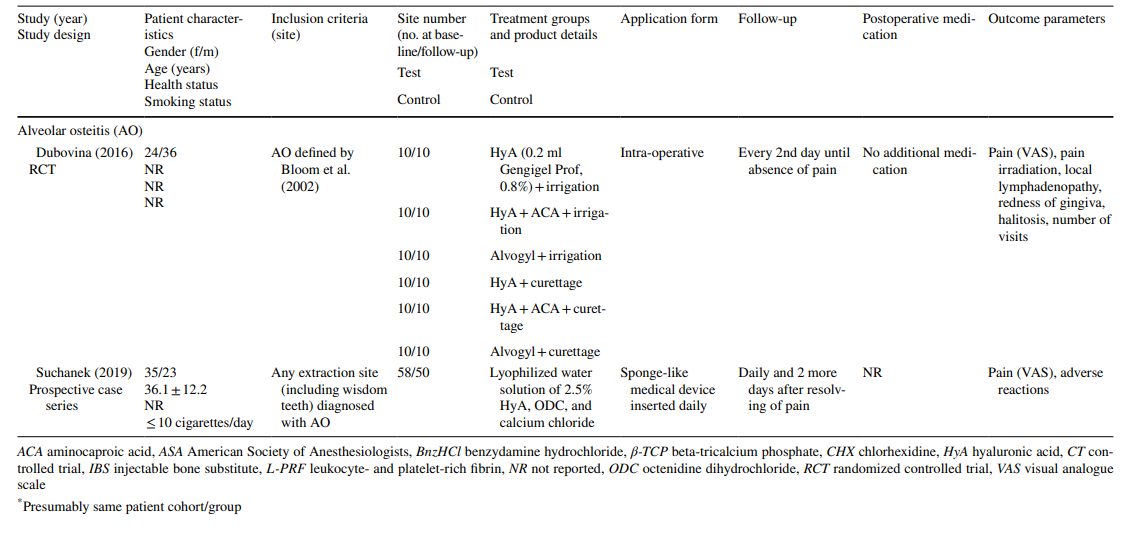
En los estudios sobre la extracción de LM3, los dientes eran asintomáticos, predominantemente impactados verticalmente o medio impactados, permitiendo el cierre primario de la herida después de la extracción quirúrgica. La mitad de los estudios sobre la extracción de dientes erupcionados regularmente incluían solo dientes de una raíz (ya sean dientes anteriores o premolares), mientras que la otra mitad incluía ya sea molares o cualquier tipo de diente. Ambos estudios en el grupo de tratamiento de AO incluyeron todos los tipos de dientes que cumplían con los criterios de AO según Blum et al. (2002).
Intervención del estudio
En todos los ensayos preclínicos, se aplicó HyA como un gel en el alvéolo de extracción inmediatamente después de la extracción del diente, ya sea solo (n = 3) o en combinación con una esponja de colágeno absorbible (n = 2) (Tabla 1).
En la mayoría de los estudios clínicos (n = 19) (Tabla 2), HyA se aplicó como un gel intraoperatoriamente en el alvéolo de extracción o postoperatoriamente en el sitio de extracción, ya sea solo (n = 13) o con algún portador (es decir, esponja de colágeno absorbible (n = 3), fibrina rica en leucocitos y plaquetas (n = 2) o sustitutos óseos (n = 1)). En los 3 estudios clínicos restantes, HyA se utilizó ya sea como spray 3 veces al día durante 1 semana (n = 2) o como enjuague bucal (n = 1).
Información sobre HyA
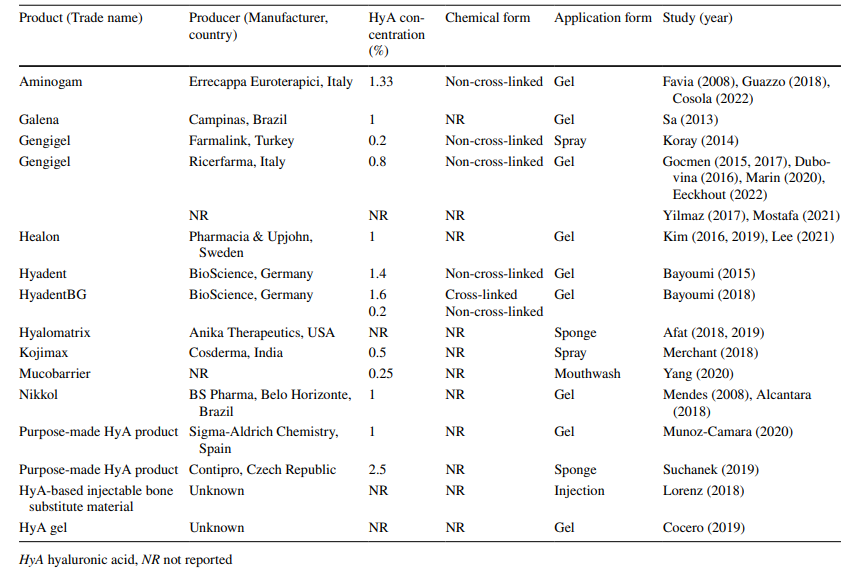
En los 5 estudios preclínicos y 22 estudios clínicos incluidos, se utilizaron 11 productos de HyA comerciales, 2 hechos en casa y 2 de origen desconocido (Tabla 3). En todos los estudios preclínicos (n = 5), HyA se aplicó como un gel, mientras que en los estudios clínicos HyA se aplicó como gel (n = 15), spray (n = 2), enjuague bucal (n = 1) o combinado con una esponja (n = 3) o material de sustitución ósea (n = 1) durante el proceso de fabricación. La concentración de HyA varió desde 0.2% en un spray, 0.25% en un enjuague bucal, hasta 2.5% en una esponja de HyA auto-combinada, mientras que en 5 estudios no se reportó la concentración de HyA. La forma química, es decir, no reticulada o reticulada, no se reportó en la mayoría de los estudios (n = 16), mientras que 10 estudios utilizaron HyA no reticulada, y un estudio combinó HyA no reticulada y reticulada.
Detalles del entorno clínico y financiación
Todos los ensayos preclínicos fueron financiados por subvenciones de investigación independientes, individuales o múltiples.
En un estudio clínico, se informó un diseño de estudio multicéntrico que incluía 8 centros médicos, mientras que todos los demás estudios clínicos se realizaron en un solo departamento en un entorno universitario. Once estudios clínicos no informaron sobre las fuentes de financiación, mientras que en 9 estudios clínicos la financiación fue proporcionada por el departamento; sin embargo, en 3 de estos 9 estudios, el gel de HyA fue proporcionado por el fabricante. En un solo estudio, la financiación fue proporcionada por 3 diferentes fundaciones de investigación.
Variables de resultado informadas y seguimiento
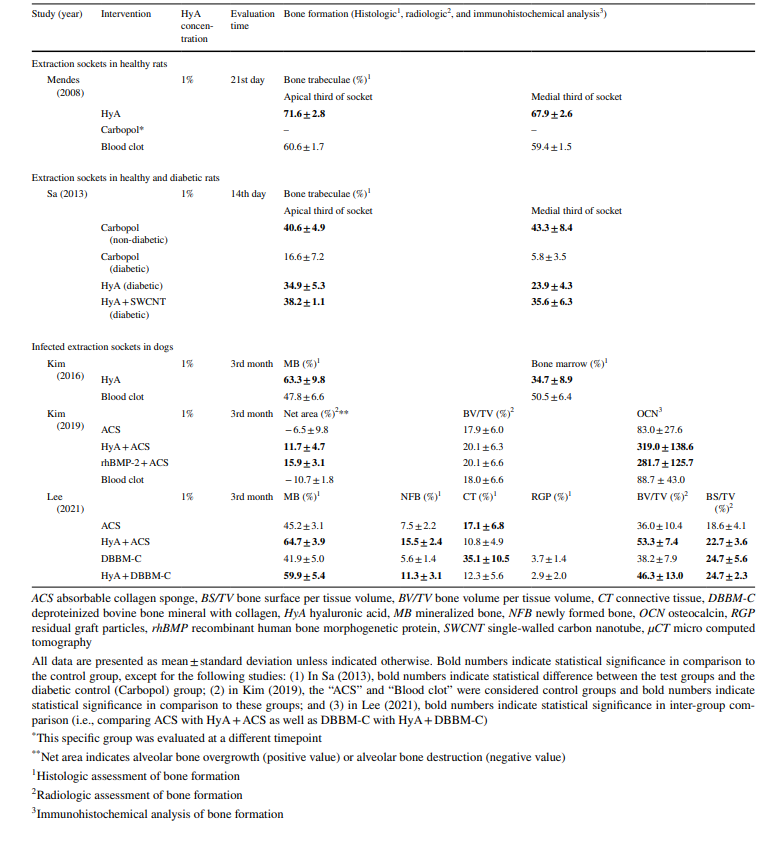
En los estudios preclínicos, la formación ósea se evaluó mediante diferentes métodos entre 14 días y 3 meses postoperatorios. Un estudio investigó además el nivel de proteína morfogenética ósea-2 y osteopontina (Tabla 1). Además, 4 estudios no registraron efectos secundarios después de la aplicación de HyA, mientras que un estudio no informó sobre la ausencia/presencia de efectos secundarios.
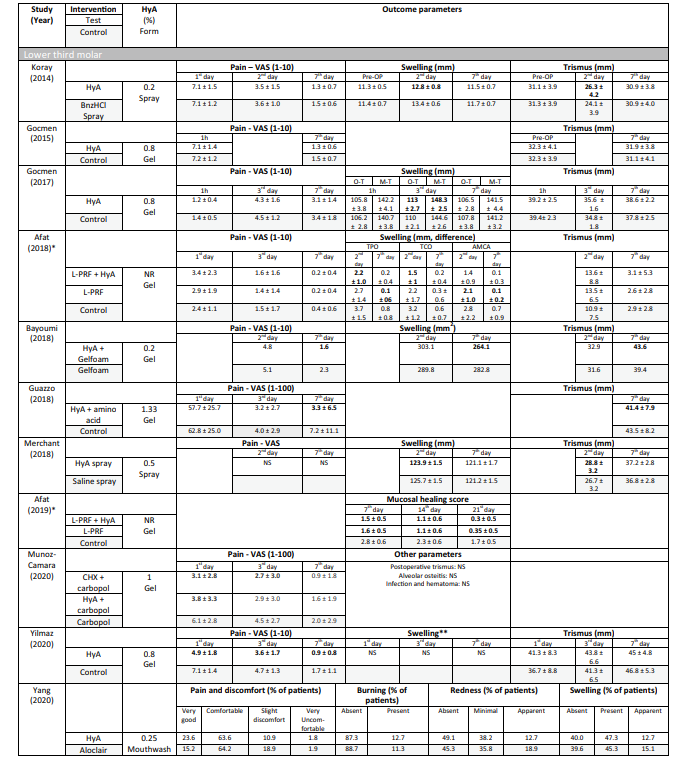
En los estudios clínicos, los parámetros de resultado evaluados variaron dependiendo de la indicación de tratamiento (Tabla 2). En los estudios sobre la extracción quirúrgica de LM3, la presencia de dolor medida por la escala analógica visual (EAV), la hinchazón y el trismo fueron los parámetros de resultado evaluados con mayor frecuencia. Otros parámetros evaluados con menos frecuencia fueron la presencia/ausencia de sangrado prolongado, la presencia/ausencia de dehiscencia de tejidos blandos, la velocidad de curación de la mucosa, la tasa de infección de AO/herida y los marcadores de laboratorio de inflamación, estrés oxidativo y curación de heridas. Entre los estudios sobre la extracción de dientes erupcionados regularmente, 3 publicaciones utilizaron diferentes puntuaciones de curación de alvéolos/tejidos blandos, 3 publicaciones evaluaron la cantidad de hueso recién formado y/o cambios dimensionales alveolares, 3 publicaciones evaluaron el dolor y un estudio evaluó la tasa de AO. Ambos estudios sobre el tratamiento de AO se centraron en la evaluación del dolor y las reacciones adversas. La mayoría de los estudios clínicos no registraron efectos secundarios después de la aplicación local de HyA, mientras que 6 estudios no mencionaron la ausencia/presencia de efectos secundarios. Un solo estudio que aplicó gel de HyA al 0.8% después de la extracción de LM3 informó un tiempo de sangrado significativamente prolongado después del cierre de la herida en comparación con el grupo de control; sin embargo, dado que la hemostasia se produjo dentro de un marco temporal fisiológico, esto no se consideró un evento adverso.
Resumen de los resultados de los estudios individuales
En todos los estudios preclínicos (Tabla 4), basados en análisis histológicos, radiológicos o inmunohistoquímicos, los grupos de prueba con HyA mostraron resultados significativamente mejores en comparación con el grupo de control en al menos uno de los parámetros relacionados con la formación ósea; esto fue independiente de la condición del alvéolo (saludable o infectado) y del tipo de tratamiento de control.
En 4 de 10 estudios clínicos sobre la extracción quirúrgica de LM3 (Tabla 5) que informaron sobre el dolor, se reportaron ventajas significativas para el grupo de prueba que usó HyA, en comparación con el grupo de control, en al menos un punto de tiempo postoperatorio. De manera similar, en 4 de 7 estudios y en 3 de 9 estudios que informaron sobre la hinchazón y el trismo, respectivamente, se reportaron ventajas significativas a favor de la aplicación de HyA en comparación con el grupo de control. En 3 de 4 estudios que informaron sobre la cicatrización de tejidos blandos después de la extracción de dientes erupcionados regularmente, se registró una cicatrización de tejidos blandos significativamente mejorada después de la aplicación de HyA en comparación con el grupo de control. Además, un estudio reportó una mejor formación ósea después de 30 días, un estudio reportó una reducción disminuida del diámetro alveolar después de hasta 21 días, mientras que 2 estudios reportaron ya sea ninguna diferencia entre los grupos o desventajas significativas para el grupo de prueba que usó HyA en términos de cambios dimensionales alveolares. Finalmente, la percepción del dolor fue reportada en 6 estudios, pero solo 2 estudios reportaron diferencias significativas entre los grupos a favor de la aplicación de HyA. Un estudio que evaluó el tratamiento de AO reportó un dolor postoperatorio significativamente menor después de la aplicación de HyA en comparación con la aplicación de alvogyl; el segundo estudio no tuvo grupo de control.
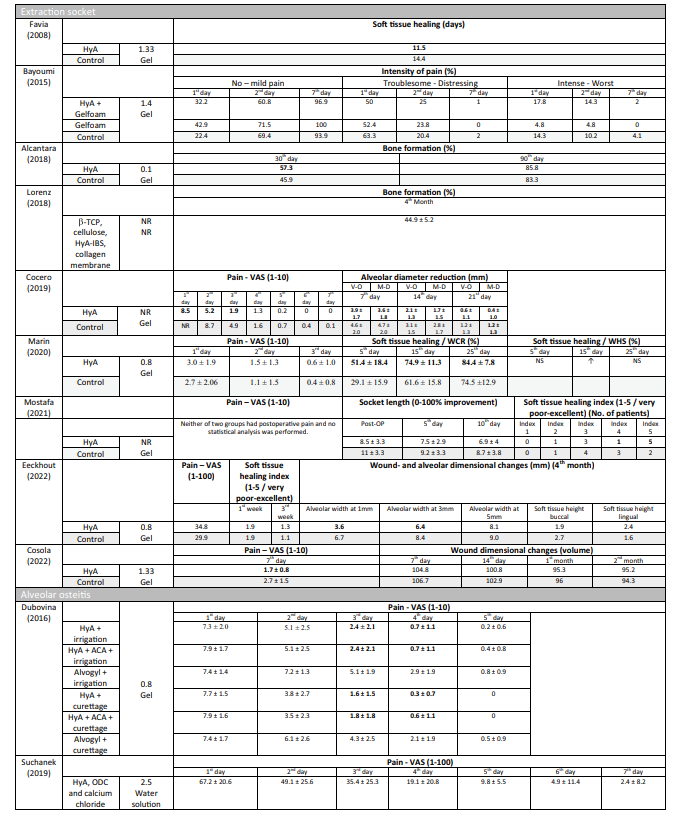

Síntesis de resultados
Estudios preclínicos—volumen óseo por volumen de tejido en ensayos preclínicos
Dos estudios preclínicos proporcionaron datos para resumir BV/TV evaluado radiográficamente 3 meses postoperatorios (Fig. 1). Los estudios compararon la aplicación de HyA en combinación con una esponja de colágeno absorbible versus la esponja de colágeno absorbible. En general, no se identificó una diferencia significativa entre los grupos (tamaño del efecto: 9.57; IC del 95%: − 86.22 a 105.36; p = 0.42), pero la heterogeneidad estadística entre los estudios fue significativa (I2 = 89.89%; p < 0.01).
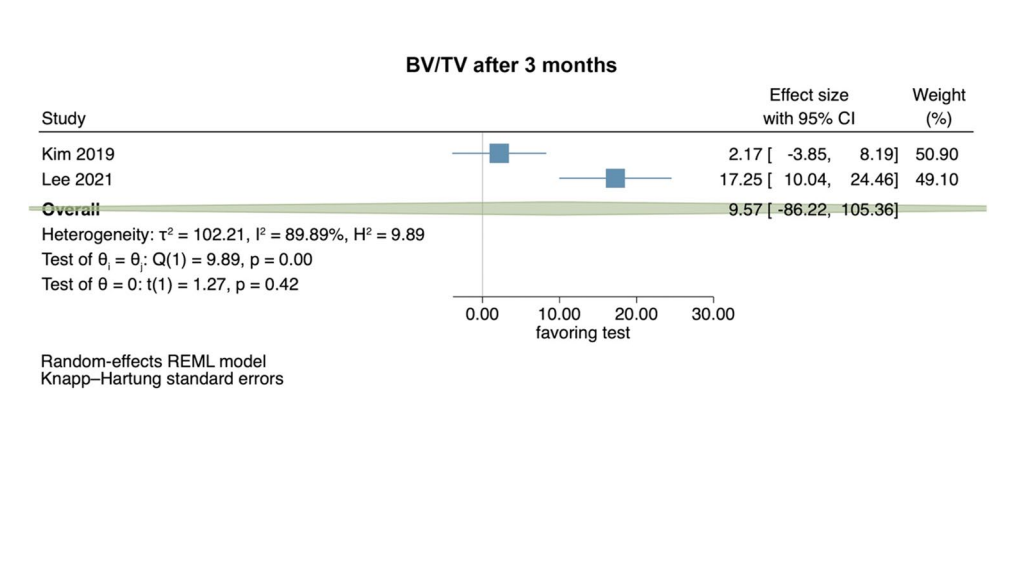
Estudios clínicos—evaluación del dolor 2–3 y 7 días después de la extracción quirúrgica de LM3
Basado en los resultados de 4 ECA, la percepción del dolor no mostró diferencias estadísticamente significativas entre los grupos de prueba y control 2–3 días postoperatorios (tamaño del efecto: 0.52; IC del 95%: − 0.34–1.38; p = 0.15), sin heterogeneidad estadística entre los estudios (I2 = 0.00%; p = 0.37). Análisis separados con 2 estudios cada uno comparando HyA con un grupo de control negativo (tamaño del efecto: 0.44; IC del 95%: − 3.24–4.12; p = 0.37) y HyA con un grupo de placebo/portador (tamaño del efecto: 0.78; IC del 95%: − 7.67–9.24; p = 0.45) también carecieron de significancia estadística (Fig. 2a).
Basado en los resultados de 5 ECA, la percepción del dolor 7 días postoperatorios fue significativamente menor en los grupos de prueba que aplicaron HyA (tamaño del efecto: 0.32; IC del 95%: 0.12–0.51; p = 0.01), sin heterogeneidad estadística entre los estudios (I2 = 0.00%; p = 0.84). Sin embargo, los análisis separados carecieron de significancia estadística para la comparación de HyA con un grupo de control negativo (3 estudios; tamaño del efecto: 0.27; IC del 95%: − 0.05–0.60; p = 0.07) y para la comparación de HyA con un grupo de placebo/portador (2 estudios; tamaño del efecto: 0.53; IC del 95%: − 0.48–1.54; p = 0.09; Fig. 2b).
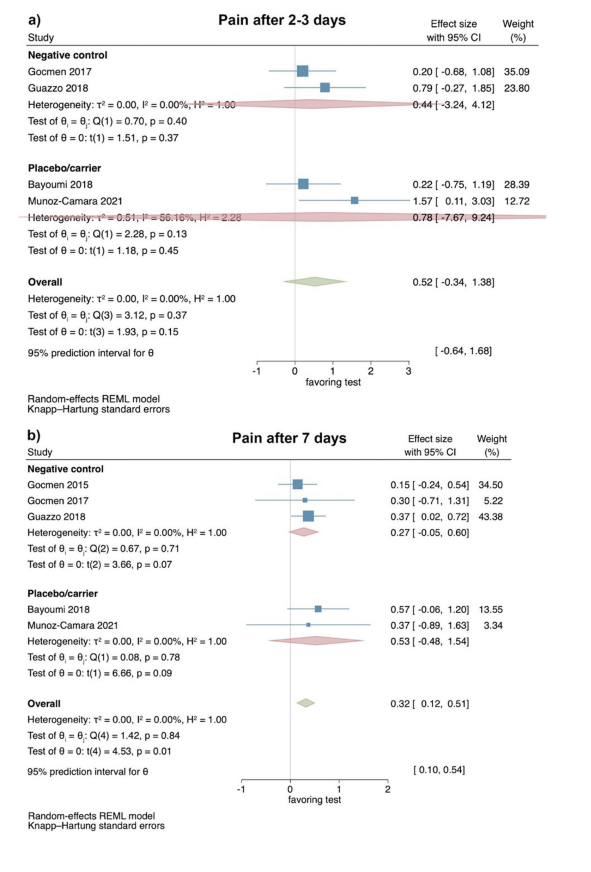
Estudios clínicos—evaluación de la hinchazón 2–3 y 7 días después de la extracción quirúrgica del LM3
Basado en los resultados de 2 ECA, la extensión de la hinchazón 2–3 días postoperatorios no mostró diferencia significativa entre los grupos de prueba y control (tamaño del efecto: − 2.08; 95% CI: − 23.73–19.58; p = 0.44); sin embargo, la heterogeneidad estadística entre los estudios fue significativa (I2 = 87.94%; p < 0.01; Fig. 3a).
De manera similar, la extensión de la hinchazón 7 días después de la operación tampoco mostró una diferencia significativa entre los grupos de prueba y control (tamaño del efecto: 1.75; 95% CI: − 14.38–17.89; p = 0.40), y la heterogeneidad estadística entre los estudios fue nuevamente significativa (I2 = 66.86%; p = 0.08; Fig. 3b). No fue posible un análisis separado para la comparación de HyA con un control negativo o grupo de placebo/transporte debido al número limitado de estudios.
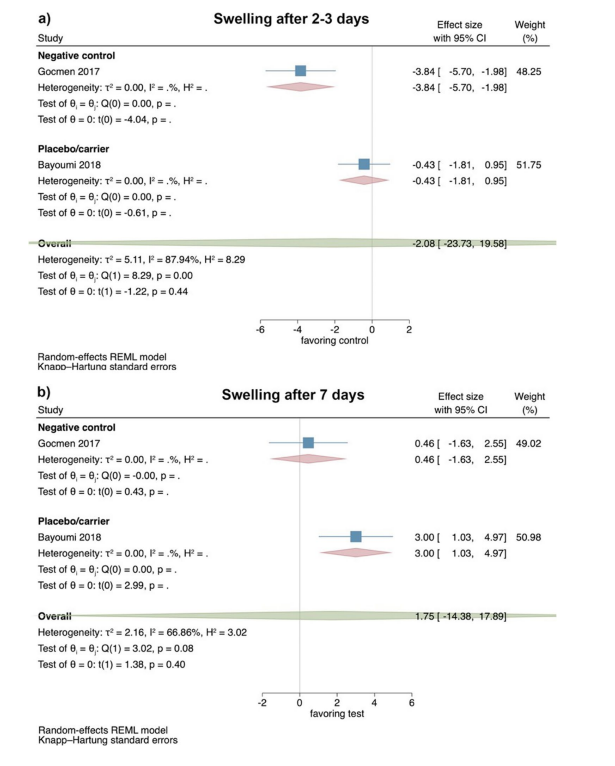
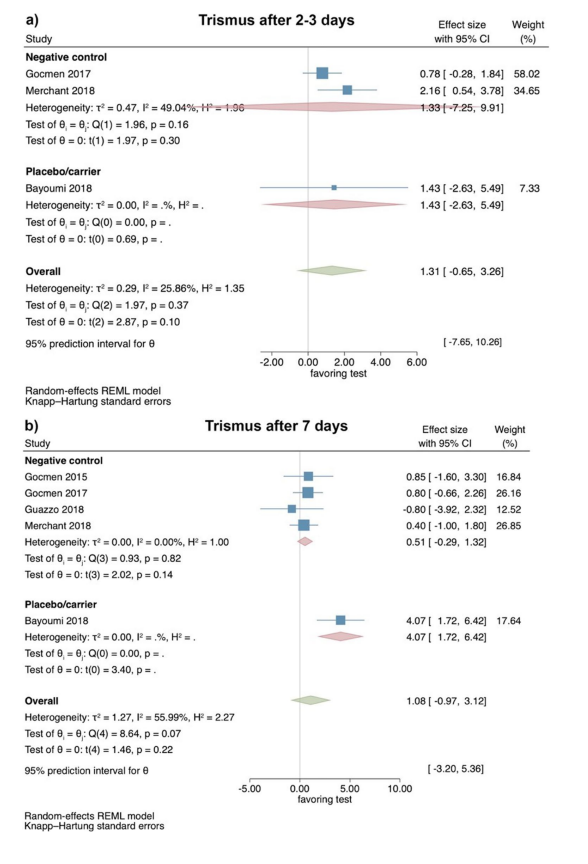
Estudios clínicos—evaluación del trismo 2–3 y 7 días después de la extracción quirúrgica de LM3
Basado en los resultados de 3 ECA, el trismo mostró 2–3 días postoperatorios sin diferencias significativas entre los grupos de prueba y control (tamaño del efecto: 1.31; IC del 95%: − 0.65–3.26; p = 0.10), sin heterogeneidad estadística entre los estudios (I2 = 25.86%; p = 0.37). Los análisis separados también carecieron de significancia estadística para la comparación de HyA con un grupo de control negativo (2 estudios; tamaño del efecto: 1.33; IC del 95%: − 7.25–9.91; p = 0.30), mientras que solo un estudio estaba disponible para la comparación de HyA con un grupo de placebo/transporte (Fig. 4a).
Basado en los resultados de 5 ECA, el trismo no mostró diferencia significativa entre los grupos de prueba y control 7 días postoperatorios (tamaño del efecto: 1.08; IC del 95%: − 0.97–3.12; p = 0.22); sin embargo, la heterogeneidad estadística entre los estudios fue significativa (I2 = 55.99%; p = 0.07). Los análisis separados también mostraron que no había diferencia significativa entre HyA y un grupo de control negativo (4 estudios; tamaño del efecto: 0.51; IC del 95%: − 0.29–1.32; p = 0.14), mientras que solo un estudio estaba disponible para la comparación de HyA con un grupo de placebo/transporte (Fig. 4b).
Evaluación del riesgo de sesgo
Entre los estudios preclínicos, la puntuación de calidad osciló entre el 20 y el 40% (Apéndice 4); solo el informe de las características basales y otras fuentes de sesgo fueron juzgadas en todos los estudios como de bajo riesgo de sesgo.
Los RCT incluidos fueron juzgados como teniendo algunas preocupaciones (n = 13) o bajo riesgo de sesgo (n = 5) (Apéndice 5). Ninguno de los RCT se desvió de la intervención prevista, 5 RCT fueron juzgados como teniendo algunas preocupaciones en el proceso de randomización, y aproximadamente la mitad de los estudios fueron juzgados como teniendo algunas preocupaciones en su informe sobre datos de resultados faltantes, medición del resultado y selección de los resultados reportados. La mayoría de los estudios no randomizados fueron juzgados como teniendo un bajo riesgo de sesgo (n = 3), mientras que un estudio fue juzgado como teniendo algunas preocupaciones (Apéndice 6).
Calidad de la evidencia (GRADE)
Para los resultados del meta-análisis que incluye 2 ensayos preclínicos, la certeza de la evidencia para el parámetro de resultado BV/TV después de 3 meses fue calificada como baja (Apéndice 8a).
La certeza de la evidencia obtenida de meta-análisis que incluyen ensayos clínicos fue juzgada como moderada para la percepción del dolor y el trismo y como baja para la evaluación de la hinchazón (Apéndice 8b).
Discusión
Se ha demostrado que el HyA posee propiedades antiinflamatorias, antiedematosas, osteoinductivas y proangiogénicas; por lo tanto, parece que el HyA mejora la cicatrización de heridas.
La presente revisión sistemática tuvo como objetivo proporcionar una evaluación integral de toda la evidencia disponible (es decir, preclínica y clínica) sobre el efecto de la aplicación de HyA en relación con la extracción dental. En general, parece que la aplicación de HyA en relación con la extracción quirúrgica del LM3 puede tener un efecto positivo en la reducción del dolor durante la primera semana postoperatoria. Específicamente, el metaanálisis de 5 estudios clínicos mostró que la aplicación local (intraquirúrgica) de gel de HyA se asoció con una percepción de dolor significativamente reducida estadísticamente 7 días después de la operación en comparación con el grupo de control que no recibió manipulación adicional de la herida o la aplicación de un placebo/transportador. La aplicación de HyA no pareció tener ningún impacto en otras complicaciones que a menudo aparecen después de la extracción del LM3 (es decir, hinchazón y trismo) o en relación con la extracción no quirúrgica de dientes normalmente erupcionados.
Este efecto positivo de la aplicación intraquirúrgica de HyA sobre la percepción del dolor dentro de la primera semana postoperatoria de la extracción del LM3 se suma a los resultados de una revisión sistemática previa, que también evaluó el posible beneficio de HyA en la misma indicación. Específicamente, basado en una selección de estudios diferente, la aplicación de HyA redujo significativamente el dolor tanto en el tercer como en el séptimo día postoperatorio. Aparentemente, el efecto positivo de HyA en los primeros días postoperatorios observado en esa revisión no se vio en el presente metaanálisis, debido a la mayor información proporcionada por 2 estudios adicionales incluidos aquí y debido a la exclusión de un estudio no aleatorizado, que favoreció fuertemente al grupo de prueba de HyA. Un efecto positivo de HyA en términos de reducción de la percepción del dolor puede explicarse en parte por su efecto modulador sobre la respuesta inflamatoria en el sitio quirúrgico. Se ha demostrado previamente que HyA puede downregular la producción y expresión de prostaglandina E2, bradiquinina y sustancia P, que están involucradas en la transmisión y sensación del dolor. Sin embargo, cualquier posible efecto positivo de HyA sobre la respuesta inflamatoria local no se traduce necesariamente en menos hinchazón y/o trismo en la clínica, ya que tanto los análisis incluidos aquí como los de la revisión mencionada anteriormente no indicaron diferencias entre los grupos de prueba y control en relación con estos aspectos. Sin embargo, estos resultados deben interpretarse con precaución debido al pequeño número de estudios originales y la falta de estandarización en los métodos que evalúan la hinchazón facial, así como en la intervención en sí. Por ejemplo, los estudios incluidos rara vez proporcionaron información sobre el nivel de dificultad quirúrgica y/o el diseño del colgajo aplicado, aspectos que pueden afectar los parámetros de resultado. Además, la falta de cualquier efecto positivo significativo de HyA en la percepción del dolor en la extracción no quirúrgica de dientes erupcionados regularmente, observado en la mayoría de los estudios (4 de 5) incluidos en esta revisión, no debe interpretarse como una falta de acción de HyA en sí. Puede deberse a diferencias en el modo de curación, es decir, "cerrado" después de la extracción quirúrgica del LM3 frente a "abierto" después de la extracción de dientes erupcionados regularmente, donde la falta de cierre primario y de cualquier portador puede haber resultado en un rápido lavado de HyA. Si la aplicación de HyA en un portador podría mejorar su acción, es difícil de evaluar, ya que esto se utilizó solo en un único estudio que no mostró diferencias. Sin embargo, también debe tenerse en cuenta que en la mayoría de los casos, la extracción dental sin complicaciones se asocia con bajos niveles de dolor, y por lo tanto, cualquier posible efecto positivo de HyA puede ser difícil de captar. De hecho, en el único estudio comparativo sobre el manejo de AO incluido en esta revisión, se informó de una reducción significativa del dolor postoperatorio en los grupos que recibieron HyA (sin cierre primario y sin uso de un portador).
Algunos de los estudios sobre la curación después de la extracción de dientes erupcionados regularmente, incluidos en esta revisión, también evaluaron el posible impacto de la aplicación de HyA en la curación de tejidos blandos y duros. En 3 de 4 estudios que evaluaron la curación de tejidos blandos, se informó un efecto positivo de HyA basado en el tiempo hasta y/o el porcentaje de cierre del alvéolo, así como en las puntuaciones para juzgar la curación de tejidos blandos. En contraste, en 3 estudios comparativos, el uso intra- o postoperatorio de gel de HyA no tuvo ningún efecto positivo en términos de cambios dimensionales alveolares en comparación con la no aplicación de HyA, después de un tiempo de seguimiento de 3 a 4 meses. De hecho, en uno de los estudios, donde tras la preservación del reborde con injerto de alvéolo con mineral óseo bovino desproteinizado enriquecido con colágeno y sellado del alvéolo mediante una matriz de colágeno en terapia quirúrgica, se aplicó gel de HyA sobre la matriz de colágeno tres veces al día durante 1 semana, se observó una pérdida ósea horizontal significativamente mayor en el aspecto coronal de los alvéolos de extracción. Estos hallazgos sobre la falta de un efecto positivo de HyA en el hueso pueden parecer de alguna manera en contraste con los hallazgos reportados en los estudios preclínicos incluidos aquí. En los 2 estudios que informaron sobre la curación de alvéolos de extracción no infectados en ratas sanas o diabéticas, la aplicación de HyA mejoró significativamente la curación ósea en comparación con el grupo de control. De manera similar, en 3 de 3 estudios en perros que informaron sobre la curación de alvéolos de extracción infectados, la aplicación de HyA, ya sea sola o con una esponja de colágeno o mineral óseo bovino desproteinizado con colágeno como portador, mejoró la curación ósea. Sin embargo, es importante mencionar que este efecto positivo de HyA en la curación ósea no se mostró en el único metaanálisis posible aquí respecto a BV/TV, probablemente debido al hecho de que ambos estudios utilizaron un tiempo de curación tardío para este modelo animal particular; es decir, la curación ósea dentro de un alvéolo de extracción en el perro está bastante avanzada después de 3 meses, incluso sin ningún tratamiento. Cabe destacar que BV/TV en el grupo de HyA fue similar al de otro grupo de prueba, tratado con proteína morfogenética ósea humana recombinante-2 (rhBMP-2), un conocido agente potenciador del hueso muy potente. Además, tales efectos positivos de HyA en la curación ósea también se han mostrado en otros estudios preclínicos, utilizando modelos de defectos de tamaño crítico. En perspectiva, ningún estudio sobre la extracción quirúrgica de LM3 evaluó el resultado de la curación en el aspecto distal del segundo molar inferior, un sitio que a menudo se asocia con un defecto periodontal profundo después de la extracción de LM3 impactado.
Esta revisión también intentó identificar si la aplicación de HyA puede reducir la tasa de AO después de la extracción dental; sin embargo, hubo un informe limitado sobre esta complicación en los estudios. En este contexto, la aplicación de HyA se considera en general segura y sin efectos secundarios; sin embargo, debe mencionarse que HyA puede provocar eventos adversos significativos en caso de que se aplique (inyecte) dentro de los tejidos. En este caso, solo un estudio informó un tiempo de sangrado prolongado después del cierre de la herida en comparación con el grupo de control; sin embargo, se juzgó que la hemostasia estaba dentro de un marco temporal fisiológico y, por lo tanto, no se consideró un evento adverso. Todos los demás estudios incluidos en esta revisión no mencionaron efectos secundarios ni complicaciones después de la aplicación de HyA. Además del hecho de que HyA es seguro de aplicar en conexión con la extracción dental quirúrgica LM3 o no quirúrgica, no se pueden hacer conclusiones sobre la formulación de HyA más eficiente (por ejemplo, baja vs. alta concentración, no reticulada vs. reticulada, gel vs. spray) o modo de aplicación (por ejemplo, con vs. sin portador, frecuencia), y por lo tanto no se puede proporcionar una recomendación clara.
En total, solo se pudo identificar un número limitado de ensayos preclínicos y clínicos bien diseñados y aleatorizados, que se combinaron en un metaanálisis. Además, como se mencionó anteriormente, hay una falta de consenso e información sobre los detalles del producto de HyA, pero también sobre los detalles quirúrgicos (por ejemplo, nivel de dificultad quirúrgica o diseño del colgajo). Estas limitaciones resultaron en una certeza general de evidencia baja a moderada. En estudios futuros, se debería implementar un mejor y más estandarizado informe sobre los detalles del producto de HyA, la dosificación y la aplicación, así como tiempos de seguimiento más largos para permitir una evaluación más completa del potencial del uso de HyA en relación con la extracción dental. Además, futuras revisiones sistemáticas actualizadas que incluyan un mayor número de estudios también deberían considerar en los metaanálisis una comparación entre estudios con brazos paralelos y estudios en diseño de boca dividida. Esto sería de interés específico para parámetros como la percepción del dolor, algo no factible aquí debido al número muy limitado de estudios de boca dividida.
Conclusión
Los resultados de la presente revisión sistemática y meta-análisis mostraron que la aplicación intraquirúrgica de HyA en conexión con la extracción quirúrgica del tercer molar (LM3) resultó en una reducción significativa en la percepción del dolor 7 días después de la cirugía, mientras que el dolor postoperatorio temprano, el trismo y la extensión de la hinchazón no se vieron afectados. Además, parece que la aplicación de HyA puede tener un efecto positivo en la cicatrización de los tejidos blandos después de la extracción no quirúrgica de dientes normalmente erupcionados, pero parece no reducir la modelación del reborde alveolar post-extracción, aunque la evidencia de estudios preclínicos indicó que HyA puede mejorar la formación ósea.
Autores: Danijel Domic, Kristina Bertl, Tobias Lang, Nikolaos Pandis, Christian Ulm, Andreas Stavropoulos
Referencias:
- Upadhyaya C, Humagain H (2010) Prevalencia de alveolitis seca tras la extracción de dientes permanentes en el Hospital Universitario de Kathmandu (KUTH), Dhulikhel, Kavre, Nepal: un estudio. Kathmandu Univ Med J (KUMJ) 8(29):18–24
- Akinbami BO, Godspower T (2014) Alveolitis seca: incidencia, características clínicas y factores predisponentes. Int J Dent 2014:796102
- Duarte-Rodrigues L et al (2018) Extracción de terceros molares y su impacto en la calidad de vida: revisión sistemática y meta-análisis. Qual Life Res 27(10):2477–2489
- Halabi D et al (2018) Clorhexidina para la prevención de osteítis alveolar: un ensayo clínico aleatorizado. J Appl Oral Sci 26:e20170245
- Kan KW et al (2002) Defectos periodontales residuales distales al segundo molar mandibular 6–36 meses después de la extracción de un tercer molar impactado. J Clin Periodontol 29(11):1004–1011
- Peng KY et al (2001) Estado periodontal del segundo molar mandibular después de la extracción del tercer molar. J Periodontol 72(12):1647–1651
- MacBeth N et al (2017) Cambios en los tejidos duros y blandos tras la preservación del reborde alveolar: una revisión sistemática. Clin Oral Implants Res 28(8):982–1004
- Taberner-Vallverdú M et al (2015) Eficacia de diferentes métodos utilizados para el manejo de la alveolitis seca: una revisión sistemática. Med Oral Patol Oral Cir Bucal 20(5):e633–e639
- Taberner-Vallverdú M, Sánchez-Garcés M, Gay-Escoda C (2017) Eficacia de diferentes métodos utilizados para la prevención de la alveolitis seca y análisis de factores de riesgo: una revisión sistemática. Med Oral Patol Oral Cir Bucal 22(6):e750–e758
- Han W et al (2022) La actividad antiinflamatoria de oligosacáridos de ácido hialurónico de tamaño específico. Carbohydr Polym 276:118699
- Harris LG, Richards RG (2004) Adhesión de Staphylococcus aureus a diferentes superficies de titanio tratadas. J Mater Sci Mater Med 15(4):311–314
- Romanò CL et al (2017) Ácido hialurónico y sus compuestos como barrera antimicrobiana/antiadhesiva local. J Bone Jt Infect 2(1):63–72
- Matheus HR et al (2021) La asociación de ácido hialurónico con un injerto bovino desproteinizado mejora la reparación ósea y aumenta la formación ósea en defectos óseos de tamaño crítico. J Periodontol 92(11):1646–1658
- Yun J, Lee J, Ha CW et al (2021) El efecto de un andamiaje de ácido poliláctico impreso en 3D con y sin ácido hialurónico en la regeneración ósea. J Periodontol 1–11. https://doi.org/10.1002/JPER.21-0428
- Shirakata Y et al (2021) Cicatrización periodontal/regeneración de defectos intrabony de dos paredes tras cirugía reconstructiva con gel de ácido hialurónico reticulado con o sin una matriz de colágeno: un estudio preclínico en perros. Quintessence Int 0(0):308–316
- Shirakata Y et al (2021) Cicatrización de recesiones gingivales bucales tras tratamiento con colgajo avanzado coronariamente solo o combinado con un gel de ácido hialurónico reticulado. Un estudio experimental en perros. J Clin Periodontol 48(4):570–580
- Maria de Souza G et al (2020) La efectividad del ácido hialurónico en el control del dolor, edema y trismo tras la extracción de terceros molares: revisión sistemática y meta-análisis. J Oral Maxillofac Surg 14:14
- de Vries R et al (2015) Un formato de protocolo para la preparación, registro y publicación de revisiones sistemáticas de estudios de intervención en animales. Evid-Based Preclin Med 2:e00007
- Page MJ et al (2021) La declaración PRISMA 2020: una guía actualizada para la presentación de revisiones sistemáticas. Syst Rev 10(1):89
- Hooijmans CR et al (2014) Herramienta de riesgo de sesgo de SYRCLE para estudios en animales. BMC Med Res Methodol 14:43
- Sterne JAC et al (2019) RoB 2: una herramienta revisada para evaluar el riesgo de sesgo en ensayos aleatorizados. BMJ 366:l4898
- Sterne JA et al (2016) ROBINS-I: una herramienta para evaluar el riesgo de sesgo en estudios no aleatorizados de intervenciones. BMJ 355:i4919
- Higgins JPT, Thompson SG, Spiegelhalter DJ (2009) Una reevaluación del meta-análisis de efectos aleatorios. J R Stat Soc A Stat Soc 172(1):137–159
- Wei D et al (2016) El uso del enfoque GRADE en revisiones sistemáticas de estudios en animales. J Evid Based Med 9(2):98–104
- Chen H et al (2015) Cómo usar gradepro gdt para evaluar la calidad de la evidencia en revisiones sistemáticas de estudios de intervención: una introducción. Chin J Evid Based Med 15:600–606
- Mendes RM et al (2010) Efectos de nanotubos de carbono de pared única y su funcionalización con hialuronato de sodio en la reparación ósea. Life Sci 87(7–8):215–222
- Kapitan M et al (2021) Observación inicial de factores que interfieren con el tratamiento de la osteítis alveolar utilizando ácido hialurónico con octenidina: una serie de informes de casos. Biomolecules 11(8):04
- Martins-Junior PA et al (2016) Evaluación de nanotubos de carbono funcionalizados con hialuronato de sodio en los procesos inflamatorios para aplicaciones de medicina regenerativa oral. Clin Oral Invest 20(7):1607–1616
- Catanzano O et al (2018) Esponjas compuestas de alginato-hialuronano para la entrega de ácido tranexámico en heridas alveolares postextractivas. J Pharm Sci 107(2):654–661
- Mendes RM et al (2008) El hialuronato de sodio acelera el proceso de cicatrización en los alvéolos dentales de ratas. Arch Oral Biol 53(12):1155–1162
- Sa MA et al (2013) Los nanotubos de carbono funcionalizados con hialuronato de sodio restauran la reparación ósea en alvéolos de ratas diabéticas. Oral Dis 19(5):484–493
- Kim JJ et al (2016) El ácido hialurónico mejora la formación ósea en alvéolos de extracción con patología crónica: un estudio piloto en perros. J Periodontol 87(7):790–795
- Kim JJ et al (2019) Biomodificación de alvéolos de extracción comprometidos utilizando ácido hialurónico y rhBMP-2: un estudio experimental en perros. J Periodontol 90(4):416–424
- Lee JB et al (2021) Efectos del ácido hialurónico y mineral óseo bovino desproteinizado con 10% de colágeno para la preservación del reborde en alvéolos de extracción comprometidos. J Periodontol 23:23
- Koray M et al (2014) Eficacia del aerosol de ácido hialurónico sobre la hinchazón, el dolor y el trismo tras la extracción quirúrgica de terceros molares mandibulares impactados. Int J Oral Maxillofac Surg 43(11):1399–1403
- Gocmen G et al (2015) La eficiencia antioxidante y antiinflamatoria del ácido hialurónico tras la extracción de terceros molares. J Craniomaxillofac Surg 43(7):1033–1037
- Gocmen G et al (2017) Efectos del ácido hialurónico sobre el sangrado tras la extracción de terceros molares. J Appl Oral Sci 25(2):211–216
- Afat İM, Akdoğan ET, Gönül O (2018) Efectos del fibrina rica en leucocitos y plaquetas sola y combinada con ácido hialurónico sobre el dolor, edema y trismo tras la extracción quirúrgica de terceros molares mandibulares impactados. J Oral Maxillofac Surg 76(5):926–932
- Bayoum A, Nadershah M, Albandar A, Alsulaimani B, Sankour I et al (2018) El efecto del ácido hialurónico reticulado en la extracción quirúrgica de terceros molares mandibulares impactados. Int J Dent Oral Health 4(2). https://doi.org/10.16966/2378-7090.254
- Guazzo R et al (2018) Efecto sobre la cicatrización de una gel tópico que contiene aminoácidos y hialuronato de sodio aplicado al alvéolo después de la extracción del tercer molar mandibular: un ensayo controlado aleatorizado doble ciego. Quintessence Int 49(10):831–840
- Merchant R et al (2018) Evaluación comparativa de la eficacia clínica del aerosol de ácido hialurónico versus aerosol de solución salina normal sobre la hinchazón, el dolor y el trismo tras la extracción quirúrgica de un tercer molar mandibular impactado: un estudio controlado aleatorizado de boca dividida. Int J Sci Res 7:152
- Afat IM, Akdoğan ET, Gönül O (2019) Efectos del fibrina rica en leucocitos y plaquetas sola y combinada con ácido hialurónico sobre la cicatrización temprana de tejidos blandos tras la extracción quirúrgica de terceros molares mandibulares impactados: un estudio clínico prospectivo. J Craniomaxillofac Surg 47(2):280–286
- Munoz-Camara D, Pardo-Zamora G, Camacho-Alonso F (2020) Efectos postoperatorios de la aplicación intraalveolar de geles bioadhesivos de clorhexidina al 0.2% o ácido hialurónico al 1% tras la extracción del tercer molar mandibular: un ensayo clínico controlado aleatorizado doble ciego. Clin Oral Investig 24:24
- Yilmaz N et al (2017) La eficacia del ácido hialurónico en alvéolos post-extracción de terceros molares impactados: un estudio piloto. Niger J Clin Pract 20(12):1626–1631
- Yang H et al (2020) Estudio de no inferioridad de la eficacia de dos productos de ácido hialurónico en alvéolos post-extracción de terceros molares impactados. Maxillofac Plast Reconstr Surg 42(1):40
- Favia G et al (2008) Cicatrización acelerada de heridas de tejidos blandos orales y efecto angiogénico inducido por un pool de aminoácidos combinado con hialuronato de sodio (AMINOGAM®). J Biol Regul Homeost Agents 22(2):109–116
- Bayoumi AM, Jan A, Amoudi WA, Shakir M (2015) Los efectos del uso de ácido hialurónico en los alvéolos de extracción. Int J Dent Oral Health 2(1). https://doi.org/10.16966/2378-7090.157
- Alcântara CEP et al (2018) El ácido hialurónico acelera la reparación ósea en alvéolos dentales humanos: un ensayo clínico aleatorizado triple ciego. Braz Oral Res 32:e84
- Lorenz J et al (2018) Material de sustitución ósea injectable basado en beta-TCP y hialuronano logra una regeneración ósea completa mientras sufre una degradación casi completa. Int J Oral Maxillofac Implants 33(3):636–644
- Marin S et al (2020) Resultado del tratamiento con ácido hialurónico en la cicatrización de heridas post-extracción en pacientes con diabetes tipo 2 mal controlada: un estudio controlado aleatorizado de boca dividida. Med Oral Patol Oral Cir Bucal 25(2):e154–e160
- Mostafa D et al (2021) Efecto del gel de ácido hialurónico en la cicatrización de alvéolos de extracción dental simple: un estudio piloto. Open Access Maced J Med Sci 9(D):190–195
- Eeckhout C et al (2022) Un ensayo controlado aleatorizado que evalúa el gel de ácido hialurónico como agente de cicatrización en la preservación del reborde alveolar. J Clin Periodontol 49(3):280–291
- Cosola S, Oldoini G, Boccuzzi M, Giammarinaro E, Genovesi A, Covani U, Marconcini S (2022) Fórmula enriquecida con aminoácidos para el cuidado postoperatorio de alvéolos de extracción evaluada mediante escaneo intraoral 3D. Int J Environ Res Public Health 19(6):3302. https://doi.org/10.3390/ijerph19063302
- Cocero N et al (2019) Eficacia del hialuronato de sodio y aminoácidos sintéticos en alvéolos post-extractivos en pacientes con insuficiencia hepática: estudio de boca dividida. J Biol Regul Homeost Agents 33(6):1913–1919
- Dubovina D et al (2016) El uso de ácido hialurónico y ácido aminocaproico en el tratamiento de la osteítis alveolar. Vojnosanit Pregl 73(11):1010–1015
- Suchánek J, Ivančaková RK, Mottl R, Browne KZ, Pilneyová KC, Pilbauerová N, Schmidt J, Suchánková Kleplová T (2019) Dispositivo médico basado en ácido hialurónico para el tratamiento de la osteítis alveolar: estudio clínico. Int J Environ Res Public Health 16:3698. https://doi.org/10.3390/ijerph16193698
- Blum IR (2002) Perspectivas contemporáneas sobre la alveolitis seca (osteítis alveolar): una evaluación clínica de la estandarización, etiopatogenia y manejo: una revisión crítica. Int J Oral Maxillofac Surg 31(3):309–317
- Lee J-B, Chu S, Amara HB et al (2021) Los efectos del ácido hialurónico y mineral óseo bovino desproteinizado con 10% de colágeno para la preservación del reborde en alvéolos de extracción comprometidos. J Periodontol 1–12. https://doi.org/10.1002/JPER. 20-0832
- Sá MA et al (2013) Los nanotubos de carbono funcionalizados con hialuronato de sodio restauran la reparación ósea en alvéolos de ratas diabéticas. Oral Dis 19(5):484–493
- Marin S et al (2020) Resultado del tratamiento con ácido hialurónico en la cicatrización de heridas post-extracción en pacientes con diabetes tipo 2 mal controlada: un estudio controlado aleatorizado de boca dividida. Medicina Oral, Patología Oral y Cirugía Bucal 25(2):e154–e160
