Comparación in vivo de la biocompatibilidad de dos selladores de conductos radiculares implantados en el tejido conectivo subcutáneo de ratas
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo).
Objetivo. Evaluar la biocompatibilidad subcutánea de 2 selladores de conductos radiculares.
Diseño del estudio. Se utilizó la técnica de implante subcutáneo recomendada por la Fédération Dentaire International (FDI) para probar los selladores de conductos radiculares Endométhasone y EndoREZ. Estos materiales se colocaron en tubos de Teflón, de 1 mm de diámetro y 10 mm de longitud, e implantados en 2 bolsillos creados en la parte posterior de 40 Calomys callosus roedores, 20 para cada material. Se recolectaron biopsias de tejido y se examinaron histológicamente 15, 30, 60 y 90 días después del procedimiento de implantación. El nivel general de la respuesta inflamatoria del tejido se clasificó como ninguna, leve, moderada o severa en la interfaz sellador–tejido conectivo en los extremos abiertos de los tubos. La respuesta del tejido conectivo a lo largo de la pared lateral fuera de cada tubo sirvió como control negativo.
Resultados. La reacción del tejido al Endométhasone disminuyó con el tiempo. El sellador EndoREZ fue altamente tóxico durante todos los períodos experimentales.
Conclusión. El sellador de conductos radiculares Endométhasone presentó biocompatibilidad dentro de los períodos analizados, mientras que EndoREZ no mostró un comportamiento biocompatible y causó una reacción hipersensible tardía. (Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007;103:e88-e94)
El éxito de la terapia endodóntica depende de diagnósticos correctos, limpieza efectiva, eliminación de infecciones y obturación adecuada de los conductos radiculares. La reacción del tejido periapical después del tratamiento de conductos radiculares puede verse influenciada por varios factores dependiendo de la naturaleza química del sellador endodóntico. Actualmente se utilizan en la práctica clínica selladores endodónticos a base de resina, óxido de zinc-eugenol, ionómero de vidrio, silicona y hidróxido de calcio. Los selladores a base de resina están ganando cada vez más popularidad, pero estudios han demostrado que algunos de estos selladores presentan toxicidad y mutagenicidad. A pesar de la gran variedad de selladores disponibles, aún no se ha encontrado un sellador de conductos radiculares que posea todas las propiedades físicas y biológicas deseables. La biocompatibilidad es una de las propiedades más importantes de los materiales de obturación radicular8 ya que la liberación de ciertas sustancias por los selladores puede generar diferentes reacciones en los tejidos periapicales. Las reacciones tisulares causadas por materiales endodónticos normalmente se investigan mediante estudios histológicos tras la implantación del material en tejido animal. Endométhasone (Spécialities Septodont, Saint-Maur-des-Fossés, Francia) es un sellador a base de óxido de zinc-eugenol que ha sido evaluado previamente en varios estudios respecto a sus propiedades biológicas. Recientemente, se ha introducido un nuevo sellador endodóntico a base de metacrilato, EndoREZ (Ultradent Products Inc., South Jordan, UT, EE. UU.), cuyas propiedades biológicas han sido poco investigadas.
El propósito de este estudio fue evaluar la reacción del tejido conectivo subcutáneo a los selladores de conducto radicular EndoREZ y Endométhasone siguiendo los requisitos recomendados por la FDI.
Métodos
El protocolo para este experimento fue aprobado por el Comité de Ética en Investigación de la Universidad de Uberlândia, y el experimento se llevó a cabo de acuerdo con la Política del Servicio de Salud Pública de EE. UU. sobre el Cuidado y Uso Humanitario de Animales de Laboratorio. Se utilizaron cuarenta roedores machos Calomys callosus (Rodentia, Cricetidae), con un peso de 150 a 200 g. Las muestras se dividieron en 2 grupos de 20 animales cada uno para los selladores de conducto radicular Endométhasone y EndoREZ. La Tabla I muestra los materiales, fabricantes y componentes principales.
Todos los materiales se prepararon de la manera aconsejada por los fabricantes para su uso clínico y se cargaron en portadores de Teflón autoclavados (politetrafluoroetileno, Du-Pont, Habia, Knivsta, Suecia), de 10 mm de largo con un solo lumen y un diámetro interno de 1 mm, asegurando que no se atrapara aire.
Los animales fueron anestesiados intraperitonealmente con 0.2 mL de ketamina que contenía acepromazina en una proporción de 1:1. Se rasuró la piel dorsal, se desinfectó con una tintura de yodo al 5%, y se realizaron pequeñas incisiones, de aproximadamente 15 mm de largo, en ambos lados del dorso. Se crearon dos bolsillos separados mediante disección roma para implantar los tubos en el tejido subcutáneo a una profundidad de ~15 mm. Los tubos que contenían selladores recién mezclados se colocaron en los bolsillos derecho e izquierdo preparados en cada animal. Se tuvo cuidado de evitar el derrame de los materiales en el tejido. Después de la implantación, las heridas se suturaron.
Los animales fueron sacrificados en grupos de 5 cada uno después de 15, 30, 60 y 90 días mediante asfixia con dióxido de carbono, asegurando un mínimo de incomodidad y angustia. Los tubos fueron extirpados junto con la piel y el tejido conectivo alrededor de ellos. Las muestras se sumergieron en formalina al 10% en una solución tamponada con fosfato de 0.1 mol/L durante 24 horas, se deshidrataron en soluciones de etanol graduales a temperatura ambiente y se incrustaron en metacrilato de glicol (Historesin; Leica Microsystems, Nussloch GmbH, Alemania). Para el corte en secciones, los bloques se orientaron paralelos al eje largo del tubo. Las secciones se cortaron a un grosor de 3 µm y se tiñeron con azul de toluidina al 1%. Las secciones histológicas se analizaron a diferentes aumentos bajo un microscopio de luz, observando las reacciones del tejido en la interfaz sellador–tejido conectivo en los extremos abiertos de los tubos. La respuesta del tejido conectivo a lo largo de la pared lateral fuera de los tubos sirvió como control negativo.
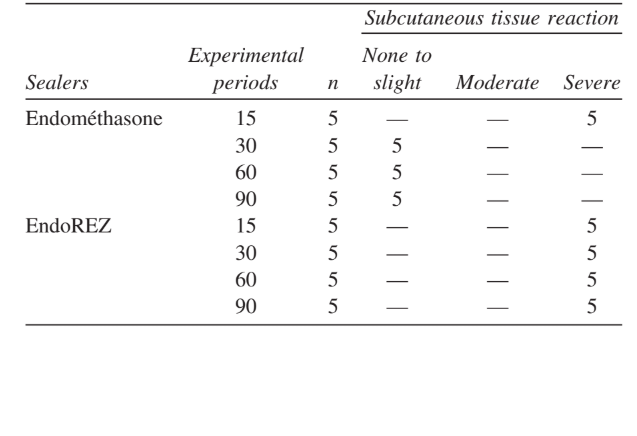
Se examinó y evaluó la interfaz en la apertura de la copa entre el material y el hueso por la intensidad de la inflamación. La evaluación de los criterios de la Fédération Dentaire International (FDI) es exclusivamente cualitativa, y no se utilizó ningún índice de puntuación. Así, el nivel general de la reacción tisular se calificó como ninguno, leve, moderado o severo, dependiendo de la presencia o ausencia de leucocitos neutrofílicos, macrófagos, linfocitos, células plasmáticas, células gigantes de cuerpo extraño, material disperso, cápsula, hueso sano recién formado, tejido necrótico y resorción. El nivel general de la respuesta tisular inflamatoria se clasificó de la siguiente manera: 1) ninguno/leve: grosor de la zona de reacción similar o solo ligeramente más ancho que el grosor a lo largo del tubo lateral, con pocas o ninguna célula inflamatoria; 2) moderado: zona de reacción aumentada en la que están presentes macrófagos, células plasmáticas o ambos; y 3) severo: zona de reacción aumentada en la que están presentes macrófagos y células plasmáticas y focos ocasionales de granulocitos neutrofílicos, linfocitos o ambos.
Las interpretaciones de los resultados se basaron en los siguientes criterios de la FDI: no a ligera reacción tanto a las 2 como a las 12 semanas es aceptable; no a ligera reacción a las 2 semanas que aumenta a reacción moderada o severa a las 12 semanas no es aceptable; reacción moderada a las 2 y 12 semanas no es aceptable; reacción moderada a las 2 semanas que disminuye a las 12 semanas es aceptable; y una reacción severa en cualquier período es inaceptable.
Resultados
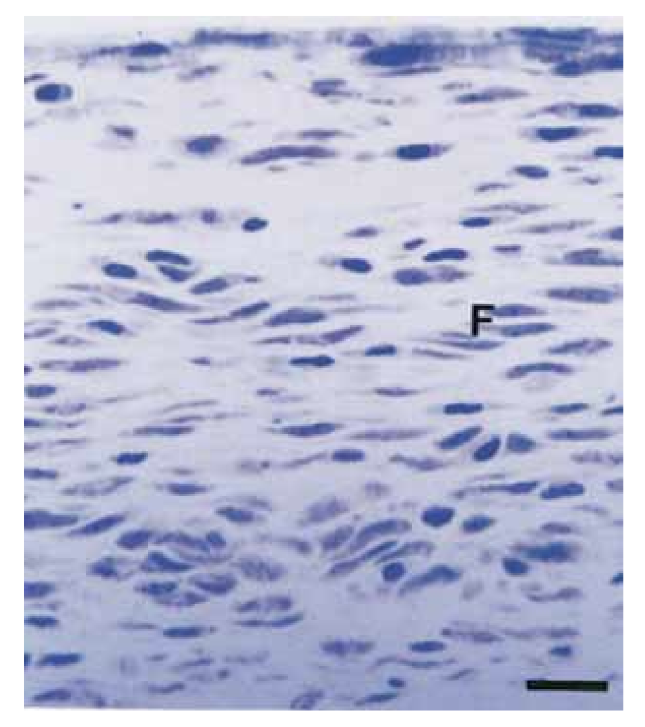
Se analizó la intensidad de la respuesta inflamatoria en todos los períodos experimentales de ambos selladores. La respuesta del tejido conectivo junto a la pared lateral fuera de los tubos de Teflón sirvió como control negativo para la técnica y no mostró reacción inflamatoria en todos los períodos de experimentación (Fig. 1). Los números de las muestras en cada categoría inflamatoria en los diferentes períodos de tiempo para los 2 tipos de selladores se presentan en la Tabla II.
Endométhasone
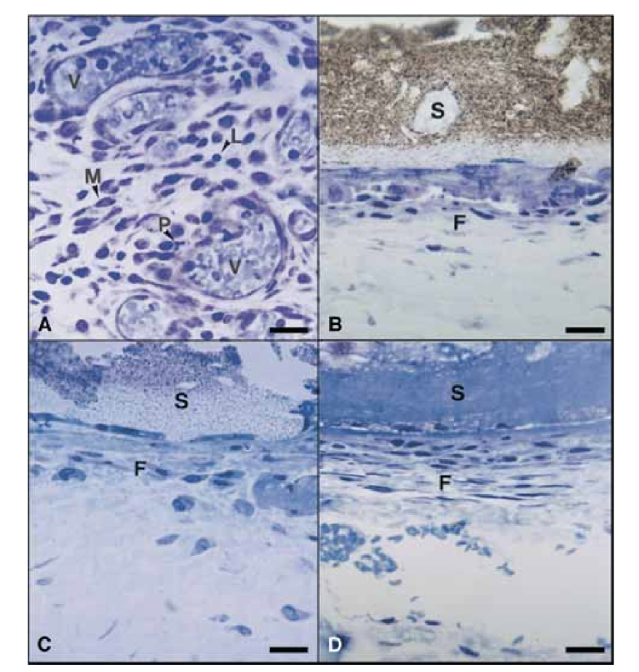
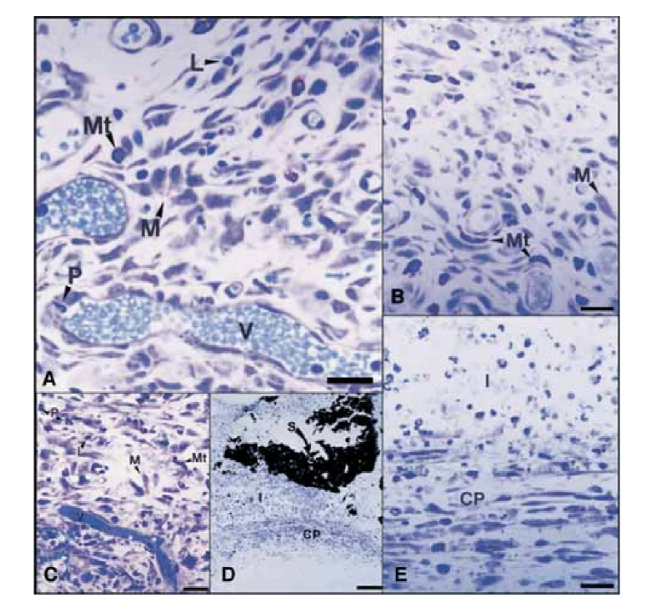
En el día 15, se observó una reacción inflamatoria de moderada a severa. El tejido estaba infiltrado predominantemente con macrófagos y linfocitos. También se observó la presencia de leucocitos polimorfonucleares, hiperemia y una matriz extracelular morfológicamente alterada (Fig. 2, A). En los días 30, 60 y 90, el tejido conectivo no mostró reacción inflamatoria (Fig. 2, B, C y D).
EndoREZ
En el día 15, se observó una reacción inflamatoria de moderada a severa. El tejido estaba infiltrado predominantemente por macrófagos, algunos leucocitos polimorfonucleares y linfocitos. También se observaron hiperemia vascular y una matriz extracelular reducida y morfológicamente alterada (Fig. 3, A). A partir del día 30, se observó una reacción inflamatoria severa y un infiltrado inflamatorio compuesto predominantemente por leucocitos polimorfonucleares, linfocitos y macrófagos parecía estar invadiendo el lumen de los tubos de teflón. Además, en la interfaz entre el sellador y el tejido conectivo, se observaron vasos sanguíneos rodeados de mastocitos (Fig. 3, B). En el día 60, persistió una reacción inflamatoria severa con macrófagos, linfocitos y leucocitos polimorfonucleares. En la apertura de los tubos de teflón, el sellador fue sustituido por un infiltrado inflamatorio con predominancia de macrófagos y linfocitos. Se observaron vasos sanguíneos congestionados rodeados de mastocitos (Fig. 3, C). También se detectó una proliferación fibroblástica consistente que rodeaba el tejido inflamatorio. En el día 90, se observó un infiltrado inflamatorio severo compuesto por macrófagos, linfocitos, leucocitos polimorfonucleares, células rojas y células muertas invaginadas en el lumen de los tubos de teflón, sustituyendo al sellador. En el extremo de apertura de los tubos, el tejido granulomatoso estaba aislado por encapsulación fibrosa (Fig. 3, D y E).
Discusión
Cuando se introduce un nuevo material en el mercado, o se propone un material existente para una aplicación diferente, sus propiedades deben ser investigadas y los resultados comparados con los de otros autores. En los Estados Unidos, la Administración de Alimentos y Medicamentos (FDA) tiene la responsabilidad de evaluar y valorar los efectos biológicos de todos los medicamentos, materiales y dispositivos utilizados en seres humanos, incluidos la mayoría de los productos y dispositivos dentales. La FDA también proporciona el reconocimiento de estándares establecidos por organizaciones privadas, como el ANSI/ADA. La revisión de las primeras Prácticas Estándar Recomendadas para la Evaluación Biológica de Materiales Dentales publicados se retrasó para incorporar los elementos esenciales de las recomendaciones de la FDA. Este nuevo documento no tenía la intención de desalentar el desarrollo industrial de nuevos y mejorados productos dentales al exigir pruebas biológicas excesivas, sino que, en esta era de preocupación por los peligros químicos, se debería desarrollar un perfil de toxicidad para todos los materiales nuevos y mejorados para obtener datos relevantes sobre seguridad y eficacia. Aunque ninguna cantidad de estudio experimental puede garantizar una seguridad absoluta para ninguna sustancia, las investigaciones toxicológicas proporcionan datos a partir de los cuales se pueden hacer proyecciones y predicciones razonables sobre las condiciones bajo las cuales el agente puede ser utilizado de manera segura.
Aunque se enumeran muchas pruebas, como citotoxicidad, hemólisis, la prueba de Ames, transformación celular de Styles, implantaciones subcutáneas y óseas, sensibilización y uso endodóntico, no todas son requeridas para cada producto. Se debe hacer un juicio sobre qué pruebas son relevantes. Las pruebas iniciales son para proporcionar un perfil de toxicidad en un sistema biológico, de modo que, en base a la comparación, el fabricante tendrá una apreciación y realización aproximada de dónde se encuentra el producto. Para la FDA, los dispositivos regulados caen en 3 clases, sin embargo, la mayoría de los dispositivos y aparatos dentales no estarían sujetos a la fijación de estándares para la autorización previa a la comercialización. En otras palabras, a veces ni siquiera se requiere una prueba de seguridad básica antes de que los productos puedan ser promovidos para uso clínico.
La biocompatibilidad de los materiales dentales es un requisito importante porque los componentes tóxicos presentes en estos materiales podrían producir irritación o incluso degeneración de los tejidos circundantes, especialmente cuando se extruyen accidentalmente en los tejidos periradiculares. La implantación de tejido conectivo subcutáneo en animales es uno de los métodos más confiables para evaluar la biocompatibilidad de los materiales dentales porque las reacciones inflamatorias son características de todos los tejidos conectivos. El roedor salvaje parecido a un ratón Calomys callosus se utiliza comúnmente para investigar infecciones experimentales y la respuesta inmune humoral y se utilizó en el presente estudio debido a su reproducibilidad como un modelo establecido ampliamente aceptado en la literatura.
Las muestras fueron incrustadas en metacrilato de glicol debido a sus ventajas en comparación con la parafina, como la producción de menos distorsión, la provisión de secciones delgadas que ofrecen una buena definición celular, la posibilidad de preparar secciones sin la eliminación de los tubos y la tinción con buena calidad y pocos artefactos técnicos, favoreciendo una evaluación más precisa de la reacción inflamatoria.
En el presente estudio, el tejido conectivo junto a la pared lateral sirvió como un control negativo y no presentó reacciones inflamatorias (Fig. 1), demostrando la biocompatibilidad del teflón y que la reacción inflamatoria en la apertura del tubo estaba relacionada con el material estudiado.
Las propiedades biológicas de la Endométhasone, un sellador de conductos radiculares a base de óxido de zinc–eugenol (ZOE), han sido estudiadas previamente en relación con la actividad antibacteriana, la citotoxicidad y la biocompatibilidad de los tejidos. El eugenol (4-alilo-2-metoxifenol) es un extracto de aceite de clavo ampliamente utilizado en odontología como agente terapéutico, más comúnmente como componente del cemento de óxido de zinc–eugenol aplicado como base o vendaje temporal al dentina o como sellador de conductos radiculares. Se han reportado varios estudios sobre la influencia histopatológica de los selladores de conductos radiculares a base de ZOE en los tejidos. El eugenol que se filtra de los selladores de conductos radiculares a base de ZOE puede participar en el desarrollo de inflamación periapical o en la continuación de una lesión periapical preexistente.
En el presente estudio, las reacciones inflamatorias del tejido subcutáneo a Endométhasone disminuyeron con el tiempo, de manera similar a los resultados obtenidos por Kaplan et al., probablemente debido a la neutralización del eugenol liberado al inicio y por la liberación local de corticoides como la dexametasona y la hidrocortisona. Muchos investigadores han sugerido que la capacidad irritativa de los selladores a base de ZOE podría atribuirse principalmente al eugenol y secundariamente a los iones de zinc. El eugenol puede inhibir la función de los macrófagos y puede influir en las reacciones inflamatorias en los tejidos periapicales. Se ha demostrado que el paraformaldehído causa reacciones alérgicas y necrosis del tejido conectivo. Sin embargo, a pesar de la alta concentración de paraformaldehído en el sellador Endométhasone, en el presente estudio no se observaron tales hallazgos.
Recientemente, se introdujo un nuevo sellador endodóntico a base de metacrilato como sellador de conductos radiculares. EndoREZ es un material hidrofílico, de 2 componentes, de curado químico que contiene óxido de zinc, sulfato de bario, resinas y pigmentos en una matriz de resina de dimetacrilato de urethane.
Las propiedades biológicas de EndoREZ han sido previamente investigadas en relación con su citotoxicidad y biocompatibilidad tisular. Los estudios sobre la biocompatibilidad tisular de los selladores a base de resina han mostrado reacciones inflamatorias de moderadas a severas. En el presente estudio, EndoREZ causó una reacción inflamatoria severa en todos los períodos experimentales. Dado que la vida media de un neutrófilo fuera del vaso sanguíneo es de 7 días, la presencia de células polimorfonucleares en todos los períodos experimentales sugiere un comportamiento tóxico de este material. Utilizando células cultivadas, se demostró que EndoREZ se volvió más citotóxico con el tiempo de exposición y presentó riesgos citotóxicos significativos cuando estaba recién mezclado. La reacción del tejido conectivo a tubos de silicona llenos de EndoREZ implantados en el tejido subcutáneo de ratas mostró una reacción severa que cambió significativamente su perfil después de 30 días, con una reacción moderada después de 3 meses y ausencia de inflamación después de 4 meses. Sin embargo, también se informó que, en algunos animales, la respuesta inflamatoria persistió en todos los períodos experimentales. Se consideró que después de la implantación subcutánea de EndoREZ fresco, componentes como el zinc y el bario estaban en contacto directo con el tejido y causaron la severa reacción inicial. En contraste con los resultados de la presente investigación, Zmener et al. demostraron una respuesta satisfactoria del tejido óseo en el período de observación de 60 días de EndoREZ implantado en las tibias de ratas. La lenta descomposición del sellador EndoREZ, ilustrada por el material disperso, y la posterior endocitosis por macrófagos, podrían haber sido la causa de tal inflamación crónica persistente. Además, la terapia de conducto radicular realizada con conos de gutapercha condensados lateralmente en conjunto con EndoREZ parece presentar una buena tasa de éxito general después de una evaluación de seguimiento de 14-24 meses.
Además, en el presente estudio se observó la presencia de muchas células cebadas en el tejido conectivo, principalmente en el área circundante de los vasos sanguíneos, en los períodos del día 30, 60 y 90, lo que sugiere una reacción hipersensible tardía a los componentes de EndoREZ. Aunque la reacción hipersensible tardía a los materiales endodónticos no se reporta con frecuencia, estas reacciones sistémicas adversas, que ocurren con más frecuencia de lo que se informa en la literatura, no deben ser desestimadas. Según Bratel et al., los materiales endodónticos pueden inducir una reacción hipersensible tardía incluso en concentraciones subtoxicas.
Conclusión
Según los criterios de la FDI, los resultados obtenidos en el presente estudio permitieron concluir que el sellador de conductos radiculares Endométhasone presentó biocompatibilidad dentro de los períodos analizados, mientras que EndoREZ no mostró un comportamiento biocompatible y una sugerencia de reacción hipersensible tardía.
Autores: Edilson José Zafalon, Marco Aurélio Versiani, Cássio José Alves de Souza, Camila Christian Gomes Moura, Paula Dechichi
Referencias:
- Bernath M, Szabo J. Reacción del tejido iniciada por diferentes selladores. Int Endod J 2003;36:256-61.
- Bouillaguet S, Wataha JC, Lockwood PE, Galgano C, Golay A, Krejci I. Citotoxicidad y propiedades de sellado de cuatro clases de selladores endodónticos evaluadas por la actividad de deshidrogenasa succínica y microscopía de escaneo láser confocal. Eur J Oral Sci 2004; 112:182-7.
- Kaplan AE, Ormaechea MF, Picca M, Canzobre MC, Ubios AM. Propiedades reológicas y biocompatibilidad de selladores endodónticos. Int Endod J 2003;36:527-32.
- Hauman CH, Love RM. Biocompatibilidad de materiales dentales utilizados en la terapia endodóntica contemporánea: una revisión. Parte 2. Materiales de obturación de conductos radiculares. Int Endod J 2003;36:147-60.
- Gençoĝlu N, Turkmen C, Ahiskali R. Un nuevo sellador de conductos radiculares a base de silicio (Roekoseal-Automix). J Oral Rehabil 2003;30:753-7.
- Zmener O, Banegas G, Pameijer CH. Respuesta del tejido óseo a un sellador endodóntico a base de metacrilato: un estudio histológico e histométrico. J Endod 2005;31:457-9.
- Huang TH, Yang JJ, Li H, Kao CT. La evaluación de la biocompatibilidad de selladores de conductos radiculares a base de resina epóxica in vitro. Biomaterials 2002;23:77-83.
- Ozbas H, Yaltirik M, Bilgic B, Issever H. Reacciones del tejido conectivo a compómeros, composite y materiales de obturación de raíz. Int Endod J 2003;36:281-7.
- Ho Y-C, Huang F-M, Chang Y-C. Mecanismos de citotoxicidad del eugenol en células osteoblásticas humanas in vitro. Int Endod J 2006;39:389-93.
- Hauman CH, Love RM. Biocompatibilidad de materiales dentales utilizados en la terapia endodóntica contemporánea: una revisión. Parte 1. Medicamentos y sustancias intracanal. Int Endod J 2003;36:75-85.
- Sousa CJ, Loyola AM, Versiani MA, Biffi JC, Oliveira RP, Pascon EA. Una evaluación histológica comparativa de la biocompatibilidad de materiales utilizados en cirugía apical. Int Endod J 2004;37:738-48.
- Tepel J, Darwisch el Sawaf M, Hoppe W. Reacción del tejido periapical inflamado a medicamentos intracanal y selladores de conductos radiculares. Endod Dent Traumatol 1994;10:233-8.
- Gerosa R, Menegazzi G, Borin M, Cavalleri G. Evaluación de la citotoxicidad de 6 selladores de conductos radiculares. J Endod 1995;21:446-8.
- Vajrabhaya L, Sithisarn P. Cultivos celulares multicapa y monocapa en un ensayo de citotoxicidad de selladores de conductos radiculares. Int Endod J 1997;30:141-4.
- Bratel J, Jontell M, Dahlgren U, Bergenholtz G. Efectos de los selladores de conductos radiculares en células inmunocompetentes in vitro y en vivo. Int Endod J 1998;31:178-88.
- Serper A, Ucer O, Onur R, Etikan I. Efectos neurotóxicos comparativos de materiales de obturación de conductos radiculares en el nervio ciático de ratas. J Endod 1998;24:592-4.
- Ersev H, Schmalz G, Bayirli G, Schweikl H. Potencias citotóxicas y mutagénicas de varios materiales de obturación de conductos radiculares en células eucariotas y procariotas in vitro. J Endod 1999;25:359-63.
- Telli C, Serper A, Dogan AL, Guc D. Evaluación de la citotoxicidad de selladores de conductos radiculares a base de fosfato de calcio mediante el ensayo MTT. J Endod 1999;25:811-3.
- Huang FM, Tai KW, Chou MY, Chang YC. Citotoxicidad de selladores de conductos radiculares a base de resina, óxido de zinc-eugenol y hidróxido de calcio en células del ligamento periodontal humano y células V79 permanentes. Int Endod J 2002;35:153-8.
- Schwarze T, Fiedler I, Leyhausen G, Geurtsen W. La compatibilidad celular de cinco selladores endodónticos durante el período de fraguado. J Endod 2002;28:784-6.
- Schwarze T, Leyhausen G, Geurtsen W. Citocompatibilidad a largo plazo de varios selladores endodónticos utilizando un nuevo modelo de conducto radicular. J Endod 2002;28:749-53.
- Gomes BP, Pedroso JA, Jacinto RC, Vianna ME, Ferraz CC, Zaia, AA, et al. Evaluación in vitro de la actividad antimicrobiana de 5 selladores de conductos radiculares. Braz Dent J 2004;15:30-5.
- Perassi FT, Filho IB, Berbert FL, Carlos IZ, de Toledo Leonardo R. Secreción de factor de necrosis tumoral-alfa por macrófagos peritoneales de ratón en presencia de selladores dentales, sealapex y endométhasone. J Endod 2004;30:534-7.
- Pizzo G, Giammanco GM, Cumbo E, Nicolosi G, Gallina G. Actividad antibacteriana in vitro de selladores endodónticos. J Dent 2006; 34:35-40.
- Zmener O. Respuesta del tejido a un nuevo sellador de conductos radiculares a base de metacrilato: observaciones preliminares en el tejido conectivo subcutáneo de ratas. J Endod 2004;30:348-51.
- Zmener O, Pameijer CH. Evaluación clínica y radiográfica de un sellador de conductos radiculares a base de resina. Am J Dent 2004;17:19-22.
- Louw NP, Pameijer CH, Norval G. Evaluación histopatológica de un sellador de conductos radiculares en primates subhumanos [resumen]. J Dent Res 2001;80:654.
- Fédération Dentaire International, Comisión de Materiales Dentales, Instrumentos, Equipos y Terapéuticas. Prácticas estándar recomendadas para la evaluación biológica de materiales dentales. Int Dent J 1980;30:140-88.
- National Institutes of Health. Política del Servicio de Salud Pública sobre el cuidado y uso humanitario de animales de laboratorio, 2006. Disponible en: http://grants.nih.gov/grants/olaw/references/phspol.htm.
- National Institutes of Health. Política del Servicio de Salud Pública sobre el cuidado y uso humanitario de animales de laboratorio aclaración sobre el uso de dióxido de carbono para la eutanasia de pequeños animales de laboratorio, 2006. Disponible en: http://grants.nih.gov/grants/olaw/ Compilation_of_Guidance.doc.
- Stanley HR. Pruebas de toxicidad de materiales dentales. 1ª ed. Miami: CRC Press; 1985.
- Sousa CJA, Montes CRM, Pascon EA, Loyola AM, Versiani MA. Comparación de la biocompatibilidad intraósea de los selladores de conductos radiculares AH Plus, Endo-REZ y Epiphany. J Endod 2006;32:656-62.
- Huang FM, Tsai CH, Yang SF, Chang YC. Inducción de la expresión génica de interleucina-6 e interleucina-8 por selladores de conductos radiculares en células osteoblásticas humanas. J Endod 2005;31:679-83.
- Olsson B, Sliwkowski A, Langeland K. Implantación subcutánea para la evaluación biológica de materiales endodónticos. J Endod 1981;7:355-67.
- de Oliveira L, Borges MM, Leal RC, Assreuy J, Kloetzel JK. Participación del óxido nítrico en la infección experimental de Trypanosoma cruzi en Calomys callosus y ratones suizos. Parasitol Res 1997;83:762-770.
- Tanisaki M, Ogawa K, Lapa SRC, Da Silva PMC, Watanabe I. Estudio morfométrico y de microscopía electrónica de barrido de alta resolución del nervio palatino mayor de Calomys callosus. Int J Morphol 2005;23:13-8.
- Dost CK, Saraiva J, Zentgraf U, Monesi N, Engels W, Albuquerque S. ¿Está involucrado el óxido nítrico en la tolerancia de Calomys callosus como huésped reservorio hacia la infección por Trypanosoma cruzi? J Infect 2006;52:49-55.
- Taniwaki NN, Andreoli WK, Calabrese KS, da Silva S, Mortara RA. Disrupción de proteínas miofibrilares en el músculo cardíaco de Calomys callosus crónicamente infectado con Trypanosoma cruzi y tratado con un agente inmunosupresor. Parasitol Res 2005;97:323-31.
- Martinez M, Milton FA, de Oliveira SA, de Lima NF, Segatelli TM, Pinheiro PF, et al. Cambios ultrastructurales en la mucosa palatina dura de Calomys callosus después de 120 días de alcoholismo crónico experimental. J Submicrosc Cytol Pathol 2005;37:59-65.
- Carroll DS, Mills JN, Montgomery JM, Bausch DG, Blair PJ, Burans JP, et al. Síndrome pulmonar por hantavirus en el centro de Bolivia: relaciones entre huéspedes reservorios, hábitats y genotipos virales. Am J Trop Med Hyg 2005;72:42-6.
- Gomes-Filho JE, Gomes BP, Zaia AA, Novaes PD, Souza-Filho FJ. Metacrilato de glicol: un método alternativo para la inclusión de implantes subcutáneos. J Endod 2001;27:266-8.
- Pascon EA, Leonardo MR, Safavi K, Langeland K. Reacción del tejido a materiales endodónticos: métodos, criterios, evaluación y observaciones. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1991;72:222-37.
- Holland R, Otoboni Filho JA, Bernabé PF, Nery MJ, de Souza V, Berbert A. Efecto del estado del conducto radicular en la curación periodontal después de una lesión quirúrgica en perros. Endod Dent Traumatol 1994;10:77-82.
- Hume WR. Efecto del eugenol en la respiración y división en la pulpa humana, fibroblastos de ratón y células hepáticas in vitro. J Dent Res 1984;63:1262-5.
- Gulati N, Chandra S, Aggarwal PK, Jaiswal JN, Singh M. Citotoxicidad del eugenol en selladores que contienen óxido de zinc. Endod Dent Traumatol 1991;7:181-5.
- Neff T, Layman D, Jeansonne BG. Evaluación de la citotoxicidad in vitro de selladores endodónticos expuestos a calor antes del ensayo. J Endod 2002;28:811-4.
- Ioannis K, Nikolaos E. Comparación in vivo de la biocompatibilidad de 2 selladores de conductos radiculares implantados en el tejido conectivo subcutáneo de ratas. J Endod 1998;24:82-5.
- Nikolaos E, Ioannis K. Estudio experimental de la biocompatibilidad de cuatro selladores de conductos radiculares y su influencia en el contenido de zinc y calcio de varios tejidos. J Endod 1995;21:122-7.
- Segura JJ, Jimenez-Rúbio A. Efecto del eugenol en la adhesión de macrófagos in vivo a superficies plásticas. Endod Dent Traumatol 1998;14:72-4.
- de Oliveira Mendes ST, Ribeiro Sobrinho AP, de Carvalho AT, de Souza Cortes MI, Vieira LQ. Evaluación in vitro de la citotoxicidad de dos selladores de conductos radiculares sobre la actividad de macrófagos. J Endod 2003;29:95-9.
- Di Felice R, Lombardi T. Necrosis gingival y del hueso mandibular causada por una pasta que contiene paraformaldehído. Endod Dent Traumatol 1998;14:196-198.
- Cotran RS, Kumar V, Robbins SL. Base patológica de la enfermedad: eventos celulares. 5ª ed. Filadelfia: Saunders; 1994.
- el Sayed F, Seite-Bellezza D, Sans B, Bayle-Lebey P, Marguery MC, Bazex J. Urticaria de contacto por formaldehído en una pasta dental de conducto radicular. Contact Dermatitis 1995;33:353.
- Ebner H, Kraft D. ¿Anaphylaxis inducida por formaldehído después del tratamiento dental? Contact Dermatitis 1991;24:307-9.

/social-network-service/media/default/6758/89a8282e.png)