Evaluación de las propiedades fisicoquímicas de cuatro selladores de conductos radiculares
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo).
Resumen
Objetivo: Evaluar las propiedades fisicoquímicas y la morfología superficial de los selladores de conductos radiculares AH Plus, GuttaFlow, RoekoSeal y Activ GP.
Metodología: Se evaluaron cinco muestras de cada material para el tiempo de fraguado, alteración dimensional, solubilidad y pruebas de radiopacidad, de acuerdo con la Especificación ANSI/ADA 57. Se utilizaron un total de 50 mL de agua destilada desionizada de las pruebas de solubilidad para medir la solubilidad metálica mediante espectrometría de absorción atómica. Las morfologías de la superficie externa y la sección transversal de las muestras se analizaron mediante un microscopio electrónico de barrido (SEM). Se realizó un análisis estadístico utilizando ANOVA de una vía y pruebas post hoc Tukey-Kramer con la hipótesis nula establecida en 5%.
Resultados: AH Plus tuvo el tiempo de fraguado más largo (580.6 ± 3.05 min) (P< 0.05). Activ GP no tuvo un valor medio en las pruebas de radiopacidad y solubilidad (1.31 ± 0.35 mm y 11.8 ± 0.43%, respectivamente) de acuerdo con ANSI/ADA, siendo significativamente diferente de los otros materiales (P< 0.05), que tuvieron valores medios para estas pruebas de acuerdo con los requisitos de la ADA. GuttaFlow fue el único sellador que cumplió con la Especificación 57 en cuanto a la prueba de alteración dimensional (0.44 ± 0.16%) (P< 0.05). La prueba de espectrometría reveló una liberación significativa de iones Ca2+, K+, Zn2+ del sellador Activ GP (32.57 ± 5.0, 1.57 ± 0.22 y 8.20 ± 1.74 μg mL–1, respectivamente). En el análisis SEM, la pérdida de matriz fue evidente y las partículas de relleno eran más distinguibles en todos los grupos.
Conclusiones: El tiempo de fraguado de todos los selladores estuvo de acuerdo con los requisitos de ANSI/ADA. Activ GP no cumplió con los protocolos de ANSI/ADA en cuanto a radiopacidad, alteración dimensional y solubilidad. Gutta-Flow fue el único sellador que se ajustó a la Especificación 57 en todas las pruebas. El análisis SEM reveló que las superficies de todos los selladores presentaron cambios micromorfológicos después de la prueba de solubilidad.
Introducción
En el tratamiento de conductos radiculares, el sellado completo del sistema de conductos radiculares después de la limpieza y conformación es crítico para prevenir que los patógenos orales se coloquen y reinfecten los tejidos radiculares y periapicales. Aunque la gutapercha sigue siendo el material de relleno de conductos radiculares más utilizado, se han desarrollado una serie de nuevas técnicas y materiales con diferentes propiedades fisicoquímicas (Ørstavik 2005, Versiani et al. 2006, Resende et al. 2009).
Durante los procedimientos de llenado de conductos, el sellador endodóntico realiza varias funciones, incluyendo el llenado de las irregularidades de las paredes del conducto radicular, como las ramificaciones apicales y los deltas, así como los espacios donde la gutapercha no pudo adaptarse (Kontakiotis et al. 2007). Debido a que los materiales de relleno convencionales no sellan eficazmente el espacio del conducto radicular, se han desarrollado nuevos selladores endodónticos (Bouillaguet et al. 2008).
Aunque AH Plus tiene una estabilidad dimensional adecuada a largo plazo, su capacidad de sellado sigue siendo controvertida en parte porque AH Plus no se adhiere a la gutapercha (Ørstavik et al. 2001). RoekoSeal Automix (Coltène Whaledent, Langenau, Alemania) es un sellador que contiene dimetilpolisiloxano con datos limitados disponibles sobre sus propiedades fisicoquímicas (Gençoglu et al. 2003). A pesar de los prometedores datos clínicos y de laboratorio reportados para el sellador a base de silicona, RoekoSeal ha sido probado en varios estudios con resultados contradictorios (De-Deus et al. 2007). GuttaFlow (Coltène Whaledent, Alstätten, Suiza) es un sellador a base de polivinilsiloxano y fue introducido con la intención de reducir las desventajas de las técnicas de gutapercha caliente (Eldeniz & Ørstavik 2009). Se ha afirmado que GuttaFlow podría mejorar el sellado debido a su mayor fluidez y al hecho de que el material se expande ligeramente al fraguarse (Bouillaguet et al. 2008, Eldeniz & Ørstavik 2009, Roggendorf et al. 2010).
Las aplicaciones dentales de los selladores de ionómero de vidrio aprovechan su unión a la dentina, la liberación de flúor, la actividad antimicrobiana y la biocompatibilidad (Ørstavik 2005). Sin embargo, algunas pruebas de laboratorio han indicado una propensión a la filtración y desintegración (Carvalho-Júnior et al. 2003, Schäfer & Zandbiglari 2003). Recientemente, el Sistema de Obturación de Precisión Activ GP (Brasseler USA, Savannah, GA, USA) se comercializó como un sistema monobloque para relleno de raíces utilizando conos de gutapercha convencionales que están recubiertos en la superficie con rellenos de ionómero de vidrio (Roggendorf et al. 2010). El fabricante afirma que el producto es superior a los sistemas anteriores basados en ionómero de vidrio en términos de características de manejo, tiempo de trabajo, radiopacidad (Fransen et al. 2008) y sellado, debido a la mayor fluidez y al hecho de que el material se expande ligeramente al fraguarse (Kontakiotis et al. 2007).
Aunque se han propuesto varios tipos de selladores endodónticos como materiales de relleno innovadores, aún no se ha encontrado el sellador ideal para conductos radiculares (Ørstavik 1983, 2005, Ørstavik et al. 2001, Versiani et al. 2006, Resende et al. 2009). Por lo tanto, el objetivo de este estudio de laboratorio fue comparar el tiempo de fraguado, la radiopacidad, el cambio dimensional y la solubilidad de selladores a base de silicona (GuttaFlow y RoekoSeal), y un sellador a base de ionómero (Activ GP) con un sellador a base de resina epoxi bien establecido (AH Plus), de acuerdo con los estándares ANSI/ADA (2000).
Materiales y métodos
El tiempo de fraguado, radiopacidad, cambios dimensionales y solubilidad, después del fraguado para AH Plus (grupo I), GuttaFlow (grupo II), RoekoSeal (grupo III) y Activ GP (grupo IV) selladores de conductos radiculares se midieron de acuerdo con las normas ANSI/ADA (2000) para materiales de sellado de conductos radiculares. Los materiales probados (Tabla 1) se manipularon según las instrucciones del fabricante. Los análisis fueron realizados por un único examinador que estaba ciego a los materiales experimentales. Para estandarizar y homogeneizar la cantidad de material, se dispensaron 0.3 g de sellador sobre una almohadilla de mezcla y se espatuló durante 15 s para cada muestra probada. Para las pruebas físico-químicas, se registró la media aritmética de cinco réplicas para cada sellador y se consideró como el resultado de la prueba.
Tiempo de fraguado
Se prepararon cinco anillos de yeso de París, con un diámetro interno de 10 mm y un grosor de 2 mm. Los bordes externos de los moldes se fijaron con cera sobre una placa de vidrio (75 x 25 x 1 mm). Luego, los moldes se llenaron con el material y se transfirieron a una cámara con 95% de humedad relativa (HR) y una temperatura de 37 °C. Después de 150 ± 10 s desde el inicio de la mezcla del sellador, se bajó cuidadosamente una aguja tipo Gilmore con una masa de 100 ± 0.5 g, que tenía un extremo plano de 2.0 ± 0.1 mm de diámetro, verticalmente sobre la superficie horizontal de cada muestra. La punta de la aguja se limpió y se repitió la prueba hasta que las impresiones dejaron de ser visibles. Si los resultados diferían en más de ±5%, se repitió la prueba.
Prueba de radiopacidad
Se prepararon cinco placas acrílicas (2.2 cm x 4.5 cm x 1 mm), que contenían cuatro pocillos de 1 mm de profundidad y 5 mm de diámetro, y se colocaron sobre una placa de vidrio cubierta con una hoja de celofán. Cada pocillo se llenó con uno de los selladores, siguiendo una secuencia de acuerdo con el tiempo de fraguado del material, desde el más largo hasta el más corto, para que las muestras estuvieran listas para la evaluación radiográfica después del fraguado final de todos los materiales. Para evitar la formación de burbujas, el sellador recién mezclado se introdujo en los pocillos utilizando una jeringa. Otra placa de vidrio cubierta con celofán se colocó encima hasta el fraguado completo y se retiró cualquier exceso de sellador. Cada placa se mantuvo en un incubador (37°C, 95% HR) durante un período correspondiente a tres veces el tiempo de fraguado.
Cada una de las placas de acrílico que contenían los selladores fue posicionada, en el momento de la exposición radiográfica, junto a otra placa de acrílico (1.3 cm x 4.5 cm x 1 mm), que contenía un cuña de paso de aluminio, hecha de aleación 1100, con un grosor que variaba de 1 a 10 mm, en pasos uniformes de 1 mm cada uno (Margraf Dental MFG Inc., Jenkintown, PA, EE. UU.). Este conjunto de placas de acrílico fue colocado frente a esta placa de fósforo, junto a la cuña de paso de aluminio, y se tomó una radiografía digital (sistema Digora™; Soredex Orion Corporation, Helsinki, Finlandia). Las imágenes radiográficas se obtuvieron utilizando la máquina de rayos X Spectro 70X (Dabi Atlante, Ribeirão Preto, SP, Brasil), a 70 kVp y 8 mA. La distancia objeto-foco fue de 30 cm y el tiempo de exposición fue de 0.2 s. Las placas de imagen expuestas de las muestras de prueba fueron escaneadas inmediatamente después de la exposición (Escáner Digora™) y analizadas utilizando el software Digora™ para Windows 5.1.
Cambio dimensional
Seis moldes de Teflón® (Politetrafluoroetileno, DuPont, HABIA, Knivsta, Suecia), preparados para la producción de cuerpos de prueba cilíndricos de 3.58 mm de altura y 3 mm de diámetro, fueron colocados sobre una placa de vidrio envuelta con una fina hoja de celofán. Los moldes se llenaron con un ligero exceso de selladores recién mezclados y se presionó un portaobjetos, también envuelto en celofán, sobre la superficie superior del molde. El grupo ensamblado se mantuvo firmemente unido con una abrazadera en forma de C y se transfirió a un incubador (37 °C, 95% HR) y se dejó reposar durante un período correspondiente a tres veces el tiempo de fraguado. Después de este período, los extremos planos de los moldes, que contenían las muestras, fueron lijados con papel de lija húmedo de grano 600. Las muestras se retiraron del molde, se midieron con un calibrador digital, se almacenaron en un recipiente de 50 mL que contenía 2.24 mL de agua destilada desionizada y se mantuvieron en un incubador (37 °C, 95% HR) durante 30 días. Luego, la muestra se retiró del recipiente, se secó con papel absorbente y se midió nuevamente para determinar la longitud. El porcentaje de las alteraciones dimensionales se calculó utilizando la fórmula:
((L30 — L )/ L) x 100
donde L30 es la longitud de la muestra después de 30 días de almacenamiento y L es la longitud inicial de la muestra.
Solubilidad
Un molde cilíndrico de Teflón® de 1.5 mm de grosor y 7.75 mm de diámetro interno fue llenado con sellador recién mezclado. El molde fue soportado por una placa de vidrio más grande y cubierto con una hoja de celofán. Se colocó un hilo de nylon impermeable dentro del material y se posicionó otra placa de vidrio, también cubierta con película de celofán, sobre el molde y se presionó manualmente de tal manera que las placas tocaran todo el molde de manera uniforme. El ensamblaje se colocó en un incubador (37 °C, 95% HR) y se dejó reposar durante un período correspondiente a tres veces el tiempo de fraguado. Tan pronto como se retiraron las muestras del molde, se pesaron tres veces cada una (HM-200, A & D Engineering, Inc., Bradford, MA, EE. UU.), y se registró la lectura media. Las muestras se suspendieron con hilo de nylon y se colocaron de dos en dos dentro de un recipiente plástico con una abertura amplia que contenía 7.5 mL de agua destilada desionizada, cuidando de evitar cualquier contacto entre ellas y la superficie interna del recipiente. Los recipientes se sellaron y se dejaron durante 7 días en un incubador (37 °C, 95% HR). Después de este período, las muestras se retiraron de los recipientes, se enjuagaron con agua destilada desionizada, se secaron con papel absorbente y se colocaron en un deshumidificador durante 24 h. Posteriormente, se pesaron nuevamente. La pérdida de peso de cada muestra (masa inicial menos masa final), expresada como un porcentaje de la masa original (m% = mi – mf), se tomó como la solubilidad del sellador.
Se vertieron 7.5 mL de agua destilada de cada muestra en un crisol de porcelana limpio y seco. Cada crisol se colocó en un mufla y se quemó a 550 °C. Las cenizas se disolvieron en 10 mL de ácido nítrico concentrado (Merck KGaA, Darmstadt, Alemania) utilizando una varilla de vidrio. A continuación, las muestras se colocaron en matraces volumétricos de 50 mL y se completó el volumen con agua ultrapura desionizada (MilliQ, Millipore, Billerica, MA, EE. UU.). Las soluciones obtenidas se rociaron en el espectrofotómetro de absorción atómica (Perkin Elmer, Überlingen, Alemania) para verificar la presencia de iones Ca2+, K+, Zn2+ y Ag+. Se registró la media aritmética de tres réplicas para cada espécimen y se consideró como el resultado, expresado en μg mL–1.
Examen por microscopía electrónica de barrido
Para el examen por microscopía electrónica de barrido (SEM), se llenaron moldes cilíndricos de Teflón® (3 x 4 mm) con selladores recién mezclados. Los moldes se apoyaron sobre una placa de vidrio cubierta con una hoja de celofán y se colocaron en una cámara (37 °C, 95% HR) durante un período correspondiente a tres veces el tiempo de fraguado. Después de eso, las muestras se seccionaron con una hoja de bisturí quirúrgico desechable número 15, se fijaron en un soporte metálico (10 x 5 mm) y se recubrieron por pulverización con oro-palidado (Bal-Tec AG, Balzers, Alemania) a 20 mA. Las morfologías de la superficie externa y la sección transversal de las muestras se analizaron cualitativamente bajo un SEM de emisión de campo (Jeol JSM 5410; Jeol Technic Co., Tokio, Japón) a un voltaje de aceleración de 15 kV, una distancia de trabajo de 6 a 10 mm y a diferentes aumentos.
Análisis estadístico
Se probaron cinco especímenes de cada grupo y se compararon estadísticamente las medias. La prueba de Kolmogorov–Smirnov mostró que los resultados eran consistentes con una curva de distribución normal, por lo que fue posible realizar un análisis estadístico paramétrico (anova de una vía y post hoc prueba de Tukey–Kramer), y la hipótesis nula se estableció en un 5% (spss 17.0 para Windows; SPSS Inc., Chicago, IL, EE. UU.).
Resultados
Tiempo de fraguado
La especificación ANSI/ADA (2000) requiere que el tiempo de fraguado de un sellador esté dentro del 10% de lo indicado por los fabricantes. Según ellos, los tiempos de fraguado de AH Plus, RSA RoekoSeal y Gutta-Flow son 480, 50 y 30 min, respectivamente. Por el contrario, el fabricante de Activ GP no proporciona esta información y solo indica que ha sido formulado con un tiempo de trabajo extendido de 15 minutos.
Se observó una diferencia estadísticamente significativa entre los grupos de AH Plus (580.6 ± 3.05 min), GuttaFlow (24.0 ± 2.0 min), RoekoSeal (40.0 ± 1.58 min) y Activ GP (15.2 ± 1.30 min) (P< 0.05). Sin embargo, los valores medios mostraron concordancia con la estandarización ANSI/ADA (Tabla 2).
Prueba de radiopacidad
AH Plus (6.0 ± 0.12 mmAl), GuttaFlow (3.0 ± 0.04 mmAl) y RoekoSeal (4.17 ± 0.45 mmAl) tuvieron radiopacidad superior a los 3 mm de aluminio, como se recomienda en la Especificación 57 de ANSI/ADA, mientras que Activ GP (1.31 ± 0.35 mmAl) no cumplió con este requisito. El análisis estadístico demostró diferencia entre los grupos experimentales (P < 0.05) (Tabla 2).
Cambio dimensional
La estandarización ANSI/ADA (2000) establece que la contracción lineal media del sellador no debe exceder el 1% o el 0.1% en expansión. Excepto por GuttaFlow (0.44 ± 0.16%), ningún sellador cumplió con la Especificación 57 (ANSI/ADA 2000). Todos los grupos mostraron expansión post-configuración, excepto RoekoSeal que mostró contracción al configurarse (-1.33 ± 0.12%). El análisis estadístico reveló una diferencia significativa entre los grupos experimentales (P < 0.05) (Tabla 2).
Solubilidad
La Especificación 57 de ANSI/ADA (2000) establece que un sellador de conducto radicular no debe exceder el 3% en masa cuando se prueba la solubilidad del material establecido. Excepto por Activ GP (11.8 ± 0.43%), todos los selladores cumplieron con la estandarización ANSI/ADA (P < 0.05) (Tabla 2). El agua destilada desionizada utilizada para la prueba de solubilidad y sometida a espectrometría de absorción atómica mostró un nivel significativo de liberación de iones Ca2+, K+ y Zn2+ en el grupo Activ GP en comparación con AH Plus, Gutta-Flow y RoekoSeal (P < 0.05). No se observaron niveles significativos de liberación de Ag+ en ningún grupo (Tabla 3).

Examen SEM
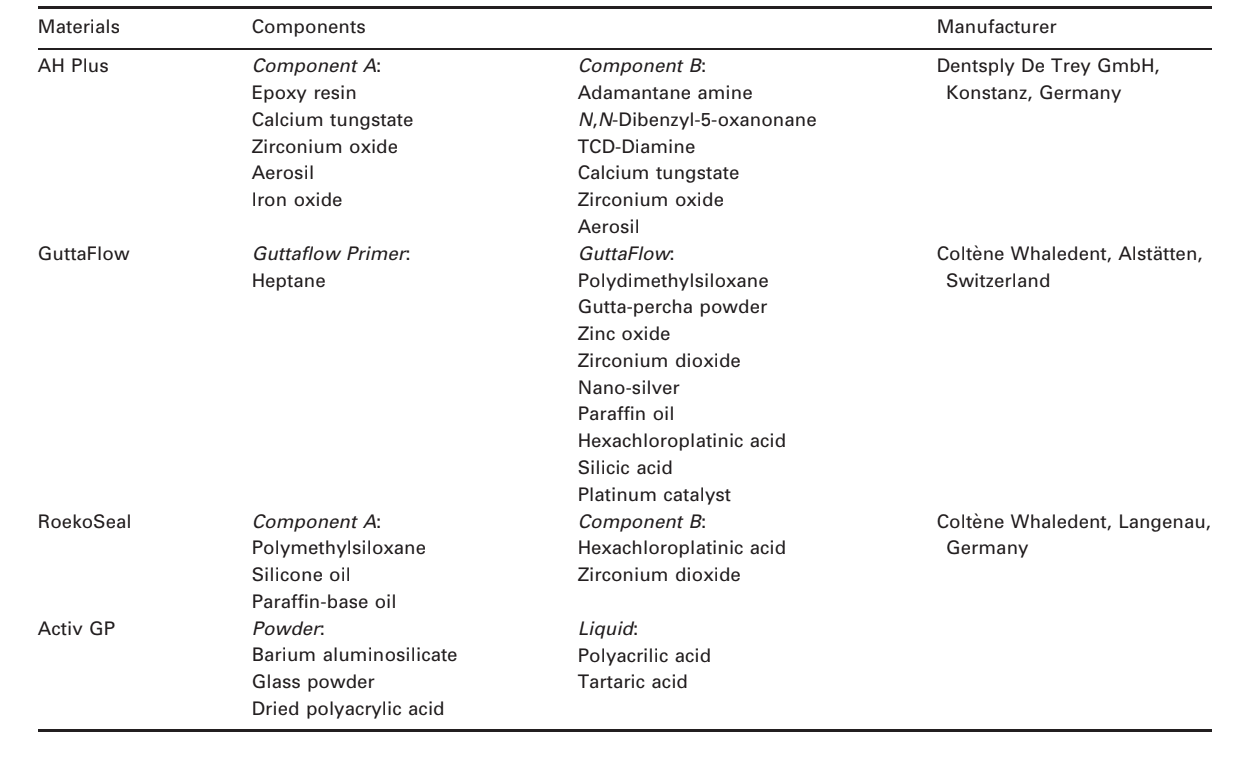
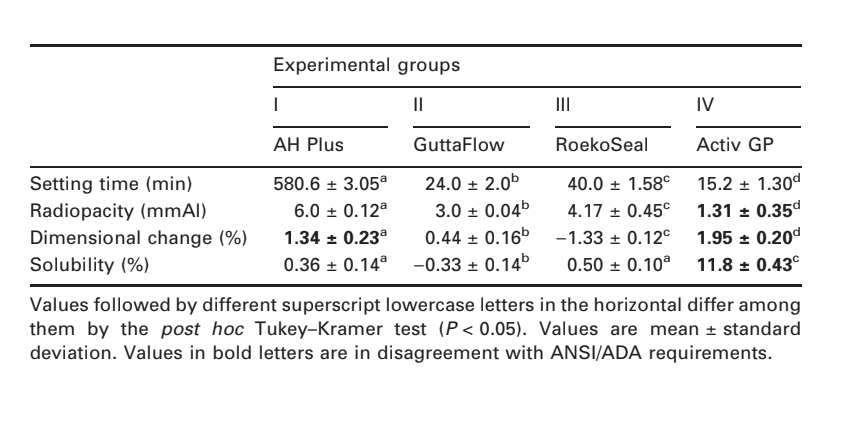
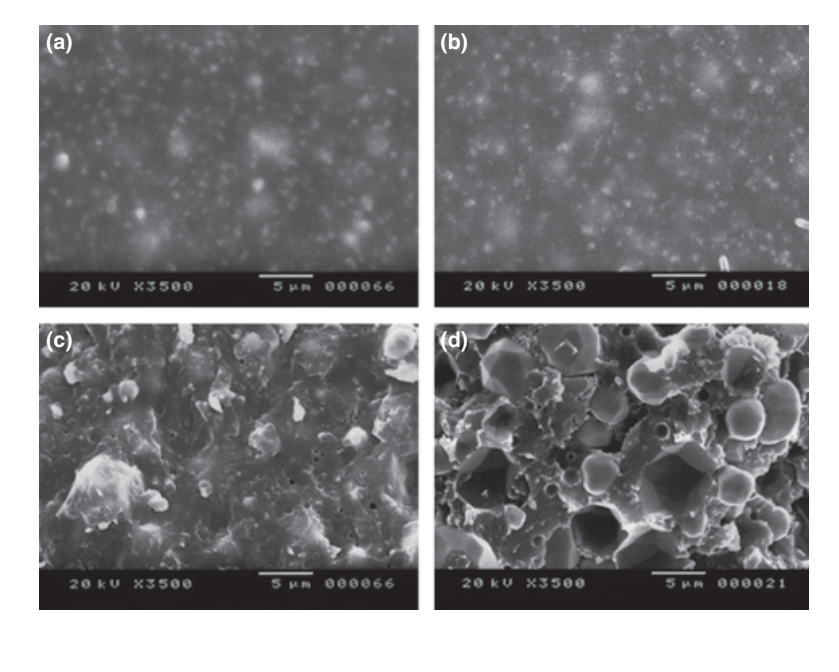
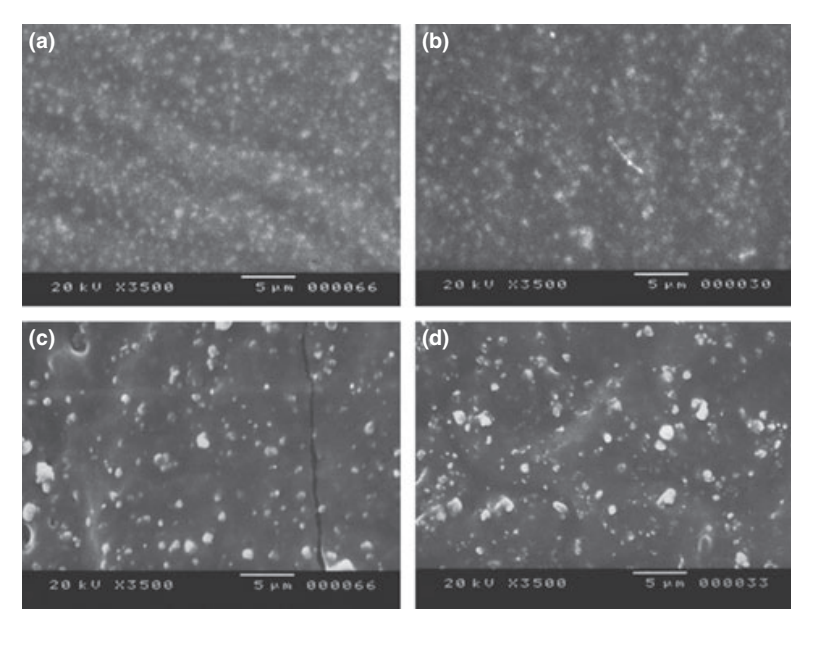
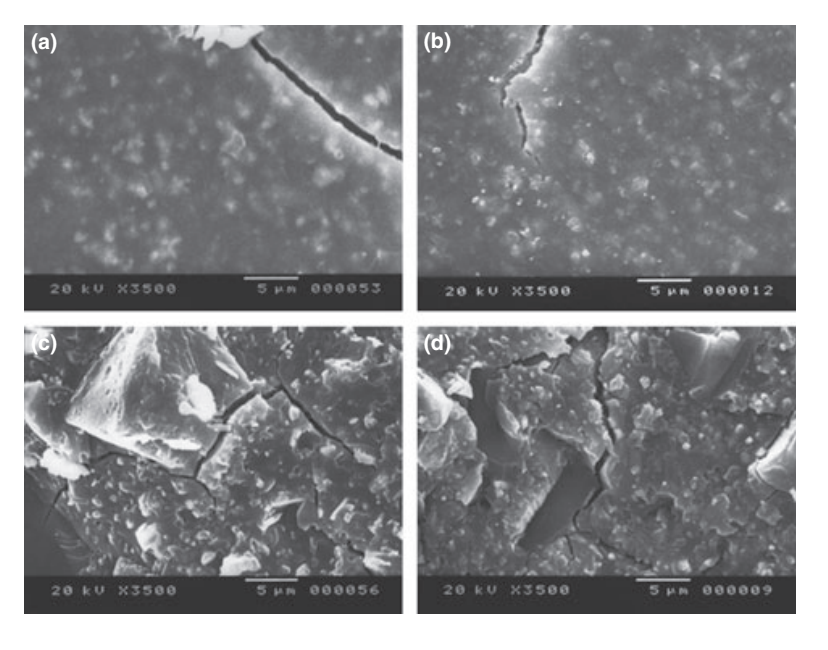
Se presentan fotomicrografías seleccionadas de las muestras polimerizadas obtenidas antes y después del almacenamiento en agua durante 7 días en las Figuras 1–4. En general, se observó que todas las superficies presentaron cambios micromorfológicos después de la prueba de solubilidad. La pérdida de matriz fue evidente y las partículas de relleno eran más distinguibles. Los grupos AH Plus (Fig. 1a,b), GuttaFlow (Fig. 2a,b) y RoekoSeal (Fig. 3a,b) tenían una superficie externa que parecía ser mayormente superficies rugosas homogéneas que disminuyen en rugosidad después de la prueba de solubilidad con un posterior aumento de la rugosidad de la superficie. No se observaron grietas en los especímenes, excepto en el grupo Activ GP. La superficie de las muestras de Activ GP era relativamente más rugosa en comparación con los otros grupos y el material de la superficie parecía estar más dañado después de la prueba de solubilidad (Fig. 4a,b).
La microscopía electrónica de barrido de la superficie de la sección transversal de las muestras reveló la presencia de polímeros en forma de esfera de diferentes tamaños que estaban dispersos de manera no homogénea. Después de la prueba de solubilidad, la superficie interna de las muestras de AH Plus (Fig. 1c,d), GuttaFlow (Fig. 2c,d) y Activ GP (Fig. 4c,d) parecía ser mucho más irregular y áspera. Se observaron varias micro-grietas en las interfaces de la matriz polimérica de relleno en el grupo Activ GP antes y después de la prueba de solubilidad (Fig. 4c,d). Por otro lado, el grupo RoekoSeal tenía una capa más uniforme y compacta compuesta de polímeros en forma de esfera con una mayor cantidad de matriz de resina (Fig. 3c,d).

Discusión
El tiempo de fraguado es principalmente una prueba de control sobre el comportamiento estable de un producto y depende de los componentes constitutivos, su tamaño de partícula, la temperatura ambiente y la humedad relativa (Ørstavik 1983, 2005, Ørstavik et al. 2001). En el presente estudio, todos los resultados fueron de acuerdo con la especificación ANSI/ADA. El tiempo de fraguado más largo de AH Plus podría explicarse por el hecho de que este sellador es un material de pasta de dos componentes basado en una reacción de polimerización lenta de aminas de resina epoxi de alto peso molecular (Bisfenol A y Bisfenol F), donde la conversión de monómeros en polímeros ocurre gradualmente (Lin-Gibson et al. 2006, Resende et al. 2009). Estos resultados fueron coherentes con investigaciones previas (Versiani et al. 2006, Resende et al. 2009), sin embargo, Garrido et al. (2010) reportaron un tiempo de fraguado de 13 h para AH Plus, lo cual está por encima de la variación del 10% permitida por la Especificación Número 57 de la ADA.
Los estándares ANSI/ADA (2000) para la radiodensidad de los materiales de sellado de conductos radiculares se han determinado utilizando películas dentales convencionales donde las imágenes radiográficas se obtienen mediante el procesamiento químico (Taşdemir et al. 2008). Sin embargo, la radiografía digital se está volviendo cada vez más común en el estudio de selladores endodónticos (Baksi Akdeniz et al. 2007, Carvalho-Júnior et al. 2007a, Rasimick et al. 2007, Taşdemir et al. 2008). Así, en el presente estudio se adquirieron imágenes digitales de materiales de obturación radicular y pasos de un cuña de aluminio utilizando un sistema de placa de fósforo y un sistema digital de escaneo, captura y lectura.
Un análisis de la composición de los materiales probados reveló que todos tienen agentes radiopacificadores (Tabla 1), excepto el sellador Activ GP. Según Tanomaru-Filho et al. (2008), la presencia de polvo de vidrio de aluminosilicato de bario en su composición no proporciona una radiopacidad satisfactoria. AH Plus contiene óxido de zirconio, óxido de hierro y tugstate de calcio como radiopacificadores (Tanomaru-Filho et al. 2007) y tuvo el valor medio de radiopacidad más alto (6.0 ± 0.12 mmAl), como se informó anteriormente (Tagger & Katz 2003, Carvalho-Júnior et al. 2007a, Tanomaru-Filho et al. 2007, Taşdemir et al. 2008). El sellador RoekoSeal contiene dióxido de zirconio como radiopacificador (Baksi Akdeniz et al. 2007) y el resultado presente (4.17 ± 0.45 mmAl) fue coherente con hallazgos anteriores que mostraron su radiopacidad en un rango de 4.0 a 5.7 (Tagger & Katz 2003, Gambarini et al. 2006, Tanomaru-Filho et al. 2007, Rasimick et al. 2007). La menor radiopacidad de GuttaFlow (3.0 ± 0.04 mmAl) en comparación con RoekoSeal también se observó en estudios previos (Tagger & Katz 2003, Gambarini et al. 2006, Rasimick et al. 2007, Tanomaru-Filho et al. 2007). Dado que el fabricante no proporciona el tipo químico y la concentración de nano-plata en GuttaFlow, es evidente que estas partículas no ejercieron una característica radiopaca. La alta solubilidad de los selladores de conductos radiculares es indeseable porque la disolución puede causar la liberación de materiales que podrían irritar los tejidos periapicales y también puede permitir la formación de huecos entre los conductos radiculares y los materiales de relleno, lo que probablemente aumente la fuga bacteriana con el tiempo (Donnelly et al. 2007). A pesar de las recomendaciones de ANSI/ADA, en el presente estudio se utilizó una modificación previamente propuesta para ambas pruebas, que logró resultados similares con una disminución en el volumen de material necesario para la producción de las muestras de prueba (Carvalho-Júnior et al. 2007b). En el presente estudio, AH Plus se expandió en la prueba de cambio dimensional. La lenta ganancia de masa a lo largo del tiempo se debió principalmente a la energía de interacción entre el agua y los sitios de adsorción para el sistema (es decir, un grupo hidroxilo, un grupo amino, el extremo de la cadena polimérica, etc.), llenando los huecos entre las cadenas poliméricas (McDermott 1993). Posiblemente, esta expansión ha compensado la contracción sufrida por el sellador a base de resina después de la polimerización (Phillips & Skinner 1991, Carvalho-Júnior et al. 2007b, Resende et al. 2009, Garrido et al. 2010).
La polimerización del AH Plus se logra a través de los monómeros de poliaminas en su composición (amina 1-adamantano, N,N’-dibenzil-5-oxa-nonandi-amina-1,9, TCD-Diamina). Cuando los compuestos de diepóxido y la pasta de poliaminas se mezclan, los grupos amina reaccionan con los grupos epóxido para formar un enlace covalente. La utilización de grupos amina alifáticos cíclicos promueve modificaciones en la tasa de curado, densidad de entrecruzamiento y morfología de las resinas epóxicas. Cada grupo NH puede reaccionar con un grupo epóxido, de modo que el polímero resultante está fuertemente entrecruzado, y es así rígido y fuerte (McDermott 1993, Case et al. 2005). Esto puede explicar la superficie rugosa homogénea y compacta revelada en el análisis SEM y los bajos resultados de solubilidad del AH Plus en el presente estudio. Schäfer & Zandbiglari (2003) también han medido la solubilidad de resinas epóxicas (AH Plus, AH 26), a base de silicona (RoekoSeal), hidróxido de calcio (Apexit, Sealapex), óxido de zinc-eugenol (Aptal-Harz) y selladores a base de ionómero de vidrio (Ketac Endo) en agua y saliva artificial. Según estos autores, el AH Plus tuvo la menor pérdida de peso de todos los selladores probados, independientemente del medio de solubilidad utilizado.
Los hallazgos anteriores han mostrado que los selladores a base de polidimetilsiloxano se expanden ligeramente durante el fraguado y exhiben una mínima absorción de agua y solubilidad (Donnelly et al. 2007, Monticelli et al. 2007). De acuerdo con esta afirmación, en el presente estudio, los selladores GuttaFlow y RoekoSeal tuvieron baja solubilidad con una mínima liberación de iones metálicos. Considerando la prueba de cambio dimensional, GuttaFlow fue el único sellador que se ajustó a la Especificación 57 (ANSI/ADA 2000), experimentando una expansión de aproximadamente 0.44%. Lo mismo no se observó con su predecesor, RoekoSeal, que demostró contracción (1.33%). Por el contrario, este resultado no estuvo de acuerdo con Ørstavik et al. (2001) quien informó que Roeko-Seal tuvo una pequeña expansión de aproximadamente 0.2% en 4 semanas, y fue estable después de eso.
La presencia de gutapercha y partículas de nano-plata en el sellador GuttaFlow proporciona mejor estabilidad a la matriz polimérica debido a la fuerza de atracción entre los átomos de plata y las moléculas de gutapercha en el entrecruzamiento del polímero (Malynych et al. 2001). Estas interacciones pueden explicar la baja liberación de iones de plata de GuttaFlow observada en la espectroscopia de absorción atómica. Además, la presencia de gutapercha en el entrecruzamiento del polímero de GuttaFlow resultó en una mayor adsorción de agua que RoekoSeal (Gong et al. 2008), explicando las diferencias en los resultados de la prueba de cambio dimensional y la capa más uniforme y compacta observada en la superficie de RoekoSeal bajo SEM.
Los resultados más altos de solubilidad y cambio dimensional del sellador Activ GP pueden estar relacionados con la metodología de ANSI/ADA que recomienda que una muestra se sumerja en agua después de un período de tres veces el tiempo de fraguado del material. Según Wilson & McLean (1988), el tiempo de fraguado del cemento ionómero se completa solo 24 h después de mezclar. Durante el tiempo de maduración de los cementos de ionómero de vidrio, la presencia de humedad puede causar la disolución de aniones y cationes que forman la matriz para las áreas que rodean el cemento (Monticelli et al. 2007). Esta disolución de iones no permite que el agua, que es parte de la composición del cemento, hidrate la matriz (Ca2+ y Al3+ forman polisalts con grupos de COO- de ácido poliacrílico), volviéndola inestable (Carvalho-Júnior et al. 2003, Schäfer & Zandbiglari 2003, Donnelly et al. 2007). Esto podría explicar la superficie más rugosa observada en SEM y el nivel significativo de liberación de iones de calcio, potasio y zinc de Activ GP en el presente estudio. Dado que las estructuras de los cementos de ionómero de vidrio probablemente se ven influenciadas por la presencia o ausencia de agua, son sensibles a la deshidratación temprano en el proceso de fraguado (Wilson & McLean 1988). Para la evaluación SEM, la deshidratación de la muestra es un proceso esencial, lo que puede explicar las microgrietas observadas en la superficie de las muestras de Activ GP. Por lo tanto, los resultados obtenidos con Activ GP en el presente estudio deben interpretarse con precaución.
Conclusiones
El tiempo de fraguado de todos los selladores estuvo de acuerdo con los requisitos de ANSI/ADA. Activ GP no cumplió con los protocolos de ANSI/ADA en cuanto a radiopacidad, alteración dimensional y solubilidad. GuttaFlow fue el único sellador que se ajustó a la Especificación 57 en todas las pruebas. El análisis SEM reveló que las superficies de todos los selladores presentaron cambios micromorfológicos después de la prueba de solubilidad.
Autores: D. S. H. Flores, F. J. A. Rached-Júnior, M. A. Versiani, D. F. C. Guedes, M. D. Sousa-Neto, J. D. Pécora
Referencias:
- ANSI/ADA (2000) Especificación n° 57 Material de Sellado Endodóntico. Chicago, EE. UU.: ADA Publishing.
- Baksi Akdeniz BG, Eyuboglu TF, Sen BH, Erdilek N (2007) El efecto de tres selladores diferentes en la radiopacidad de los rellenos radiculares en canales simulados. Oral Surgery Oral Medicine Oral Pathology Oral Radiology and Endodontics 103, 138–41.
- Bouillaguet S, Shaw L, Barthelemy J, Krejci I, Wataha JC (2008) Capacidad de sellado a largo plazo de Pulp Canal Sealer, AH-Plus, GuttaFlow y Epiphany. International Endodontic Journal 41, 219–26.
- Carvalho-Júnior JR, Guimarães LF, Correr-Sobrinho L, Pécora JD, Sousa-Neto MD (2003) Evaluación de la solubilidad, desintegración y alteraciones dimensionales de un sellador de conducto radicular de ionómero de vidrio. Brazilian Dental Journal 14, 114–8.
- Carvalho-Júnior JR, Correr-Sobrinho L, Correr AB, Sinhoreti MA, Consani S, Sousa-Neto MD (2007a) Radiopacidad de materiales de relleno radicular utilizando radiografía digital. International Endodontic Journal 40, 514–20.
- Carvalho-Júnior JR, Correr-Sobrinho L, Correr AB, Sinhoreti MA, Consani S, Sousa-Neto MD (2007b) Solubilidad y cambio dimensional después del fraguado de selladores de conducto radicular: una propuesta para dimensiones más pequeñas de las muestras de prueba. Journal of Endodontics 33, 1110–6.
- Case SL, O’Brien EP, Ward TC (2005) Perfiles de curado, densidad de entrecruzamiento, tensiones residuales y adhesión en un modelo de epoxi. Polymer 46, 10831–40.
- De-Deus G, Brandão MC, Fidel RA, Fidel SR (2007) La capacidad de sellado de GuttaFlow en canales de forma ovalada: un estudio ex vivo utilizando un modelo de fuga polimicrobiana. International Endodontic Journal 40, 794–9.
- Donnelly A, Sword J, Nishitani Y et al. (2007) Sorción de agua y solubilidad de selladores de conducto radicular a base de resina metacrilato. Journal of Endodontics 33, 990–4.
- Eldeniz AU, Ørstavik D (2009) Una evaluación de laboratorio de la fuga bacteriana coronal en conductos radiculares rellenos con selladores nuevos y convencionales. International Endodontic Journal 42, 303–12.
- Fransen JN, He J, Glickman GN, Rios A, Shulman JD, Honeyman A (2008) Evaluación comparativa de ActiV GP/Glass Ionomer sealer, Resilon/Epiphany y Gutta-Percha/AH Plus obturación: un estudio de fuga bacteriana. Journal of Endodontics 34, 725–7.
- Gambarini G, Testarelli L, Pongione G, Gerosa R, Gagliani M (2006) Propiedades radiográficas y reológicas de un nuevo sellador endodóntico. Australian Endodontic Journal 32, 31–4.
- Garrido ADB, Lia RCC, França EC, da Silva JF, Astolfi-FIlho S, Sousa-Neto MD (2010) Evaluación de laboratorio de las propiedades fisicoquímicas de un nuevo sellador de conducto radicular a base de Copaifera multijuga aceite-resina. International Endodontic Journal 43, 283–91.
- Gençoglu N, Türkmen C, Ahiskali R (2003) Un nuevo sellador de conducto radicular a base de silicona (Roekoseal-Automix). Journal of Oral Rehabilitation 30, 753–7.
- Gong W, Zeng K, Wang L, Zheng S (2008) Poli(hidroxiéter de bisfenol A)-bloque-copolímero alternante de polidimetilsiloxano y sus mezclas nanoestructuradas con resina epoxi. Polymer 49, 3318–26.
- Kontakiotis EG, Tzanetakis GN, Loizides AL (2007) Un estudio comparativo de los ángulos de contacto de cuatro selladores de conducto radicular diferentes. Journal of Endodontics 33, 299–302.
- Lin-Gibson S, Landis FA, Drzal PL (2006) Investigación combinatoria de la caracterización de la estructura-propiedades de redes de dimetacrilato fotopolimerizadas. Biomaterials 27, 1711–7.
- Malynych S, Robuck H, Chumanov G (2001) Fabricación de ensamblajes bidimensionales de nanopartículas de Ag y nano-cavidades en resina de poli(dimetilsiloxano). Nano Letters 1, 647–9.
- McDermott J (1993) La Estructura de la Industria de Compuestos Avanzados: Advance Composites Bluebook. Cleveland: Advanstar Communications.
- Monticelli F, Sword J, Martin RL et al. (2007) Propiedades de sellado de dos sistemas contemporáneos de obturación de cono único. International Endodontic Journal 40, 374–85.
- Ørstavik D (1983) Propiedades físicas de los selladores de conducto radicular: medición del flujo, tiempo de trabajo y resistencia a la compresión. International Endodontic Journal 16, 99–107.
- Ørstavik D (2005) Materiales utilizados para la obturación de conductos radiculares: pruebas técnicas, biológicas y clínicas. Endodontic Topics 12, 25–38.
- Ørstavik D, Nordahl I, Tibballs JE (2001) Cambio dimensional tras el fraguado de materiales de selladores de conducto radicular. Dental Materials 17, 512–9.
- Phillips RW, Skinner EW (1991) Ciencia de los Materiales Dentales de Skinner, 9ª ed. Filadelfia: Saunders.
- Rasimick BJ, Shah RP, Musikant BL, Deutsch AS (2007) Radiopacidad de materiales endodónticos en película y un sensor digital. Journal of Endodontics 33, 1098–101.
- Resende LM, Rached-Junior FJ, Versiani MA et al. (2009) Un estudio comparativo de las propiedades fisicoquímicas de los selladores de conducto radicular AH Plus, Epiphany y Epiphany SE. International Endodontic Journal 42, 785–93.
- Roggendorf MJ, Legner M, Ebert J, Fillery E, Frankenberger R, Friedman S (2010) Evaluación de micro-CT de material residual en canales rellenos con Activ GP o GuttaFlow tras la eliminación con instrumentos de NiTi. International Endodontic Journal 43, 200–9.
- Schäfer E, Zandbiglari T (2003) Solubilidad de selladores de conducto radicular en agua y saliva artificial. International Endodontic Journal 36, 660–9.
- Tagger M, Katz A (2003) Radiopacidad de selladores endodónticos: desarrollo de un nuevo método para medición directa. Journal of Endodontics 29, 751–5.
- Tanomaru-Filho M, Jorge EG, Guerreiro Tanomaru JM, Goncalves M (2007) Evaluación de la radiopacidad de nuevos materiales de relleno de conducto radicular mediante digitalización de imágenes. Journal of Endodontics 33, 249–51.
- Tanomaru-Filho M, Jorge EG, Tanomaru JM, Goncalves M (2008) Evaluación de la radiopacidad de selladores de conducto radicular a base de hidróxido de calcio y ionómero de vidrio. International Endodontic Journal 41, 50–3.
- Tas¸demir T, Yesilyurt C, Yildirim T, Er K (2008) Evaluación de la radiopacidad de nuevas pastas/selladores de conducto radicular mediante radiografía digital. Journal of Endodontics 34, 1388–90.
- Versiani MA, Carvalho-Junior JR, Padilha MI, Lacey S, Pascon EA, Sousa-Neto MD (2006) Un estudio comparativo de las propiedades fisicoquímicas de los selladores de conducto radicular AH Plus y Epiphany. International Endodontic Journal 39, 464–71.
- Wilson AD, McLean JW (1988) Cemento de Ionómero de Vidrio. Chicago: Quintessence Pub. Co.

/social-network-service/media/default/6758/89a8282e.png)