Un ensayo controlado aleatorizado de regeneración ósea guiada para defectos de dehiscencia peri-implantaria con dos materiales de hueso bovino anorgánico cubiertos por mallas de titanio.
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
El objetivo de este estudio es comparar dos materiales de hueso bovino anorgánico sinterizados a baja temperatura (ABBMs), Bio-Oss (Geistlich, Wolhusen, Suiza) y A-Oss (Osstem, Seúl, Corea), para GBR en defectos de dehiscencia. Se colocó un implante de forma simultánea con GBR en el defecto óseo bucal o buco-proximal mediante una doble capa de injerto alógeno interno y ABBM externo, cubierto por una malla de titanio ultrafina preformada y una membrana de colágeno absorbible. Los cambios en el volumen injertado se evaluaron mediante tomografía computarizada de haz cónico, tomada preoperatoriamente (T0), inmediatamente después de la cirugía del implante (T1), después de la cirugía de reingreso (T2) y después de la entrega de la restauración final (T3). La densidad del hueso regenerado se evaluó midiendo la profundidad de sondaje en el centro medio bucal de la malla después de retirar la malla en T2. También se registraron las secuelas postoperatorias. Se observó una contracción del volumen injertado del 46.0% (0.78 ± 0.37 cc) y 40.8% (0.79 ± 0.33 cc) en el grupo Bio-Oss (8 pacientes) y el grupo A-Oss (8 pacientes), respectivamente, en T3 (p < 0.001). No hubo diferencias significativas en los cambios de volumen injertado según los períodos de tiempo o la densidad ósea entre los dos grupos. A pesar de la exposición postoperatoria de la malla (3 pacientes), no fue necesaria la extracción prematura de estas mallas expuestas ni injertos adicionales, y todos los implantes fueron funcionales durante el período de seguimiento de 1 año. Ambos ABBMs con mallas de titanio no mostraron diferencias significativas en la cantidad y densidad del hueso regenerado después de GBR para defectos periimplantarios.
Introducción
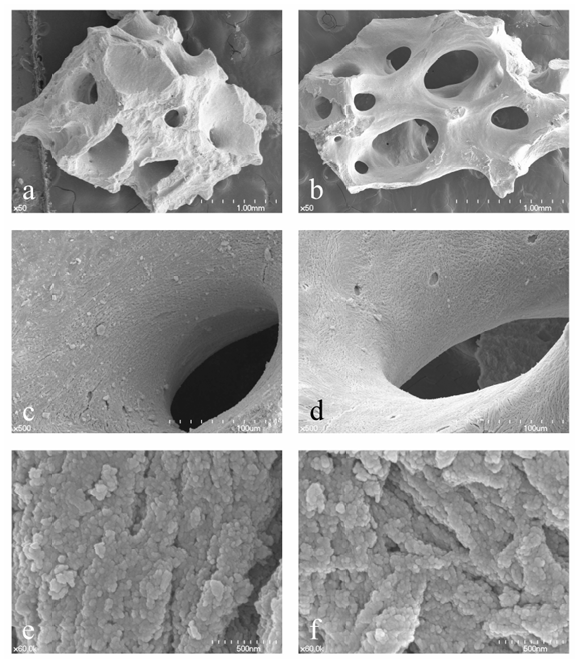
Dispositivos y tecnologías innovadoras para reducir la morbilidad, los tiempos biológicos y quirúrgicos son un tema de intensa investigación en la odontología de implantes, y la regeneración ósea guiada (GBR) es un procedimiento quirúrgico de aumento óseo para implantes dentales, utilizando varios materiales de injerto óseo con membranas de barrera concurrentes. Los materiales de hueso bovino anorgánico (ABBM) se han utilizado ampliamente como material osteoconductivo para cirugías de elevación de seno, preservación de cresta, cirugía de implantes inmediatamente después de la extracción dental y GBR. La ventaja única de los ABBM es su propia propiedad de mantenimiento de volumen con una lenta sustitución por el nuevo hueso en comparación con el material de injerto óseo autógeno y alogénico. Hay muchos otros tipos de ABBM que se sinterizan a alta temperatura o están basados en porcino y equino; sin embargo, los ABBM basados en bovino y sinterizados a baja temperatura parecen dominar el mercado dental. Históricamente, el Bio-Oss (Geistlich, Wolhusen, Suiza) ha sido considerado durante mucho tiempo el estándar de oro debido a la sólida evidencia científica; sin embargo, el A-Oss (Osstem, Seúl, Corea) es un ABBM producido por tratamiento químico con un disolvente aromático y fuerte álcali y finalmente por un proceso de recocido a baja temperatura por debajo de 400°C con una tasa de calentamiento extremadamente baja (<0.3°C por minuto). La caracterización fisicoquímica de A-Oss, que podría ser sustancialmente equivalente a la de Bio-Oss en vista de una mayor porosidad y menor cristalinidad, está estrechamente asociada con menos degradación y actividad de remodelación en comparación con otros xenoinjertos (Figura 1).
En el campo de la cirugía oral y maxilofacial, la malla de titanio ha sido ampliamente adoptada para casos que requieren una gran cantidad de reconstrucción ósea debido a su biocompatibilidad inherente y rigidez como metal ligero. En particular, la reciente introducción de una malla de titanio ultrafina preformada, que está conectada y fijada directamente al implante, ha aumentado su popularidad en GBR para defectos óseos periimplantarios. Resistente al colapso durante todo el período de curación de GBR, esta malla de titanio ultrafina tiene múltiples poros de tamaños variables para obtener resultados óptimos en GBR.
El propósito de este ensayo clínico controlado aleatorizado fue comparar dos ABBMs sinterizados a baja temperatura, Bio-Oss y A-Oss, que se utilizan en GBR para la reconstrucción de defectos de dehiscencia peri-implantaria, en combinación con la malla de titanio ultrafina. Hasta donde sabemos, este es el primer estudio que mide y compara los cambios volumétricos tridimensionales de los ABBMs para fines de GBR. La hipótesis nula era que no había diferencia en los cambios en el volumen injertado (cantidad de hueso), densidad (calidad del hueso) del hueso regenerado y secuelas postoperatorias entre los grupos.
Materiales y Métodos
Este estudio fue diseñado como un ensayo clínico controlado aleatorizado de diseño de grupos paralelos y se llevó a cabo en la División de Cirugía Oral y Maxilofacial, Departamento de Odontología, Hospital Universitario Hanyang, entre junio de 2018 y julio de 2019. El estudio fue aprobado por la Junta de Revisión Institucional del Hospital Universitario Hanyang (No. IRB 2018-03-006) y registrado en la plataforma de registro de ensayos clínicos internacionales de la OMS (KCT0004906). Se llevó a cabo de acuerdo con las Declaraciones de Helsinki y las pautas internacionalmente aceptadas para ensayos clínicos aleatorizados, incluyendo la declaración CONSORT (accedida el 2 de marzo de 2018). Todos los procedimientos quirúrgicos y protésicos fueron realizados por un experto en implantología (C.-J.P.).
Selección de Pacientes
Después de exámenes clínicos y radiológicos preoperatorios, incluyendo tomografía computarizada de haz cónico (CBCT), cualquier paciente sano de 18 años o más, que requiriera la colocación de un solo implante en la cresta alveolar cicatrizada con GBR para el defecto de dehiscencia peri-implantaria cuando el implante fue simulado en una posición guiada prostéticamente (OneGuide, Osstem, Seúl, Corea), fue incluido en este estudio tras proporcionar su consentimiento informado. En particular, los defectos óseos debían limitarse únicamente al aspecto bucal y/o proximal y no involucrar la superficie del diente adyacente o el aspecto lingual. Los criterios de exclusión incluían la necesidad de más de dos implantes consecutivos y tener contraindicaciones sistémicas o locales para la colocación de implantes, incluyendo un historial de trastornos metabólicos no controlados, tabaquismo, bruxismo o enfermedad periodontal no controlada. Los pacientes inscritos fueron informados sobre los procedimientos quirúrgicos, los materiales a utilizar, los beneficios y los riesgos y complicaciones potenciales de este estudio clínico, y se obtuvo el consentimiento informado por escrito.
Procedimiento Quirúrgico
Todos los procedimientos se realizaron bajo anestesia local y sedación intravenosa moderada. Se levantó un colgajo de grosor completo y se eliminó a fondo todo el tejido de granulación. Se realizó una perforación inicial con marcado de hueso cortical mediante un taladro guía. Se utilizaron taladros cónicos secuenciales para preparar el sitio del implante (kit OneGuide o kit 122 Taper, Osstem), y se hizo especial énfasis en obtener una posición tridimensional correcta del implante. Se instaló un implante dental (TS III SOI, Osstem, o T01 SA, Toplan, Seúl, Corea) 1 mm subcrestal al cresta alveolar lingual o palatina, y se produjo un defecto de dehiscencia alrededor de la parte superior del implante, exponiendo las roscas bucales y/o proximales del implante.
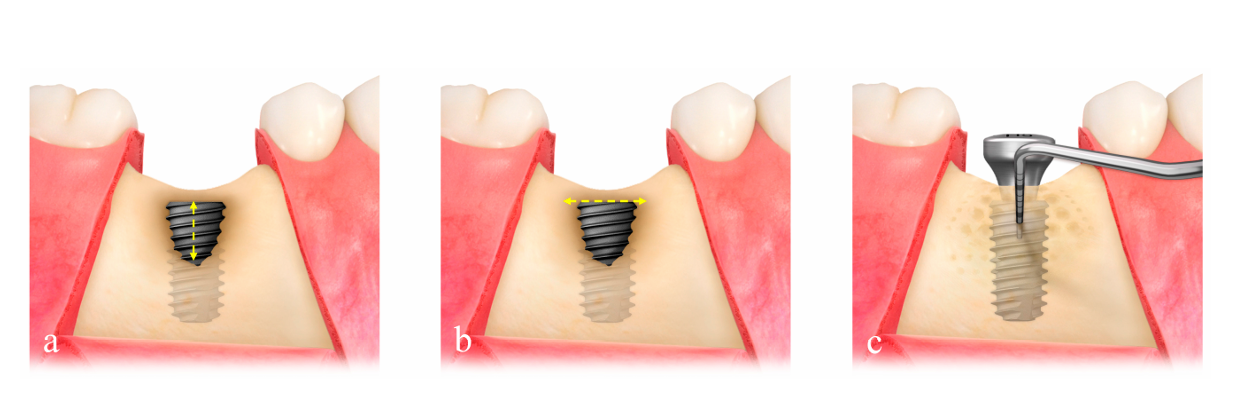
El tamaño del defecto (mm) consistió en la altura del defecto, que se midió desde la parte superior del implante hasta el primer contacto hueso-implante, y el ancho del defecto, que se midió desde la cresta ósea mesial hasta la distal a nivel de la parte superior del implante (Figura 2a,b). Se seleccionó la malla de titanio ultrafina preformada (OssBuilder, Osstem), que era la más adecuada para el tamaño del defecto medido, de varias opciones de tipo I para defecto de dehiscencia bucal y tipo II para defecto de dehiscencia buco-proximal combinado (Figura 3). Se realizaron pequeños recortes y contornos de la malla de titanio para una mejor contención del material de injerto si era necesario. Se realizaron múltiples aperturas de médula ósea para inducir las células osteogénicas para una regeneración ósea más rápida y mejor.
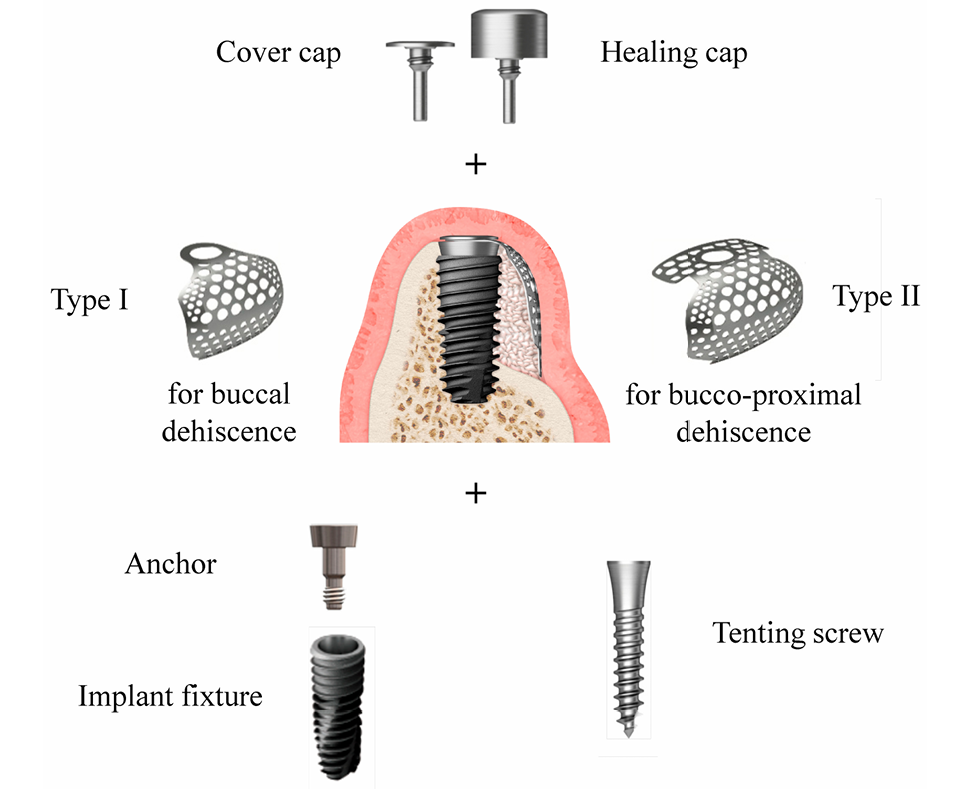
De acuerdo con el sobre de aleatorización, los pacientes fueron asignados a dos grupos: grupo Bio-Oss y grupo A-Oss. Las roscas del implante expuestas fueron cubiertas por un injerto óseo alogénico liofilizado (FDBA; SureOss, HansBiomed, Seúl, Corea) y sobrepuestas por un ABBM, Bio-Oss o A-Oss, en una proporción de volumen de 1:1 para el mantenimiento del contorno. La parte de anclaje, que conecta el implante y la malla de titanio ultrafina preformada, fue ajustada a mano en el implante, y la malla de titanio ultrafina seleccionada se aplicó sobre este ancla para contener todo el material de injerto (Figura 3). Si el implante fue insertado con un par de apriete
≤30 Ncm o un valor de cociente de estabilidad del implante ≤70, la tapa de cobertura se conectó a la malla de titanio según un enfoque sumergido. Si no, la tapa de cicatrización se conectó inmediatamente según un enfoque no sumergido. Se adaptó una membrana de colágeno absorbible (OssGuide, SK Bioland, Cheonan, Corea) o OssMem hard (Osstem) sobre la malla de titanio para minimizar el riesgo de adelgazamiento de la encía superior, lo que resultaría en la exposición temprana de la malla de titanio. El periostio del colgajo de grosor completo se liberó para un cierre primario de la herida sin tensión. Los pacientes recibieron analgésicos y antibióticos durante 10 días para controlar el dolor postquirúrgico y la infección. También se prescribieron enjuagues bucales de clorhexidina dos veces al día. Se retiraron los puntos 10 días después de la cirugía.
A los 8 meses postoperatorios, se realizó una cirugía de reingreso utilizando un diseño de colgajo similar bajo anestesia local. Después de retirar la malla de titanio, se evaluó la densidad ósea mediante la profundidad de sondaje, que se midió en el hueso regenerado debajo del centro medio de la malla de titanio, utilizando una fuerza controlada de 0.25 N (Figura 2c). La tapa de cobertura o la tapa de cicatrización se reemplazó por un pilar de cicatrización, y los colgajos se ajustaron y suturaron. Se retiraron los puntos 10 días después de la cirugía. Después de la cirugía de reingreso, se permitió que el tejido blando alrededor del pilar de cicatrización sanara antes de tomar impresiones. Se incorporó una restauración temporal única con el pilar de titanio personalizado para carga progresiva, y la restauración final se entregó a los 12 meses postoperatorios. Cualquier secuela postoperatoria en los procedimientos de GBR se registró de acuerdo con la clasificación previa de complicaciones de GBR y fue tratada por el mismo cirujano (C.-J.P.).
Evaluación del Volumen Injertado
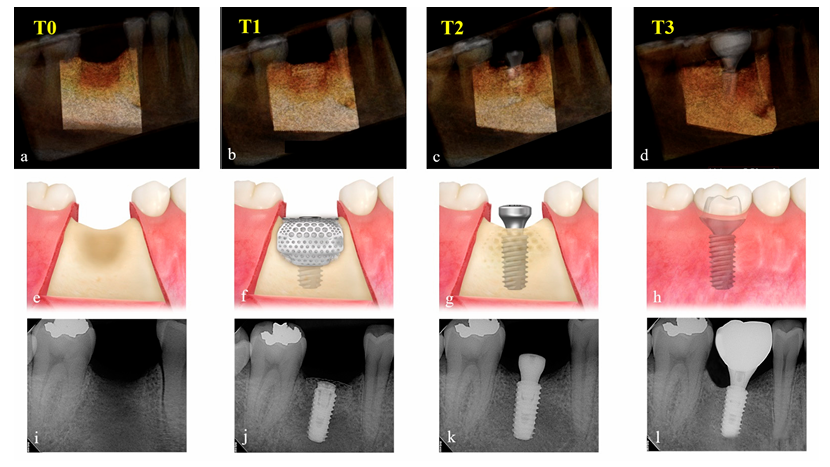
Los cambios en el volumen aumentado del material de injerto se evaluaron comparando los datos de CBCT tomados preoperatoriamente (T0), inmediatamente después de la cirugía de implante y GBR (T1), después de la cirugía de reingreso (T2) y después de la entrega de la restauración final (T3). Los parámetros de exposición para la exploración de CBCT (campo de visión 35 × 50 mm; tamaño de voxel 0.2 mm; tiempo 10.8 s; kV 75; mA 10; producto de dosis área 240 mGy·cm2) se establecieron tan bajos como razonablemente sea posible (ALARA). Usando el software Aquarium iNtuition (TeraRecon, Durham, NC, EE. UU.), se reconstruyó el sitio del implante en una imagen tridimensional y se segmentó como una región de interés (ROI) utilizando estructuras anatómicas cercanas, como dientes adyacentes, piso del seno y canal alveolar inferior. Se restaron los compartimentos, que son radiológicamente uniformes en densidad y tamaño, como el cuerpo del implante y el pilar de cicatrización, y se calculó el volumen (cc) en ROI según los períodos de tiempo (Figura 4) por un examinador independiente ciego (K.-G.H.). Dado que este software se utiliza ampliamente en el campo médico para detectar con precisión la porción ocluida de los vasos principales y medir con exactitud el volumen del órgano para trasplante, se aplicó para este estudio para medir el volumen de ROI y complementar la tecnología de TC.
Análisis Estadístico
El tamaño de la muestra se determinó para satisfacer un poder del 90% de la prueba como mínimo a α = 0.05 de acuerdo con la suposición de varianza igual basada en las medias dentro de los sujetos y entre los sujetos del estudio controlado aleatorio anterior que comparaba Bio-Oss y el ABBM recubierto de fosfato de calcio en la augmentación de seno. Basado en estos resultados, se estimó que el tamaño mínimo de la muestra sería de 9 sujetos en cada grupo, considerando una posible tasa de deserción del 10% durante el período del estudio.
Se utilizó el modelo de efectos mixtos para examinar las diferencias en los cambios de volumen injertado entre los grupos Bio-Oss y A-Oss con el ajuste por covariables, donde los cambios de volumen injertado se midieron en tres períodos de tiempo consecutivos así como en la línea base (T0). La significancia de los efectos de las covariables y los cambios de volumen injertado predichos
se probaron a α = 0.05. Además, se resumieron estadísticas descriptivas sobre la información general de los pacientes en la línea base con el número de casos y porcentaje para variables categóricas y con la media ± desviación estándar para variables continuas.
Todos los análisis estadísticos se realizaron utilizando SAS, versión 9.4 (SAS Inc., Cary, NC, EE. UU.). La significancia estadística se estableció como p < 0.05.
Resultados
Un total de 18 pacientes fueron inscritos de manera consecutiva, y dos pacientes abandonaron (uno en cada grupo) debido a la pérdida de seguimiento. Finalmente, se recopilaron y evaluaron datos de 16 pacientes (7 hombres y 9 mujeres) con una edad media de 54.3 ± 11.7 años (rango de 28 a 72 años) en este ensayo (Tabla 1). La comparación demográfica entre los dos grupos se muestra en la Tabla 2. Hubo una diferencia significativa entre los grupos Bio-Oss y A-Oss solo en términos de la longitud del implante (p < 0.01).
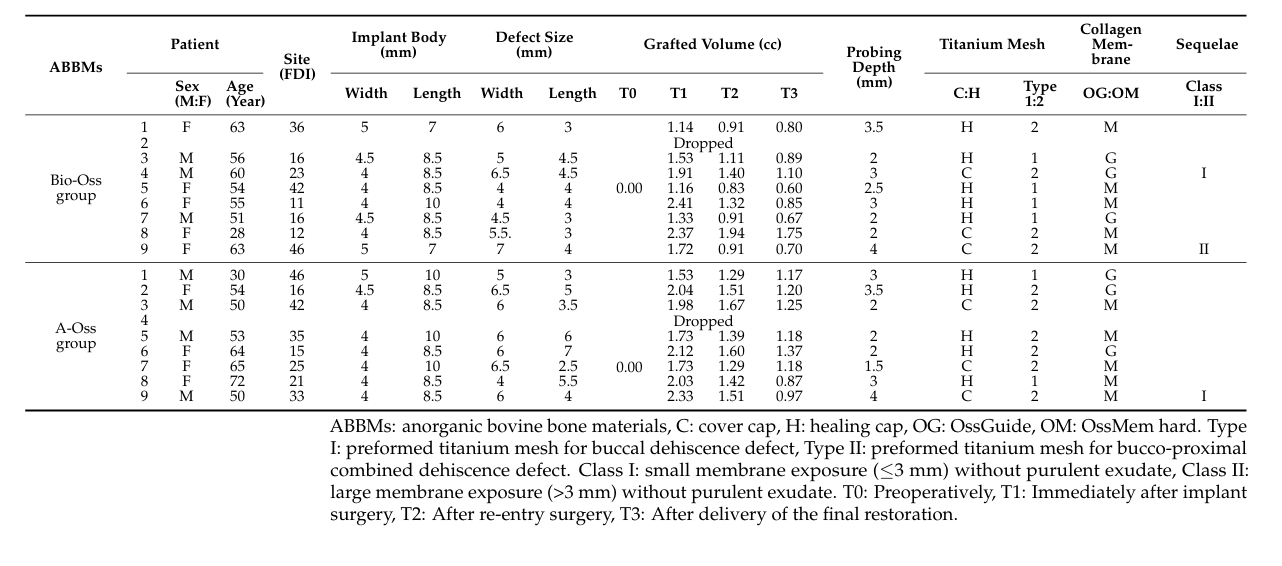
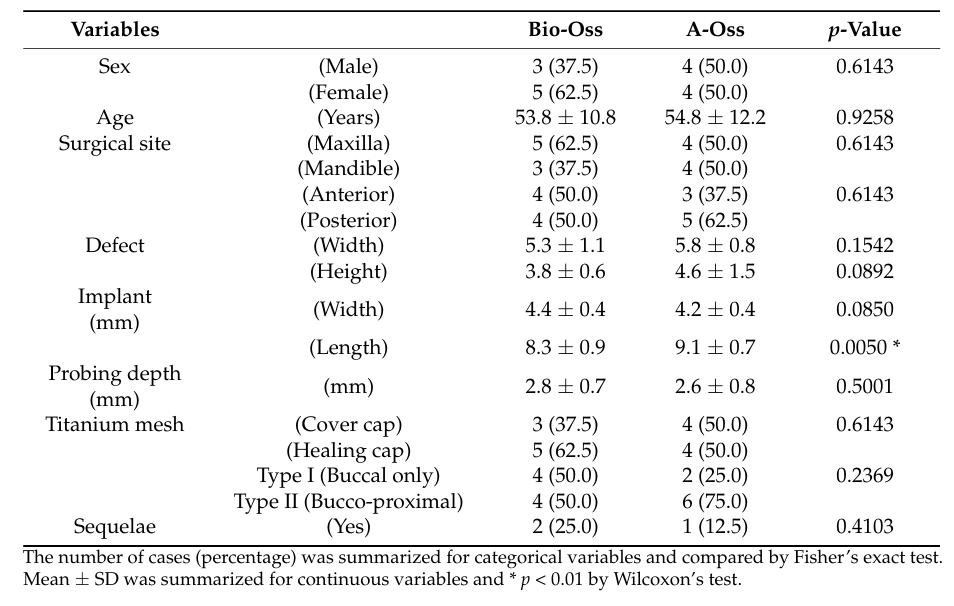
En ambos grupos, el volumen injertado, que alcanzó un pico de 1.70 ± 0.50 cc en el grupo Bio-Oss y 1.94 ± 0.26 cc en el grupo A-Oss en T1, continuó disminuyendo hasta T3. Los volúmenes injertados se redujeron a 1.17 ± 0.38 cc en el grupo Bio-Oss y 1.46 ± 0.14 cc en el grupo A-Oss en T2 y 0.92 ± 0.37 cc en el grupo Bio-Oss y 1.15 ± 0.16 cc en el grupo A-Oss en T3; hubo una diferencia significativa en los volúmenes injertados entre los períodos de tiempo (p < 0.001, Tabla 3). Sin embargo, no hubo una diferencia significativa entre los dos grupos en todos los períodos de tiempo (p > 0.05, Figura 5). Además, no hubo una diferencia significativa en las densidades del hueso regenerado en T3 entre los grupos (p > 0.05).

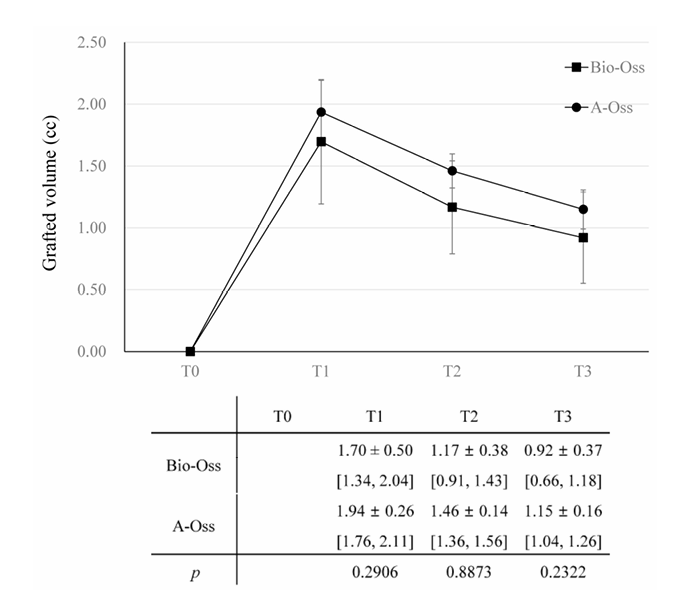
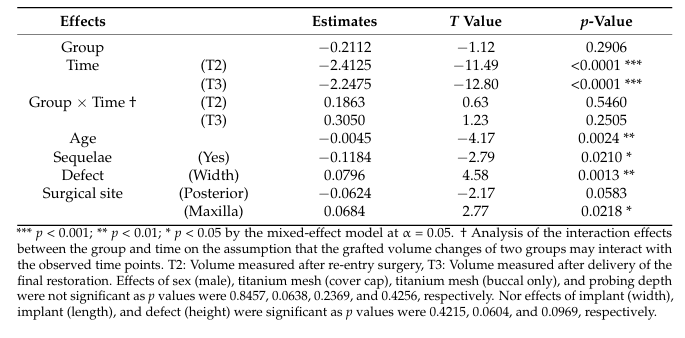
En el análisis del modelo de efectos mixtos, T2 y T3 como períodos de tiempo (p < 0.001), la edad avanzada (p < 0.01) y la existencia de secuelas (p < 0.05) indicaron decrementos significativos en el volumen injertado; por el contrario, un defecto más amplio (p < 0.01) y el maxilar como el sitio quirúrgico (p < 0.05) resultaron en menores decrementos en el volumen injertado (Tabla 4). Se observaron secuelas postoperatorias en tres pacientes, con dos pacientes (Clase I y II en los sitios de sutura crestal) en el grupo Bio-Oss y uno (Clase I en el borde bucco-mesial de la malla) en el grupo A-Oss. Todas las secuelas postoperatorias ocurrieron en casos sumergidos con tapas de cobertura, y no hubo diferencia significativa entre los dos grupos. Se instruyó a los pacientes a cepillar la malla con cuidado y suavidad con un cepillo de dientes suave empapado en gel de clorhexidina al 1% dos veces al día. A pesar de que no hubo reepitelización que cubriera el área expuesta de la malla, no fue necesaria la remoción prematura de estas mallas expuestas, y no se observaron reexposición de los hilos del implante y pérdida severa del material injertado con supuración durante todo el período de curación; no fue necesario injertar adicionalmente en T2.
Discusión
Este ensayo controlado aleatorizado fue diseñado para evaluar el potencial de A-Oss para mantener la cantidad y calidad ósea del hueso regenerado por GBR como un ABBM sinterizado a baja temperatura en comparación con Bio-Oss, y se aceptó la hipótesis nula de que no había diferencia. A pesar del uso de ABBMs estables en volumen, se perdió un total del 46.0% (0.78 ± 0.37 cc) y 40.8% (0.79 ± 0.33 cc) de los volúmenes injertados durante el proceso de sustitución por nuevo hueso en los grupos de Bio-Oss y A-Oss, respectivamente. Una posible explicación para una mayor reabsorción más allá de lo esperado es que el volumen injertado medido en T1 estaba claramente delineado por una malla de titanio radiopaca delgada en las exploraciones CBCT, mientras que la periferia radiológica indistinta entre los materiales de injerto y el tejido blando resultó en una subestimación del volumen injertado después de la eliminación de la malla de titanio tanto en T2 como en T3. En comparación con el 17.3~23.9% de pérdida de volumen injertado hasta 6 meses postoperatorios después de la cirugía de elevación de seno, se asumió que la contracción del volumen injertado después de GBR era mayor porque la presión general del tejido blando superior puede ser mayor que la presión neumática intra-sinusal. Solo se realizaron mediciones lineales para evaluar el grosor de la región aumentada por GBR en exploraciones CBCT limitadas, y nuestros resultados no son sorprendentes, considerando que la reducción lineal osciló entre el 20.2% y el 42.8% en el hombro del implante después del injerto de Bio-Oss. Sin embargo, debemos admitir que había un riesgo constante de errores de medición resultantes de artefactos metálicos porque varios componentes metálicos, como un cuerpo de implante y una malla de titanio, existían simultáneamente en CBCT.
Enfocándose en el cambio de volumen injertado, los efectos de la existencia de secuelas y el sitio quirúrgico mostraron diferencias estadísticamente significativas (p < 0.05). En otras palabras, si el GBR tuvo complicaciones postoperatorias o el sitio quirúrgico fue posterior (vs. anterior, p = 0.0583) y no el maxilar (vs. mandíbula), es más probable que ocurra más reabsorción del volumen injertado. El área posterior mandibular está generalmente compuesta de hueso duro con una corteza más gruesa, y el resultado de la augmentación ósea es menos predecible incluso si se combina con amplias aberturas de médula ósea. Además, los efectos de la edad y el ancho del defecto también mostraron diferencias significativas (p < 0.01), lo que significa que los pacientes mayores y los defectos de dehiscencia más estrechos probablemente mostrarán más reabsorción del volumen injertado. Los pacientes mayores tendían a presentar un mayor riesgo de fracaso del implante con menores potenciales de regeneración ósea después del GBR, y hubo menos reabsorción en el sitio de GBR a medida que se empacaban más materiales de injerto óseo en defectos más amplios y se protegían de manera segura con una malla de titanio maximizando la propiedad de estabilidad de volumen de los ABBMs. La malla de titanio ultrafina preformada era adecuada para el contorno óseo ideal, particularmente a nivel de la parte superior del implante, previniendo el colapso del injerto. Suponiendo que el defecto peri-implantario se localiza dentro de la cavidad ósea original, los defectos tipo fenestración han mostrado más llenado óseo y menos complicaciones que los de tipo dehiscencia. Así, no podemos encontrar la influencia significativa de la altura del defecto en el cambio de volumen injertado.
En contraste con el ABBM para la preservación del volumen, los materiales de injerto óseo alogénico mostraron una robusta formación ósea con islas de nuevo hueso que podrían interpretarse como evidencia de inducción ósea y parecían estar en un estado más activo de recambio y reemplazo. Una técnica de estratificación utilizando diferentes materiales de injerto se aplica comúnmente para aumentar el hueso alveolar dehiscent o deficiente alrededor de los implantes dentales. Generalmente, se utilizó hueso autógeno como una capa interna en contacto cercano con el implante; sin embargo, también se utilizó hueso alogénico cuando el volumen de extracción de hueso autógeno no era adecuado. En este estudio, se colocó una capa externa de ABBM sobre el injerto alogénico para preservar y mantener el hueso aumentado, y se colocó una tercera capa de membrana de colágeno absorbible para prevenir la invasión de tejido blando y células no osteogénicas en el sitio injertado. En vista del requisito de una membrana de barrera, se utilizó malla de titanio por su capacidad para crear espacio y estabilizar los coágulos sanguíneos, y la membrana de colágeno absorbible que la cubría se utilizó para la oclusividad celular para prevenir el adelgazamiento prematuro de la encía superior al separar completamente los compartimentos para la regeneración ósea y epitelial. Como una membrana de barrera no absorbible, la eliminación de la malla de titanio es inevitable; sin embargo, la cirugía de reingreso para retirarla es una oportunidad perfecta para evaluar la cantidad y calidad del hueso regenerado para determinar el éxito de la GBR. Comúnmente, mientras que la cantidad de hueso puede evaluarse radiológicamente mediante la reconstrucción tridimensional de escaneos de CBCT en el sitio de GBR, la calidad del hueso se ha evaluado histológicamente o histomorfométricamente al obtener y analizar la biopsia de núcleo óseo del reborde regenerado. Sin embargo, en nuestro estudio, la calidad del hueso se evaluó de manera general al evaluar la corticalización del sitio de GBR utilizando la profundidad de sondaje durante el reingreso, ya que era técnicamente difícil o frecuentemente imposible obtener la muestra de hueso del sitio peri-implantario reconstruido. Después de la eliminación de la malla de titanio, una inspección más cercana del sitio curado reveló tejido duro regenerado cubierto superficialmente por una delgada capa de tejido blando que tenía un grosor de 1 a 2 mm. Esta capa se describió como "pseudo-periósteo" y la significancia clínica de esta capa de tejido conectivo y de granulación histológicamente es desconocida; sin embargo, esta delgada capa parece estable en dimensión, y su eliminación no fue indicada durante el reingreso. En nuestro estudio, las profundidades de sondaje de 2.8 ± 0.7 mm y 2.6 ± 0.8 mm en los grupos Bio-Oss y A-Oss, respectivamente, podrían ser el grosor de hueso inmaduro, incluyendo el "pseudo-periósteo", durante el proceso de corticalización debajo de la malla de titanio. Este enfoque para evaluar la calidad del hueso regenerado se presume como la principal limitación de nuestro estudio y se necesitarán más investigaciones histológicas y histomorfométricas para analizar el hueso regenerado en detalle.
A pesar de que no se produjo reepitelización en exposiciones pequeñas (2 pacientes) y grandes (1 paciente) de malla de titanio sin exudado purulento durante el período de curación, no se observó fuga de material de injerto, y no se indicó la extracción prematura de la malla de titanio expuesta ni injertos suplementarios. Sin embargo, la profundidad de sondaje aumentó hasta 3~4 mm debido a la presencia compensatoria de un “pseudo-periósteo” más grueso, que estuvo involucrado en mantener el material de injerto contenido de manera segura en los casos de malla de titanio expuesta. Un estudio previo también confirmó que la exposición a la malla de titanio no tuvo influencia negativa en el resultado clínico del procedimiento de aumento y el éxito del procedimiento de injerto óseo. Especialmente, todas las secuelas postoperatorias ocurrieron en casos donde la malla de titanio fue fijada y estabilizada con tapas de cobertura, aunque no fue estadísticamente significativo. Dado que las tapas de cobertura estaban conectadas al implante con baja estabilidad primaria en nuestro estudio, más tensión resultante de menos tejido blando redundante podría atribuirse a una mayor incidencia de dehiscencia de la herida postoperatoria en el enfoque sumergido en comparación con el enfoque no sumergido. No hubo diferencia significativa en las secuelas postoperatorias entre los grupos Bio-Oss y A-Oss.
Conclusiones
Dentro de las limitaciones de este estudio, se puede concluir que
- Un defecto de dehiscencia peri-implantaria fue reconstruido con éxito mediante GBR con doble capa de aloinjerto y ABBM, que fueron cubiertos por una malla de titanio ultrafina preformada y una membrana de colágeno absorbible;
- A pesar del efecto de mantenimiento de volumen de los ABBM, se observó aproximadamente un 27.8% de resorción del volumen injertado en T2, y no hubo diferencia significativa entre los grupos Bio-Oss y A-Oss, incluso en la calidad del hueso regenerado;
- La pérdida de volumen injertado (aproximadamente 43.2%) continuó hasta T3 y no difirió entre los grupos Bio-Oss y A-Oss.
JaeHyung Lim, SangHo Jun, Marco Tallarico, Jun-Beom Park, Dae-Ho Park, Kyung-Gyun Hwang y Chang-Joo Park
Referencias
- Pjetursson, B.E.; Thoma, D.; Jung, R.; Zwahlen, M.; Zembic, A. Una revisión sistemática de las tasas de supervivencia y complicaciones de prótesis dentales fijas soportadas por implantes (FDP s) después de un período de observación medio de al menos 5 años. Clin. Oral Implant. Res. 2012, 23, 22–38. [CrossRef] [PubMed]
- Urban, I.; Caplanis, N.; Lozada, J.L. Regeneración ósea guiada vertical simultánea y regeneración de tejidos guiada en el maxilar posterior utilizando factor de crecimiento derivado de plaquetas humanas recombinante: Un informe de caso. J. Oral Implantol. 2009, 35, 251–256. [CrossRef]
- Adeyemo, W.; Reuther, T.; Bloch, W.; Korkmaz, Y.; Fischer, J.H.; Zöller, J.E.; Kuebler, A.C. Cicatrización de injertos óseos mandibulares onlay cubiertos con membrana de colágeno o sustitutos óseos bovinos: Un estudio microscópico e inmunohistoquímico en ovejas. Int. J. Oral Maxillofac. Surg. 2008, 37, 651–659. [CrossRef] [PubMed]
- Block, M.S.; Kaleem, A. Uso de xenoinjerto sinterizado sobre aloinjerto para la augmentación del reborde: Nota técnica. J. Oral Maxillofac. Surg. 2014, 72, 496–502. [CrossRef] [PubMed]
- Buser, D.; Chappuis, V.; Kuchler, U.; Bornstein, M.; Wittneben, J.; Buser, R.; Cavusoglu, Y.; Belser, U.C. Estabilidad a largo plazo de la colocación temprana de implantes con aumento de contorno. J. Dent. Res. 2013, 92, 176S–182S. [CrossRef] [PubMed]
- Jensen, S.S.; Bosshardt, D.D.; Gruber, R.; Buser, D. Estabilidad a largo plazo del aumento de contorno en la zona estética: Evaluación histológica e histomorfométrica de 12 biopsias humanas 14 a 80 meses después de la augmentación. J. Periodontol. 2014, 85, 1549–1556. [CrossRef] [PubMed]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Análisis comparativo radiológico entre el relleno de solución salina y fibrina rica en plaquetas después de un levantamiento sinusal transcrestal hidráulico sin injerto óseo adicional: Un ensayo controlado aleatorio. Clin. Oral Implant. Res. 2020, 31, 1087–1093. [CrossRef]
- Nevins, M.; Nevins, M.L.; Kim, S.-W.; Schupbach, P.; Kim, D.M. El uso de la matriz de colágeno mucograft para aumentar la zona de tejido queratinizado alrededor de los dientes: Un estudio piloto. Int. J. Periodontics Restor. Dent. 2011, 31, 367–373.
- Lee, J.S.; Shin, H.K.; Yun, J.H.; Cho, K.S. Ensayo clínico aleatorio de injerto de seno maxilar utilizando mineral óseo porcino y bovino desproteinizado. Clin. Implant. Dent. Relat. Res. 2017, 19, 140–150. [CrossRef] [PubMed]
- Susin, C.; Lee, J.; Fiorini, T.; Koo, K.T.; Schüpbach, P.; Angst, P.D.; Finger Stadler, A.; Wikesjö, U.M. Selección de biomateriales candidatos para la augmentación alveolar utilizando un modelo de defecto crítico en calvaria de rata. J. Clin. Periodontol. 2018, 45, 884–893. [CrossRef]
- Amara, H.B.; Lee, J.-W.; Kim, J.-J.; Kang, Y.-M.; Kang, E.-J.; Koo, K.-T. Influencia de rhBMP-2 en la regeneración ósea guiada para la colocación y carga funcional de implantes dentales: Un estudio radiográfico e histológico en perros. Int. J. Oral Maxillofac. Implant. 2017, 32, e265–e276. [CrossRef] [PubMed]
- Cho, J.S.; Kim, H.S.; Um, S.H.; Rhee, S.H. Preparación de un nuevo xenoinjerto de hueso bovino anorgánico con bioactividad y osteoconductividad mejoradas. J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 855–869. [CrossRef] [PubMed]
- Her, S.; Kang, T.; Fien, M.J. Malla de titanio como alternativa a una membrana para la augmentación del reborde. J. Oral Maxillofac. Surg. 2012, 70, 803–810. [CrossRef]
- Louis, P.J.; Gutta, R.; Said-Al-Naief, N.; Bartolucci, A.A. Reconstrucción del maxilar y la mandíbula con injerto óseo particulado y malla de titanio para la colocación de implantes. J. Oral Maxillofac. Surg. 2008, 66, 235–245. [CrossRef] [PubMed]
- Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Membranas de barrera actuales: Malla de titanio y otras membranas para la regeneración ósea guiada en aplicaciones dentales. J. Prosthodont. Res. 2013, 57, 3–14. [CrossRef]
- Jung, G.-U.; Jeon, J.-Y.; Hwang, K.-G.; Park, C.-J. Evaluación preliminar de una malla de titanio tridimensional, personalizada y preformada en la regeneración ósea alveolar peri-implantaria. J. Korean Assoc. Oral Maxillofac. Surg. 2014, 40, 181. [CrossRef]
- Lee, S.-H.; Moon, J.-H.; Jeong, C.-M.; Bae, E.-B.; Park, C.-E.; Jeon, G.-R.; Lee, J.-J.; Jeon, Y.-C.; Huh, J.-B. Las propiedades mecánicas y el efecto biométrico de una membrana de titanio preformada en 3D para la regeneración ósea guiada en un defecto óseo alveolar. BioMed Res. Int. 2017, 2017, 7102123. [CrossRef]
- Tallarico, M.; Ceruso, F.M.; Muzzi, L.; Meloni, S.M.; Kim, Y.-J.; Gargari, M.; Martinolli, M. Efecto de la colocación inmediata de implantes y la reconstrucción ósea guiada con membranas de malla de titanio ultrafina en parámetros radiográficos y clínicos después de 18 meses de carga. Materials 2019, 12, 1710. [CrossRef] [PubMed]
- Fontana, F.; Maschera, E.; Rocchietta, I.; Simion, M. Clasificación clínica de complicaciones en procedimientos de regeneración ósea guiada mediante una membrana no reabsorbible. Int. J. Periodontics Restor. Dent. 2011, 31, 265.
- Liyanage, L.; Lee, N.J.; Cook, T.; Herrmann, H.C.; Jagasia, D.; Litt, H.; Han, Y. El impacto del género en la calcificación del sistema cardiovascular en pacientes muy ancianos con estenosis aórtica severa. Int. J. Cardiovasc. Imaging 2016, 32, 173–179. [CrossRef]
- Lodewick, T.M.; Arnoldussen, C.W.; Lahaye, M.J.; van Mierlo, K.M.; Neumann, U.P.; Beets-Tan, R.G.; Dejong, C.H.; van Dam, R.M. Volumetría hepática rápida y precisa antes de la hepatectomía. HPB 2016, 18, 764–772. [CrossRef] [PubMed]
- Pang, K.-M.; Lee, J.-K.; Choi, S.-H.; Kim, Y.-K.; Kim, B.-J.; Lee, J.-H. Aumento del seno maxilar con hueso bovino anorgánico recubierto con fosfato de calcio: Ensayo clínico multicéntrico aleatorio comparativo con evaluación histológica y radiográfica. Implant. Dent. 2019, 28, 39–45. [CrossRef] [PubMed]
- Mir-Mari, J.; Wui, H.; Jung, R.E.; Hämmerle, C.H.; Benic, G.I. Influencia del cierre de heridas ciego en la estabilidad del volumen de diferentes materiales GBR: Un examen tomográfico en 3D in vitro. Clin. Oral Implant. Res. 2016, 27, 258–265. [CrossRef] [PubMed]
- Ohe, J.Y.; Kim, G.T.; Lee, J.W.; Al Nawas, B.; Jung, J.; Kwon, Y.D. Estabilidad del volumen de material de injerto óseo bipásico de hidroxiapatita y β-fosfato tricálcico en la elevación del suelo del seno maxilar: Un estudio radiográfico utilizando tomografía computarizada en 3D. Clin. Oral Implant. Res. 2016, 27, 348–353. [CrossRef] [PubMed]
- Mir-Mari, J.; Benic, G.I.; Valmaseda-Castellón, E.; Hämmerle, C.H.; Jung, R.E. Influencia del cierre de heridas en la estabilidad del volumen de materiales GBR particulados y no particulados: Un examen tomográfico en 3D in vitro. Parte II. Clin. Oral Implant. Res. 2017, 28, 631–639. [CrossRef] [PubMed]
- Esposito, M.; Maghaireh, H.; Grusovin, M.G.; Ziounas, I.; Worthington, H.V. Manejo de tejidos blandos para implantes dentales: ¿Cuáles son las técnicas más efectivas? Una revisión sistemática de Cochrane. Eur. J. Oral. Implant. 2012, 5, 221–238.
- Jemt, T. Fracasos de implantes y edad en el momento de la cirugía: Un estudio retrospectivo sobre el tratamiento con implantes en 2915 mandíbulas parcialmente edéntulas. Clin. Implant. Dent. Relat. Res. 2019, 21, 686–692. [CrossRef] [PubMed]
- Jensen, S.S.; Terheyden, H. Procedimientos de aumento óseo en defectos localizados en el reborde alveolar: Resultados clínicos con diferentes injertos óseos y materiales sustitutos óseos. Int. J. Oral Maxillofac. Implant. 2009, 24, 218–236.
- Scheyer, E.T.; Heard, R.; Janakievski, J.; Mandelaris, G.; Nevins, M.L.; Pickering, S.R.; Richardson, C.R.; Pope, B.; Toback, G.; Velásquez, D.; et al. Un ensayo clínico controlado aleatorio multicéntrico de preservación del reborde alveolar post-extracción. J. Clin. Periodontol. 2016, 43, 1188–1199. [CrossRef]
- Wang, H.-L.; Misch, C.; Neiva, R.F. Técnica de aumento óseo “sándwich”: Razonamiento e informe de casos piloto. Int. J. Periodontics Restor. Dent. 2004, 24, 232–245.
- Sarnachiaro, G.O.; Chu, S.J.; Sarnachiaro, E.; Gotta, S.L.; Tarnow, D.P. Colocación inmediata de implantes en alvéolos de extracción con defectos de dehiscencia de la placa labial: Una serie de casos clínicos. Clin. Implant. Dent. Relat. Res. 2016, 18, 821–829. [CrossRef]
- Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Baldoni, E.; Pisano, M.; Tallarico, M. Aumento horizontal del reborde utilizando GBR con una membrana de colágeno nativo y una relación de 1:1 de xenoinjerto particulado y hueso autólogo: Un estudio clínico prospectivo 3 años después de la carga final. Clin. Implant. Dent. Relat. Res. 2019, 21, 669–677. [CrossRef] [PubMed]
- Cucchi, A.; Sartori, M.; Parrilli, A.; Aldini, N.N.; Vignudelli, E.; Corinaldesi, G. Análisis histológico e histomorfométrico del tejido óseo después de la regeneración ósea guiada con membranas no reabsorbibles vs membranas reabsorbibles y malla de titanio. Clin. Implant. Dent. Relat. Res. 2019, 21, 693–701. [CrossRef]
- Proussaefs, P.; Lozada, J. Uso de malla de titanio para la augmentación alveolar localizada en etapas: Evaluación clínica e histológica-histomorfométrica. J. Oral Implantol. 2006, 32, 237–247. [CrossRef]
- Sagheb, K.; Schiegnitz, E.; Moergel, M.; Walter, C.; Al-Nawas, B.; Wagner, W. Resultado clínico de la augmentación del reborde alveolar con malla de titanio producida por CAD-CAM individualizada. Int. J. Implant. Dent. 2017, 3, 1–7. [CrossRef] [PubMed]
