Rol de las Nuevas Superficies Hidrofílicas en la Tasa de Éxito Temprano y Estabilidad del Implante: Resultados a 1 Año Post-Carga de un Estudio Controlado Aleatorizado Multicéntrico y de Boca Dividida
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivo: Comparar la falla temprana del implante y la estabilidad del implante de los implantes Hiossen ET III de una etapa con su nueva superficie hidrofílica (NH), en comparación con los implantes Hiossen ET III con la superficie arenada y grabada con ácido (SA) en un seguimiento de 1 año.
Materiales y Métodos: Este estudio fue diseñado como un ensayo controlado aleatorio multicéntrico de boca dividida con el objetivo de comparar los implantes de superficie SA (grupo SA) y los de superficie NH (grupo NH). Los resultados fueron las tasas de supervivencia de implantes y prótesis, complicaciones, el torque de inserción al colocar el implante y los valores del cociente de estabilidad del implante (ISQ).
Resultados: Veintinueve pacientes (edad media 59.9 ± 11.3 años) fueron tratados y seguidos hasta 1 año después de la carga. Ningún paciente abandonó el estudio. Se colocaron cincuenta y ocho implantes (29 grupo SA y 29 grupo NH). No hubo fallas en los implantes o prótesis y no se experimentaron complicaciones durante el seguimiento. El torque de inserción medio fue de 40.5 ± 3.23 (38.17–41.83) Ncm en el grupo SA y 40.48 ± 3.49 (38.02–41.98) Ncm en el grupo NH (p = 0.981). Hubo una diferencia estadísticamente significativa en la segunda semana (T2) con valores más altos en el grupo NH (p = 0.041). Se encontraron resultados similares en el maxilar (p = 0.045), pero no en la mandíbula (p = 0.362). Se encontró una correlación positiva entre el torque de inserción inicial y el ISQ con un valor más alto en el grupo NH (0.73 vs. 0.66).
Conclusiones: Los implantes NH son una alternativa viable a la superficie SA, ya que parecen evitar la caída del ISQ durante la fase de remodelación ósea.
Introducción
El dentista moderno tiene una excelente solución para resolver el edentulismo del paciente utilizando implantes dentales. Se ha demostrado que los implantes dentales tienen resultados exitosos a largo plazo, representando una opción viable para que los clínicos rehabiliten a pacientes edéntulos completos o parciales con soluciones fijas y removibles. Albrektsson et al introdujeron el concepto de equilibrio de cuerpo extraño, aplicado a la oseointegración de implantes dentales de titanio. Este equilibrio es un balance de reacción inmunitaria mediada por cuerpo extraño durante la integración biológica de los implantes dentales en el hueso. Cuando este equilibrio se desplaza hacia una desventaja, puede ocurrir pérdida ósea periimplantaria. Sin embargo, los fracasos de implantes aún pueden ocurrir en un número reducido de pacientes comprometidos, debido a la falta de suficiente comprensión de los factores de riesgo relacionados.
Las causas de la pérdida ósea alrededor de los implantes dentales y el consiguiente fracaso del implante pueden ser diferentes y estar relacionadas con el macro/microdiseño del implante y la composición química de la superficie, problemas biológicos, calidad ósea, técnica quirúrgica, factores relacionados con el huésped y factores iatrogénicos. El fracaso de un implante dental se ha clasificado como temprano o tardío dependiendo de su momento de ocurrencia. Los fracasos tempranos de implantes dentales ocurren antes de la conexión del pilar, como consecuencia de una falta de integración con el hueso, y los fracasos tardíos ocurren después de la carga protésica, como consecuencia de la periimplantitis inducida por placa y/o sobrecarga oclusal. La oseointegración alrededor de los implantes de titanio es un fenómeno biológico complejo que aún no se comprende claramente. Sin embargo, las modificaciones de superficie de los implantes dentales de titanio juegan roles importantes en la mejora de la oseointegración. Con el objetivo de acelerar y mejorar el proceso de oseointegración, se han propuesto muchos tratamientos de superficie de implantes. La modificación de la superficie se centra principalmente en mejorar químicamente la rugosidad de los implantes dentales para aumentar la respuesta biológica adecuada entre los tejidos vivos y los implantes dentales. Además, aparte de mejorar la oseointegración, estas modificaciones de superficie de los implantes han demostrado aumentar la viabilidad celular y la biocompatibilidad.
Este cambio topográfico se logra mediante tratamientos ácidos, arenado o diferentes mecanismos de oxidación.
Los implantes dentales con superficie arenada y grabada con ácido (SA) tienen una macrorugosidad lograda con partículas abrasivas (arenado) y micropits obtenidos por grabado ácido para mejorar la oseointegración. La superficie SA proporciona un espacio adecuado para la adhesión, proliferación y diferenciación de osteoblastos. Este resultado se puede mejorar aún más utilizando un proceso de grabado doble que aumenta la superficie disponible para el crecimiento del nuevo hueso, mejorando así en gran medida la fijación mecánica. Cuanto más se utilizan los implantes dentales en la práctica dental diaria, mayor es el interés clínico en que los implantes se integren rápidamente con el hueso para ser funcionales. En la última década, ha habido un compromiso continuo para mejorar la superficie del implante y acelerar el proceso de oseointegración y mejorar su calidad. Hoy en día, el objetivo es reducir el período de cicatrización de 6 a 8 semanas a 3 a 4 semanas en todas las indicaciones. Estos esfuerzos se han concentrado en mejorar la interfaz hueso-implante químicamente (incorporando fases inorgánicas en o sobre la capa de óxido de titanio) o físicamente (aumentando el nivel de rugosidad). Aunque se presentó un período de cicatrización más corto en muchos estudios experimentales y clínicos utilizando superficies arenadas, de grano grueso y grabadas con ácido (SLA), la modificación de esta superficie parece presentar una respuesta ósea más fuerte que su predecesora.
El objetivo de este ensayo controlado aleatorizado de boca dividida fue comparar el fracaso temprano del implante y la estabilidad del implante de los implantes Hiossen ET III de una etapa con su nueva superficie hidrofílica (NH), en comparación con los implantes Hiossen ET III con la conocida superficie SA en un seguimiento de 1 año. La hipótesis nula era que no hay diferencia entre los grupos. La hipótesis nula se probó contra la hipótesis alternativa de diferencias entre ellos. Se ha publicado un informe preliminar de un centro. El siguiente ensayo se informó de acuerdo con las directrices de la declaración CONSORT (http://www.consort-statement.org/).
Materiales y Métodos
Este estudio fue diseñado como un ensayo controlado aleatorizado de boca dividida de grupos paralelos con dos brazos y evaluación de resultados independiente cuando fue posible, realizado en cuatro centros entre noviembre de 2017 y mayo de 2018. El protocolo fue registrado en clinicaltrial.gov (NCT03649100). Se adhirió a la declaración de Helsinki de 2013. El estudio se realizó después de recibir la aprobación de la Junta de Revisión Institucional de la Universidad Aldent, Tirana, Albania (marzo de 2018). Todos los procedimientos quirúrgicos y protésicos fueron realizados por un clínico experto en cada centro.
Cualquier paciente sano, de 18 años o más, que requiriera al menos dos implantes para ser rehabilitado con una restauración fija soportada por implantes, con un índice de sangrado en boca completa y un índice de placa en boca completa ≤25%, con suficiente hueso para permitir la colocación de implantes de al menos 11.5 mm de longitud, y un ancho de hueso de al menos 6 a 8 mm para la colocación de un implante Hiossen ET III de plataforma regular (Deutsche Osstem GmbH, Eschborn, Alemania) fueron incluidos en este estudio. Los criterios de exclusión se encuentran en la Tabla 1.
Se informó a los pacientes sobre los procedimientos clínicos, los materiales que se utilizarían, los beneficios, los riesgos potenciales y las posibles complicaciones, así como sobre cualquier evaluación de seguimiento requerida para el estudio clínico. Los pacientes debían firmar el consentimiento informado antes de ser incluidos en el estudio.
Se administró una dosis única de antibiótico (2 g de amoxicilina y ácido clavulánico o 600 mg de clindamicina si los pacientes eran alérgicos a la penicilina) de forma profiláctica 1 hora antes de la cirugía. Los pacientes enjuagaron con clorhexidina al 0.2% durante 1 minuto. Se inducirá anestesia local utilizando una solución de articaína al 4% con epinefrina 1:100,000 (Ubistesin; 3M Italia, Milán, Italia). Los implantes se colocaron en los sitios anatómicos planificados utilizando un enfoque sin colgajo o un mini-colgajo. La densidad ósea se evaluó, de acuerdo con la clasificación de Lekholm y Zarb, durante la fase de perforación, según la experiencia y el juicio del clínico. El sitio del implante se preparó simultáneamente, de acuerdo con el protocolo de perforación recomendado por el fabricante (colocado a un nivel subcrestal de 0.5 mm o más profundo según la calidad del hueso y el grosor del tejido blando). Los implantes de superficie SA (grupo SA) o los implantes de superficie SA con un recubrimiento nanométrico bioabsorbible de apatita recién desarrollado (grupo NH) fueron aleatorizados después de la preparación del sitio del implante, inmediatamente antes de la colocación del implante. Los implantes utilizados en cada grupo eran idénticos excepto por el tratamiento de superficie. Los implantes se colocaron de acuerdo con un protocolo de una sola etapa.
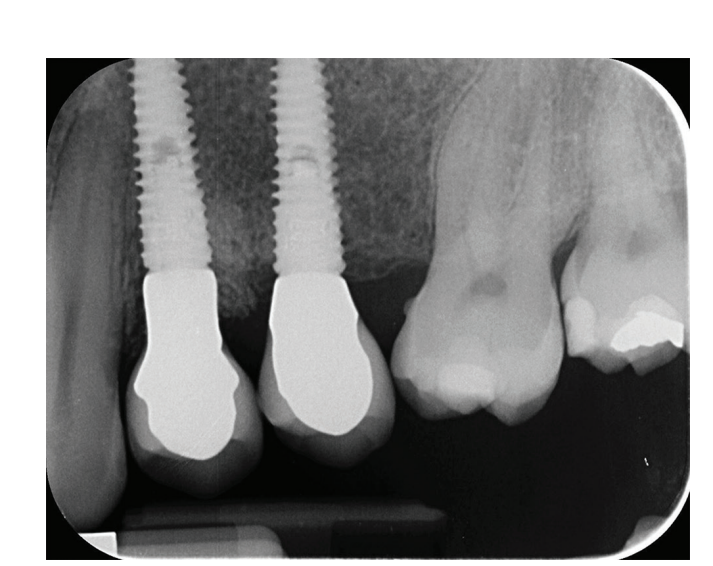
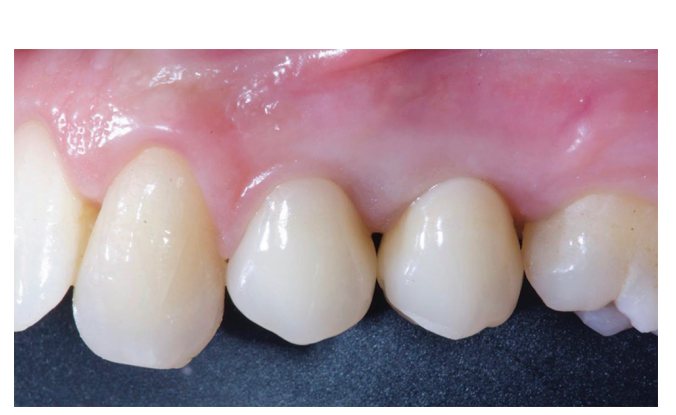
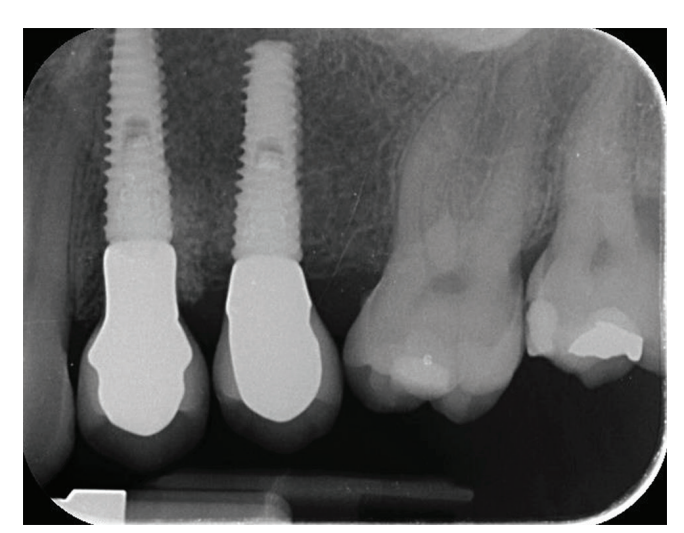
El tratamiento analgésico postsquirúrgico se realizó con ibuprofeno de 600 mg, que se administró dos veces al día durante 2 días después de la cirugía, y posteriormente, si era necesario. Se tomaron radiografías periapicales con un soporte personalizado en la colocación del implante, en la entrega de la prótesis definitiva (Figs. 1 y 2), y luego anualmente (Figs. 3 y 4). De dos a tres meses después de la colocación de los implantes, los pacientes reciben restauraciones retenidas por un solo tornillo.
Las medidas de resultado fueron las tasas de supervivencia de implantes y prótesis, cualquier complicación biológica o mecánica en los implantes que ocurrió durante todo el período de observación, el torque de inserción en la colocación del implante y el cociente de estabilidad del implante (ISQ).
Las tasas de éxito de los implantes y prótesis fueron evaluadas por un evaluador independiente (E.X.). Un implante se consideró un fracaso si presentaba movilidad, evaluada después del período de osteointegración al golpear o mover la cabeza del implante con las manijas metálicas de dos instrumentos, pérdida ósea marginal progresiva o infección, o cualquier complicación mecánica que hiciera que el implante fuera inutilizable, aunque aún mecánicamente estable en el hueso. Una prótesis se consideró un fracaso si necesitaba ser reemplazada por otra prótesis.
Complicaciones biológicas (dolor, hinchazón, supuración, etc.) y/o mecánicas (aflojamiento de tornillos, fractura del armazón, del material de recubrimiento, etc.) ocurrieron durante el período de seguimiento. Las complicaciones fueron evaluadas y tratadas por el mismo cirujano (M.T.).
El torque de inserción se registró en la colocación del implante por el mismo cirujano (M.T.) utilizando la unidad quirúrgica iChiropro (Bien-Air, Bienne, Suiza).
Los valores de torque de inserción de los implantes se midieron y registraron en la colocación del implante, utilizando la misma unidad quirúrgica utilizada para colocar los implantes.
El ISQ se midió y registró utilizando un perno inteligente (Tipo 47 cod. 100478, Osstell, Gotemburgo, Suecia) conectado a los implantes, y el dispositivo Osstell Mentor (Osstell). Las mediciones se realizaron en el momento de la colocación del implante y cada semana hasta 8 semanas después de la colocación del implante. En caso de que el valor de ISQ fuera <55 o en caso de movilidad del implante, el pilar de cicatrización se reemplazó por un tornillo de cobertura y el implante se dejó sanar sumergido durante al menos 6 semanas.
Un evaluador de resultados ciego recopiló los datos (E.X.), de acuerdo con un estudio previamente publicado.
Se creó una lista aleatoria pregenerada, que consistía en una secuencia aleatoria de números consecutivos que coincidían con los dos procedimientos diferentes dentro del grupo A o grupo B, utilizando el generador de números aleatorios pro 1.91 para Windows (Segobit Software; www.segobit.com). Los sobres opacos que contenían los códigos de aleatorización fueron numerados secuencialmente y sellados. De acuerdo con una lista pregenerada, un consultor independiente, no involucrado previamente en el ensayo, preparó todos los sobres y luego se abrieron inmediatamente después de la preparación de los sitios de implante. El sitio uno se definió como el sitio con el número de sextante más bajo y el más mesial. Los pacientes y el estadístico fueron cegados, mientras que el médico no, debido a la diferente opacidad de la superficie del implante. Los datos de los pacientes se recopilaron en una hoja de cálculo de Excel (Microsoft) que reflejaba los parámetros en los registros de los pacientes. Los datos se exportaron al software SPSS para Mac OS X (versión 22.0; SPSS, Chicago, Illinois, Estados Unidos), para el análisis estadístico. Se realizó un análisis descriptivo para los parámetros numéricos utilizando medias y desviaciones estándar (intervalo de confianza del 95%). Las complicaciones y fallos se compararon utilizando la prueba exacta de Fisher. Se realizaron comparaciones entre grupos (SA vs. NH) y entre mandíbulas (maxilar vs. mandíbula) mediante la prueba t no apareada, mientras que la comparación entre la línea base (T0) y el último seguimiento (T8) se realizó mediante pruebas t apareadas para detectar cualquier cambio durante el seguimiento. Se utilizó el coeficiente de correlación de Pearson para evaluar la correlación entre el torque de inserción en la colocación del implante y el valor de ISQ 8 semanas después de la colocación del implante. Todas las comparaciones estadísticas fueron de dos colas y se realizaron al nivel de significancia de 0.05. El paciente se utilizó como la unidad estadística de análisis.
Resultados
Solo tres de cuatro centros lograron reclutar y tratar pacientes de acuerdo con el protocolo del estudio. Inicialmente, se evaluaron 39 pacientes, pero seis pacientes no fueron incluidos porque no tenían suficiente hueso para permitir la colocación de implantes de 11.5 mm de largo y 4 mm de diámetro; dos pacientes no fueron incluidos porque no querían participar en el estudio; y los otros dos pacientes eran fumadores empedernidos. Un total de 29 pacientes (22 mujeres y siete hombres, con una edad media en la inserción del implante de 59.9 ± 11.3 años) fueron tratados de acuerdo con las intervenciones asignadas y se les dio seguimiento hasta 1 año después de la carga. Ningún paciente abandonó el estudio. Se colocaron un total de 58 implantes (29 con superficie SA y 29 con superficie SA con el nuevo recubrimiento nanométrico bioabsorbible de apatita). Dieciocho pacientes fueron rehabilitados en el maxilar y 11 en la mandíbula. Un año después de la carga, ningún implante y ninguna prótesis falló. Dos semanas después de la colocación del implante, dos implantes Hiossen ET III SA mostraron una pequeña movilidad con valores de ISQ inferiores a 55 (49 y 51, respectivamente). Los pilares de cicatrización fueron reemplazados por tornillos de cobertura y los implantes se dejaron sanar sin interrupciones hasta 8 semanas después de su colocación. Sin embargo, no se alcanzó una diferencia estadísticamente significativa (p = 0.491). En ambos implantes, los pilares de cicatrización fueron reemplazados por un tornillo de cobertura y los implantes se dejaron sanar sumergidos durante 6 semanas (hasta 8 semanas después de la colocación del implante).
El par de inserción medio osciló entre 35.0 y 45.0 Ncm (media de 40.5 ± 3.23 [38.17–41.83] Ncm en el grupo SA y 40.48 ± 3.49 [38.02–41.98] Ncm en el grupo NH). La diferencia entre los grupos no fue estadísticamente significativa (p = 0.981).
La comparación entre los valores de ISQ se informó en la Tabla 2 y en las Figuras 5 a 7.
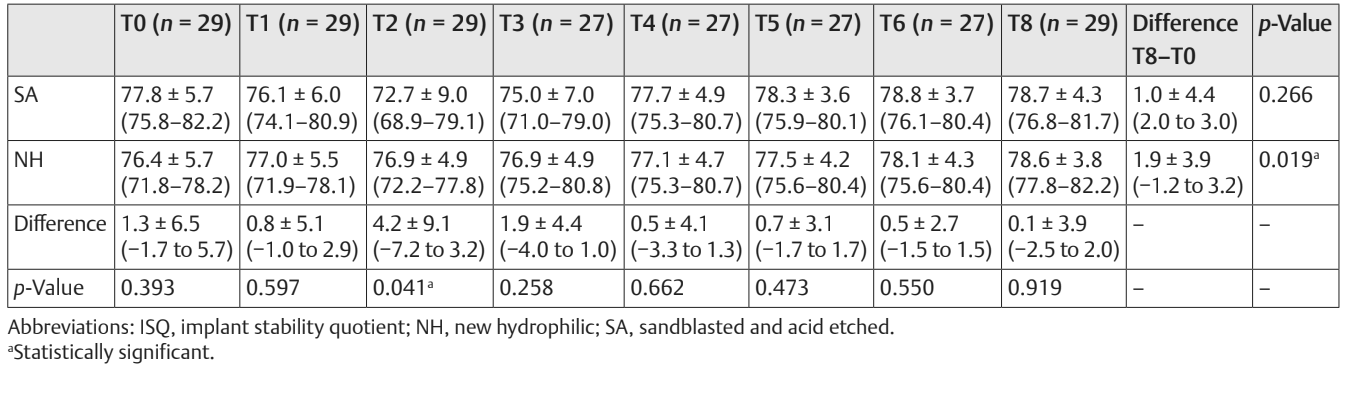
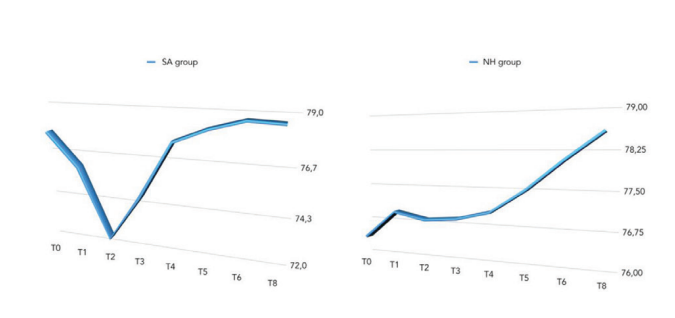
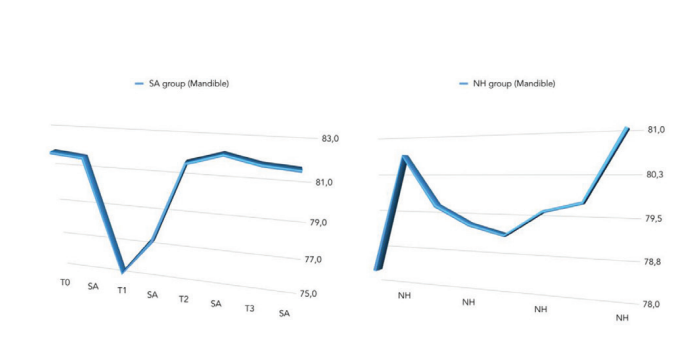
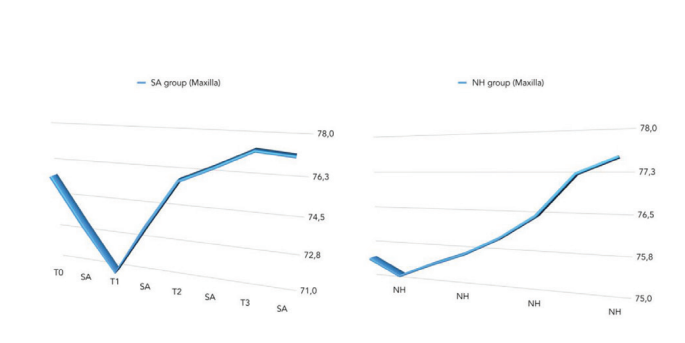
Hubo una diferencia estadísticamente significativa entre los grupos en la segunda semana después de la colocación del implante (T2) con valores más altos en el grupo NH (p = 0.041). Se encontraron resultados similares en el maxilar (p = 0.045), pero no en la mandíbula (p = 0.362). En general, los valores de ISQ mejoraron en ambos grupos durante todo el seguimiento (8 semanas), con una diferencia estadísticamente significativa en el grupo NH (p = 0.019), pero no en el grupo SA (p = 0.266). Se encontró una correlación positiva entre el par de inserción inicial y el ISQ con un valor más alto en el grupo NH (0.73 vs. 0.66). La correlación fue más fuerte en la mandíbula (SA = 0.71; NH = 0.86) en comparación con el maxilar (SA = 0.52; NH = 0.55).
Discusión
Hoy en día, hay un gran esfuerzo por mejorar la interfaz entre el hueso y el implante modificando la superficie del implante dental para mejorar la integración ósea y reducir el tiempo de este proceso para ayudar al clínico en el tratamiento de pacientes edéntulos. Exactamente en este contexto se orientó nuestro estudio, de hecho, este ensayo controlado aleatorizado de boca partida tenía como objetivo comparar la falla temprana del implante y la estabilidad del implante de implantes Hiossen ET III de una etapa con su superficie NH, en comparación con los implantes Hiossen ET III con la conocida superficie SA hasta 1 año de seguimiento. La hipótesis nula de que no hay diferencia fue parcialmente rechazada a favor de la hipótesis alternativa de diferencia entre grupos.
En general, el ISQ medio mejoró en ambos grupos durante las 8 semanas de seguimiento, pero los valores mostraron una diferencia estadísticamente significativa solo en el grupo NH (p = 0.019). La razón fue en parte debido al hecho de que 2 semanas después de la colocación de los implantes, el valor medio de ISQ fue estadísticamente significativo más alto en el grupo NH en comparación con el grupo SA (p = 0.041). Una posible explicación podría ser los valores inesperados de ISQ en el grupo de implantes SA causados por dos implantes que mostraron valores <55 con una ligera movilidad del implante. Como consecuencia, los implantes se dejaron sanar sumergidos durante las siguientes 6 semanas. Sin embargo, se puede asumir que los implantes con la superficie hidrofílica (NH) parecen reducir las complicaciones evitando la caída del ISQ durante la fase de remodelación, permitiendo así beneficios en la carga inmediata, mala calidad ósea, post-extracción y maxilar. Las principales limitaciones del presente ensayo controlado aleatorizado son el pequeño tamaño de la muestra y el seguimiento a corto plazo. Desafortunadamente, un centro no participó en el estudio, contribuyendo al pequeño tamaño de la muestra.
El esfuerzo continuo de las empresas dentales por mejorar la interfaz entre el hueso y la superficie del implante para acelerar el proceso de osteointegración ha sido propuesto por investigadores y empresas de implantes dentales, y los datos subrayados en este documento, especialmente para la superficie NH, confirman la posibilidad de reducir el tiempo en la terapia de implantes. Hoy en día, la estabilidad primaria del implante y la ausencia de micromovimientos siguen siendo dos de los principales requisitos para obtener una osteointegración estable y alcanzar tasas de éxito a largo plazo. Por el contrario, si durante el primer período de cicatrización del implante la estabilidad primaria es insuficiente, puede ocurrir un fallo temprano del implante.
En el presente estudio, se encontró una significancia estadística similar en el maxilar (p = 0.045), pero no en la mandíbula (p = 0.362). Para minimizar el riesgo de fallo temprano del implante, durante las últimas décadas se ha sugerido que los implantes deben mantenerse libres de carga durante un período de cicatrización de 3 a 4 meses en mandíbulas y de 6 a 8 meses en maxilares. Hoy en día, cuanto más se utilizan los implantes en la rutina clínica, mayor es el interés clínico en que los implantes se integren rápidamente con el hueso para ser funcionales. Se ha propuesto un esfuerzo continuo para mejorar la interfaz entre el hueso y la superficie del implante para acelerar el proceso de osteointegración, modificando la rugosidad y la topografía de la superficie del implante. Para entender mejor la rugosidad de los implantes dentales, comúnmente se divide, dependiendo de la dimensión de las características de la superficie medida, en rugosidad macro, micro y nano. Todos estos tipos de rugosidad y topografía tienen consecuencias directas en la respuesta ósea durante el período de cicatrización de los tejidos alrededor de los implantes dentales. Hoy en día, se sabe bien que la rugosidad del implante mejora la osteointegración y la mayoría de los tipos de implantes son arenados y/o grabados ácidos para aumentar su textura superficial. Además, la rugosidad en nanómetros tiene un papel principal en la adsorción de proteínas, la adhesión de células osteoblásticas y, por lo tanto, en la tasa de osteointegración. Además, Schwarz et al. mostraron que las superficies hidrofílicas mejoran el proceso de angiogénesis cuando ocurren las primeras etapas de la osteointegración. De hecho, la rápida vascularización parece ser beneficiosa para la formación ósea porque se ha observado que las células osteogénicas surgen de pericitos adyacentes a pequeños vasos sanguíneos. En una revisión de Wennerberg et al., se encontró poca evidencia clínica que afirmara claramente una preferencia por SLActive sobre el implante SLA. En el seguimiento a 1 año, hubo una alta tasa de supervivencia (100% para SLActive frente al 96% para los implantes SLA) y una baja pérdida ósea crestal <0.4 mm en ambos grupos sin diferencia significativa.
La literatura reciente sugiere que un torque de inserción óptimo podría estar alrededor de 30 Ncm para obtener una osteointegración exitosa y duradera, lo cual también es suficiente para permitir tanto la carga oclusal convencional como inmediata de los implantes dentales. La razón por la cual las empresas de implantes dentales y los investigadores se centran en las mejoras del diseño del implante y la modificación de la superficie es ayudar tanto a los clínicos como a los pacientes a acelerar la cirugía de implante y el tiempo protésico; por las mismas razones, los investigadores se centran en la odontología digital y en el desarrollo de guías en odontología de implantes.
En el presente estudio, se encontró una correlación positiva entre el torque de inserción inicial y el ISQ con un valor más alto en el grupo NH (0.73 vs. 0.66). La correlación fue más fuerte en la mandíbula (SA = 0.71; NH = 0.86) en comparación con el maxilar (SA = 0.52; NH = 0.55). La implicación clínica de este ensayo controlado aleatorio puede ser que los implantes con modificación de superficie NH podrían ser una opción importante al tratar a los pacientes, especialmente cuando el momento de la carga es crucial. Considerando la correlación positiva encontrada entre un alto torque de inserción y un aumento en el nivel de ISQ, y mejores resultados en el maxilar, este tratamiento de superficie podría ser una opción de tratamiento viable en caso de carga inmediata, mala calidad ósea (como en el maxilar posterior), implantes postextractivos, o pacientes de alto riesgo, como pacientes inmunocomprometidos o fumadores empedernidos.
Conclusiones
Considerando la limitación de este ensayo controlado aleatorio multicéntrico y de boca dividida, los implantes NH son una alternativa viable a la superficie SA, ya que parecen evitar la caída del ISQ durante la fase de remodelación. Puede ser beneficioso en la carga inmediata, calidad ósea deficiente, implantes postextractivos, tabaquismo e inmunosupresión. Se necesitan más estudios para mejorar el número de pacientes y el seguimiento a largo plazo.
Marco Tallarico, Nicola Baldini, Fulvio Gatti, Matteo Martinolli, Erta Xhanari, Silvio Mario Meloni, Cervino Gabriele, Lumbau Aurea Inmacolata
Referencias
- Albrektsson T, Chrcanovic B, Östman P-O, Sennerby L. Respuestas iniciales y a largo plazo del hueso crestal a los implantes dentales modernos. Periodontol 2000 2017;73(1):41–50
- Trindade R, Albrektsson T, Tengvall P, Wennerberg A. Reacción del cuerpo extraño a biomateriales: sobre los mecanismos de acumulación y descomposición de la oseointegración. Clin Implant Dent Relat Res 2016;18(1):192–203
- Albrektsson T, Canullo L, Cochran D, De Bruyn H. “Peri-implantitis”: una complicación de un cuerpo extraño o una “enfermedad” creada por el hombre. Hechos y ficción. Clin Implant Dent Relat Res 2016;18(4):840–849
- Albrektsson T, Dahlin C, Jemt T, Sennerby L, Turri A, Wennerberg A. ¿Es la pérdida ósea marginal alrededor de los implantes orales el resultado de una reacción provocada por un cuerpo extraño? Clin Implant Dent Relat Res 2014;16(2):155–165
- Albrektsson T, Donos N; Grupo de Trabajo 1. Supervivencia de implantes y complicaciones. La tercera conferencia de consenso de la EAO 2012. Clin Oral Implants Res 2012;23(suppl 6):63–65
- Cicciu M, Bramanti E, Matacena G, Guglielmino E, Risitano G. Evaluación FEM de la prótesis de corona dental de un solo diente retenida por cemento frente a la retenida por tornillo. Int J Clin Exp Med 2014;7(4):817–825
- Bramanti E, Cervino G, Lauritano F, et al. Análisis FEM y de Von Mises sobre los elementos estructurales de coronas protésicas: evaluación de diferentes materiales aplicados. ScientificWorldJournal 2017;2017:1029574
- Anil S, Anand PS, Alghamdi H, Jansen JA, Mejora de la superficie del implante dental y oseointegración. En: Turkyilmez I, ed. Odontología de implantes—Una práctica en rápida evolución. Rijeka, Croacia: InTech; 2011 83–87
- Cicciù M, Risitano G, Maiorana C, Franceschini G. Análisis paramétrico de la resistencia en el sistema de prótesis óseas “Toronto”. Minerva Stomatol 2009;58(1-2):9–23
- Tallarico M, Baldini N, Martinolli M, et al. ¿Tienen las nuevas superficies hidrofílicas alguna influencia en la tasa de éxito temprano y la estabilidad del implante durante el período de oseointegración? Resultados preliminares de cuatro meses de un ensayo controlado aleatorio de boca dividida. Eur J Dent 2019;13(1):95–101
- Tallarico M, Vaccarella A, Marzi GC. Resultados clínicos y radiológicos de la colocación de implantes en 1 versus 2 etapas: resultados de 1 año de un ensayo clínico aleatorio. Eur J Oral Implantology 2011;4(1):13–20
- Le Guéhennec L, Soueidan A, Layrolle P, Amouriq Y. Tratamientos de superficie de implantes dentales de titanio para una rápida oseointegración. Dent Mater 2007;23(7):844–854
- Chrcanovic BR, Albrektsson T, Wennerberg A. Razones para fallos de implantes orales. J Oral Rehabil 2014;41(6):443–476
- Renvert S, Polyzois I, Claffey N. ¿Cómo influyen las características de la superficie del implante en la enfermedad peri-implantaria? J Clin Periodontol 2011;38(suppl 11):214–222
- Dohan Ehrenfest DM, Coelho PG, Kang BS, Sul YT, Albrektsson T. Clasificación de las superficies de implantes oseointegrados: materiales, química y topografía. Trends Biotechnol 2010;28(4): 198–206
- Xuereb M, Camilleri J, Attard NJ. Revisión sistemática de los materiales de recubrimiento de implantes dentales actuales y técnicas de recubrimiento novedosas. Int J Prosthodont 2015;28(1):51–59
- Piattelli A, Cosci F, Scarano A, Trisi P. Infección ósea supurativa crónica localizada como secuela de peri-implantitis en un implante dental recubierto de hidroxiapatita. Biomaterials 1995;16(12): 917–920
- Payne AG, Tawse-Smith A, Duncan WD, Kumara R. Carga convencional y temprana de implantes ITI no divididos que soportan sobredentaduras mandibulares. Clin Oral Implants Res 2002;13(6): 603–609
- Cochran DL, Schenk RK, Lussi A, Higginbottom FL, Buser D. Respuesta ósea a implantes de titanio no cargados y cargados con una superficie arenada y grabada: un estudio histométrico en la mandíbula canina. J Biomed Mater Res 1998;40(1):1–11
- Khandelwal N, Oates TW, Vargas A. Alexander PP, Schoolfield JD, Alex McMahan C. Implantes SLA convencionales y SLA químicamente modificados en pacientes con diabetes tipo 2 mal controlada: un ensayo controlado aleatorio. Clin Oral Implants Res 2013;24(1):13–19
- Brånemark PI, Hansson BO, Adell R, et al. Implantes oseointegrados en el tratamiento de la mandíbula edéntula. Experiencia de un período de 10 años. Scand J Plast Reconstr Surg Suppl 1977;16:1–132
- Makary C, Rebaudi A, Sammartino G, Naaman N. Estabilidad primaria del implante determinada por análisis de frecuencia de resonancia: correlación con el torque de inserción, volumen óseo histológico y estabilidad torsional a las 6 semanas. Implant Dent 2012;21(6):474–480
- Szmukler-Moncler S, Salama H, Reingewirtz Y, Dubruille JH. Tiempo de carga y efecto del micromovimiento en la interfaz hueso-implante dental: revisión de la literatura experimental. J Biomed Mater Res 1998;43(2):192–203
- Lioubavina-Hack N, Lang NP, Karring T. Significado de la estabilidad primaria para la oseointegración de implantes dentales. Clin Oral Implants Res 2006;17(3):244–250
- Brånemark PI, Adell R, Breine U, Hansson BO, Lindström J, Ohlsson A. Anclaje intraóseo de prótesis dentales. I. Estudios experimentales. Scand J Plast Reconstr Surg 1969;3(2):81–100
- Tallarico M, Vaccarella A, Marzi GC, Alviani A, Campana V. Un ensayo clínico prospectivo controlado comparando implantes Nobel Biocare TiUnite de 1 y 2 etapas: análisis de frecuencia de resonancia evaluado por Osstell Mentor durante la integración. Quintessence Int 2011;42(8):635–644
- Junker R, Dimakis A, Thoneick M, Jansen JA. Efectos de los recubrimientos y la composición de la superficie del implante en la integración ósea: una revisión sistemática. Clin Oral Implants Res 2009;20(suppl 4): 185–206
- Rupp F, Liang L, Geis-Gerstorfer J. Scheideler L, Hüttig F. Características de la superficie de los implantes dentales: una revisión. Dent Mater 2018;34(1):40–57
- Heitz-Mayfield LJ. Enfermedades peri-implantarias: diagnóstico e indicadores de riesgo. J Clin Periodontol 2008;35(suppl 8):292–304
- Braceras I, Alava JI, Oñate JI, et al. Mejorada oseointegración en implantes dentales tratados por implantación iónica. Surf Coat Tech 2002;158–159:28–32
- Schwarz F, Herten M, Sager M, Wieland M, Dard M, Becker J. Análisis histológico e inmunohistoquímico de la integración ósea inicial y temprana en implantes de titanio SLA modificados químicamente y convencionales: resultados preliminares de un estudio piloto en perros. Clin Oral Implants Res 2007;18(4):481–488
- Long MW, Robinson JA, Ashcraft EA, Mann KG. Regulación de las células osteoprogenitoras derivadas de la médula ósea humana por factores de crecimiento osteogénicos. J Clin Invest 1995;95(2):881–887
- Reilly TM, Seldes R, Luchetti W, Brighton CT. Similitudes en la expresión fenotípica de pericitos y células óseas. Clin Orthop Relat Res 1998;(346):95–103
- Murphy M, Walczak MS, Thomas AG, Silikas N, Berner S, Lindsay R. Hacia la optimización del rendimiento de los implantes dentales: caracterización de la superficie de los materiales de implante Ti y TiZr. Dent Mater 2017;33(1):43–53
- Wennerberg A, Galli S, Albrektsson T. Conocimientos actuales sobre la superficie SLActive hidrofílica y nanostructurada. Clin Cosmet Investig Dent 2011;3:59–67
- Smeets R, Stadlinger B, Schwarz F, et al. Impacto de las modificaciones de la superficie del implante dental en la oseointegración. BioMed Res Int 2016;2016:6285620
- Faot F, Bielemann AM, Schuster AJ, et al. Influencia del torque de inserción en los resultados clínicos y biológicos antes y después de la carga de sobredentaduras retenidas por implantes mandibulares en mandíbulas edéntulas atróficas. BioMed Res Int 2019;2019: 8132520
- Herford AS, Miller M, Lauritano F, Cervino G, Signorino F, Maiorana C. El uso de la planificación quirúrgica virtual y la navegación en el tratamiento de trauma orbital. Chin J Traumatol 2017;20(1):9–13
- Stacchi C, Lombardi T, Cusimano P, et al. Raspadores óseos versus cirugía piezoeléctrica en la antrostomía lateral para elevación del suelo del seno. J Craniofac Surg 2017;28(5):1191–1196
- Lo Giudice G, Cicciù M, Cervino G, Lizio A, Visco AM. Resina fluida y espacio marginal en la tercera cavidad medial del diente que involucra esmalte y cemento radicular: una evaluación SEM de dos técnicas de restauración. Indian J Dent Res 2012;23(6): 763–769
- Cervino G, Terranova A, Briguglio F, et al. Diabetes: calidad de vida relacionada con la salud oral y alteraciones orales. BioMed Res Int 2019;2019:5907195
- Lo Giudice G, Lipari F, Lizio A, Cervino G, Cicciù M. Técnica de re-adherencia de fragmento dental en un diente pluri-traumatizado. J Conserv Dent 2012;15(1):80–83
- Cervino G, Fiorillo L, Herford AS, et al. Biomarcadores moleculares relacionados con el carcinoma oral: evaluación de resultados de ensayos clínicos en una revisión de la literatura. Dis Markers 2019;2019:8040361
- Pozzi A, Tallarico M, Moy PK. Carga inmediata con un nuevo implante caracterizado por geometría de rosca variable, conexión cónica interna y desplazamiento de plataforma: resultados de tres años de un estudio de cohorte prospectivo. Eur J Oral Implantol 2015;8(1):51–63
- Cervino G, Fiorillo L, Arzukanyan AV, Spagnuolo G, Cicciù M. Flujo de trabajo digital restaurativo dental: diseño digital de sonrisa desde la estética hasta la función. Dent J (Basel) 2019;7(2):28
- Lavorgna L, Cervino G, Fiorillo L, et al. Fiabilidad de un proyecto prostodóntico virtual realizado a través de una adquisición fotográfica 2D y 3D: un estudio experimental sobre la precisión de diferentes sistemas digitales. Int J Environ Res Public Health 2019;16(24):5139
- Laino L, Cicciù M, Fiorillo L, et al. Riesgo quirúrgico en pacientes con coagulopatías: pautas sobre pacientes hemofílicos para cirugía oromaxilofacial. Int J Environ Res Public Health 2019; 16(8):1386
