Recubrimiento de una superficie de implante arenada y grabada con ácido con un agente amortiguador de pH tras fotofuncionalización por vacío-UV
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
La fotofuncionalización ultravioleta (UV) puede reiniciar el envejecimiento biológico del titanio después de la preparación y almacenamiento de implantes dentales al transformar superficies de titanio hidrofóbicas en superficies superhidrofílicas. La formación de coágulos sanguíneos alrededor del implante puede iniciar y promover el proceso de curación en la interfaz hueso-implante. El objetivo de este estudio es evaluar y comparar las capacidades de humectabilidad de la superficie y coagulación sanguínea de implantes con una superficie convencional arenada y grabada con ácido (SA), una superficie arenada y grabada con ácido tratada con UV al vacío (SA + VUV), y una superficie arenada y grabada con ácido recubierta con un agente amortiguador de pH después del tratamiento con UV al vacío (SA + VUV + BS). Se realizaron pruebas estáticas y dinámicas de humectabilidad de la superficie y coagulación sanguínea in vitro para SA + VUV y SA + VUV + BS (n = 5), mientras que la hemostasia resultante de la coagulación sanguínea se evaluó in vivo para SA, SA + VUV y SA + VUV + BS (n = 4). Una prueba de Kruskal-Wallis mostró diferencias estadísticamente significativas (p < 0.05) en todas las pruebas, con la excepción de la prueba in vitro de coagulación sanguínea estática. Por lo tanto, el tratamiento VUV es efectivo para hacer que una superficie SA sea superhidrofílica como alternativa a la radiación UV-C de rutina. La adición de un agente amortiguador de pH a SA + VUV también mejoró la humectabilidad de la superficie y la coagulación sanguínea, que son cruciales para una exitosa oseointegración.
Introducción
El titanio se ha utilizado ampliamente para la restauración y reconstrucción dental y ortopédica debido a su biocompatibilidad, resistencia a la corrosión y propiedades mecánicas. El titanio se oxida fácilmente, formando una capa delgada (1–5 nm), estable y pasiva que es autolimitante y protege la superficie del metal de una mayor oxidación. Esta capa superficial de dióxido de titanio (TiO2) se considera responsable de su rendimiento biológico efectivo debido a la transferencia de iones de calcio y fósforo de la matriz ósea dentro de la capa de TiO2. Sin embargo, se producen reducciones significativas en la oseointegración y otras capacidades biológicas del titanio con el tiempo, ya que el carbono superficial aumenta debido a una deposición inevitable de carbono de la atmósfera sobre la capa de TiO2 en forma de hidrocarburo. Este fenómeno se define como el envejecimiento biológico del titanio, y la capacidad de las superficies de titanio para atraer proteínas y células osteogénicas disminuye de manera dependiente del tiempo. Otro cambio notable en las superficies de titanio con el tiempo es la desaparición de la hidrofobicidad. Inmediatamente después del procesamiento, las superficies de titanio exhiben un ángulo de contacto del agua de 0 o menos de 5 grados, y tales superficies se llaman superhidrofílicas. Esta característica se atenúa gradualmente y se vuelve hidrofóbica en 2 y 4 semanas, con un ángulo de contacto de más de 40 y 60 grados, respectivamente.
El tratamiento de superficie se utiliza para modificar la topografía y la energía de la superficie del implante dental, lo que resulta en una mejor humectabilidad, un aumento en la proliferación y crecimiento celular, y una aceleración de la oseointegración. El tratamiento de superficie se puede lograr mediante una técnica aditiva o sustractiva. La técnica sustractiva elimina o rugosa una capa de material base, como se ejemplifica con una superficie arenada y grabada con ácido (SA). En la técnica aditiva, se añaden otros materiales o agentes químicos superficialmente a la superficie del titanio a través de recubrimientos, como el rociado de plasma de titanio, recubrimiento de hidroxiapatita, recubrimiento de fosfato de calcio y otros recubrimientos biomiméticos. La perforación antes de la colocación del implante causa que el tejido óseo sufra un trauma similar a una fractura. El sitio se vuelve relativamente hipóxico, y el pH extracelular se vuelve ácido. En tales condiciones, las células estromales de la médula ósea exhiben una actividad reducida de fosfatasa alcalina (ALP) y síntesis de colágeno, ambos importantes en la formación ósea y la oseointegración. La glucólisis y la síntesis de ADN de los osteoblastos también se ven afectadas por condiciones ácidas. La agregación plaquetaria, que es un paso crítico en la formación de coágulos sanguíneos o trombogenesis, también se reduce por la acidosis extracelular, mediada por la vía de entrada de iones de calcio. La formación de un coágulo sanguíneo suficiente ofrece un enlace directo y estable en la interfaz hueso-implante y juega un papel importante en las respuestas trombógenas y la oseointegración. Además, se encontró una relación entre varias superficies de implantes y la extensión del coágulo de fibrina.
En nuestro estudio anterior, se introdujo una nueva superficie de SA recubierta con un agente amortiguador de pH después del tratamiento con UV-Vacío (VUV). Esta superficie estaba estrechamente asociada con una mayor afinidad por proteínas, células y plaquetas, lo que promovió una coagulación sanguínea rápida y estable, trombogénesis y osteointegración. El propósito del presente estudio fue evaluar y comparar la humectabilidad de la superficie y las habilidades de coagulación sanguínea de varias superficies de implantes, incluyendo una superficie de SA convencional (SA), una superficie de SA con tratamiento VUV (SA + VUV) y una superficie de SA recubierta con un agente amortiguador de pH después del tratamiento VUV (SA + VUV + BS), mediante análisis in vitro e in vivo.
Materiales y Métodos
2.1. Preparación de los Fijadores de Implante
Los fijadores de implante de titanio comercialmente puro (grado IV) se prepararon como SA, SA + VUV (TS III SA, Osstem, Seúl, Corea) y SA + VUV + BS (TS III SOI, Osstem) para su uso en este estudio. Como se muestra en la Figura 1a,b, la rugosidad de la superficie de los fijadores de implante se midió en 2.5 ± 0.5 µm de valor Ra, y el tratamiento VUV para la fotofuncionalización se logró exponiendo un fijador de implante a lámparas de arco de mercurio de baja presión que emiten UV-C y VUV en un limpiador de ozono UV durante 1 h. El recubrimiento de la superficie del implante con un agente amortiguador de pH, que comprende grupos iónicos cargados positiva y negativamente, con un valor de pKa de 7.31 a 37°C, se suplementó para una mejor superhidrofobicidad (Figura 1c).
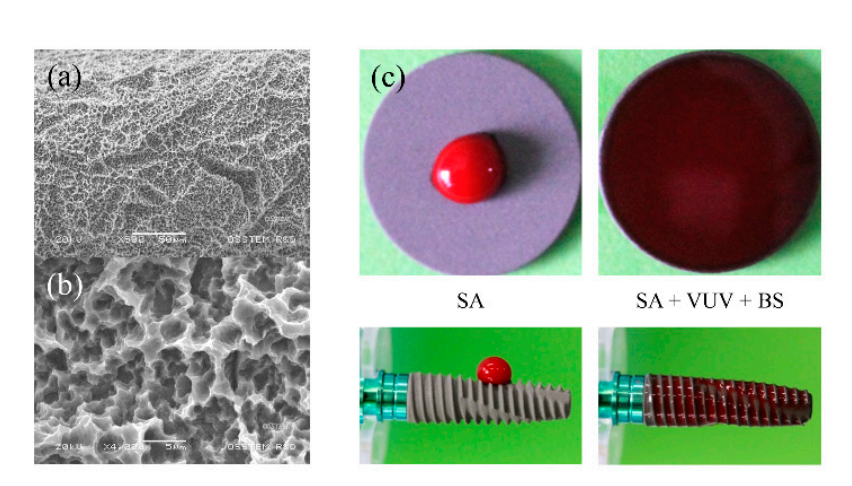
2.2. Pruebas In Vitro
2.2.1. Humectabilidad Estática de la Superficie
Se llenó un plato de 3.5 cm de diámetro con sangre de oveja heparinizada a una profundidad de 2 a 3 cm. Los implantes de SA + VUV y SA + VUV + BS (n = 5, respectivamente) se sumergieron en sangre hasta la discontinuidad más alta de las roscas apicales, y se registró el tiempo para alcanzar la parte superior del implante para calcular la velocidad de humectación. El tiempo no se contó desde el ápice del implante, porque la presencia de la discontinuidad de las roscas apicales hizo que la absorción de sangre se detuviera abruptamente.
2.2.2. Humectabilidad Dinámica de la Superficie
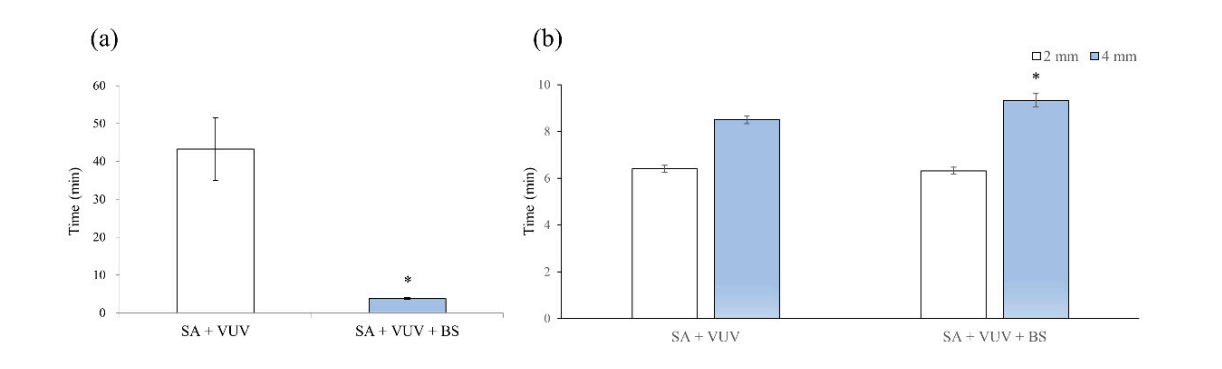
Para simular las situaciones clínicas de instalación de implantes, se hicieron agujeros en una placa de acrílico transparente para asegurar la visibilidad, de acuerdo con el protocolo de perforación del fabricante para densidad ósea dura utilizando un Kit de 122 Taper (Osstem). Se colocó una muestra de 130 µM de sangre de oveja defibrinada en cada agujero de la placa de acrílico, y los implantes de SA + VUV y SA + VUV + BS (n = 5, respectivamente) se sumergieron en el agujero mediante un medidor de empuje–tirón (MX-500N, Imada Co., Tokio, Japón) a una velocidad de 50 mm/min, y se registraron los tiempos en que la sangre alcanzó los puntos de 2 mm y 4 mm del eje central del implante sobre la placa horizontal, respectivamente (Figura 2).

2.2.3. Coagulación Sanguínea Estática
Los accesorios de implante de SA + VUV y SA + VUV + BS, de 11.5 mm de largo y 4.5 mm de diámetro (n = 5, respectivamente), se sumergieron hasta sus extremos en un plato de 3.5 cm de diámetro lleno con 3 mL de sangre de oveja no heparinizada. Se midió el peso (g) del coágulo de sangre alrededor del accesorio del implante a los 5 min, 7.5 min, 10 min y 12.5 min, respectivamente.
2.2.4. Coagulación Sanguínea Dinámica
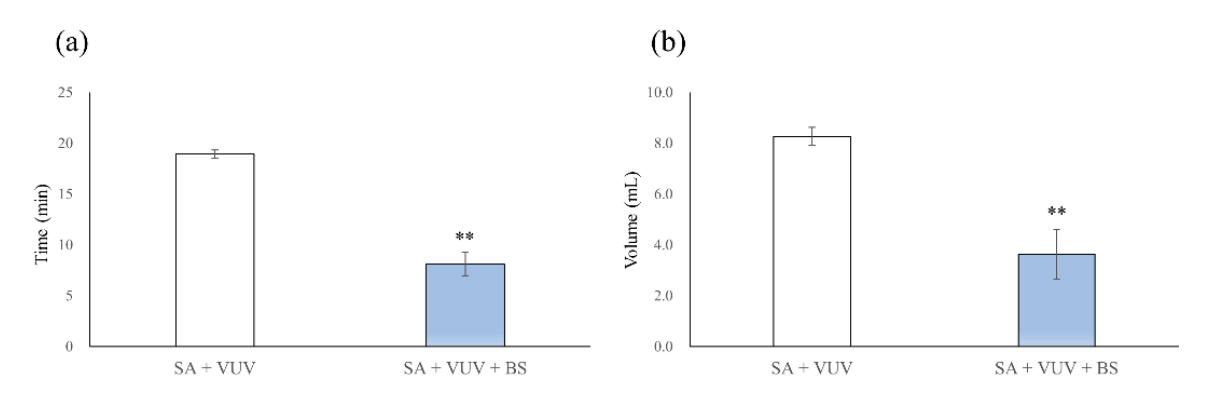
Este modelo para la coagulación sanguínea activa fue diseñado para simular un suministro continuo de sangre a través de los capilares. Los implantes SA + VUV y SA + VUV + BS, que tenían 10 mm de largo con un diámetro de 4.0 mm (n = 5), fueron insertados con un par de torsión de inserción preestablecido de 5 N cm en un tubo Eppendorf modificado, que estaba conectado a una bomba de jeringa que infundía sangre de oveja, mezclada con 1 IU/mL de heparina, en la parte inferior a 37°C. Después de 30 minutos de suministro de sangre a una tasa de infusión de 0.05 mL/min, se midió el tiempo (min) hasta que la sangre dejó de gotear por la formación de coágulos alrededor del implante y el volumen (mL) de sangre, que se recolectó en el tubo de 15 mL debajo del tubo Eppendorf.
2.3. Prueba In Vivo
Se utilizó un modelo de mandíbula de perro beagle. Todos los procedimientos se llevaron a cabo con la aprobación del Comité de Ética de Experimentación Animal del Comité Institucional de Cuidado y Uso de Animales (CRONEX-IACUC 20191002; Cronex, Hwasung, Corea) de acuerdo con las directrices de Investigación Animal: Informe de Experimentos In Vivo (ARRIVE).
Cuatro beagles hembras de 18 meses de edad fueron sometidas a extracción bilateral de sus premolares mandibulares y el primer molar bajo anestesia general. El protocolo anestésico para todos los procedimientos quirúrgicos incluyó una inyección intramuscular de 1 mL con una dosis de 15 mg/kg de tiletamina/zolazepam (Zoletil 50, Virbac, Seúl, Corea) y 5 mg/kg de xylazina (Rompun, Bayer Corea, Seúl, Corea). Después de la anestesia local, se levantó un colgajo mucoperióstico de grosor completo adyacente a los premolares y molares mandibulares (Figura 3). Los dientes fueron hemisecados bajo abundante irrigación con una pequeña fresa de fisura. Las extracciones se realizaron con elevadores y fórceps. Los colgajos se cerraron con suturas interrumpidas simples. El protocolo de cuidado postoperatorio incluyó antibióticos y control del dolor. Durante este intervalo, todos los perros fueron mantenidos en una dieta blanda y agua ad libitum.
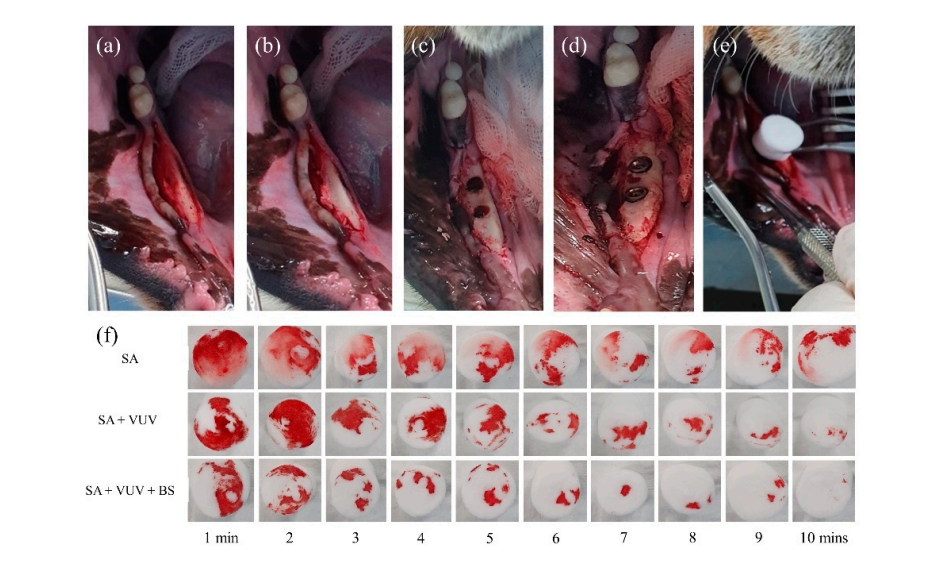
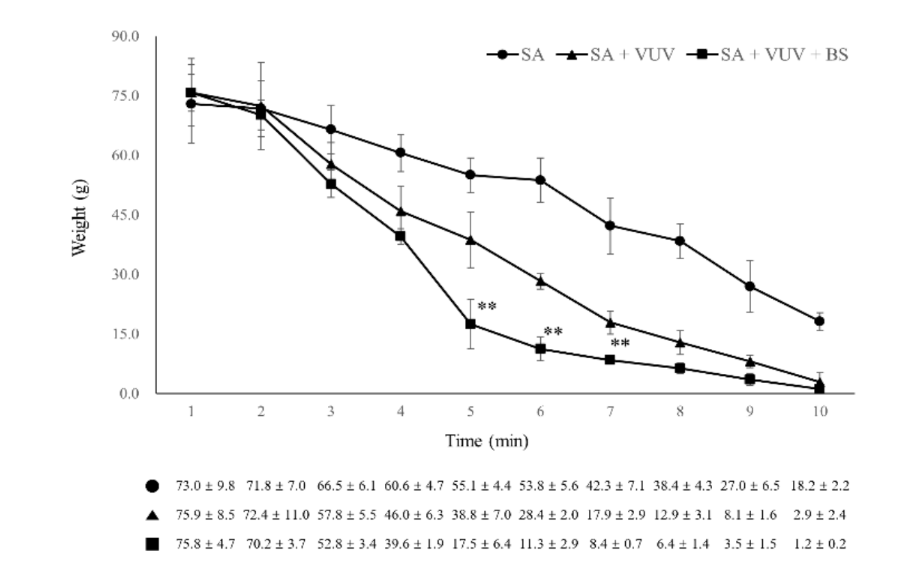
Tres meses después de las extracciones, se realizó la colocación quirúrgica de implantes dentales en los sitios de extracción cicatrizados bajo condiciones estériles. Después de la anestesia local, se elevó un colgajo de grosor completo para exponer la cresta alveolar, y la cresta alveolar irregular fue aplanada. Se realizaron perforaciones secuenciales para los sitios de implantes consecutivos, que eran más grandes que el fixture del implante, utilizando un taladro guía, un taladro de 2.2 mm, un taladro de 3.0 mm, un taladro de 4.0 mm y un taladro ultra-cónico de 6.0 mm. Se colocaron un total de 12 fixtures de implante de SA, SA + VUV y SA + VUV + BS, de 8.5 mm de largo con un diámetro de 3.5 mm, bilateralmente con un par de inserción preestablecido de 35 N cm. La sangre completa del espacio entre el agujero y el fixture del implante fue absorbida en un pellet de algodón hasta 10 minutos después de la colocación del implante, y el peso (g) del pellet de algodón fue medido cada minuto para evaluar el potencial de coagulación de los fixtures del implante. Todos los animales experimentales fueron sacrificados después de la cirugía por una sobredosis intravenosa de cloruro de potasio.
2.4. Análisis Estadístico
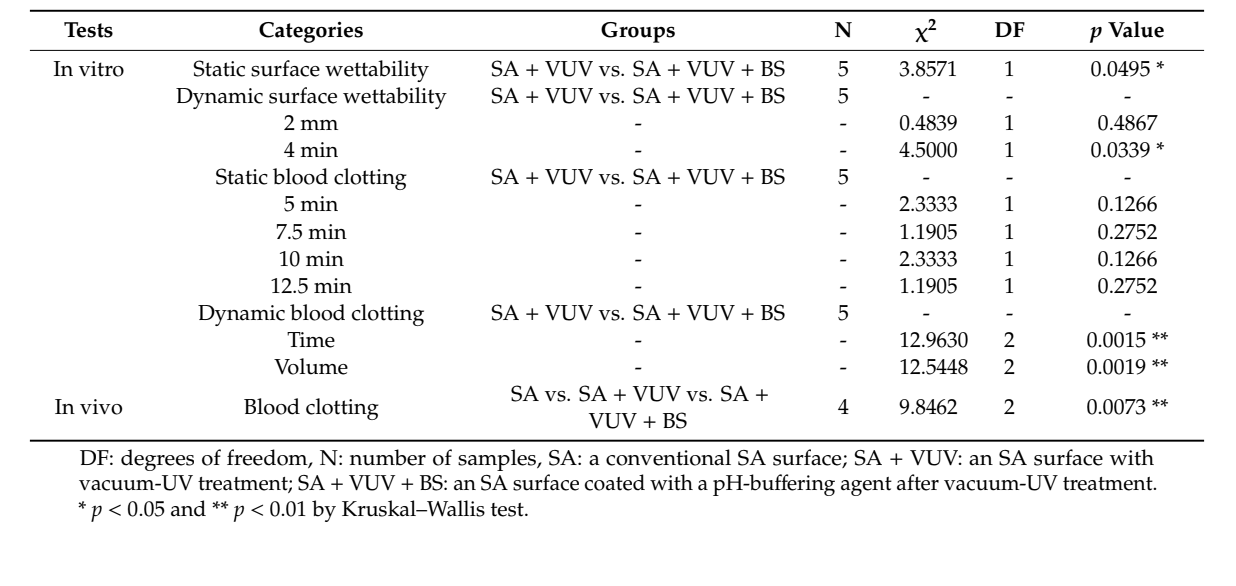
Debido a un tamaño de muestra pequeño, realizamos una prueba de Kruskal–Wallis, que es una comparación no paramétrica de la diferencia de las medias sin suposición de normalidad, para examinar las diferencias entre SA + VUV y S + VUV + BS in vitro y entre SA, SA + VUV y SA + VUV + BS in vivo, con una significancia estadística de p < 0.05 a α = 0.05. Todos los análisis estadísticos se realizaron utilizando SAS, versión 9.4 (SAS Inc., Cary, NC, EE. UU.).
Resultados
3.1. Pruebas In Vitro
3.1.1. Humedad Estática de la Superficie
Los tiempos antes de que la sangre alcanzara la parte superior del implante fueron de 43.3 ± 8.3 min y 3.8 ± 0.3 min en SA + VUV y SA + VUV + BS, respectivamente, y se evidenció una diferencia estadísticamente significativa (p < 0.05) entre los dos (Figura 4a).
3.1.2. Humedad Dinámica de la Superficie
Los tiempos antes de que la sangre alcanzara 2 mm por encima de la placa horizontal fueron de 6.4 ± 0.1 min y 6.3 ± 0.2 min, y para 4 mm por encima de la placa horizontal, fueron de 8.5 ± 0.2 min y 9.3 ± 0.3 min en SA + VUV y SA + VUV + BS, respectivamente. Se encontró una diferencia estadísticamente significativa (p < 0.05) entre SA + VUV y SA + VUV + BS solo para el tiempo antes de que la sangre alcanzara 4 mm por encima de la placa horizontal (Figura 4b).
3.1.3. Coagulación Sanguínea Estática
En SA + VUV, los pesos del coágulo de sangre formado alrededor del implante, que se midieron a los 5 min, 7.5 min, 10 min y 12.5 min después de sumergir el implante en la sangre, fueron 0.04 ± 0.01 g, 0.09 ± 0.03 g, 0.23 ± 0.06 g y 0.39 ± 0.16 g, respectivamente. En SA + VUV + BS, los pesos fueron 0.07 ± 0.03 g, 0.12 ± 0.02 g, 0.39 ± 0.20 g y 0.61 ± 0.18 g, respectivamente, y no se midieron diferencias estadísticamente significativas entre SA + VUV y SA + VUV + BS en ningún momento (p > 0.05).
3.1.4. Coagulación Sanguínea Dinámica
Los tiempos para la hemostasia completa fueron 19.0 ± 0.4 min y 8.1 ± 1.2 min en SA + VUV y SA + VUV + BS, respectivamente, y hubo una diferencia estadísticamente significativa entre SA + VUV y SA + VUV + BS (p < 0.01, Figura 5a). Además, los volúmenes de sangre recolectados en el tubo subyacente fueron 8.27 ± 0.36 mL y 3.64 ± 0.99 mL en SA + VUV y SA + VUV + BS, respectivamente, con una diferencia estadísticamente significativa (p < 0.01, Figura 5b) evidente entre SA + VUV y SA + VUV + BS.
3.2. Prueba In Vivo
Entre SA, SA + VUV y SA + VUV + BS, hubo diferencias estadísticamente significativas en los pesos de la sangre total absorbida en el pellet de algodón medidos a los 5 min, 6 min y 7 min (p < 0.01, Figura 6). Las estadísticas resumidas de este estudio se muestran en la Tabla 1.
Discusión
La fotofuncionalización UV, un método de modificación de superficies de titanio después del tratamiento UV que incluye alterar las propiedades fisicoquímicas y mejorar las biocompatibilidades, se ha propuesto para reiniciar el envejecimiento biológico del titanio. Después del tratamiento con radiación UV, la capa de TiO2 de una superficie de titanio incorporada con hidrocarburos se volvió notablemente hidrofílica o superhidrofílica. Se sabe que la cantidad de carbono en la superficie varía dependiendo de la edad de la superficie y, según se informa, puede aumentar hasta aproximadamente el 60% al 70% de los componentes atómicos de la superficie. El tratamiento UV limpia tales superficies de titanio contaminadas con carbono, reduciendo el porcentaje de carbono a menos del 20% y aumentando simultáneamente el nivel de oseointegración. En el espectro UV, tanto UV-A como UV-C convierten las superficies de titanio envejecidas biológicamente de hidrofóbicas a superhidrofílicas, pero solo se sabe que UV-C (200–280 nm) reduce efectivamente el carbono en la superficie a un nivel equivalente a una superficie nueva y mejora la bioactividad. UV-C es capaz de eliminar hidrocarburos de una capa de TiO2 de titanio mediante fotodecomposición directa, lo que es más efectivo que la fotocatálisis por UV-A. En nuestro estudio, todos los implantes fueron fotofuncionalizados por UV-C y VUV (100–200 nm), y la eliminación radical de hidrocarburos de la capa de TiO2 de titanio podría proporcionar más superhidrofobicidad. VUV es rápidamente absorbido por el agua en la atmósfera y, por lo tanto, es capaz de generar varias especies reactivas de oxígeno al romper enlaces de hidrógeno en las moléculas de agua a través de la hidrólisis. La hidrólisis iniciada por VUV es un método eficiente para obtener grupos hidroxilo o hidróxido en una capa de TiO2 que proporciona superhidrofobicidad persistente. Dado que el tratamiento VUV tiende a generar más ozono en la atmósfera y radicales hidroxilo en el agua, debe ser estrictamente limitado solo a entornos de laboratorio o fábrica, no clínicos.
Para acelerar la curación ósea y mejorar el anclaje óseo a un implante, la interfaz hueso/implante se puede mejorar topográfica y bioquímicamente incorporando fases inorgánicas, como el fosfato de calcio, y moléculas orgánicas, como proteínas, enzimas o péptidos, sobre o en una capa de TiO2. Las superficies de implante nanostructuradas, que tienen una amplia área de superficie, alta energía libre de superficie y humectabilidad, parecen ser capaces de modificar la respuesta del tejido huésped. Las superficies de implante SA han demostrado resultados clínicos predecibles y se consideran como la superficie estándar de implante. La superhidrofobicidad de SA + VUV + BS, que se encontró previamente en la superficie plana de discos, fue confirmada en nuestra prueba de humectabilidad superficial estática. Dado que la capacidad de atraer sangre cerca de la parte superior del fijador del implante (aproximadamente 4 mm por encima de la placa horizontal en nuestro estudio) es lo que la mayoría de los clínicos prefieren verificar en un entorno clínico, añadimos una nueva prueba dinámica de humectabilidad superficial para comparar las velocidades de humectación de SA + VUV y SA + VUV + BS con más detalle. Dado que SA es una superficie seca que no ha estado en contacto con ningún líquido, la humectabilidad superficial de SA + VUV + BS podría ser significativamente superior a la de SA únicamente por el efecto del agente amortiguador de pH de SA + VUV + BS. Sin embargo, dado que los fijadores de implante se colocan con superficies secas o sin ninguna hidratación adicional en situaciones clínicas reales, elegimos un SA ingenuo, en lugar de un SA hidratado en solución, como control. Se ha encontrado previamente que una superficie más hidrofílica está estrechamente relacionada con una mejor y más rápida oseointegración. Además, se sabe que la humectabilidad superficial altera las respuestas biológicas de las superficies de implante con respecto a la adhesión de proteínas y otras moléculas, así como las interacciones celulares.
A medida que la formación de coágulos sanguíneos señala el comienzo del proceso de curación, la interacción entre un implante y la sangre se considera importante para la exitosa oseointegración de implantes de titanio después de la implantación. La formación de coágulos sanguíneos en superficies de titanio rugosas puede inducir el reclutamiento celular y estimular la curación de heridas, y se ha revelado que tanto los preosteoblastos como los osteoblastos pueden adherirse a una superficie de implante cubierta por plaquetas y fibrina, donde se diferencian bajo la estimulación de factores osteogénicos y citoquinas liberadas del coágulo sanguíneo peri-implantario. Se cree que la formación de coágulos sanguíneos en el implante con varias superficies de implante es un factor crucial en la retención efectiva de fibrina y puede afectar críticamente la curación ósea y la oseointegración al influir en el transporte de macromoléculas, el comportamiento celular y la osteogénesis de contacto/distancia. En una prueba de coagulación sanguínea estática, el SA + VUV + BS mostró una superior absorción de sangre alrededor de los fijadores del implante en comparación con SA + VUV, pero no a un grado estadísticamente significativo. Esto indica que una superficie SA fotofuncionalizada con VUV tiene al menos una capacidad igual en la coagulación sanguínea. Diseñamos nuevos experimentos para confirmar la coagulación sanguínea mediante hemostasia de sangrados capilares continuos para simular situaciones clínicas reales de la manera más precisa posible. En una prueba de coagulación sanguínea dinámica in vitro, los coágulos se formaron significativamente más rápido, y el volumen total de sangre recolectada a través del espacio entre los agujeros y el fijador del implante hasta la hemostasia fue significativamente menor en SA + VUV + BS que en SA + VUV. Una prueba in vivo también mostró una diferencia significativa en el peso total de sangrado entre el agujero sobrepreparado y un fijador de implante entre SA, SA + VUV y SA + VUV + BS. Esto sugiere que SA + VUV + BS puede inducir una formación de coágulos sanguíneos más rápida alrededor de la superficie del implante, lo que lleva a una interacción más efectiva de la interfaz hueso-implante para la oseointegración. En un aspecto clínico, estas características de SA + VUV + BS son importantes para visualizar el sitio quirúrgico y la regeneración ósea guiada simultánea, que se indica con frecuencia para la cantidad y calidad adecuadas de los tejidos peri-implantarios para obtener resultados más estéticos y funcionales, porque la rápida coagulación sanguínea está estrechamente asociada con la estabilización del material de injerto y la membrana de barrera. Finalmente, SA + VUV podría ser una alternativa a SA + VUV + BS en comparación con SA con respecto al potencial para la formación de coágulos sanguíneos en superficies de implante.
Durante la perforación del implante en el hueso, que produce una condición débilmente ácida, un tampón de pH puede ayudar a mantener el pH constante. Como material de recubrimiento, el agente amortiguador de pH parece controlar la liberación de los mediadores inflamatorios y mejorar las condiciones para la actividad de los osteoblastos al mantener el pH constante o al menos prevenir cambios significativos. La actividad de las plaquetas en la coagulación sanguínea y tanto la actividad de los osteoblastos como el nivel de ALP para la formación ósea también son inhibidos por la acidosis extracelular. SA + VUV + BS podría maximizar la actividad de las plaquetas, la trombogenesis, la actividad de los osteoblastos y el nivel de ALP en una interfaz hueso-implante a través de un efecto amortiguador de pH. Se necesitarán más estudios para investigar SA + VUV + BS con respecto a su seguridad y efectividad en entornos clínicos. También se deben seguir ensayos controlados aleatorios para confirmar su viabilidad en diversas condiciones clínicas, como la colocación de implantes inmediatamente después de la extracción dental o con aumento óseo simultáneo.
Chang-Joo Park, Jae Hyung Lim, Marco Tallarico, Kyung-Gyun Hwang, Hyook Choi, Gyu-Jang Cho, Chang Kim, Il-Seok Jang, Ju-Dong Song, Amy M. Kwon, Sang Ho Jeon y Hyun-Kyung Park
Referencias
- Özcan, M.; Hämmerle, C. Titanio como material de reconstrucción e implante en odontología: Ventajas y desventajas. Materials 2012, 5, 1528–1545. [CrossRef]
- Ehrenfest, D.M.D.; Coelho, P.G.; Kang, B.S.; Sul, Y.T.; Albrektsson, T. Clasificación de superficies de implantes oseointegrados: Materiales, química y topografía. Trends Biotechnol. 2010, 28, 198–206. [CrossRef]
- Milošev, I.; Metikoš-Hukovic´, M.; Strehblow, H.H. Película pasiva en aleación de TiAlV ortopédica formada en solución fisiológica investigada por espectroscopia de fotoelectrones de rayos X. Biomaterials 2000, 21, 2103–2113. [CrossRef]
- Lee, J.H.; Ogawa, T. El envejecimiento biológico de los implantes de titanio. Implant Dent. 2012, 21, 415–421. [CrossRef]
- Hori, N.; Att, W.; Ueno, T.; Sato, N.; Yamada, M.; Saruwatari, L.; Suzuki, T.; Ogawa, T. Degradación dependiente de la edad de la capacidad de adsorción de proteínas del titanio. J. Dent. Res. 2009, 88, 663–667. [CrossRef]
- Hori, N.; Ueno, T.; Suzuki, T.; Iwasa, F.; Yamada, M.; Att, W.; Okada, S.; Ohno, A.; Aita, H.; Kimoto, K. Tratamiento con luz ultravioleta para la restauración de la degradación relacionada con la edad de la bioactividad del titanio. Int. J. Oral Maxillofac. Implant. 2010, 25, 49–62.
- Ogawa, T. Fotofuncionalización ultravioleta de implantes de titanio. Int. J. Oral Maxillofac. Implant. 2014, 29, e95–e102. [CrossRef] [PubMed]
- Rosales-Leal, J.; Rodríguez-Valverde, M.; Mazzaglia, G.; Ramón-Torregrosa, P.; Díaz-Rodríguez, L.; García-Martínez, O.; Vallecillo-Capilla, M.; Ruiz, C.; Cabrerizo-Vílchez, M. Efecto de la rugosidad, humectabilidad y morfología de superficies de titanio diseñadas en la adhesión de células similares a osteoblastos. Colloids Surf. Physicochem. Eng. Aspects 2010, 365, 222–229. [CrossRef]
- Cicciù, M.; Fiorillo, L.; Herford, A.S.; Crimi, S.; Bianchi, A.; D’Amico, C.; Laino, L.; Cervino, G. Superficies de titanio bioactivas: Interacciones de células eucariotas y procariotas de dispositivos nano aplicados a la práctica dental. Biomedicines 2019, 7, 12. [CrossRef]
- Li, D.; Ferguson, S.J.; Beutler, T.; Cochran, D.L.; Sittig, C.; Hirt, H.P.; Buser, D. Comparación biomecánica de la superficie de titanio arenado y grabada con ácido y la mecanizada y grabada con ácido para implantes dentales. J. Biomed. Mater. Res. 2002, 60, 325–332. [CrossRef]
- Kaysinger, K.K.; Ramp, W.K. El pH extracelular modula la actividad de osteoblastos humanos cultivados. J. Cell. Biochem. 1998, 68, 83–89. [CrossRef]
- Marumo, M.; Suehiro, A.; Kakishita, E.; Groschner, K.; Wakabayashi, I. El pH extracelular afecta la agregación plaquetaria asociada con la modulación de la entrada de Ca2+ operada por almacenamiento. Thromb. Res. 2001, 104, 353–360. [CrossRef]
- Hong, J.; Kurt, S.; Thor, A. Una superficie de implante dental hidrofílica exhibe propiedades trombogénicas in vitro. Clin. Implant Dent. Relat. Res. 2013, 15, 105–112. [CrossRef]
- Di Iorio, D.; Traini, T.; Degidi, M.; Caputi, S.; Neugebauer, J.; Piattelli, A. Evaluación cuantitativa de la extensión del coágulo de fibrina en diferentes superficies de implantes: Un estudio in vitro. J. Biomed. Mater. Res. 2005, 74, 636–642. [CrossRef]
- Pae, H.C.; Kim, S.K.; Park, J.Y.; Song, Y.W.; Cha, J.K.; Paik, J.W.; Choi, S.H. Características bioactivas de una superficie de implante recubierta con un agente amortiguador de pH: Un estudio in vitro. J. Periodontal Implant. Sci. 2019, 49, 366–381. [CrossRef]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Análisis comparativo radiológico entre el relleno de suero salino y fibrina rica en plaquetas después de un levantamiento sinusal transcrestal hidráulico sin injerto óseo adicional: Un ensayo controlado aleatorio. Clin. Oral Implant. Res. 2020. [CrossRef] [PubMed]
- Att, W.; Hori, N.; Iwasa, F.; Yamada, M.; Ueno, T.; Ogawa, T. El efecto de la fotofuncionalización UV en la bioactividad relacionada con el tiempo de aleaciones de titanio y cromo-cobalto. Biomaterials 2009, 30, 4268–4276. [CrossRef]
- Shie, J.L.; Lee, C.H.; Chiou, C.S.; Chang, C.T.; Chang, C.C.; Chang, C.Y. Cinética de fotodegradación de formaldehído utilizando fuentes de luz UVA, UVC y UVLED en presencia de un fotocatalizador compuesto de óxido de titanio y plata. J. Hazard. Mater. 2008, 155, 164–172. [CrossRef]
- McGivney, E.; Carlsson, M.; Gustafsson, J.P.; Gorokhova, E. Efectos de los procesos de oxidación avanzada de TiO2 UV-C y Vacuum-UV en la mortalidad aguda de microalgas. Photochem. Photobiol. 2015, 91, 1142–1149. [CrossRef]
- Westall, J.; Hohl, H. Una comparación de modelos electrostáticos para la interfaz de solución de óxido. Adv. Colloid Interface Sci. 1980, 12, 265–294. [CrossRef]
- Tang, L.; Thevenot, P.; Hu, W. La química de superficie influye en la biocompatibilidad del implante. Curr. Top. Med. Chem. 2008, 8, 270–280. [CrossRef]
- Coelho, P.G.; Granjeiro, J.M.; Romanos, G.E.; Suzuki, M.; Silva, N.R.; Cardaropoli, G.; Thompson, V.P.; Lemons, J.E. Métodos de investigación básica y tendencias actuales de superficies de implantes dentales. J. Biomed. Mater. Res. 2009, 88, 579–596. [CrossRef]
- Puleo, D.; Nanci, A. Comprender y controlar la interfaz hueso-implante. Biomaterials 1999, 20, 2311–2321. [CrossRef]
- Morra, M.; Cassinelli, C.; Cascardo, G.; Mazzucco, L.; Borzini, P.; Fini, M.; Giavaresi, G.; Giardino, R. Superficies de titanio recubiertas de colágeno I: Adhesión de células mesenquimatosas y evaluación in vivo en implantes de hueso trabecular. J. Biomed. Mater. Res. 2006, 78, 449–458. [CrossRef] [PubMed]
- Morra, M. Modificación bioquímica de superficies de titanio: Péptidos y proteínas de la MEC. Eur. Cell. Mater. 2006, 12, 15. [CrossRef]
- Makowiecki, A.; Hadzik, J.; Błaszczyszyn, A.; Gedrange, T.; Dominiak, M. Una evaluación de superficies superhidrofílicas de implantes dentales: una revisión sistemática y un metaanálisis. BMC Oral Health 2019, 19, 79. [CrossRef]
- Khandelwal, N.; Oates, T.W.; Vargas, A.; Alexander, P.P.; Schoolfield, J.D.; Alex McMahan, C. Implantes SLA convencionales y SLA químicamente modificados en pacientes con diabetes mellitus tipo 2 mal controlada: Un ensayo controlado aleatorio. Clin. Oral Implant. Res. 2013, 24, 13–19. [CrossRef]
- Kokovic, V.; Jung, R.; Feloutzis, A.; Todorovic, V.S.; Jurisic, M.; Hämmerle, C.H. Carga inmediata vs. carga temprana de implantes SLA en la mandíbula posterior: Resultados a 5 años de un ensayo clínico controlado aleatorio. Clin. Oral Implant. Res. 2014, 25, e114–e119. [CrossRef]
- Cesaretti, G.; Botticelli, D.; Renzi, A.; Rossi, M.; Rossi, R.; Lang, N.P. Evaluación radiográfica de implantes cargados inmediatamente que soportan puentes fijos de 2 a 3 unidades en el maxilar posterior: Un estudio clínico multicéntrico prospectivo controlado aleatorio de seguimiento a 3 años. Clin. Oral Implant. Res. 2016, 27, 399–405. [CrossRef]
- Buser, D.; Broggini, N.; Wieland, M.; Schenk, R.; Denzer, A.; Cochran, D.; Hoffmann, B.; Lussi, A.; Steinemann, S. Aumento de la aposición ósea a una superficie de titanio SLA químicamente modificada. J. Dent. Res. 2004, 83, 529–533. [CrossRef]
- Lang, N.P.; Salvi, G.E.; Huynh-Ba, G.; Ivanovski, S.; Donos, N.; Bosshardt, D.D. Osseointegración temprana en superficies de implantes hidrofílicas e hidrofóbicas en humanos. Clin. Oral Implant. Res. 2011, 22, 349–356. [CrossRef] [PubMed]
- Gittens, R.A.; Scheideler, L.; Rupp, F.; Hyzy, S.L.; Geis-Gerstorfer, J.; Schwartz, Z.; Boyan, B.D. Una revisión sobre la humectabilidad de las superficies de implantes dentales II: Aspectos biológicos y clínicos. Acta Biomater. 2014, 10, 2907–2918. [CrossRef]
- Shiu, H.T.; Goss, B.; Lutton, C.; Crawford, R.; Xiao, Y. La formación de coágulos de sangre en implantes biomateriales influye en la curación ósea. Tissue Eng. Part B Rev. 2014, 20, 697–712. [CrossRef]
- Yang, J.; Zhou, Y.; Wei, F.; Xiao, Y. El coágulo de sangre formado en la superficie rugosa de titanio induce el reclutamiento celular temprano. Clin. Oral Implant. Res. 2016, 27, 1031–1038. [CrossRef]
- Gassling, V.; Hedderich, J.; Açil, Y.; Purcz, N.; Wiltfang, J.; Douglas, T. Comparación de fibrina rica en plaquetas y colágeno como andamios sembrados con osteoblastos para aplicaciones de ingeniería de tejidos óseos. Clin. Oral Implant. Res. 2013, 24, 320–328. [CrossRef]