Efecto de la colocación inmediata de implantes simultáneos y reconstrucción ósea guiada con membranas de malla de titanio ultrafina en parámetros radiográficos y clínicos después de 18 meses de carga.
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Antecedentes: El objetivo del presente estudio de serie de casos prospectivo fue evaluar las tasas de supervivencia de implantes y prótesis, complicaciones y pérdida ósea marginal utilizando una membrana de malla de titanio ultrafina con colocación simultánea de implantes, para proporcionar el mantenimiento del espacio necesario para la reconstrucción ósea guiada de defectos óseos alveolares.
Materiales y Métodos: los pacientes fueron reclutados y tratados en una clínica privada en Roma, Italia, entre marzo de 2016 y octubre de 2017. Se colocaron implantes cónicos autoperforantes a través de un enfoque asistido por plantilla guiada por computadora. Se colocó hueso autógeno solo sobre la superficie expuesta del implante, luego se mezcló con material óseo bovino inorgánico. Finalmente, se conectó y dio forma a la membrana para cerrar de manera segura el área del injerto, y se conectó y atornilló el tapón de cicatrización al conector de altura. Las medidas de resultado fueron: fallo del implante y de la prótesis, complicaciones biológicas y mecánicas, cambios en el nivel óseo marginal y volumétrico, evaluación estética realizada de acuerdo con el puntaje estético rosa (PES).
Resultados: en total, siete pacientes (cinco mujeres, dos hombres) con una edad media de 52.7 ± 20.3 años (rango: 27–71) recibieron 10 implantes cónicos autoperforantes y regeneración ósea guiada simultánea con membranas de malla de titanio ultrafina. No se produjeron fallos de implantes ni de prótesis durante todo el período de seguimiento. Se observó una ligera exposición de la membrana un mes después de la colocación del implante en un paciente. La pérdida ósea marginal media (MBL) al cargar el implante fue de 0.13 ± 0.09 mm (IC 95 % 0.08–0.19). En el examen de seguimiento a los 18 meses, la MBL media fue de 0.28 ± 0.33 mm (IC 95 % 0.07–0.50). La diferencia no fue estadísticamente significativa (0.15 ± 0.31; IC 95 % 0.05–0.35; P = 0.1888). El ancho medio del reborde alveolar horizontal fue de 3.72 ± 1.08 mm (IC 95 % 3.22–4.22 mm). En la cirugía de II etapa, el ancho óseo medio fue de 8.79 ± 0.98 mm (IC 95 % 8.51–9.07 mm). La ganancia ósea media fue de 5.06 ± 1.13 mm (IC 95 % 4.68–5.44 mm; P = 0.000). El volumen medio del hueso injertado calculado utilizando la técnica de superposición fue de 0.99 ± 0.38 CC (IC 95 % 0.75–1.23 CC). La PES media al cargar el implante fue de 8.2 ± 0.8 mm (IC 95 % 7.7–8.7). En el examen de seguimiento a los 18 meses, la PES media fue de 12.0 ± 0.7 mm (IC 95 % 11.5–12.5). La diferencia fue estadísticamente significativa (3.8 ± 0.4; IC 95 % 3.5–4.1; P = 0.0000).
Conclusión: con la limitación del presente estudio prospectivo, la reconstrucción ósea guiada utilizando una membrana de malla de titanio ultrafina con colocación simultánea de implantes parece proporcionar buenos y estables resultados en el éxito del implante/prótesis. Se necesita más investigación con un seguimiento más prolongado y un tamaño de muestra mayor para confirmar los resultados de este informe preliminar.
Introducción
La atrofia del hueso alveolar es una situación clínica crónica y progresiva caracterizada por una pérdida moderada a severa del volumen óseo debido a la pérdida o extracción de dientes. Además, las condiciones o enfermedades locales, como la extracción traumática, la enfermedad periodontal y el trauma, podrían magnificar esta condición patológica, dificultando o haciendo desfavorable la colocación de implantes dentales desde una perspectiva funcional y estética. Para superar estos posibles inconvenientes, se han introducido técnicas de reconstrucción ósea. Entre estas, la regeneración ósea guiada (GBR) es un procedimiento quirúrgico que utiliza un material de injerto como andamiaje aislado y protegido con una membrana, de las células no osteogénicas, derivadas del tejido conectivo adyacente. De este modo, el efecto barrera de la membrana debería permitir solo el paso de las células osteogénicas, derivadas del hueso y los vasos circundantes, hacia el defecto óseo, permitiendo la formación ósea a través de la presencia de señales estimulantes.
Tanto las membranas reabsorbibles como las no reabsorbibles se han utilizado para aislar y mantener un andamiaje biológico correcto y planificado, necesario para la formación de nuevo tejido óseo. Dada la naturaleza de su función, la membrana no reabsorbible debería ser más predecible y segura de usar. Sin embargo, la principal limitación es que se necesita una cirugía adicional para retirar la membrana. No obstante, la reconstrucción ósea guiada generalmente se realiza en dos etapas o con un protocolo de implante sumergido cuando se realiza en una sola etapa. Así, la membrana podría ser retirada en el momento de la colocación del implante o en la segunda etapa si la GBR se realizó al mismo tiempo que el implante.
En la práctica diaria, las membranas no reabsorbibles de politetrafluoroetileno expandido (e-PTFE) podrían considerarse como la primera opción en las reconstrucciones de defectos óseos horizontales y verticales. Sin embargo, desde la década de 1990, varios investigadores han investigado el uso clínico de mallas de titanio ultrafinas (mallas de Ti) para la reconstrucción de la mandíbula y el maxilar atróficos. El titanio es más resistente al colapso que el e-PTFE y las membranas reabsorbibles. Por lo tanto, la rigidez del titanio puede funcionar como un andamiaje, manteniendo el espacio requerido para la regeneración ósea, incluso en casos de un gran defecto óseo, como la reconstrucción ósea vertical.
La porosidad de las mallas de Ti se puede modificar para lograr una mejor integración y formación del tejido. Variar la porosidad de las mallas de Ti permite que los fluidos y nutrientes pasen a través de la membrana mientras se evitan las células infiltrantes.
Hoy en día, se han propuesto diferentes formas de membrana de malla de Ti para maximizar la formación de nuevo hueso, estabilizar los materiales de injerto bajo la membrana y reducir el riesgo de exposición de la membrana, que puede provocar colapso y/o crecimiento de los tejidos blandos adyacentes.
El objetivo del presente estudio de serie de casos prospectivo fue evaluar las tasas de supervivencia del implante y prostéticas, complicaciones, pérdida ósea marginal, utilizando membrana de malla de titanio ultrafina y colocación simultánea de implantes, para proporcionar el mantenimiento del espacio necesario para la augmentación ósea de los defectos óseos alveolares. Este ensayo siguió las disposiciones de la Declaración sobre el Fortalecimiento de la Información de Estudios Observacionales en Epidemiología (STROBE).
Materiales y Métodos
Esta investigación fue diseñada como un estudio de serie de casos para evaluar los resultados clínicos y radiográficos de la reconstrucción ósea guiada simultánea y la colocación de implantes con membrana de malla de titanio ultrafina. Los pacientes fueron reclutados y tratados en una clínica privada en Roma, Italia, entre marzo de 2016 y octubre de 2017. Los procedimientos quirúrgicos fueron realizados por un clínico experto (MT) certificado en terapia basada en implantes por la asociación europea para la oseointegración en 2013. Todos los pacientes fueron informados sobre la naturaleza del estudio y dieron su consentimiento por escrito para los procedimientos quirúrgicos y prostéticos y para el uso de datos radiológicos y clínicos para la publicación. Se adhirió estrictamente a los principios consagrados en la Declaración de Helsinki de 2013. Además, el protocolo radiológico fue aprobado por el Comité Científico Técnico y Ético de la Universidad de Sassari (2069/CE).
Cualquier paciente consecutivo de 18 años o más que presentara edentulismo parcial del maxilar o la mandíbula, capaz de entender y firmar un consentimiento informado, y que requiriera una restauración soportada por implantes, fue considerado elegible para su inclusión en este estudio. Los pacientes fueron finalmente incluidos si presentaban una atrofia de clase IV a VI de Cawood y Howell del reborde alveolar residual en el examen de tomografía computarizada de haz cónico. Se excluyeron a los pacientes que presentaban contraindicaciones generales para la cirugía de implantes (como irradiación del área de cabeza y cuello en los cinco años anteriores a la implantación, o diabetes no controlada); embarazo o lactancia; abuso de sustancias; terapia psiquiátrica o expectativas poco realistas; tratamiento previo o en curso con bisfosfonatos intravenosos; periodontitis no tratada o mala higiene oral (sangrado al sondeo y/o índice de placa ≥ 25%); fumadores empedernidos (≥11 cigarrillos/día); sitios post-extracción.
Antes de la cirugía de implantes, se realizó una tomografía CBCT (CBCT, CRANEX 3D; Soredex, Tuusula, Finlandia) y una impresión digital intraoral (escáner intraoral CS 3600, Carestream Dental, Atlanta, GA, EE. UU.). La tomografía CBCT se configuró con un campo de visión de 80 mm × 150 mm; tamaño de voxel de 0.3 µm; 90 KV; 6.3–10 mA durante 4.5 s, resultando en un producto de dosis-área de 579.7–920.2 (mGycm2). Los datos STL y DICOM (Imágenes Digitales y Comunicaciones en Medicina) se importaron en un software dedicado para diagnóstico y planificación de implantes (3Diagnosys versión 4.2, 3DIEMME srl, Cantù, Italia). Posteriormente, se planificaron virtualmente los implantes guiados por prótesis.
Una hora antes de la cirugía, se administró una dosis única de antibióticos (2 g de amoxicilina y ácido clavulánico, o 600 mg de clindamicina si es alérgico a la penicilina) de manera profiláctica. Se administró un enjuague bucal de digluconato de clorhexidina al 0.2% durante dos minutos antes de la cirugía.
Todos los pacientes fueron tratados bajo sedación oral con diazepam 10 mg (Valium, Roche S.p.A., Monza, Italia). Se administró anestesia local utilizando articaína con adrenalina 1:100,000. Se realizó una incisión midcrestal en el tejido queratinizado utilizando una hoja de bisturí quirúrgico No. 15C. Se elevó un colgajo de grosor completo más allá de la unión mucogingival. Luego, se realizaron dos incisiones verticales a un diente de distancia del defecto óseo, o al menos 5 mm de distancia en caso de área edéntula. A continuación, se limpió el sitio receptor eliminando todos los restos de tejido blando. Se colocó un implante TSIII autoperforante y cónico (Osstem Implant, Seúl, Corea) a través de un enfoque asistido por plantilla guiada por computadora, al nivel del hueso o 1 mm más profundo, de acuerdo con el protocolo de perforación sugerido por el fabricante. Todas las plantillas quirúrgicas estaban soportadas por dientes y se hicieron sin mangas metálicas. La característica principal de la membrana OssBuilder es que se fija directamente al implante en un enfoque de una sola etapa. Para asegurar la membrana al implante, se debe utilizar una herramienta especial llamada conector de altura (Osstem Implant). Esta herramienta está disponible en diferentes alturas para conectar la membrana al implante a diferentes niveles dependiendo del hueso residual y la profundidad del implante. Usando un destornillador hexagonal de 1.2, se atornilló el conector de altura al fixture a 5 a 8 N·cm. Luego, se recolectó hueso autógeno del área adyacente, utilizando un colector de hueso cortical mínimamente invasivo (Micross, Meta, Italia). El hueso se recolectó en el área mesial o distal cerca del defecto. Después, se midió el defecto óseo para determinar la forma y el tamaño apropiados de la membrana de malla de titanio (OssBuilder, Osstem Implant). Todas las membranas utilizadas eran de titanio puro grado 2 y estaban diseñadas con poros de 0.6 a 1 mm de diámetro.
Se colocó hueso autógeno solo sobre la superficie expuesta del implante. Luego, se utilizó una segunda capa compuesta por hueso autógeno mezclado con material óseo bovino anorgánico (Bio-OSS, Geistlich Biomaterials Italia S.r.l.) en una proporción de 1:1, para injertar el defecto restante. El injerto óseo se contorneó en exceso para compensar la resorción final del injerto. Finalmente, la membrana se conectó al conector de altura y se moldeó para cerrar de manera segura el área del injerto, y se conectó y atornilló el tapón de cicatrización al conector de altura utilizando el controlador de tapa de cobertura a 5 a 8 N·cm. Se realizó una incisión periosteal para permitir una adaptación pasiva, sin tensión, y el cierre del colgajo. La herida se suturó en dos capas con una sutura de poliglactina 910 de 4-0 (Vicryl V271; Ethicon, West Somerville, NJ, EE. UU.) (Figuras 1–3). Se administró cobertura antibiótica durante siete días (1 g de amoxicilina y ácido clavulánico o 300 mg de clindamicina dos veces al día) después de la cirugía. Se prescribió un enjuague bucal de digluconato de clorhexidina al 0.2% durante un minuto, dos veces al día, durante tres semanas, y se recomendó una dieta blanda durante cuatro semanas. Se debía tomar ibuprofeno de 400 mg (o paracetamol de 1 g) en caso de dolor.
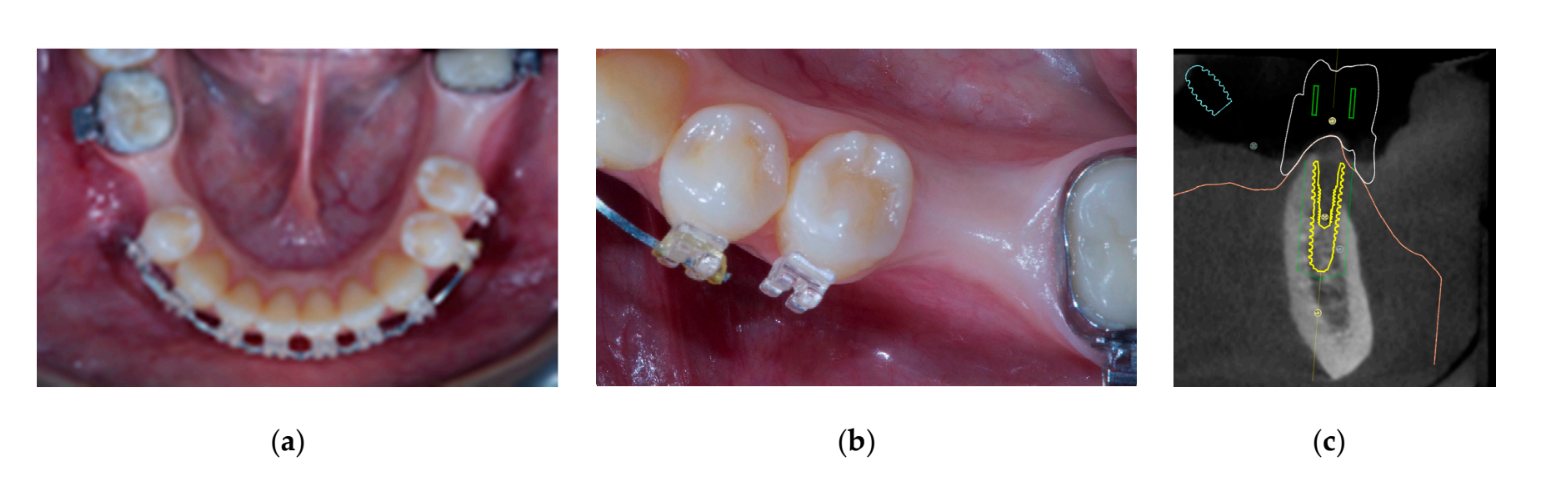
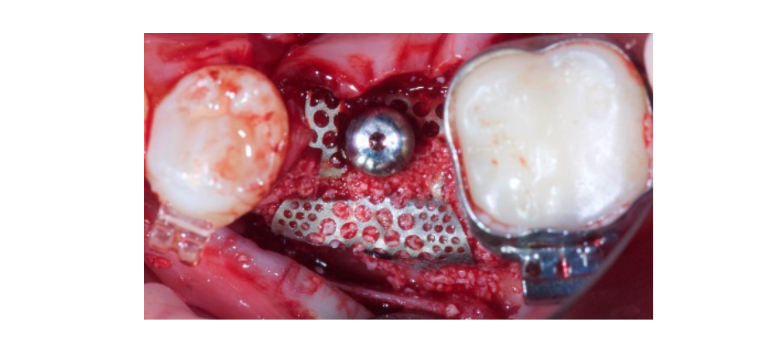
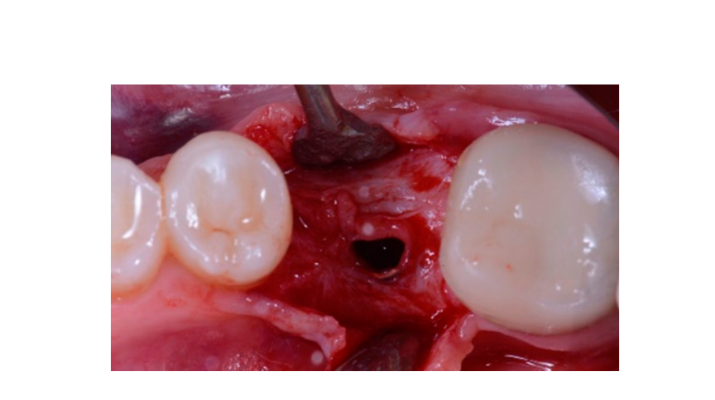
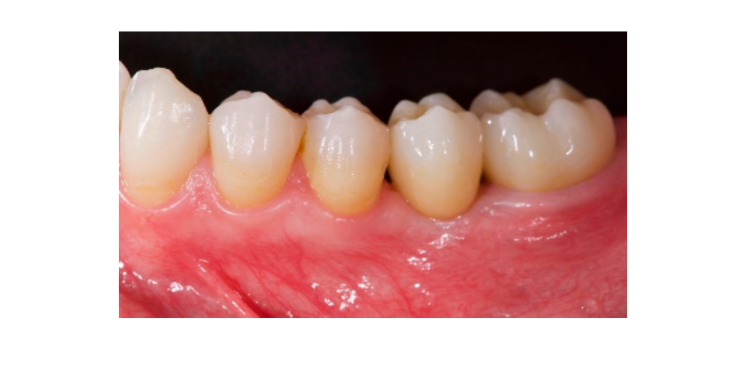
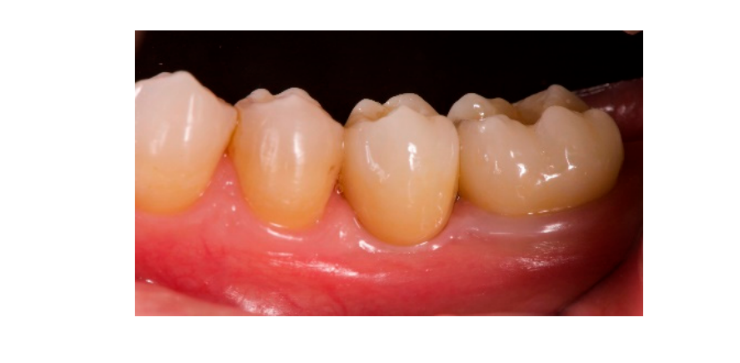
Siete a ocho meses después de la colocación del implante, el paciente se sometió a una segunda tomografía computarizada de haz cónico (CBCT) para evaluar la reconstrucción ósea. La CBCT se configuró con un campo de visión de 60 mm × 80 mm; tamaño de voxel de 0.3 µm; 90 kV; 4–6.3 mA durante 2.3 s, resultando en un producto de dosis-área de 192.4–307.8 (mGycm2). Luego, se realizó un procedimiento quirúrgico de segunda etapa, asegurándose de preservar el tejido queratinizado alrededor del implante dental. La malla de titanio ultra-fina fue cuidadosamente retirada y se atornilló un pilar de cicatrización al fixture (Figura 4). Luego, se adaptó una membrana de fibrina rica en plaquetas (PRF) sobre el hueso reconstruido y el colgajo se llevó coronariamente y se suturó. Dos semanas después, se proporcionó una restauración provisional. Tres a cuatro meses después, se entregó una restauración de zirconia retenida por tornillo CAD/CAM (Figuras 5 y 6). Se ajustó la oclusión para evitar contactos prematuros. Se tomaron radiografías periapicales y fotografías clínicas. Se programaron visitas de seguimiento cada tres meses después de la colocación del implante (Figuras 7 y 8).
Medidas de Resultados Incluidas:
- Tasa de supervivencia del implante: un implante se consideró fallido si presentaba alguna movilidad, fractura del implante o una infección que requería la extracción del implante.
- Una restauración se consideró fallida si necesitaba ser reemplazada por una restauración alternativa.
- Presencia de complicaciones biológicas (dolor, hinchazón, supuración, etc.) o mecánicas (aflojamiento del tornillo o fractura del armazón y/o del material de recubrimiento, etc.).
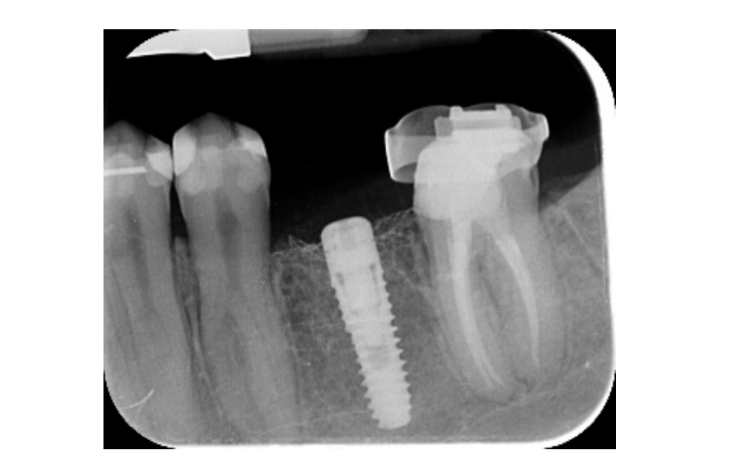
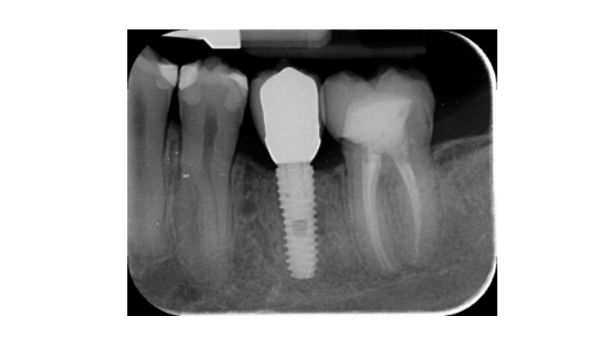
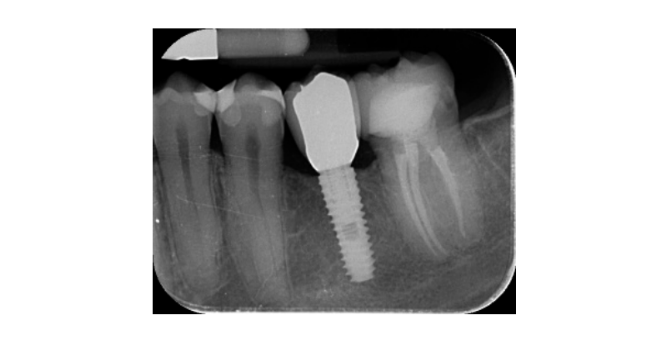
- Los cambios en el nivel óseo marginal se evaluaron mediante radiografías periapicales digitales (Digora Optime; Soredex, Tuusula, Finlandia) utilizando la técnica paralela y soportes de película disponibles comercialmente. Se evaluaron tres puntos en el tiempo, en la colocación del implante (línea base), inmediatamente después de la inserción de la restauración y un año después de la carga. Las distancias mesial y distal promediadas desde el margen más coronal del implante y el primer contacto hueso-implante se midieron a la décima más cercana de 0.01 mm y se tomaron como el nivel óseo marginal. La diferencia en los niveles entre los puntos en el tiempo se tomó como pérdida ósea marginal (MBL).
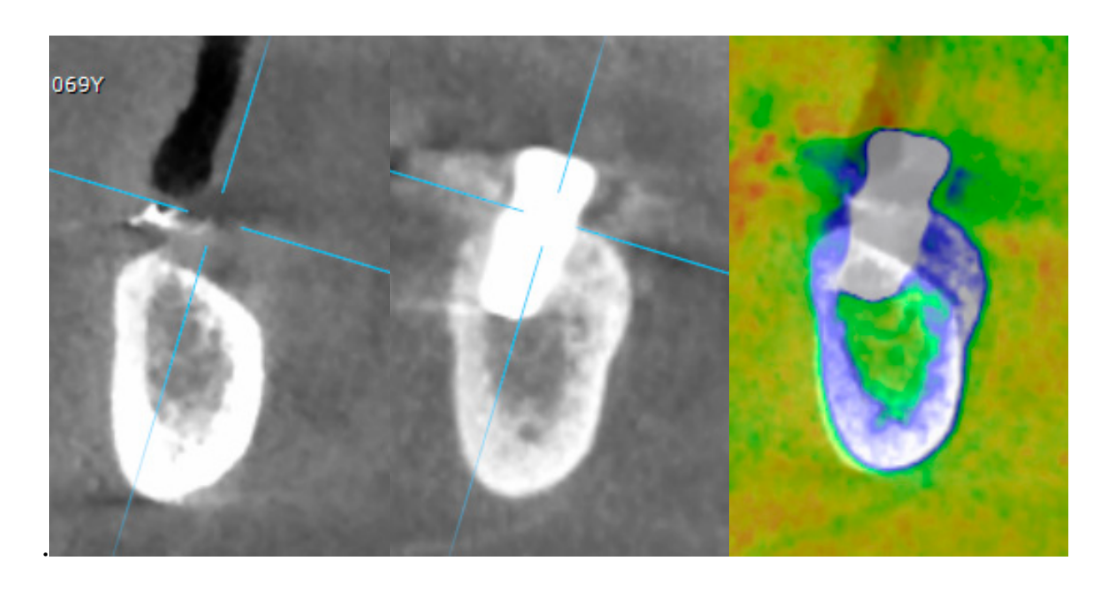
- La augmentación ósea horizontal se evaluó en las tomografías CBCT, 1 mm por debajo de la cresta ósea original. Los datos volumétricos se superpusieron utilizando los dientes adyacentes como puntos de referencia, y un nuevo conjunto de datos DICOM generado se almacenó como archivos separados. Se tomaron medidas antes y después del tratamiento, y la diferencia de estas dos mediciones se tomó como augmentación ósea horizontal (Figura 9).
- Las mediciones volumétricas del hueso reconstruido se realizaron automáticamente en el conjunto de datos volumétricos CBCT fusionados, utilizando el módulo Fusion del software OnDemand 3D (Cybermed Inc., Seúl, Corea), de acuerdo a un protocolo publicado previamente [8].
- La evaluación estética se realizó de acuerdo con el puntaje estético rosa (PES) en las imágenes vestibulares y oclusales tomadas incluyendo al menos un diente adyacente por lado. Los valores se evaluaron a los 6 y 12 meses después de las exámenes de seguimiento de carga (seguimiento de 18 meses). Se evaluaron siete variables (pápila mesial, pápila distal, nivel de tejido blando, contorno de tejido blando, deficiencia del proceso alveolar, color y textura del tejido blando) con un puntaje de 2-1-0 (2 siendo el mejor y 0 siendo el peor) por el mismo dentista ciego.
Las tasas quirúrgicas de implantes y prótesis y las complicaciones fueron evaluadas por los mismos clínicos que realizaron todos los casos (MT). La pérdida ósea marginal y el puntaje estético rosa fueron evaluados por un evaluador independiente no involucrado previamente en el estudio (MM). Se realizó un análisis descriptivo para la media ± desviación estándar (DE), mediana y el intervalo de confianza (IC) del 95% utilizando Numbers (Versión 5.2) para Mac OS High Sierra 10.X. Las comparaciones entre seguimientos se realizaron mediante una prueba t de Student pareada utilizando SPSS (Versión 22.0; IBM Corporation, Armonk, NY, EE. UU.) para Mac OS High Sierra 10.X. Todas las comparaciones estadísticas se llevaron a cabo a un nivel de significancia de 0.05. La unidad estadística fue el implante.
Resultados
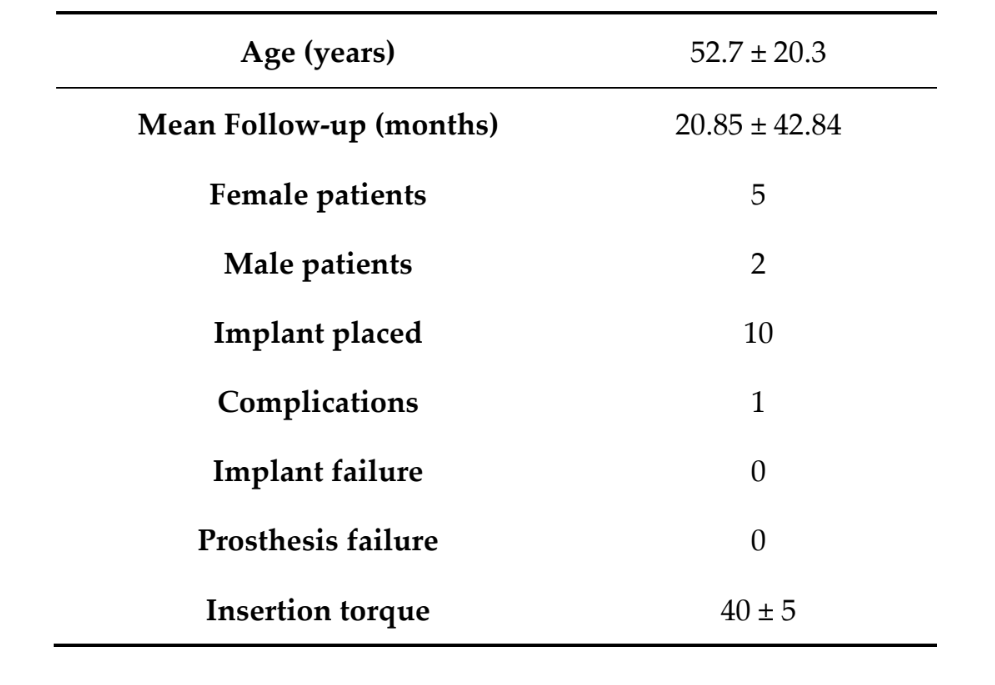
En total, siete pacientes (cinco mujeres, dos hombres) con una edad media de 52.7 ± 20.3 años (rango: 27–71) recibieron 10 implantes TSIII autoperforantes y cónicos (Osstem Implant) y regeneración ósea guiada simultánea con membranas de malla de titanio ultrafinas (OssBuilder; Osstem Implant). 18 meses después de la carga, ningún paciente abandonó el estudio y no hubo desviaciones del protocolo original. El tiempo medio de seguimiento fue de 20.85 ± 42.84 meses después de la colocación del implante (rango: 18–24 meses). Todos los implantes se insertaron con torques entre 35 y 45 N·cm utilizando un enfoque guiado por plantilla basado en computadora (Tabla 1).
No se produjeron fallos de implantes ni de prótesis durante el período de seguimiento. Se observó una ligera exposición de la membrana un mes después de la colocación del implante en un paciente. Se instruyó a los pacientes a cepillar cuidadosamente la membrana con un cepillo de dientes suave y a aplicar spray de clorhexidina dos veces al día. Se observó una curación completa de los tejidos blandos cuatro semanas después.
Todos los implantes se colocaron a nivel óseo o 1 mm más profundo. La pérdida media de hueso marginal al cargar el implante fue de 0.13 ± 0.09 mm (IC del 95% 0.08–0.19). En el examen de seguimiento a los 18 meses, la pérdida media de hueso marginal fue de 0.28 ± 0.33 mm (IC del 95% 0.07–0.50). La diferencia no fue estadísticamente significativa (0.15 ± 0.31; IC del 95% 0.05–0.35; P = 0.1888) (Tabla 2).

El ancho medio del reborde alveolar horizontal fue de 3.72 ± 1.08 mm (IC 95% 3.22–4.22 mm). En la cirugía de II etapa, el ancho medio del hueso fue de 8.79 ± 0.98 mm (IC 95% 8.51–9.07 mm). La ganancia media de hueso fue de 5.06 ± 1.13 mm (IC 95% 4.68–5.44 mm; P = 0.000). El volumen medio del hueso injertado calculado utilizando la técnica de superposición fue de 0.99 ± 0.38 CC (IC 95% 0.75–1.23 CC).
El PES medio al cargar el implante fue de 8.2 ± 0.8 mm (IC 95% 7.7–8.7). En el examen de seguimiento a los 18 meses, el PES medio fue de 12.0 ± 0.7 mm (IC 95% 11.5–12.5). La diferencia fue estadísticamente significativa (3.8 ± 0.4; IC 95% 3.5–4.1; P = 0.0000) (Tabla 2).
Discusión
La presente investigación se llevó a cabo para evaluar datos clínicos y radiológicos, un año después de la carga, de una regeneración ósea guiada utilizando una membrana de malla de titanio ultrafina con colocación simultánea de implantes, para proporcionar un efecto de andamiaje (mantenimiento del espacio) que es necesario para permitir la reconstrucción ósea de defectos óseos crestales. Dado que esta investigación se diseñó como un estudio de serie de casos prospectivo, su limitación principal es la falta de un grupo de control. La principal limitación del presente estudio fue el pequeño tamaño de la muestra. Sin embargo, esta investigación se diseñó como un estudio de serie de casos prospectivo. Esta limitación podría resolverse realizando ensayos adicionales con tamaños de muestra más grandes, que podrían calcularse en función de los resultados preliminares del presente estudio. Otra limitación de este estudio, que podría ser un factor de confusión, fue que no se consideró el biotipo gingival. Sin embargo, los resultados del presente estudio estaban de acuerdo con informes publicados anteriormente. De hecho, varios investigadores apoyaron las propiedades mecánicas ideales de la malla de Ti en términos de rigidez, plasticidad y elasticidad. Además, la malla de Ti parece ser menos susceptible a la contaminación bacteriana, en comparación con materiales reabsorbibles. Para subrayar este concepto, los autores observaron solo una leve exposición de la membrana un mes después de la colocación del implante. Se instruyó a los pacientes para que cepillaran cuidadosamente la membrana con un cepillo de dientes suave y aplicaran spray de clorhexidina dos veces al día. La curación completa de los tejidos blandos se observó cuatro semanas después. Esta complicación menor sugiere la efectividad de esta malla de titanio. Además, en este estudio prospectivo no fallaron implantes ni prótesis durante el período de seguimiento. Gracias a estos datos, es razonable considerar este procedimiento seguro y fácil para el clínico. Varias características de las membranas de barrera son necesarias para una reconstrucción ósea guiada exitosa, como la manejabilidad clínica, biocompatibilidad, capacidad para la creación de espacio, exclusión celular e integración tisular. Las mallas de Ti son membranas no reabsorbibles, y su porosidad puede variar para lograr compatibilidad tisular. En el presente estudio, se utilizó una membrana de titanio puro de grado 2 ultrafina. El grosor de la malla de titanio fue de 100 µm, mientras que la porosidad fue de 0.6 a 1 mm de diámetro. Los poros de 1 mm de diámetro pueden proporcionar un suministro sanguíneo óptimo y difusión de factores de crecimiento, necesarios para promover la curación y regeneración ósea. Sin embargo, los poros de 0.6 mm de diámetro pueden prevenir el desplazamiento o migración del material de injerto óseo mientras permiten la difusión del suministro sanguíneo. Además, estas membranas presentaron algunas perforaciones laterales que deberían ser capaces de mantener una alta resistencia mecánica, al tiempo que permiten flexibilidad para dar forma y modificación.
No obstante, la exposición de membranas y la infección son relativamente comunes. En contraste con la membrana de PTFE, que es relativamente gruesa, aproximadamente 200 µm, y susceptible a la captura bacteriana debido a su estructura porosa, el titanio puede fabricarse en una forma más delgada.
Recientemente, se sabe que los patrones de superficie ultrafinos asociados con poros, canales y otras características en los bioscaffolds influyen en la migración, proliferación y diferenciación celular. Por lo tanto, la tecnología de procesamiento por láser es favorable para crear una variedad de patrones de superficie ultrafinos.
Para obtener una buena y predecible regeneración ósea, el injerto óseo debe incluir tres características:
(1) Células osteoblásticas o células madre mesenquimatosas; (2) Factores de crecimiento, para asegurar el progreso de la regeneración; y (3) Un 'esqueleto' capaz de ofrecer soporte mecánico para la adherencia y proliferación celular.
Los autores hipotetizaron que esta estructura ultrafina, utilizada en este estudio prospectivo, permite minimizar el crecimiento de tejido blando en la microperforación y mantiene la permeabilidad de nutrientes o fluidos tisulares a través de la membrana, lo que promovería la adherencia, migración y proliferación de células derivadas de la médula ósea, resultando en una mayor regeneración ósea.
Durante la última década, estudios a largo plazo han evaluado y subrayado que la GBR es una técnica exitosa y predecible para que el clínico obtenga aumento vertical y horizontal del reborde. La GBR se puede lograr con dos enfoques diferentes: la aplicación de una membrana de politetrafluoroetileno (PTFE) reforzada con titanio (es decir, una membrana no reabsorbible) y una malla de titanio ultrafina o una membrana de colágeno (es decir, una membrana reabsorbible). Los implantes se colocaron utilizando un enfoque asistido por plantilla guiada por computadora, al nivel del hueso o 1 mm más profundo, de acuerdo con el protocolo de perforación sugerido por el fabricante. En nuestra opinión, este enfoque guiado permite una mejor instalación del implante impulsada prostéticamente y permite la regeneración ósea de acuerdo con la prótesis necesaria.
Los resultados del presente estudio están en concordancia con la literatura reciente publicada sobre implantes colocados después o durante el procedimiento de GBR.
Conclusiones
Con la limitación del presente estudio prospectivo, la reconstrucción ósea guiada utilizando una membrana de malla de titanio ultrafina con colocación simultánea de implantes, para proporcionar el mantenimiento del espacio necesario para el aumento óseo de defectos óseos alveolares parece proporcionar éxito en implantes/prótesis. Se necesita más investigación con un tamaño de muestra mayor y un seguimiento más prolongado para confirmar estos resultados preliminares.
Marco Tallarico, Francesco Mattia Ceruso, Leonardo Muzzi, Silvio Mario Meloni, Yong-Jin Kim, Marco Gargari y Matteo Martinolli
Referencias
- Atwood, D.A. Reducción de crestas residuales: una entidad de enfermedad oral mayor. J. Prosthet. Dent. 1971, 26, 266–279.
- Chiapasco, M.; Casentini, P.; Zaniboni, M. Procedimientos de aumento óseo en odontología implantológica. Int. J. Oral Implant. 2009, 24, 237–259.
- Rakhmatia, Y.D.; Jinno, Y.; Furuhashi, A.; Koyano, K.; Ayukawa, Y. Análisis de microtomografía computarizada de la curación ósea en etapa temprana utilizando malla de titanio microporosa para regeneración ósea guiada: experimento preliminar en un modelo canino. Odontology 2017, 8, 25–417.
- Meloni, S.M.; Jovanovic, S.A.; Pisano, M.; De Riu, G.; Baldoni, E.; Tallarico, M. Regeneración ósea guiada horizontal de un solo paso con hueso autólogo, hueso bovino anorgánico y membranas de colágeno: Seguimiento de un estudio prospectivo 30 meses después de la carga. Eur. J. Oral Implantol. 2018, 11, 89–95.
- Becker, W.; Becker, B.; Mellonig, J. Un estudio multicéntrico prospectivo que evalúa la regeneración periodontal para invasiones de furcación de clase II y defectos infrabónicos después del tratamiento con una membrana de barrera bioabsorbible: resultados a 1 año. J. Periodontol. 1996, 67, 641–649.
- Zitzmann, N.U.; Naef, R.; Scharer, P. Membranas reabsorbibles versus no reabsorbibles en combinación con Bio-Oss para regeneración ósea guiada. Int. J. Oral Maxillofac. Implants 1997, 12, 844–852.
- Merli, M.; Moscatelli, M.; Mariotti, G.; Rotundo, R.; Bernardelli, F.; Nieri, M. Variación del nivel óseo después de un aumento de cresta vertical: barreras reabsorbibles versus barreras reforzadas con titanio. Un ensayo clínico aleatorizado doble ciego de 6 años. Int. J. Oral Maxillofac. Implants 2014, 29, 905–913.
- Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Canullo, L.; Pisano, M.; Tallarico, M. Aumento de cresta horizontal utilizando GBR con una membrana de colágeno nativo y una relación de 1:1 de xenoinjerto particulado y hueso autólogo: Un estudio clínico prospectivo de 1 año. Clin. Implant Dent. Relat. Res. 2017, 19, 38–45.
- Sottosanti, J.S. Sulfato de calcio: una valiosa adición al complejo de regeneración de implantes/hueso. Dent. Implant. Updat. 1997, 8, 25–29.
- Roccuzzo, M.; Ramieri, G.; Spada, M.C.; Bianchi, S.D.; Berrone, S. Aumento vertical de la cresta alveolar mediante una malla de titanio y injertos óseos autógenos. Clin. Oral Implant. 2004, 15, 73–81.
- Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Membranas de barrera actuales: malla de titanio y otras membranas para regeneración ósea guiada en aplicaciones dentales. J. Prosthodont. 2013, 57, 3–14.
- Tallarico, M.; Martinolli, M.; Kim, Y.; Cocchi, F.; Meloni, S.M.; Alushi, A.; Xhanari, E. Precisión de la colocación de implantes asistida por computadora utilizando dos plantillas quirúrgicas diferentes diseñadas con o sin mangas metálicas: un ensayo controlado aleatorizado. Dent. J. 2019, 7, 41.
- Tallarico, M.; Kim, Y.J.; Cocchi, F.; Martinolli, M.; Meloni, S.M. Precisión de las plantillas diseñadas con mangas recién desarrolladas para la inserción de implantes dentales: un ensayo clínico multicéntrico prospectivo. Clin. Implant Dent. Relat. Res. 2019, 21, 108–113.
- Fürhauser, R.; Florescu, D.; Benesch, T.; Haas, R.; Mailath, G.; Watzek, G. Evaluación de los tejidos blandos alrededor de coronas de implantes de un solo diente: el puntaje estético rosa. Clin. Oral Implant. 2005, 16, 639–644.
- Ciocca, L.; Lizio, G.; Baldissara, P.; Sambuco, A.; Scotti, R.; Corinadesi, G. Aumento óseo guiado por CAD-CAM protésicamente de mandíbulas atróficas utilizando malla de titanio personalizada: Resultados preliminares de un estudio prospectivo abierto. J. Oral Implant. 2018, 44, 131–137.
- Schopper, C.H.; Goriwoda, W.; Moser, D. Resultados a largo plazo después de la regeneración ósea guiada con membranas de titanio reabsorbibles y microporosas. J. Oral Maxillofac. Surg. Clin. North Am. 2001, 13, 449–458.
- Scantlebury, T.V. 1982-1992: una década de desarrollo tecnológico para la regeneración de tejidos guiada. J. Periodontol. 1993, 64, 1129–1137.
- A Fugazzotto, P. Tasas de éxito y fracaso de implantes oseointegrados en función en hueso regenerado durante 72 a 133 meses. Int. J. Oral Implant. 2005, 20, 77–83.
- Kim, Y.-K.; Yun, P.-Y.; Kim, S.-G.; Oh, D.S. Comparación in vitro mediante microscopía electrónica de barrido de la superficie interna de membranas no reabsorbibles expuestas y no expuestas. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2009, 107, e5–e11.
- Watzinger, F.; Luksch, J.; Millesi, W.; Schopper, C.; Neugebauer, J.; Moser, D.; Ewers, R. Regeneración ósea guiada con membranas de titanio: un estudio clínico. Br. J. Oral Surg. 2000, 38, 312–315.
- Selvig, K.A.; Kersten, B.G.; Chamberlain, A.D.H.; Wikesjö, U.M.E.; Nilvúus, R.E. Cirugía regenerativa de defectos periodontales intrabónicos utilizando membranas de barrera ePTFE: Evaluación mediante microscopía electrónica de barrido de membranas recuperadas versus curación clínica. J. Periodontol. 1992, 63, 974–978.
- Hasegawa, H.; Masui, S.; Ishihata, H.; Kaneko, T.; Ishida, D.; Endo, M.; Kanno, C.; Yamazaki, M.; Kitabatake, T.; Utsunomiya, S.; et al. Evaluación de una membrana de titanio puro microperforada de nuevo diseño para la regeneración ósea guiada. Int. J. Oral Maxillofac. Implants 2019, 34, 411–422.
- Roberts, E.W.; E Simmons, K.; Garetto, L.P.; A DeCastro, R. Fisiología y metabolismo óseo en implantología dental: factores de riesgo para osteoporosis y otras enfermedades óseas metabólicas. Implant. Dent. 1992, 1, 11–21.
- Wessing, B.; Urban, I.; Montero, E.; Zechner, W.; Hof, M.; Chamorro, J.A.; Martin N.A.; Polizzi, G.; Meloni, S.; Sanz, M. Un ensayo clínico controlado aleatorizado multicéntrico utilizando una nueva membrana de colágeno no entrecruzada reabsorbible para la regeneración ósea guiada en sitios de implantes únicos dehiscentes: resultados intermedios de un procedimiento de aumento óseo. Clin. Oral Implants Res. 2017, 28, e218–e226, doi: 10.1111/clr.12995.
- Urban, I.; Wessing, B.; Alández, N.; Meloni, S.; González-Martin, O.; Polizzi, G.; Sanz-Sanchez, I.; Montero, E.; Zechner, W. Un ensayo clínico controlado aleatorizado multicéntrico utilizando una nueva membrana de colágeno para la regeneración ósea guiada en sitios de implantes únicos dehiscentes: Resultado en la entrega protésica y en el seguimiento a 1 año. Clin. Oral Implants Res. 2019, doi: 10.1111/clr.13426.