Corrección de la Dehiscencia Ósea Bucal Peri-Implantar Tras la Técnica de Capa Aumentada Subperióstica con Injerto Xenógeno en Bloque o Particulado: Un Estudio Retrospectivo
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivo: Evaluar la efectividad de la técnica de Capa Aumentada Subperióstica Peri-implante (SPAL) realizada con mineral óseo bovino desproteinizado (DBBM), administrado ya sea como particulado (pDBBM) o bloque (bDBBM), en la corrección de una dehiscencia ósea peri-implante (PIBD). También se examinaron implantes que mostraban una placa ósea bucal peri-implante (PBBP) gruesa (≥ 2 mm) en el momento de la colocación.
Material y Métodos: Se incluyeron pacientes con una PIBD ≥ 1 mm, tratados con SPAL con pDBBM (SPALparticulado) o bDBBM (SPALbloque), y pacientes con un implante que mostraba una PBBP ≥ 2 mm en la inserción (CONTROL). La reentrada se realizó ya sea a los 6 meses (grupos SPAL) o a los 3 meses (CONTROL). La tasa de pacientes que no presentaron PIBD en la reentrada fue el resultado primario. La altura de la dehiscencia ósea (BDH) y el ancho (BDW), el grosor de los tejidos bucales (BTT) y el nivel óseo marginal (MBL) fueron resultados secundarios.
Resultados: Se analizaron treinta y nueve implantes en 39 pacientes (14 en SPALparticulado, 14 en SPALbloque y 11 en CONTROL). No se encontraron PIBD en SPALparticulado, mientras que en SPALbloque se presentó una PIBD. Dos pacientes en CONTROL presentaron una PIBD. Se observó una reducción tanto en BDH como en BDW en ambos SPALparticulado (2.7 ± 1.6 mm para BDH y 3.9 ± 0.2 mm para BDW) y SPALbloque (2.5 ± 1.8 mm para BDH y 3.8 ± 1.1 mm para BDW). SPALbloque mostró un BTT más alto que SPALparticulado en la reentrada (3.6 ± 1.3 mm para SPALbloque y 2.6 ± 0.6 mm para SPALparticulado, p = 0.0160). Todos los grupos mostraron un MBL similar.
Introducción
La colocación de implantes impulsada por prótesis en una dimensión ósea horizontal reducida a menudo resulta en una dehiscencia ósea peri-implantar (PIBD) (Bressan et al. 2017; Pramstraller et al. 2018).
Los pequeños defectos de dehiscencia ósea dejados para la curación espontánea revelaron una mayor pérdida ósea vertical en el aspecto bucal después de la inserción del implante y también una mayor pérdida ósea marginal en comparación con los sitios tratados con GBR (Jung et al. 2017; Monje et al. 2023). Aunque los implantes con pequeñas dehiscencias óseas bucales no contenidas mostraron altas tasas de supervivencia de implantes y tejidos peri-implantares saludables en un seguimiento de 7.5 años (Waller et al. 2020), la presencia de una PIBD evidente se asoció con una mayor incidencia de mucositis y peri-implantitis, así como una progresión más rápida de la peri-implantitis en comparación con los implantes completamente rodeados de hueso (Schwarz, Sahm y Becker 2012; Monje et al. 2019). A pesar de que el valor pronóstico de una PIBD sobre la salud de los tejidos peri-implantares a largo plazo sigue siendo controvertido, la corrección de una dehiscencia ósea bucal en la colocación del implante ha sido recientemente recomendada para favorecer la estabilidad y las condiciones saludables de los tejidos peri-implantares a lo largo del tiempo (Herrera, et al. 2023; Monje et al. 2023; Song et al. 2024).
Para tratar un PIBD, se propusieron procedimientos de aumento de tejido óseo o blando. Ambos tratamientos mostraron proporcionar resultados clínicos y radiográficos estables a medio y largo plazo (Jensen et al. 2023; Monje et al. 2023). Entre los diferentes procedimientos de aumento óseo lateral en la colocación simultánea de implantes, la Regeneración Ósea Guiada (GBR) y la técnica de Capa Aumentada Subperióstica Peri-implante (SPAL, Trombelli et al. 2018) se han asociado con una alta probabilidad de corregir completamente un PIBD (Severi et al. 2022). En particular, SPAL se basa en el uso del periostio del paciente como una membrana de barrera para contener un injerto que actúa como un andamio de "creación de espacio". Cuando se realiza en combinación con un injerto particulado de mineral óseo bovino desproteinizado (DBBM), se demostró que SPAL es efectivo para corregir completamente hasta el 90.9% de los PIBDs (Trombelli et al. 2019, 2020). Un estudio retrospectivo reciente comparó las condiciones de tejidos duros y blandos peri-implantarios en implantes que presentaban un PIBD tratado con SPAL o un PBBP grueso (≥ 2 mm) en la colocación del implante (Trombelli et al. 2020). Aunque se encontraron condiciones saludables similares de los tejidos peri-implantarios en ambos grupos, se encontró una posición más apical del nivel óseo marginal radiográfico (MBL) en el grupo SPAL, sugiriendo un patrón de remodelación diferente del injerto en comparación con el hueso nativo (Trombelli et al. 2020). Estos hallazgos pueden cuestionar la relevancia de las características físico-químicas del injerto con respecto a la estabilidad del resultado reconstructivo tras SPAL. En este sentido, un informe anecdótico sugirió que el uso de un bloque de DBBM (bDBBM) puede ser una alternativa exitosa en combinación con SPAL (Trombelli et al. 2022).
Por lo tanto, el objetivo del presente estudio retrospectivo fue evaluar la efectividad de la SPAL realizada en combinación con pDBBM o bDBBM para corregir un PIBD. Además, se analizaron los cambios en el tejido duro peri-implantario que ocurrieron desde la colocación del implante hasta la reentrada para la exposición del implante. También se examinó un grupo de control que comprendía implantes que mostraban un PBBP grueso (≥ 2 mm) en la colocación del implante.
Materiales y Métodos
2.1 Aspectos Éticos
El presente estudio retrospectivo fue aprobado por el Comité Ético del Área Vasta Emilia Centro, Italia (protocolo n° 523/2024/Oss/UniFe, fecha de aprobación 16.10.2024). Cada paciente proporcionó un consentimiento informado por escrito antes del tratamiento quirúrgico.
Todos los procedimientos clínicos se han realizado de acuerdo con la Declaración de Helsinki y las Buenas Prácticas Clínicas (BPC).
2.2 Población del Estudio
Se revisaron las historias clínicas de pacientes que se sometieron a rehabilitación protésica soportada por implantes en el período de mayo de 2020 a septiembre de 2021 en el Centro de Investigación para el Estudio de Enfermedades Periodontales y Peri-implantarias, Universidad de Ferrara, y en una clínica dental privada ubicada en Ferrara para determinar la elegibilidad de los pacientes para el estudio. El presente estudio retrospectivo se llevó a cabo siguiendo las pautas/lista de verificación de la declaración STROBE para estudios transversales.
Basado en las condiciones de la placa ósea bucal en el momento de la colocación del implante y la gestión quirúrgica, los pacientes se categorizaron en 2 grupos:
- Pacientes con al menos un implante que presentaba un PIBD ≥ 1 mm, tratados con SPAL en combinación con pDBBM (grupo SPALparticulado );
- Pacientes con al menos un implante que presentaba un PIBD ≥ 1 mm, tratados con SPAL en combinación con bDBBM (grupo SPALbloque ).
Los grupos SPAL estaban compuestos por pacientes tratados de manera consecutiva donde se pudieron recuperar mediciones clínicas y radiográficas pertinentes para el análisis de datos. Si dos o más implantes en el mismo paciente eran elegibles para el estudio, solo se seleccionó el implante que presentaba el PIBD con la mayor dehiscencia ósea para el análisis. Además, los pacientes con al menos un implante que presentaba un grosor residual de PBBP ≥ 2 mm después de la inserción del implante se consideraron como grupo de control (grupo CONTROL).
Todos los implantes seleccionados debían ser colocados en un cresta ósea curada (implantes tipo 4C, Gallucci et al. 2018) y debían mostrar estabilidad primaria, según lo evaluado por el torque de inserción. Los fumadores empedernidos (consumo de cigarrillos > 10 cigarrillos/día) y los pacientes con diabetes mellitus en el momento de la cirugía fueron excluidos del estudio.
2.3 Procedimientos Clínicos
2.3.1 Procedimientos Preoperatorios
Antes de la colocación del implante, todos los pacientes habían recibido terapia activa para tratar lesiones cariosas y enfermedades periodontales, y habían sido inscritos en un mantenimiento profesional con una frecuencia de citas programadas de acuerdo con la herramienta de evaluación PerioRisk (Trombelli et al. 2009, 2017; Farina et al. 2021).
Todos los procedimientos quirúrgicos fueron realizados por dos operadores capacitados (L.T., M.S.). Se administraron 2 g de amoxicilina + ácido clavulánico (Augmentin, GlaxoSmithKline, Verona, Italia) 1 h antes de la cirugía. La anestesia local se logró utilizando articaína con 1:100,000 de epinefrina administrada por infiltración local.
2.3.2 Procedimientos Quirúrgicos
2.3.2.1 Grupos SPAL.
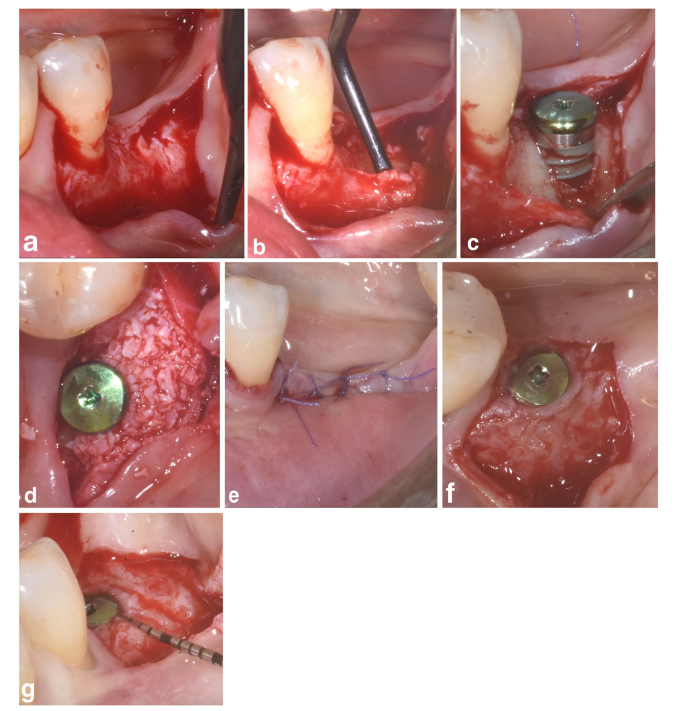
En ambos grupos SPALparticulado y SPAL-bloque, se realizó el acceso quirúrgico a la cresta ósea de acuerdo con un procedimiento previamente descrito (Trombelli et al. 2018). Brevemente, se elevó una capa mucosa en el aspecto bucal mediante disección de grosor parcial con una hoja 15C (Figuras 1a y 2a). Luego, se elevó la capa periosteal del hueso con un elevador periosteal (PTROM, Hu-Friedy, Chicago, Illinois) así como cuchillos de túnel (KPAX, TKN1X y TKN2X, Hu Friedy, Chicago, Illinois) con bordes afilados angulados variados, creando un saco subperiosteal que podría acomodar un injerto (Figuras 1b y 2b). Se elevó un colgajo de grosor total en el aspecto oral (lingual/palatino). Las fibras del músculo milohioideo se separaron del colgajo lingual utilizando un instrumento romo para permitir el avance coronal. Se realizaron perforaciones corticales con una fresa de carburo cilíndrica calibrada para aumentar el suministro de sangre al área quirúrgica (Majzoub et al. 1999; Acar et al. 2016).
Se colocaron implantes a nivel de tejido (Elemento SPI; Thommen Medical, Grenchen, Suiza) con el margen coronal del collar pulido de 1 mm al nivel de la cresta ósea (Figuras 1c y 2c).
Se utilizó un xenoinjerto de origen bovino, entregado ya sea en forma particulada (gránulos de Bio-Oss esponjosa, tamaño de partícula 0.25–1.0 mm; Geistlich Pharma, AG, Wolhusen, Suiza) (Trombelli et al. 2018) o en bloque (bloque de Bio-Oss; Geistlich Pharma, AG, Wolhusen, Suiza) (Trombelli et al. 2022), para llenar el espacio creado quirúrgicamente entre la capa periosteal y la superficie expuesta del implante. El bloque se fragmentó en piezas más pequeñas mediante una hoja 15C o un bur diamante para adaptarse a la extensión del espacio subperiosteal y alcanzar el contorno deseado de la placa bucal. Se realizó injerto para corregir completamente el PIBD hasta la cresta ósea. En todos los casos, el injerto subperiosteal proporcionó al menos 2 mm de grosor en el collar pulido del implante.
La porción coronal de la capa periosteal fue asegurada al colgajo oral mediante suturas internas de colchón reabsorbibles (Vicryl 6/0, Ethicon, Somerville NJ, EE. UU.) (Figuras 1d y 2d). Posteriormente, la capa mucosa fue avanzada coronariamente y suturada al colgajo oral mediante suturas internas de colchón horizontales y suturas interrumpidas para proporcionar una cicatrización sumergida tanto para el injerto como para el implante (Figuras 1e–2e).
En la reentrada quirúrgica a los 6 meses para la exposición del implante, se disecó un colgajo bucal de grosor parcial para posicionar el pilar de cicatrización. Con el fin de evaluar la presencia/ausencia de un PIBD residual, se evaluó la presencia de tejido duro alrededor de la superficie del implante utilizando una sonda UNC-15. Si no había penetración de la sonda más allá del collar del implante pulido, el implante se categorizó como “dehiscencia completamente corregida”.
Para proporcionar dimensiones adecuadas de la mucosa peri-implantaria queratinizada (KT), se realizó ya sea un posicionamiento apical del colgajo (APF) o un injerto gingival libre (FGG) (Trombelli et al. 2019) (Figuras 1f,g y 2f). La elección de realizar un APF o un FGG se basó en la necesidad de asegurar una altura de KT de al menos 2 mm en ambos aspectos bucal y lingual del implante.
2.3.2.2 Grupo CONTROL.
Se levantó un colgajo de grosor total bucal y lingual/palatino para exponer la cresta ósea. El sitio del implante se preparó de acuerdo con las instrucciones del fabricante y se insertaron implantes de nivel de tejido (SPI Element; Thommen Medical, Grenchen, Suiza) con el margen coronal del collar pulido de 1 mm al nivel de la cresta ósea. No se realizó ningún procedimiento de aumento óseo. En todos los casos, el colgajo se suturó utilizando suturas internas en colchón y suturas interrumpidas (Vicryl 5/0, Ethicon, Somerville NJ, EE. UU.) para proporcionar una cicatrización sumergida.
En la reentrada quirúrgica de 3 meses para el destape del implante, se elevó un colgajo de grosor total bucal para atornillar el pilar de cicatrización. Luego, el colgajo se recortó y adaptó al pilar de cicatrización para proporcionar dimensiones adecuadas de mucosa queratinizada peri-implante.
2.3.2.3 Procedimientos Postoperatorios.
Se prescribió un medicamento antiinflamatorio de rescate (es decir, tabletas de ibuprofeno de 600 mg) inmediatamente después de la cirugía, y luego pro re nata durante los siguientes días postoperatorios. Se instruyó a los pacientes que no usaran prótesis removibles para evitar la compresión en el sitio quirúrgico durante al menos 4 semanas, y que no masticaran ni cepillaran en el área tratada durante aproximadamente 2 semanas. Se prescribió el uso domiciliario de una solución de clorhexidina al 0.12% (Dentosan, Recor-dati, Milán, Italia) para el control químico de la placa (enjuague de 1 minuto b.i.d. durante 3 semanas). Las suturas se retiraron a las 2 semanas post-cirugía.
2.4 Parámetros del Estudio
2.4.1 Mediciones Clínicas
Para evaluar el efecto del tratamiento en PIBD, se recuperaron las siguientes mediciones clínicas de las historias clínicas:
- Altura de dehiscencia ósea (BDH): medida en el aspecto medio-bucal del implante como la distancia entre el margen apical del collar pulido del implante y el primer contacto hueso-implante;
- Anchura de dehiscencia ósea (BDW): medida en el aspecto bucal del implante como la porción expuesta más ancha de la superficie rugosa del implante.
En todos los grupos, BDH y BDW se habían evaluado inmediatamente después de la colocación del implante y en la reentrada para la exposición del implante.
Además, el grosor de los tejidos bucales (BTT) se había medido como la distancia entre el contorno bucal del collar pulido y el aspecto externo ya sea del área injertada (grupos SPAL) o de la cresta ósea nativa (grupo CONTROL) en el aspecto medio-bucal del implante. Se había registrado el BTT basal:
- Inmediatamente después de la colocación del implante para el grupo CONTROL;
- Inmediatamente después del injerto para ambos grupos SPAL; BTT se registró de nuevo en la reentrada quirúrgica para todos los grupos.
Todas las mediciones se realizaron utilizando una sonda periodontal UNC-15 y se redondearon al milímetro más cercano.
2.4.2 Mediciones Radiográficas
Las radiografías periapicales, tomadas con la técnica de cono largo paralelo inmediatamente después de la cirugía y en la reentrada para todos los grupos, fueron digitalizadas y analizadas utilizando un software diseñado específicamente (NIS elements v4.2; Nikon Instruments, Campi Bisenzio, Firenze, Italia). El nivel de hueso marginal (MBL) se midió como la distancia (aproximada al milímetro más cercano) entre el margen apical más bajo del collar pulido del implante y la cresta ósea en el aspecto mesial (mMBL) y distal (dMBL) de cada implante utilizando una magnificación de 10×–15×. El MBL se registró como negativo o positivo cuando el margen apical del collar pulido se encontraba ya sea apical o coronalmente a la cresta ósea, respectivamente.
Se utilizó una marca de referencia de 1 mm de altura presente en la radiografía digital para la calibración.
Dos examinadores (C.F. y M.S.) realizaron las mediciones radiográficas. Los examinadores participaron en una sesión de calibración sobre una muestra de radiografías obtenidas de pacientes no seleccionados para el presente estudio. La sesión de calibración consistió en dos sesiones de mediciones de MBL, realizadas con un intervalo de 7 días, y permitió alcanzar un excelente acuerdo inter e intra-examinador (k-score 0.87).
Análisis Estadístico
La tasa de pacientes que presentaron la superficie del implante rugosa cubierta hasta la parte apical del collar pulido (es decir, sin PIBD) en la reentrada se consideró como el resultado principal. Los valores y cambios en BDH, BDW, BTT y MBL fueron variables de resultado secundarias.
El tamaño de la muestra se calculó utilizando datos derivados de un estudio previo (Benic et al. 2019) donde la tasa de pacientes que presentaron la superficie del implante rugosa cubierta hasta el hombro del implante en la reentrada fue del 91.7% en los grupos de bloques de DBBM y del 25.0% en el grupo de partículas de DBBM, respectivamente. La prueba Z estimó que se requerían al menos 11 pacientes para cada uno de los dos grupos independientes de SPAL para lograr un poder estadístico del 95% con un error alfa de 0.05.
El paciente fue considerado como la unidad estadística. Los datos se describieron utilizando la media, la desviación estándar, la mediana, el rango intercuartílico (IR) y los valores mínimo-máximo para variables cuantitativas, y proporciones porcentuales para variables categóricas.
Las comparaciones intra-grupo para variables continuas/ordinales se realizaron utilizando la prueba de rangos con signo de Wilcoxon para datos emparejados. Las comparaciones inter-grupo para variables continuas/ordinales se realizaron utilizando ANOVA de Kruskal-Wallis. En caso de significancia en la prueba de Kruskal-Wallis, se calcularon comparaciones múltiples (post hoc) de los rangos promedio; se calcularon valores z normales para cada comparación, así como probabilidades post hoc (corregidas por el número de comparaciones) para una prueba de significancia de dos lados. Las comparaciones inter-grupo para variables binarias se realizaron utilizando pruebas de Chi-cuadrado de Máxima Verosimilitud con la corrección de Yate. El cambio en las variables de resultado secundarias se evaluó estadísticamente utilizando Modelos Lineales Generalizados (GLZ) ajustados por los confusores significativos, seguido de ANOVA para medidas repetidas para comparaciones inter-grupo y con la prueba HSD de N desiguales post hoc.
Resultados
4.1 Población del Estudio
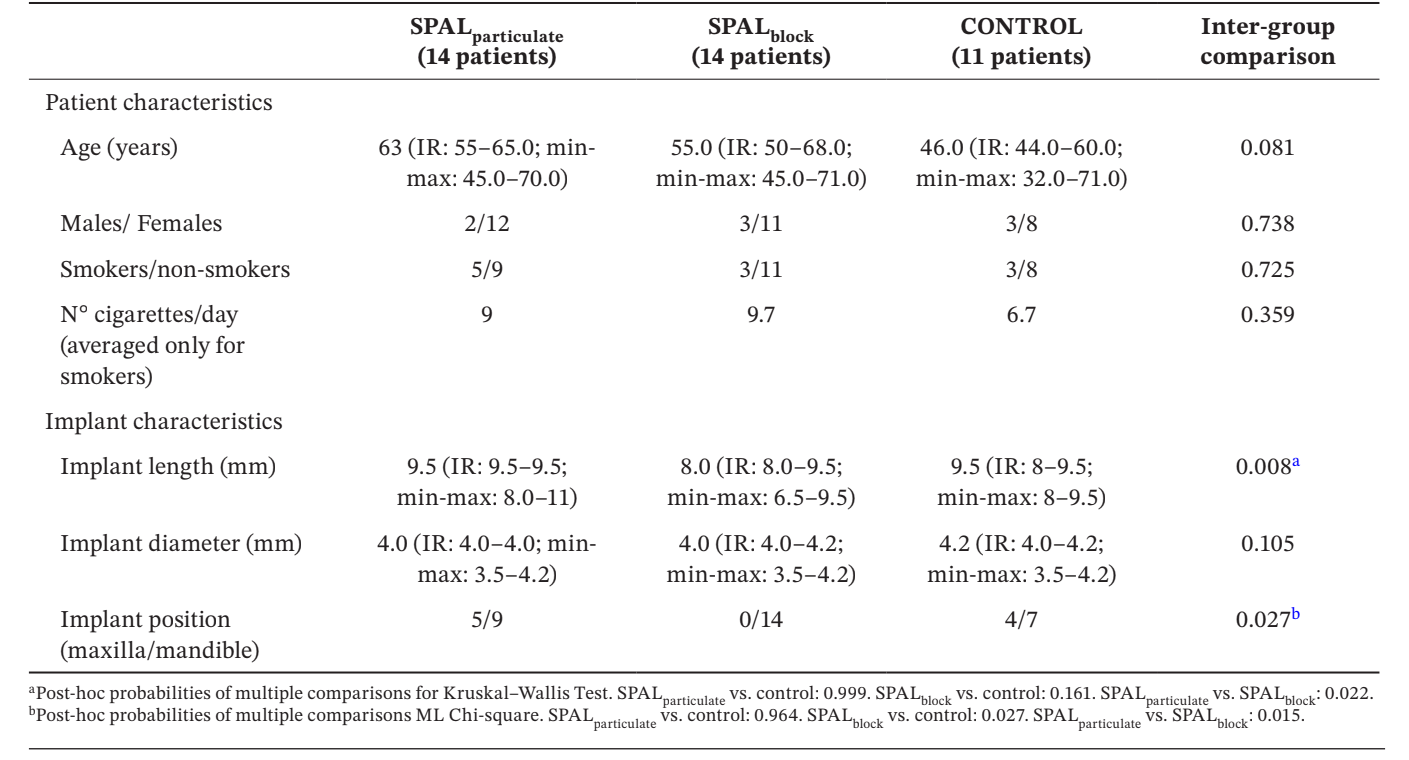
Treinta y nueve implantes en 39 pacientes (14 en el grupo SPALparticulado, 14 en el grupo SPALbloque y 11 en el grupo CONTROL) fueron seleccionados para análisis (Tabla 1). No se observaron diferencias en edad, género y estado de tabaquismo entre los grupos, siendo la gran mayoría de los pacientes no fumadores. En los grupos SPALparticulado y CONTROL, un tercio de los implantes se ubicaron en el maxilar, mientras que todos los implantes se ubicaron en la mandíbula en el grupo SPALbloque. Esta diferencia fue estadísticamente significativa (p = 0.027). Los implantes colocados en el grupo SPALbloque fueron significativamente más cortos que los colocados en ambos grupos SPALparticulado y CONTROL (p = 0.008).
4.1.1 Cicatrización Post-Operativa
En ambos grupos, SPALparticulado y CONTROL, la cicatrización temprana fue sin complicaciones en todos los pacientes.
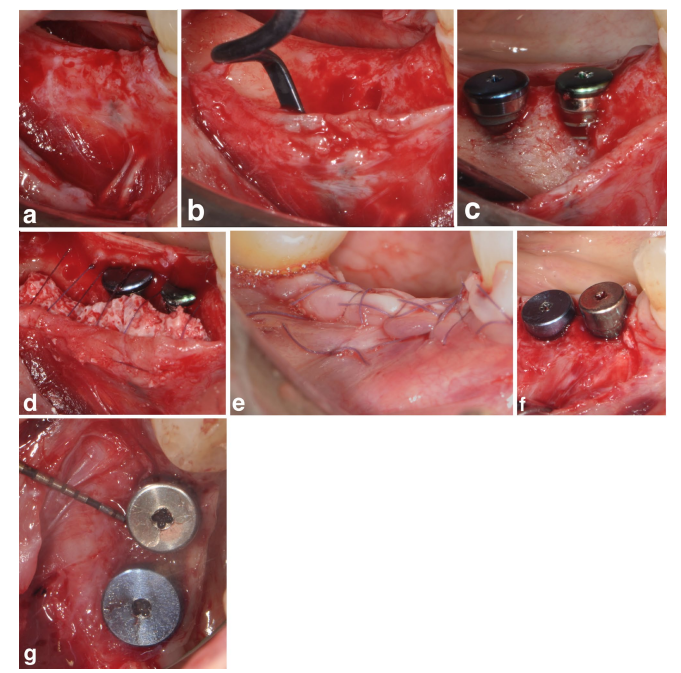
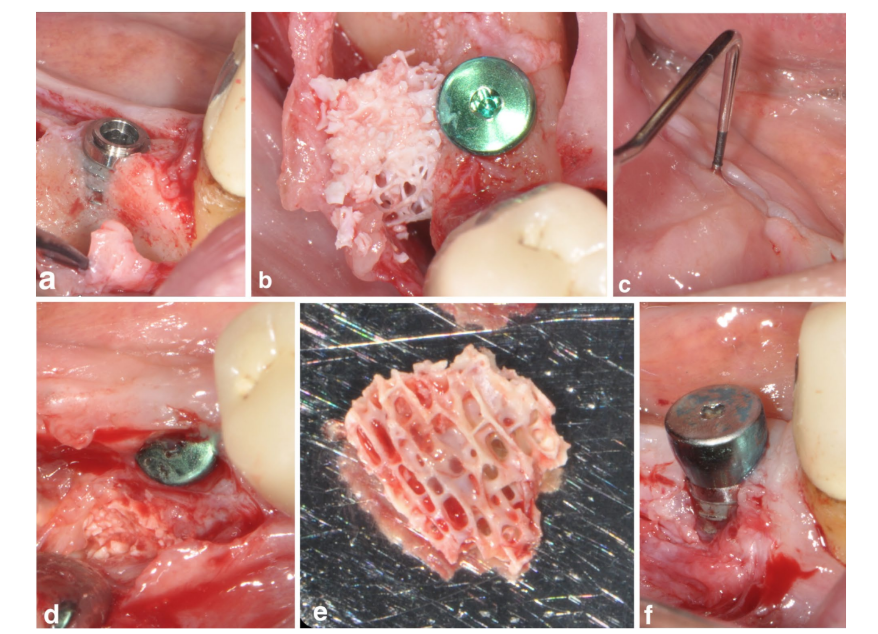
Un paciente en el grupo SPALbloque experimentó una infección post-operatoria a las 4 semanas después de la intervención quirúrgica. El paciente reportó hinchazón y dolor en el área tratada quirúrgicamente, y se evidenció una fístula drenando exudado purulento (Figura 3a–f). Después de la elevación del colgajo de grosor parcial, se encontró que el injerto de bloque de DBBM estaba incrustado en tejido de granulación y, por lo tanto, fue removido.
4.2 Resultados del Estudio
4.2.1 Resultado Primario
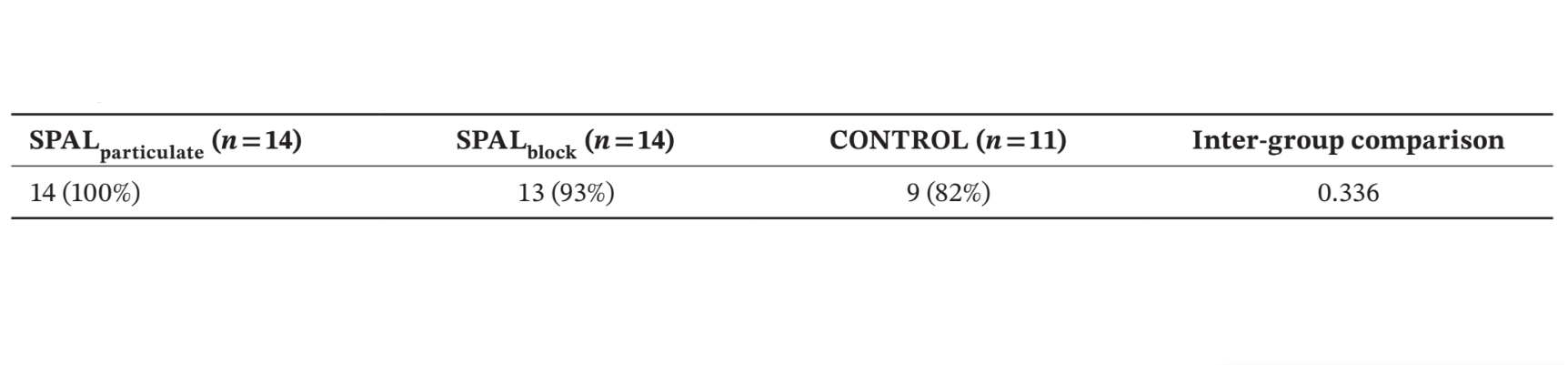
Número y % de pacientes que presentaron la superficie rugosa del implante cubierta hasta la parte apical del collar pulido en la reentrada (es decir, sin PIBD) se muestra en la Tabla 2. No se encontró defecto residual en el grupo SPALparticulado, mientras que en el grupo SPALbloque el paciente que había experimentado la infección del injerto postoperatorio presentó un PIBD residual. Dos pacientes en el grupo CONTROL presentaron un PIBD incidente en la reentrada (Tabla 2). Las diferencias entre los grupos no fueron estadísticamente significativas.
4.2.2 Resultados Secundarios
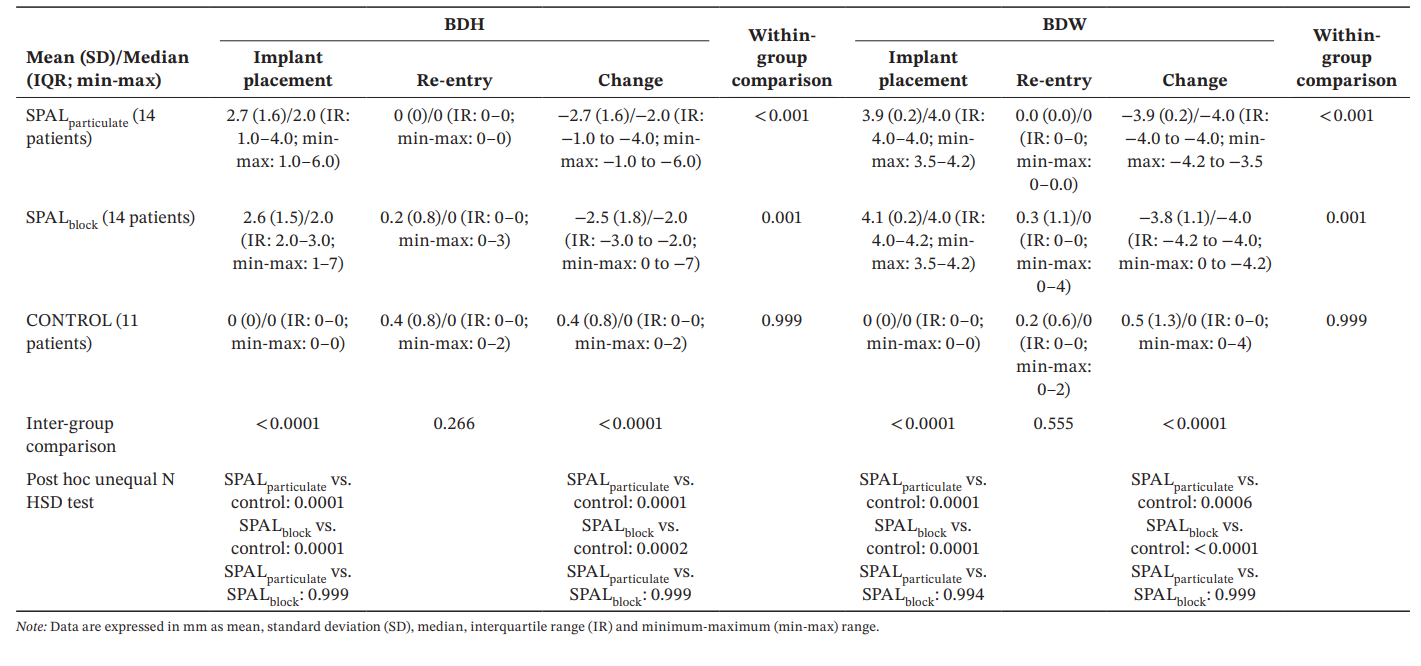
El modelo GLZ ajustado por los factores de confusión identificados (longitud y posición del implante) mostró que tanto el tratamiento como el tiempo fueron predictores significativos tanto para BDH como para BDW (tiempo, p < 0.0001 para ambos; tratamiento, p < 0.001 para ambos). Las comparaciones intra- e intergrupales para BDH y BDW se informan en la Tabla 3. La prueba de Wilcoxon para datos pareados mostró una reducción significativa en el tiempo tanto para SPALparticulate (p < 0.001 para ambos BDH y BDW) como para los grupos SPALblock (p = 0.001 para ambos BDH y BDW). En la colocación del implante, los grupos SPAL fueron significativamente diferentes del grupo CONTROL (p = 0.0001 para ambos BDH y BDW). Sin embargo, no se detectaron diferencias significativas entre los grupos en la reentrada para ambos BDH y BDW. En el grupo SPALblock el paciente con el PIBD residual mostró un BDH de 3 mm y un BDW de 4 mm. En el grupo CONTROL, los dos pacientes con un PIBD incidente en la reentrada mostraron un BDH de 2 mm y un BDW de 2 mm y un BDH de 2 mm y un BDW de 4 mm, respectivamente.
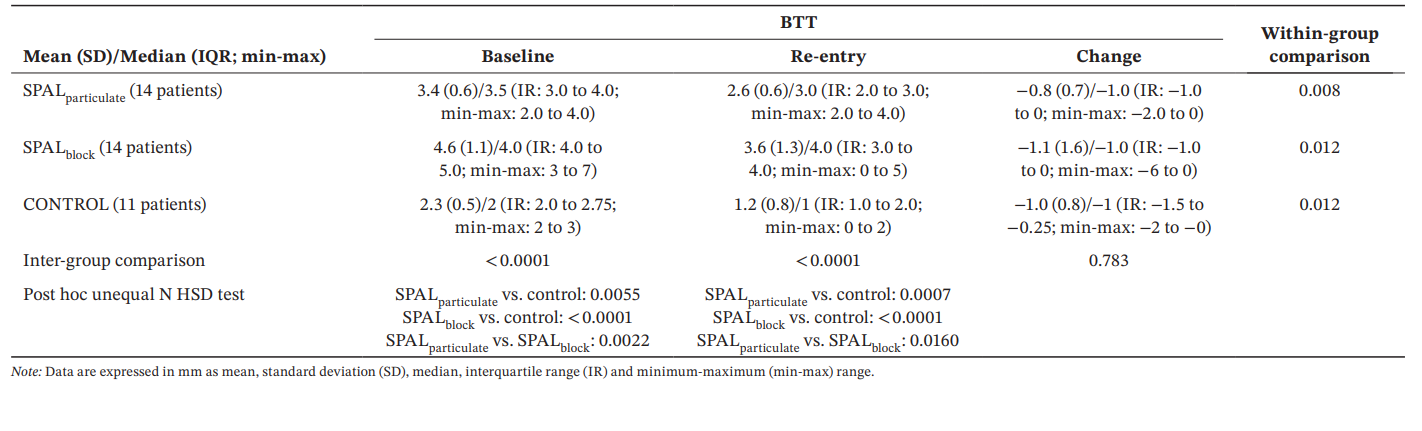
Para BTT, el modelo GLZ ajustado por los factores de confusión identificados mostró que tanto el tratamiento como el tiempo fueron predictores significativos (p < 0.0001 para ambos factores). Las comparaciones dentro y entre grupos para BDH y BDW se informan en la Tabla 4. Se observó una diferencia significativa entre los grupos tanto en la línea de base como en la reentrada (p < 0.0001). En particular, el grupo SPALblock mostró valores significativamente mayores que el grupo SPALparticulate tanto en la línea de base (p = 0.0022) como en la reentrada (p = 0.0160). Las comparaciones dentro del grupo mostraron una reducción significativa en BTT a lo largo del tiempo para todos los grupos, siendo la magnitud de esta reducción similar entre los grupos.
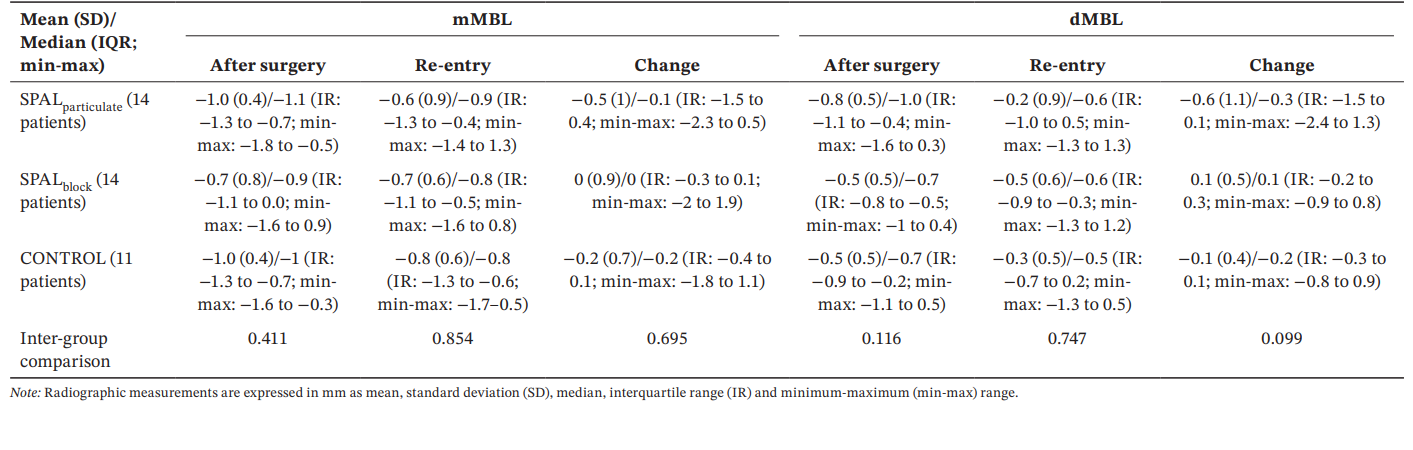
Todos los grupos mostraron valores similares de mMBL y dMBL después de la cirugía y en la reentrada, así como cambios a lo largo del tiempo (Tabla 5).
Discusión
El objetivo del presente estudio retrospectivo fue evaluar la efectividad de la técnica SPAL realizada en combinación con DBBM en forma de partículas o bloque para corregir completamente un PIBD en la colocación del implante. Los grupos SPAL también se compararon con un grupo de pacientes que mostraban una placa ósea bucal peri-implantaria de al menos 2 mm después de la colocación del implante. Los resultados mostraron que, independientemente de la forma de DBBM, los implantes tratados con la técnica SPAL mostraron una tasa igualmente alta de pacientes que mostraron una corrección completa del defecto a los 6 meses de reingreso. El grupo SPALbloque mostró un BTT significativamente mayor tanto en la línea base como en el reingreso. Sin embargo, la extensión del remodelado del injerto/hueso fue similar entre los grupos.
La elección de utilizar la tasa de corrección completa de dehiscencia como resultado primario se debió al hecho de que un PIBD no tratado o parcialmente corregido puede (i) favorecer la ocurrencia de una complicación biológica (Monje et al. 2019; Schwarz, Sahm y Becker 2012) y (ii) llevar a una mayor pérdida ósea peri-implantaria interproximal (Jung et al. 2017). El grupo CONTROL se incluyó para evaluar la extensión del remodelado de los dos biomateriales de injerto en comparación con el hueso nativo.
La efectividad de la SPAL realizada en combinación con un pDBBM para el tratamiento de un PIBD fue consistente con la reportada en estudios clínicos previos donde se utilizó el mismo injerto particulado, mostrando una tasa de cobertura completa de dehiscencia que varía del 80% al 91% (Trombelli et al. 2019, 2020). Estos hallazgos podrían atribuirse en parte a aspectos biológicos y técnicos específicos del procedimiento regenerativo. En la técnica SPAL, la capa de periostio representa una fuente de células osteogénicas que pueden (i) contribuir favorablemente a la formación de nuevo hueso (Ceccarelli, et al., 2016) y (ii) actuar como un inductor neoangiogénico, proporcionando así la vascularización temprana del injerto de DBBM (Nobuto et al. 2005). Además, la creación de un espacio subperióstico aislado puede permitir una adecuada acomodación y estabilización del injerto en la porción más coronal del implante (Trombelli et al. 2018, 2019, 2020). La estabilidad del injerto para apoyar la actividad osteoconductiva del injerto también se ve mejorada mediante suturas internas en forma de colchón que aseguran la porción coronal de la capa perióstica al colgajo oral. Consistentemente, un meta-análisis en red que compara diferentes opciones de tratamiento para corregir completamente un PIBD mostró que la SPAL con un pDBBM tiene la mayor probabilidad de éxito entre los procedimientos incluidos (Severi et al. 2022).
Recientemente, se propuso el uso de un bDBBM en combinación con SPAL como una alternativa prometedora a un injerto particulado (Trombelli et al. 2022). Se sugirió que el bDBBM actúa como un andamiaje osteoconductivo eficaz debido a sus propiedades mecánicas que abarcan una dislocación limitada durante la manipulación del colgajo, así como una mayor estabilidad dimensional (Benic et al. 2016; Benic et al. 2017; Mir-Mari et al. 2016). La efectividad del bDBBM está respaldada por nuestros hallazgos que mostraron una tasa del 93% de corrección completa de PIBD. Además, el uso de bDBBM resultó en un mayor BTT que pDBBM tanto en la línea base como en la reentrada. Estos resultados son consistentes con los de un estudio donde se demostró que la combinación de un bDBBM y una membrana de colágeno, simultáneamente con la colocación del implante, era superior a la combinación de la misma membrana y un pDBBM en la resolución completa del defecto y la restauración de una placa bucal gruesa (Benic et al. 2019). Sin embargo, debe enfatizarse que un paciente que recibió el injerto en bloque experimentó una infección del injerto post-cirugía que llevó a una dehiscencia persistente a los 6 meses. Estudios previos donde se utilizó un bloque óseo xenogénico para un procedimiento de aumento de cresta realizado antes de la colocación del implante informaron una tasa de infección del injerto y posterior extracción del 33% (Ortiz-Vigón et al. 2017) al 40% (Schwarz et al. 2021) de los casos tratados. Estudios preclínicos (Benic et al. 2016; Benic et al. 2017) y clínicos (Laas, et al., 2020) mostraron que el bDBBM estaba pobremente colonizado por hueso nuevo en comparación con pDBBM. La limitada formación ósea observada se relacionó con una vascularización deficiente del bloque debido a su macroestructura (Laass et al. 2020). La medida en que el uso de un bDBBM podría representar una alternativa segura y eficaz al pDBBM cuando se combina con la técnica SPAL necesita ser evaluada más a fondo.
Nuestro diseño de estudio puede proporcionar una visión preliminar sobre la extensión de la remodelación del injerto tras los procedimientos SPAL con diferentes formas de injerto en comparación con la remodelación ósea después de la colocación del implante. A pesar de que el grupo SPALblock mostró un BTT significativamente mayor tanto después de la cirugía como en la reentrada, la magnitud de la remodelación del injerto fue similar para los dos injertos y en comparación con el hueso nativo. Los cambios en el BTT en el grupo SPALblock fueron consistentes con estudios previos que evaluaron la remodelación del injerto tras el procedimiento GBR realizado utilizando un bDBBM en combinación con una membrana de colágeno (Benic et al. 2019). En contraste, el mismo estudio mostró que la reducción media en el grosor para un pDBBM más una membrana de colágeno fue dos veces mayor (2 mm) en comparación con nuestros datos. Las diferencias en los cambios de BTT observadas en los dos estudios pueden explicarse por las dinámicas de remodelación del injerto variables, así como por la extensión del desplazamiento del injerto como consecuencia del procedimiento regenerativo específico. En conjunto, estas observaciones sugieren la necesidad de sobrecorregir la dimensión del BTT para compensar la contracción horizontal postquirúrgica del injerto, independientemente de los procedimientos de aumento óseo utilizados.
En nuestro material, el grupo CONTROL consistió en pacientes donde se presentó un grosor de PBBP de al menos 2 mm después de la colocación del implante. Esta elección se basó en estudios previos que mostraron que el grosor de PBBP se correlaciona con la incidencia de pérdida ósea vertical en la placa bucal tras la inserción del implante (Spray et al. 2000) y la consiguiente necesidad de procedimientos de aumento óseo (Roccuzzo, Imber y Jensen 2021). Curiosamente, también se observó una reducción media en el BTT de 1 mm en el grupo CONTROL, lo que llevó a que dos pacientes (18%) experimentaran un incidente PIBD en la reentrada. El remodelado óseo superó lo reportado en estudios previos donde la reducción en el grosor de PBBP tras la colocación del implante osciló entre 0.3 (Merheb et al. 2017) y 0.4 mm (Cardaropoli, Lekholm y Wennström 2006). Diferentes factores, incluyendo la posición del implante en 3D (Nomiyama et al. 2022), métodos para la preparación del sitio del implante (Baggi et al. 2008; Peker Tekdal et al. 2016), diseño/superficie del implante (Linkevicius et al. 2020; Galindo-Moreno et al. 2016; Camarda et al. 2021), ubicación anatómica (anterior/posterior, mandíbula/maxilar) (Ghaly et al. 2023), grosor de la mucosa peri-implantaria (Maia et al. 2015; Suárez-López Del Amo et al. 2016), y conexión protésica (Linkevicius et al. 2015) pueden haber contribuido parcialmente a esta observación discrepante.
Con el fin de facilitar el cierre por primera intención, se habían colocado implantes de nivel de tejido con el margen coronal del collar pulido al nivel de la cresta ósea. En este sentido, no se puede excluir un impacto de la posición del implante en la cantidad de corrección de PIBD, así como en la extensión del remodelado óseo peri-implantario tras la inserción del implante (Saleh et al. 2018). Además, los grupos SPAL y el grupo CONTROL fueron reingresados para la exposición del implante en diferentes períodos postquirúrgicos (6 meses frente a 3 meses). Esta diferencia puede haber impactado de diversas maneras en el remodelado de tejidos tras la inserción del implante.
La pérdida de hueso marginal peri-implantario tras la instalación del implante puede resultar de un remodelado fisiológico debido a traumas mecánicos y térmicos durante la preparación del sitio del implante. Curiosamente, en nuestro material se observó una cantidad limitada de remodelado de injerto/hueso de manera similar entre los grupos y fue consistente con estudios previos donde los implantes de nivel de tejido fueron colocados equicrestalmente (Saleh et al. 2018) o tratados con SPAL más pDBBM (Trombelli et al. 2020).
Algunas limitaciones del presente estudio deben ser consideradas al interpretar sus hallazgos. La elección de un estudio piloto con un diseño retrospectivo se basó en la falta de indicaciones clínicas específicas (es decir, factores relacionados con el paciente/defecto) para combinar la técnica SPAL con partículas de DBBM o bloques de DBBM debido a la evidencia limitada y anecdótica (Trombelli et al. 2022) que apoya el uso de bloques de DBBM en combinación con la técnica SPAL. Se utilizó una formulación específica de DBBM de acuerdo con la preferencia del operador. Esta selección imparcial del injerto utilizado no ha resultado en diferencias significativas en términos de características del paciente y del defecto. Sin embargo, algunos factores, como la ubicación anatómica y la longitud de los implantes, estaban distribuidos de manera desigual entre los grupos y, aunque fueron controlados por el análisis estadístico, pueden haber sesgado los resultados observados. Dado que los pacientes incluidos fueron tratados de manera consecutiva durante la actividad clínica rutinaria, una sonda UNC 15 fue la herramienta regular/estandarizada utilizada para tomar todas las mediciones clínicas, incluidas las dimensiones PIBD. Otros métodos de medición, como un calibrador (Roccuzzo, Imber y Jensen 2021) o un dispositivo diseñado específicamente (Merheb et al. 2017), podrían haber resultado en registros más apropiados del tamaño de la dehiscencia y BBT.
En conclusión, nuestros resultados parecen indicar que el SPAL realizado en combinación con un injerto DBBM particulado o en bloque es igualmente efectivo para corregir un PIBD, así como para aumentar el BTT a los 6 meses.
Mattia Severi, Franzini Chiara, Anna Simonelli, Chiara Scapoli, Leonardo Trombelli
Referencias
- Baggi, L., I. Cappelloni, M. Di Girolamo, F. Maceri, y G. Vairo. 2008. “La Influencia del Diámetro y la Longitud del Implante en la Distribución del Estrés de los Implantes Osteointegrados Relacionados con la Geometría del Hueso Crestales: Un Análisis de Elementos Finitos Tridimensional.” Journal of Prosthetic Dentistry 100, no. 6: 422–431. https://doi.org/10.1016/S0022-3913(08)60259-0.
- Benic, G. I., B. M. Eisner, R. E. Jung, T. Basler, D. Schneider, y C. H. F. Hämmerle. 2019. “Cambios en el Tejido Duro Después de la Regeneración Ósea Guiada de Defectos Peri-Implantarios Comparando Injertos Óseos en Bloque versus Particulados: Resultados a los 6 Meses de un Ensayo Clínico Controlado Aleatorizado.” Clinical Oral Implants Research 30: 1016– 1026. https://doi.org/10.1111/clr.13515.
- Benic, G. I., D. S. Thoma, F. Muñoz, I. S. Martin, R. E. Jung, y C. H. F. Hämmerle. 2016. “Regeneración Ósea Guiada de Defectos Peri-Implantarios con Sustitutos Óseos Xenogénicos Particulados y en Bloque.” Clinical Oral Implants Research 27, no. 5: 567–576. https://doi.org/10.1111/clr.12625.
- Benic, G. I., D. S. Thoma, I. Sanz-Martin, et al. 2017. “Regeneración Ósea Guiada en Implantes Dentales de Circonio y Titanio: Una Investigación Histológica Piloto.” Clinical Oral Implants Research 28, no. 12: 1592–1599. https://doi.org/10.1111/clr.13030.
- Bressan, E., N. Ferrarese, M. Pramstraller, D. Lops, R. Farina, y C. Tomasi. 2017. “Dimensiones de la Cresta del Mandíbula Edéntula en el Sextante Posterior: Un Estudio Observacional en Radiografías de Tomografía Computarizada de Haz Cónico.” Implant Dentistry 26, no. 1: 66–72. https:// doi.org/10.1097/ID.0000000000000489.
- Camarda, A. J., R. Durand, M. Benkarim, P. H. Rompré, G. Guertin, y H. Ciaburro. 2021. “Ensayo Clínico Aleatorizado Prospectivo Evaluando los Efectos de Dos Diseños Diferentes de Cuello de Implante en la Cicatrización Peri-Implantar y la Osteointegración Funcional Después de 25 Años.” Clinical Oral Implants Research 32: 285–296. https://doi.org/10.1111/clr.13699.
- Cardaropoli, G., U. Lekholm, y J. L. Wennström. 2006. “Alteraciones de Tejido en Reemplazos de Diente Único Soportados por Implantes: Un Estudio Clínico Prospectivo de 1 Año.” Clinical Oral Implants Research 17, no. 2: 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x.
- Farina, R., A. Simonelli, A. Baraldi, et al. 2021. “Pérdida Dental en Pacientes con Periodontitis Cumplidores y No Cumplidores con Diferentes Niveles de Riesgo Periodontal Durante el Cuidado Periodontal de Soporte.” Clinical Oral Investigations 25, no. 10: 5897–5906. https://doi.org/10.1007/s00784-021-03895-8.
- Galindo-Moreno, P., A. León-Cano, A. Monje, I. Ortega-Oller, F. O'Valle, y A. Catena. 2016. “La Altura del Pilar Influye en el Efecto del Cambio de Plataforma en la Pérdida de Hueso Marginal Peri-Implantar.” Clinical Oral Implants Research 27, no. 2: 167–173. https://doi.org/10.1111/clr.12554.
- Gallucci, G. O., A. Hamilton, W. Zhou, D. Buser, y S. Chen. 2018. “Colocación de Implantes y Protocolos de Carga en Pacientes Parcialmente Edéntulos: Una Revisión Sistemática.” Clinical Oral Implants Research 29, no. Suppl 16: 106–134. https://doi.org/10.1111/clr.13276.
- Ghaly, M., D. Tarrazzi, V. Xia, S. Tharrington, y T. R. Schoenbaum. 2023. “Cambios en el Nivel de Hueso Marginal Peri-Implantar por Ubicación de la Mandíbula: Una Revisión Sistemática y Meta-Análisis de 4970 Implantes.” Journal of Oral Implantology 49, no. 4: 444–455. https://doi.org/10.1563/aaid-joi-D-22-00252.
- Herrera, D., T. Berglundh, F. Schwarz, et al. 2023. “Prevención y Tratamiento de Enfermedades Peri-Implantarias—La Guía de Práctica Clínica de Nivel EFP S3.” Journal of Clinical Periodontology 50, no. Suppl 26: 4–76. https://doi.org/10.1111/jcpe.13823.
- Jensen, S. S., T. Aghaloo, R. E. Jung, et al. 2023. “Informe de Consenso del Grupo 1 ITI: El Papel de las Dimensiones Óseas y los Procedimientos de Aumento de Tejido Blando en la Estabilidad de los Resultados Clínicos, Radiográficos y Reportados por el Paciente del Tratamiento con Implantes.” Clinical Oral Implants Research 34, no. Suppl 26: 43–49. https://doi.org/10.1111/clr.14154.
- Jung, R. E., M. Herzog, K. Wolleb, C. F. Ramel, D. S. Thoma, y C. H. F. Hämmerle. 2017. “Un Ensayo Clínico Controlado Aleatorizado Comparando Defectos de Dehiscencia Bucal Pequeños Alrededor de Implantes Dentales Tratados con Regeneración Ósea Guiada o Dejados para Cicatrización Espontánea.” Clinical Oral Implants Research 28, no. 3: 348–354. https://doi.org/10.1111/clr.12806.
- Laass, A., B. M. Eisner, C. H. F. Hämmerle, R. E. Jung, D. S. Thoma, y G. I. Benic. 2020. “Resultados Histológicos Después de la Regeneración Ósea Guiada de Defectos Peri-Implantarios Comparando Sustitutos Óseos en Bloque con Forma Individual versus Particulados.” International Journal of Periodontics and Restorative Dentistry 40, no. 4: 519–527. https://doi.org/10.11607/prd.4575.
- Linkevicius, T., A. Puisys, L. Linkeviciene, V. Peciuliene, y M. Schlee. 2015. “Estabilidad del Hueso Crestales Alrededor de Implantes con Conexión Horizontalmente Coincidente Después del Engrosamiento del Tejido Blando: Un Ensayo Clínico Prospectivo.” Clinical Implant Dentistry and Related Research 17, no. 3: 497–508. https://doi.org/10.1111/cid.12155.
- Linkevicius, T., A. Puisys, R. Linkevicius, J. Alkimavicius, E. Gineviciute, y L. Linkeviciene. 2020. “La Influencia del Pilar de Cicatrización Sumergido o la Colocación de Implantes Subcrestales en el Grosor del Tejido Blando y la Estabilidad del Hueso Crestales. Un Ensayo Clínico Aleatorizado de 2 Años.” Clinical Implant Dentistry and Related Research 22, no. 4: 497–506. https://doi.org/10.1111/cid.12903.
- Maia, L. P., D. M. Reino, V. A. Muglia, et al. 2015. “Influencia del Grosor del Tejido Periodontal en la Remodelación de la Placa Bucal en Implantes Inmediatos con Xenoinjerto.” Journal of Clinical Periodontology 42: 590–598. https:// doi.org/10.1111/jcpe.12405.
- Merheb, J., M. Vercruyssen, W. Coucke, L. Beckers, W. Teughels, y M. Quirynen. 2017. “El Destino del Hueso Bucal Alrededor de Implantes Dentales. Un Estudio de Seguimiento de 12 Meses Después de la Carga.” Clinical Oral Implants Research 28, no. 1: 103–108. https://doi.org/10.1111/clr.12767.
- Mir-Mari, J., H. Wui, R. E. Jung, C. H. F. Hämmerle, y G. I. Benic. 2016. “Influencia del Cierre de Herida Ciego en la Estabilidad del Volumen de Diferentes Materiales GBR: Un Examen Tomográfico de Haz Cónico In Vitro.” Clinical Oral Implants Research 27, no. 2: 258–265. https://doi.org/10.1111/clr.12590.
- Monje, A., V. Chappuis, F. Monje, et al. 2019. “El Grosor Crítico de la Pared Ósea Bucal Peri-Implantar Revisado: Un Estudio Experimental en el Perro Beagle.” International Journal of Oral & Maxillofacial Implants 34, no. 6: 1328–1336. https://doi.org/10.11607/jomi.7657.
- Monje, A., A. Roccuzzo, D. Buser, y H. L. Wang. 2023. “Influencia del Grosor de la Pared Ósea Bucal en los Cambios Dimensionales de los Tejidos Duro y Blando Peri-Implantarios: Una Revisión Sistemática.” Clinical Oral Implants Research 34, no. 3: 157–176. https://doi.org/10.1111/clr.14029.
- Nobuto, T., F. Suwa, T. Kono, et al. 2005. “Respuesta Microvascular en el Periostio Después de la Cirugía de Colgajo Mucoperiosteal en Perros: Angiogénesis y Resorción y Formación Ósea.” Journal of Periodontology 76, no. 8: 1346–1353. https://doi.org/10.1902/jop.2005.76.8.1346.
- Nomiyama, L. M., E. K. Matumoto, M. G. Corrêa, et al. 2022. “Comparación Entre Cirugía Guiada Sin Colgajo y Cirugía Convencional para la Colocación de Implantes: Un Ensayo Clínico Aleatorizado de 12 Meses.” Clinical Oral Investigations 27: 1665–1679. https://doi.org/10.1007/s00784-022-04793-3.
- Ortiz-Vigón, A., I. Suarez, S. Martínez-Villa, I. Sanz-Martín, J. Bollain, y M. Sanz. 2017. “Seguridad y Rendimiento de un Nuevo Bloque Óseo Xenogénico Colagenado para la Aumento de la Cresta Alveolar Lateral para la Colocación de Implantes en Etapas.” Clinical Oral Implants Research 29, no. 1: 36–45. https://doi.org/10.1111/clr.13036.
- Peker Tekdal, G., N. Bostanci, G. N. Belibasakis, y A. Gürkan. 2016. “El Efecto de la Osteotomía de Implante con Cirugía Piezoeléctrica en los Parámetros Radiológicos y Moleculares de la Pérdida de Hueso Crestales Peri-Implantarios: Un Ensayo Controlado Aleatorizado de Boca Dividida.” Clinical Oral Implants Research 27, no. 5: 535–544. https://doi.org/10.1111/clr.12620.
- Pramstraller, M., G. P. Schincaglia, R. Vecchiatini, R. Farina, y L. Trombelli. 2018. “Dimensiones de la Cresta Alveolar en Regiones Posteriores Mandibulares: Un Estudio Comparativo Retrospectivo de Sitios Dentados y Edéntulos Usando Datos de Tomografía Computarizada.” Surgical and Radiologic Anatomy 40, no. 12: 1419–1428. https://doi.org/10.1007/s00276-018-2095-0.
- Roccuzzo, A., J. C. Imber, y S. S. Jensen. 2021. “Necesidad de Aumento Óseo Lateral en Dos Implantes de Diámetro Estrecho: Un Estudio Clínico Prospectivo y Controlado.” Clinical Oral Implants Research 32, no. 4: 511–520. https://doi.org/10.1111/clr.13721.
- Saleh, M. H. A., A. Ravidà, F. Suárez-López Del Amo, G. H. Lin, F. Asa'ad, y H. L. Wang. 2018. “El Efecto de la Posición de la Junta Implante-Pilar en la Pérdida de Hueso Crestales: Una Revisión Sistemática y Meta-Análisis.” Clinical Implant Dentistry and Related Research 20, no. 4: 617–633. https://doi.org/10.1111/cid.12600.
- Schwarz, F., D. Sahin, S. Civale-Schweighöfer, y J. Becker. 2021. “Resultados a Largo Plazo Después de la Aumento Lateral de la Cresta Alveolar Usando un Bloque Óseo Xenogénico Colagenado: Un Estudio Clínico Prospectivo Monocéntrico de Un Solo Brazo.” International Journal of Implant Dentistry 7, no. 1: 9. https://doi.org/10.1186/s40729-021-00293-3.
- Schwarz, F., N. Sahm, y J. Becker. 2012. “Impacto del Resultado de la Regeneración Ósea Guiada en Defectos Tipo Dehiscencia en la Estabilidad a Largo Plazo de la Salud Peri-Implantar: Observaciones Clínicas a los 4 Años.” Clinical Oral Implants Research 23, no. 2: 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x.