Condiciones de tejido peri-implantario en implantes tratados con la técnica de Capa Aumentada Sub-periosteal: Una serie de casos retrospectiva
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivos: Evaluar las condiciones de los tejidos peri-implantarios a corto plazo en pacientes que reciben la técnica de Capa Aumentada Subperióstica Peri-implantaria (SPAL) y en pacientes con un grosor adecuado (≥2 mm) de la placa ósea bucal peri-implantaria (PBBP) en el momento de la colocación.
Métodos: Se seleccionaron retrospectivamente pacientes en los que se corrigió un defecto de dehiscencia o una PBBP delgada en el momento de la colocación del implante mediante la técnica SPAL (grupos SPALdehiscencia y SPALdelgada, respectivamente) y pacientes que presentaban un grosor residual de PBBP ≥2 mm en el momento de la colocación del implante (grupo de control). El número de sitios peri-implantarios positivos a sangrado al sondeo (BoP) a los 6 meses después de la carga protésica fue el resultado primario. También se evaluaron la altura de la mucosa queratinizada, el nivel del tejido blando marginal, el Índice de Placa, la profundidad de sondeo peri-implantario, la supuración al sondeo y el nivel óseo radiográfico interproximal (RBL).
Resultados: Treinta y cuatro pacientes (11 en el grupo SPALdehiscencia, 11 en el grupo SPALdelgado y 12 en el grupo de control) fueron incluidos. En cada grupo SPAL, 10 pacientes (90.9%) mostraron un grosor de tejido peri-implantario ≥2 mm en la porción más coronal del implante al destapar. La prevalencia (número) de sitios positivos para BoP fue de 2, 1 y 0 en los grupos SPALdehiscencia, SPALdelgado y de control, respectivamente. La RBL fue de 0.3 mm en el grupo SPALdehiscencia, 0.2 mm en el grupo SPALdelgado y 0 mm en el grupo de control.
Conclusión: Después de 6 meses de carga protésica, los pacientes tratados con la técnica SPAL muestran una inflamación mucosa peri-implantaria limitada en asociación con una PD superficial y KM adecuada. Sin embargo, en los implantes que reciben la técnica SPAL, se encontró RBL interproximal apical a su posición ideal.
Introducción
La colocación de implantes impulsada por prótesis en una dimensión ósea horizontal reducida a menudo resulta en una dehiscencia o fenestración ósea peri-implantaria. Incluso en presencia de una placa ósea cortical bucal intacta pero delgada, el trauma quirúrgico y el consiguiente remodelado óseo tras la colocación del implante pueden llevar a una pérdida ósea vertical con la exposición de la parte coronal del implante al destapado (Merheb et al., 2017, Monje, et al., 2019, Spray, Black, Morris, 2000). Aunque se ha demostrado que la cantidad de remodelado óseo tras la inserción del implante es similar tanto en placas óseas bucales delgadas como gruesas (Merheb et al., 2017), dicho remodelado puede tener un impacto diferente en la integridad de la placa ósea bucal peri-implantaria (PBBP). En este sentido, se ha demostrado un mayor riesgo de complicaciones estéticas y biológicas tras la colocación del implante en sitios con un defecto de dehiscencia o una PBBP delgada en comparación con una PBBP gruesa en estudios preclínicos (Monje, et al., 2019) y clínicos (Schwarz, Sahm, Becker, 2012, Jung et al., 2017). En conjunto, estos hallazgos subrayan la relevancia de la integridad y el grosor de la PBBP en la colocación del implante para favorecer condiciones estables y saludables de los tejidos peri-implantarios a lo largo del tiempo (Sanz-Sánchez et al., 2018).
El procedimiento más documentado y eficaz para corregir quirúrgicamente un defecto tipo dehiscencia se basa en el uso de membranas de barrera combinadas con injertos de reemplazo óseo de acuerdo con los principios de regeneración ósea guiada (GBR) (Sanz-Sánchez, Ortiz-Vigón, Sanz-Martín, Figuero, Sanz, 2015). La reducción o resolución de la dehiscencia ósea peri-implantaria reportada tras la GBR (Thoma, Bienz, Figuero, Jung, Sanz-Martín, 2019) parece tener un impacto positivo en las condiciones a largo plazo del implante, en términos de tasa de supervivencia del implante y estabilidad del tejido peri-implantario (Sanz-Sánchez et al., 2018). Desafortunadamente, si un aumento en la cantidad de grosor óseo peri-implantario asociado con la cobertura completa de la superficie expuesta del implante puede apoyar la salud peri-implantaria no ha sido completamente elucidado.
Recientemente, se ha descrito un procedimiento simplificado de aumento óseo, a saber, la técnica de Capa Aumentada Subperióstica Peri-implantaria (SPAL), basada en el uso del periostio como una membrana de barrera y un injerto como "dispositivo" para crear espacio para el aumento óseo concomitante a la colocación del implante (Trombelli, Severi, Pramstraller, Farina, 2018). La efectividad de esta técnica para corregir una dehiscencia ósea peri-implantaria y/o aumentar el grosor del hueso peri-implantario se reportó previamente (Trombelli, Severi, Pramstraller, Farina, 2019), y su aplicación también se ha explorado en el tratamiento de defectos de peri-implantitis (Trombelli et al. 2020). El objetivo de la presente serie de casos retrospectiva fue evaluar las condiciones del tejido peri-implantario a corto plazo en pacientes que recibieron la técnica SPAL en comparación con pacientes con un grosor adecuado (≥2 mm) de PBBP en la colocación del implante.
Material y métodos
2.1 Diseño del estudio y aspectos éticos
El presente estudio fue diseñado de acuerdo con la guía STROBE Apéndice S1. El protocolo fue aprobado por el Comité Ético del Área Vasta Emilia Centro, Italia (número de protocolo 637/2018/ Oss/UniFe, fecha de aprobación 12.12.2018). Cada paciente había proporcionado un consentimiento informado por escrito antes del tratamiento quirúrgico. Todos los procedimientos clínicos se realizaron de acuerdo con la Declaración de Helsinki y las Buenas Prácticas Clínicas (GCP).
2.2 Población del estudio
Se revisaron las historias clínicas de pacientes que se sometieron a rehabilitación protésica soportada por implantes en el período de diciembre de 2015 a julio de 2018 en el Centro de Investigación para el Estudio de Enfermedades Periodontales y Peri-implantarias, Universidad de Ferrara, y en una clínica dental privada en Ferrara para determinar la elegibilidad de los pacientes para el estudio. La inclusión de pacientes en el estudio estaba subordinada a los siguientes criterios:
- No fumadores o fumadores ≤10 cigarrillos/día en el momento de la cirugía;
- No diabéticos o diabéticos bien controlados (HbA1c ≤ 7%) en el momento de la cirugía;
- Disponibilidad de parámetros clínicos y exámenes radiográficos para el estudio (ver “Parámetros del estudio” para más detalles).
- No estar tomando medicamentos que influyan en el metabolismo óseo (por ejemplo, bisfosfonatos, corticosteroides);
- Haber recibido colocación de implantes completamente en hueso nativo (con un grosor residual de PBBP ≥2 mm después de la inserción del implante) o concomitantemente con la técnica SPAL.
La inclusión de implantes en el estudio estaba subordinada a los siguientes criterios:
- Colocación en cresta cicatrizada (implantes tipo IV, Hämmerle, Chen, Wilson, 2004);
- Estabilidad primaria, evaluada por el torque de inserción.
Basado en las condiciones de PBBP en el momento de la colocación del implante y en su manejo clínico, los pacientes fueron categorizados en tres grupos:
- Pacientes con implante/s que presentan un grosor residual de PBBP ≥2 mm después de la inserción del implante (grupo de control);
- Pacientes con implante/s tratados con la técnica SPAL para corregir una dehiscencia ósea peri-implantaria ≥3 mm concomitantemente con la colocación del implante (grupo SPALdehiscencia);
- Pacientes con implante/s tratados con la técnica SPAL para aumentar un PBBP delgado (≤1 mm) concomitantemente con la colocación del implante (grupo SPALdelgado).
2.3 Procedimientos clínicos
Antes de la colocación del implante, todos los pacientes habían recibido terapia activa para tratar lesiones cariosas y enfermedades periodontales y habían sido inscritos en un mantenimiento profesional con frecuencia de seguimientos programados de acuerdo con la herramienta de evaluación PerioRisk (Trombelli, Farina, Ferrari, Pasetti, Calura, 2009, Trombelli et al., 2017).
Todos los procedimientos quirúrgicos fueron realizados por dos periodontistas experimentados (L.T. y M.P.). Se administraron 2 g de amoxicilina + ácido clavulánico (Augmentin, GlaxoSmithKline) una hora antes de la cirugía. Se logró anestesia local utilizando articaína con 1:100,000 de epinefrina administrada por infiltración local.
2.3.1 Procedimientos quirúrgicos—grupos SPAL
En pacientes donde se corrigió un defecto de dehiscencia o un PBBP delgado en la colocación mediante la técnica SPAL (Figuras 1 y 2, respectivamente), se realizó el acceso quirúrgico a la cresta ósea como se describió anteriormente (Trombelli, Severi, Pramstraller, & Farina, 2018). En resumen, se levantó una capa mucosa en el aspecto bucal mediante disección de grosor parcial con una hoja 15C, así como cuchillos de túnel (KPAX, TKN1X y TKN2X, Hu-Friedy) con bordes afilados angulados variables según la ubicación anatómica. Luego, se elevó la capa periosteal del hueso con un elevador periosteal (PTROM, Hu-Friedy), creando un bolsillo que podría acomodar un injerto. Se elevó un colgajo de grosor total en el aspecto oral (lingual/palatino).
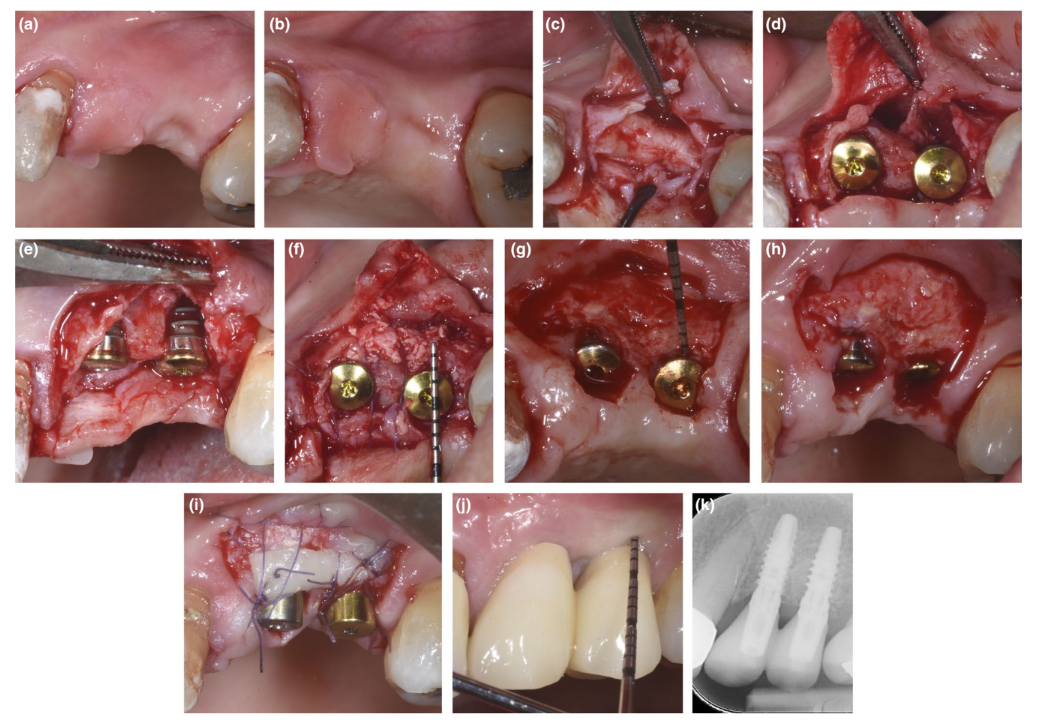
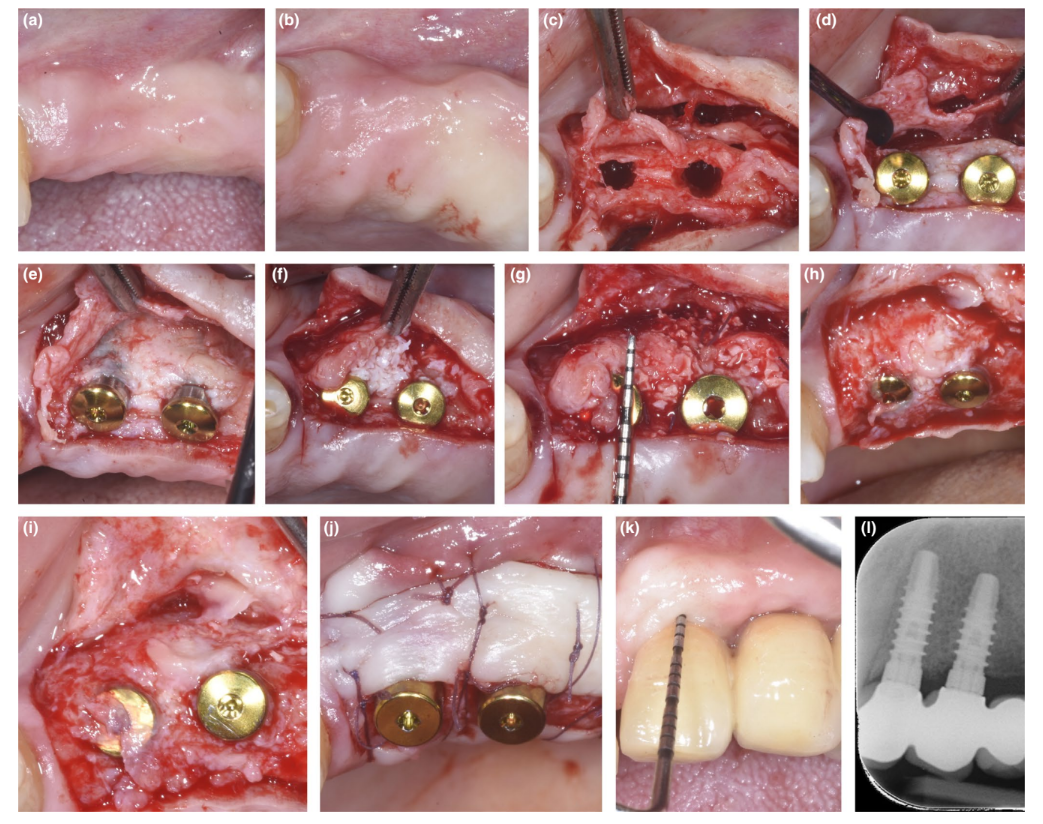
Se insertaron implantes a nivel de tejido (SPI Element™; Thommen Medical). Se utilizó un xenoinjerto de origen bovino (Bio-Oss® gránulos de esponjosa, tamaño de partícula 0.25–1.0 mm; Geistlich Pharma, AG) solo o en combinación con partículas de hueso cortical autógeno para llenar el espacio creado quirúrgicamente entre la capa periosteal y ya sea la delgada placa ósea bucal o la superficie del implante expuesta. En presencia de una dehiscencia, se realizó injerto para corregir completamente el defecto peri-implantario hasta el collar pulido. En todos los casos, el injerto sub-periosteal proporcionó al menos 2 mm de grosor en la porción más coronal del implante.
La porción coronal de la capa periosteal se estabilizó al colgajo mucoperiosteal oral mediante suturas internas de colchón reabsorbibles (Vicryl 6/0, Ethicon). Luego, la capa mucosa se avanzó coronariamente y se suturó sin tensión mediante suturas internas de colchón horizontales e interrumpidas para sumergir tanto el injerto como los implantes.
En el procedimiento de reingreso para la exposición del implante, se disecó un colgajo bucal de grosor parcial para posicionar el pilar de cicatrización. Para proporcionar dimensiones adecuadas de la mucosa peri-implantaria queratinizada, se realizó un colgajo posicionado apicalmente o un injerto gingival libre (Trombelli, Severi, Pramstraller, & Farina, 2019).
2.3.2 Procedimientos quirúrgicos—grupo de control
Se levantó un colgajo bucal y lingual/palatino de grosor total para exponer la cresta ósea. El sitio del implante se preparó de acuerdo con las instrucciones del fabricante, y se insertaron implantes de nivel de tejido (SPI Element™; Thommen Medical). Debido a la presencia de un grosor residual de PBBP ≥2 mm, no se realizó ningún procedimiento de aumento óseo. En todos los casos, el colgajo se recortó y se posicionó alrededor del pilar de cicatrización con suturas reabsorbibles (Vicryl 6/0, Ethicon). El diseño y la manipulación del colgajo, así como la técnica de sutura, se realizaron para asegurar dimensiones adecuadas (altura, grosor) de la mucosa peri-implantaria queratinizada.
2.3.3 Procedimientos postoperatorios
Se instruyó a los pacientes que no usaran ninguna prótesis removible para evitar la compresión en el sitio quirúrgico durante al menos 4 semanas y que no masticaran ni cepillaran en el área tratada durante aproximadamente 2 semanas.
Se prescribió el uso en casa de una solución de clorhexidina al 0.12% (Curasept ADS Trattamento Rigenerante®; Curaden Healthcare) para el control químico de la placa (enjuague de 1 minuto dos veces al día durante 3 semanas). Se retiraron los puntos a las 2 semanas post-cirugía.
2.3.4 Tiempo de rehabilitación protésica
La rehabilitación protésica se inició a los 3–4 meses después de la colocación del implante en el grupo de control, mientras que al menos 4 semanas después de la exposición del implante en los grupos SPAL.
2.4 Parámetros del estudio
2.4.1 Parámetros clínicos
Después de 6 meses de carga protésica, un examinador capacitado (M.S.) que había estado involucrado en estudios previos sobre la técnica SPAL (Trombelli, Severi, Pramstraller, Farina, 2019) realizó las siguientes mediciones clínicas con una sonda periodontal UNC-15 en la siguiente secuencia cronológica:
- Altura de la mucosa queratinizada (KM): medida en el aspecto medio-bucal del implante como la distancia entre el margen mucoso peri-implantario bucal y la unión mucogingival, y registrada al milímetro más cercano;
- Nivel de tejido blando marginal (MSTL) (Zitzmann, Schärer, Marinello, 2001): medida en el aspecto medio-bucal del implante como la distancia entre el margen mucoso peri-implantario bucal y la unión implante-abutment, y registrada al milímetro más cercano. MSTL se registró como positivo o negativo cuando el margen del abutment estaba ubicado por encima o por debajo del margen mucoso, respectivamente;
- Índice de Placa (PlI; O'Leary, Drake, Naylor, 1972): registrado en los aspectos mesiobucal, medio-bucal, distobucal, medio-lingual/palatino del implante como placa supragingival presente o ausente después de explorar el margen protésico yuxtagingival con la punta de la sonda;
- Profundidad de sondaje (PD): medida desde el margen mucoso hasta la penetración más profunda de la sonda en seis sitios (mesiobucal, medio-bucal, distobucal, disto-lingual, medio-lingual y mesiolingual) utilizando una fuerza de 0.2–0.3 N, y registrada al milímetro más cercano;
- Sangrado al sondaje (BoP; Ainamo y Bay, 1975): registrado como presente o ausente en la evaluación de PD;
- Supuración al sondaje (SoP): registrado como presente o ausente en la evaluación de PD.
2.4.2 Nivel óseo radiográfico
Radiografías periapicales no estandarizadas tomadas con la técnica paralela de cono largo a los 6 meses después de la carga protésica fueron digitalizadas y analizadas utilizando un software diseñado específicamente (NIS elements v4.2; Nikon Instruments, Campi Bisenzio). El nivel óseo radiográfico (RBL) se midió como la distancia (aproximada al milímetro más cercano) entre el margen apical del collar pulido del implante y la cresta ósea en el aspecto mesial (mRBL) y distal (dRBL) de cada implante utilizando una magnificación de 10x–15x. Se utilizó una marca de referencia de 1 mm de altura presente en la radiografía digital para la calibración.
Un examinador (A.S.) realizó las mediciones radiográficas. El examinador participó en una sesión de calibración sobre una muestra de radiografías obtenidas de pacientes no seleccionados para el presente estudio. La sesión de calibración consistió en dos sesiones de mediciones de RBL, realizadas con un intervalo de 7 días, y permitió alcanzar un excelente acuerdo intraexaminador (puntuación k = 0.89), con una diferencia media entre mediciones emparejadas de 0.04 ± 0.15 mm.
2.5 Análisis estadístico
El paciente fue considerado como la unidad estadística. Si dos o más implantes en el mismo paciente eran elegibles para el estudio, solo se incluyó un implante de forma aleatoria para el análisis. Los datos se describieron utilizando la media y la desviación estándar (DE), la mediana y el rango intercuartílico (RI), valores mínimo-máximo para variables cuantitativas, y frecuencia y porcentaje para variables categóricas.
El número mediano de sitios positivos para BoP evaluados a los 6 meses después de la carga del implante fue la variable de resultado principal del estudio. Los valores medianos de PD, KM, MSTL, RBL, número de sitios positivos para PlI y número de sitios positivos para SoP fueron variables de resultado secundarias.
Debido al tamaño de muestra limitado, no se realizaron estadísticas inferenciales y los resultados se informaron con un enfoque narrativo. Sin embargo, se calculó el tamaño del efecto (ES) para cada variable de resultado de acuerdo con la prueba no paramétrica de Kruskal-Wallis. El ES se clasificó como pequeño (d = 0.1–0.3), medio (d = 0.3–0.5) o grande (d ≥ 0.5) (Cohen, 1988).
Resultados
3.1 Población del estudio
Treinta y cuatro pacientes con 34 implantes (11 en el grupo SPALdehiscencia, 11 en el grupo SPALdelgado, y 12 en el grupo de control) fueron incluidos para el análisis. La gran mayoría de los pacientes eran no fumadores (90.9% en el grupo SPALdehiscencia, 90.9% en el grupo SPALdelgado, y 75% en el grupo de control). Los implantes en el grupo SPALdehiscencia estaban predominantemente ubicados en la mandíbula, mientras que los implantes en el grupo SPALdelgado y el grupo de control estaban predominantemente colocados en el maxilar (Tabla 1). No se perdieron pacientes ni implantes durante el período de seguimiento.
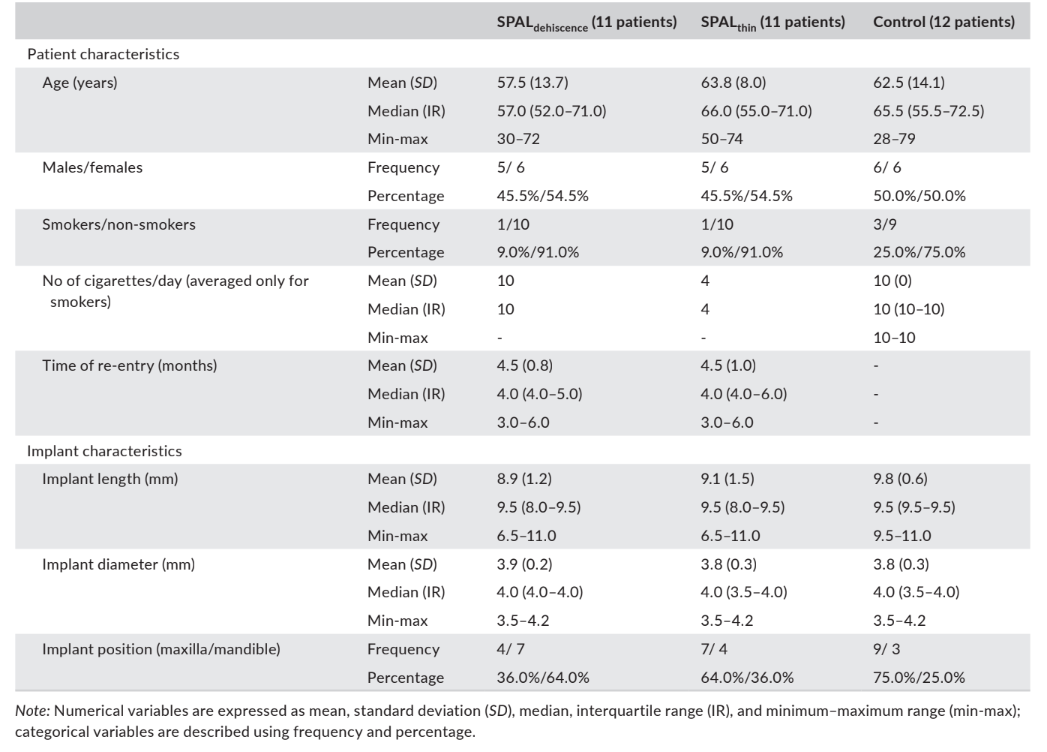
En el grupo SPALdehiscencia, 1 paciente presentó dehiscencia de la herida después de 2 semanas, con exposición parcial de las roscas del implante. El paciente fue visto mensualmente hasta la reentrada, y el sitio fue desinfectado localmente con una solución de clorhexidina al 0.12% en cada visita de seguimiento.
En ambos grupos, SPALdehiscencia y SPALdelgado, se realizó la reentrada a los 3–6 meses después de la colocación del implante (mediana: 4.0 meses en ambos grupos; p = 1; Tabla 1). El grosor del hueso peri-implantario y la altura y ancho de la dehiscencia ósea peri-implantaria registrados para los grupos SPALdehiscencia y SPALdelgado se informan en las Tablas 2 y 3, respectivamente. En cada grupo SPAL, 10 pacientes (90.9%) mostraron ausencia de dehiscencia peri-implantaria combinada con un grosor de hueso peri-implantario ≥2 mm (Tablas 2 y 3). Un paciente en el grupo SPALdehiscencia presentó una dehiscencia residual de 2 mm (Tabla 2), que fue cubierta con un injerto gingival libre. Un paciente en el grupo SPALdelgado presentó un grosor de hueso peri-implantario de 1 mm sin dehiscencia (Tabla 3).
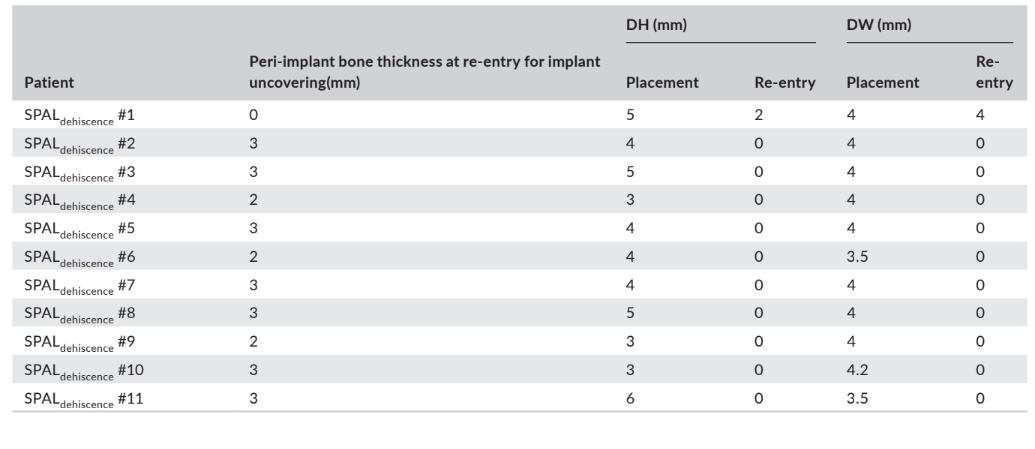
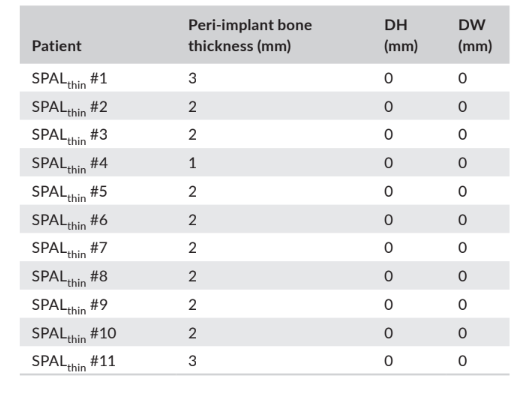
y ancho (DH y DW, respectivamente) evaluados en la reentrada para
la exposición del implante en cada paciente del grupo SPALthin
En el grupo SPALdehiscencia, 8 implantes soportaron una prótesis parcial fija, 2 implantes fueron restaurados con una corona individual, y 1 implante fue parte de una sobredentadura. En el grupo SPALthin, 9 implantes soportaron una prótesis parcial fija, 2 implantes fueron restaurados con una corona individual, y 1 fue parte de una sobredentadura. En el grupo de control, 4 implantes fueron parte de una prótesis parcial fija y 8 implantes fueron restaurados con una corona individual.
3.2 Resultados del estudio
Los datos relacionados con los resultados clínicos (es decir, PD, BoP, SoP, PlI, MSTL y KM) y RBL, evaluados a los 6 meses después de la carga del implante, se informan en la Tabla 4.
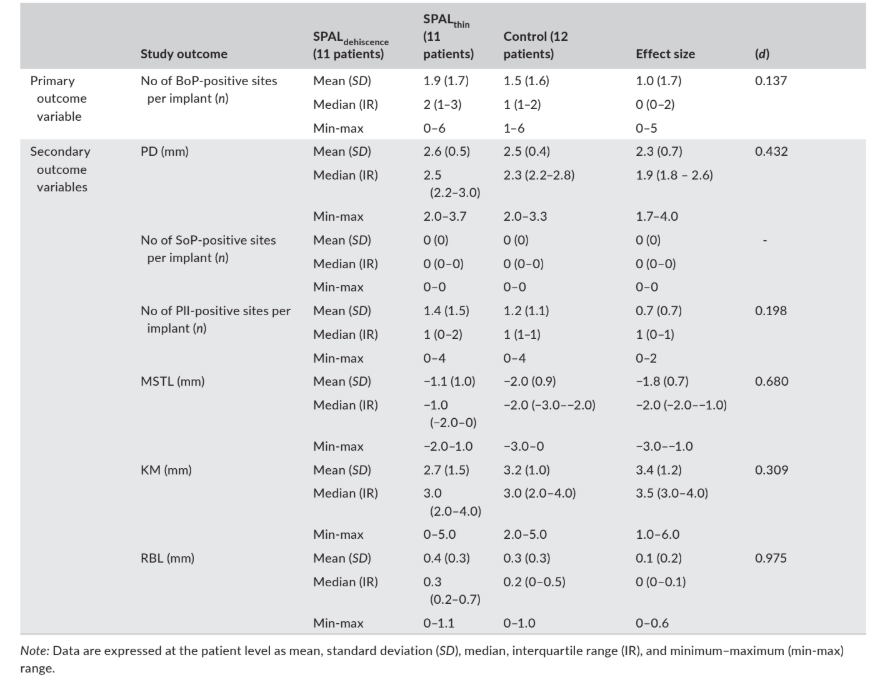
La prevalencia mediana (número) de sitios positivos para BoP fue de 2, 1 y 0 en los grupos SPALdehiscencia, SPALdelgado y control, respectivamente.
El número mediano de sitios positivos para PlI fue de 1 en todos los grupos. SoP fue negativo en todos los sitios de implantes.
El margen mucoso se ubicó a 1 mm (grupo SPALdehiscencia) o 2 mm (grupos SPALdelgado y control) por encima de la unión implante–pilar en todos los grupos, y los grupos de estudio presentaron una KM mediana de al menos 3 mm.
El nivel óseo radiográfico fue de 0.3 mm en el grupo SPALdehiscencia, 0.2 mm en el grupo SPALdelgado y 0 mm en el grupo control.
ES fue pequeño para el número de sitios BoP + (d = 0.137) y PlI (d = 0.198), medio para KM (d = 0.309), PD (d = 0.432) y MSTL (d = 0.680), y grande para RBL (d = 0.975) (Tabla 4).
Discusión
El objetivo de la presente serie de casos retrospectiva fue evaluar las condiciones de los tejidos peri-implantarios a corto plazo en pacientes que recibieron la técnica SPAL y en pacientes con un grosor adecuado (≥2 mm) de PBBP en la colocación del implante. Los resultados indicaron que los pacientes tratados con la técnica SPAL mostraron un bajo número de sitios peri-implantarios inflamados y una PD superficial (<4 mm) a los 6 meses de carga protésica. Además, se encontró que el nivel óseo interproximal estaba apical (aunque en una medida limitada) al collar pulido del implante solo en los grupos SPAL.
El sangrado al sondeo fue seleccionado como resultado primario ya que (a) la evaluación de BoP se identifica actualmente como la medida clínica para distinguir entre la salud y la enfermedad peri-implantaria, siendo un elemento diagnóstico invariable de la mucositis peri-implantaria y la peri-implantitis (Renvert, Persson, Pirih, Camargo, 2018, Berglundh et al., 2018), y (b) su ausencia está asociada con la estabilidad de las condiciones de los tejidos peri-implantarios (Jepsen, Rühling, Jepsen, Ohlenbusch, Albers, 1996, Luterbacher, Mayfield, Brägger, Lang, 2000). La proporción de sitios peri-implantarios inflamados, tal como se registró en los grupos de estudio, se compara con hallazgos previos que evaluaron la prevalencia de BoP en 289 implantes (Farina, Filippi, Brazzioli, Tomasi, Trombelli, 2017). Además, se informaron condiciones inflamatorias peri-implantarias similares a los 18 meses tras GBR (Jung et al., 2017).
En nuestro estudio, se observó una baja frecuencia de sitios mucosos periimplantarios inflamados en todos los grupos de estudio. Esto puede deberse en parte a características similares de factores que se ha demostrado que influyen en el BoP alrededor de los implantes, como la baja presencia de placa yugstagingival (Pontoriero et al., 1994; Salvi et al., 2012), PD superficial (Farina, Filippi, Brazzioli, Tomasi, & Trombelli, 2017) y una cantidad adecuada de KM (Chung, Oh, Shotwell, Misch, Wang, 2006, Perussolo et al., 2018). Nuestros hallazgos son consistentes con los derivados de una revisión sistemática reciente sobre complicaciones biológicas de los implantes dentales colocados ya sea en sitios prístinos o en sitios aumentados. El metaanálisis mostró una prevalencia similar de mucositis periimplantaria en pacientes que recibieron (19.6%; 95% CI: 0%–40%) o no recibieron (22.4%; 95% CI: 6%–38%) procedimientos para la preservación del reborde alveolar y/o aumento del reborde vertical/lateral (Salvi, Monje, Tomasi, 2018). Además, se informaron condiciones inflamatorias similares en implantes colocados en hueso nativo en comparación con implantes colocados concomitantemente con un procedimiento de GBR (Benic, Jung, Siegenthaler, Hammerle, 2009; Benic, Bernasconi, Jung, Hammerle, 2017).
Es notable considerar que en la reentrada, la gran mayoría de los pacientes que recibieron la técnica SPAL mostraron un grosor óseo peri-implantario ≥2 mm en la porción más coronal del implante. Aunque la medición de PBBP no estuvo disponible en la reentrada para el grupo de control (procedimiento de una sola etapa), se puede asumir la integridad de PBBP tras la remodelación ósea peri-implantaria post-inserción basada en datos preclínicos (Monje, et al., 2019) y clínicos (Spray, Black, Morris, & Ochi, 2000) sobre dimensiones críticas de la placa ósea bucal. En conjunto, los datos disponibles parecen sugerir que dimensiones verticales y horizontales adecuadas de los tejidos peri-implantarios logradas mediante procedimientos de aumento pueden favorecer condiciones para limitar la inflamación de los tejidos peri-implantarios. Sin embargo, la asociación de la integridad de PBBP hasta la porción más coronal del implante y la gravedad de la inflamación mucosa peri-implantaria no está del todo clara (Jung et al., 2017).
A los 6 meses de carga protésica, se observó una posición diferente del nivel óseo peri-implantario interproximal entre los grupos, con una RBL más apical en los grupos SPAL. Es notable que, en los grupos SPAL, los implantes de nivel de tejido se posicionaron ligeramente subcrestales (Figuras 1 y 2). Aunque esto pudo haber facilitado el injerto del saco periosteal hasta la parte más coronal del implante, así como el cierre por intención primaria, la posición subcrestal también podría haber contribuido al remodelado óseo interproximal (Saleh et al., 2018). Además, dado que los implantes que recibieron la técnica SPAL se sometieron a cirugía adicional para el descubrimiento, incluyendo un colgajo posicionado apicalmente o un injerto gingival libre, el remodelado óseo interproximal en los grupos SPAL también puede atribuirse en parte al efecto perjudicial de la elevación del colgajo sobre el suministro sanguíneo local. De manera consistente, se ha informado de pérdida ósea marginal peri-implantaria entre la reentrada para el descubrimiento y la entrega final de la prótesis por otros autores (Cardaropoli, Lekholm, Wennstrom, 2006, Nader et al., 2016). También se debe considerar que, en algunos pacientes del grupo SPALdehiscencia, el injerto se extendió a los aspectos mesial y/o distal del implante debido a una extensión interproximal del defecto óseo peri-implantario. En el grupo SPALdehiscencia, por lo tanto, la extensión del remodelado del injerto en los sitios interproximales puede haber impactado negativamente en los valores de RBL. Datos recientes han mostrado que incluso los biomateriales de injerto de reabsorción lenta, como el DBBM, están asociados con una reducción sustancial del área injertada en la evaluación radiográfica a los 12 meses tras procedimientos de aumento endosinusal (Franceschetti et al., 2019). Sin embargo, la magnitud de la RBL observada en el presente estudio es limitada en comparación con la reportada para implantes colocados con GBR concomitante o en hueso nativo (Urban et al., 2019) e implantes que presentan una dehiscencia bucal no tratada (Jung et al., 2017).
Se observó un KM y MSTL ligeramente más bajos para el grupo SPALdehiscencia. Esto ocurrió a pesar de que la manipulación del tejido blando peri-implantario se realizó adecuadamente para proporcionar dimensiones adecuadas de mucosa peri-implantaria queratinizada y una posición subgingival de los márgenes protésicos. Este hallazgo puede estar algo correlacionado con el aumento del remodelado óseo (RBL) observado en el grupo SPALdehiscencia, que también puede haber involucrado la placa ósea bucal regenerada. Una revisión sistemática reciente correlacionó el remodelado del hueso bucal con la ocurrencia de recesión del tejido blando peri-implantario (Aizcorbe-Vicente, Peñarrocha-Oltra, Canullo, Soto-Peñaloza, & Peñarrocha-Diago, 2020). En el grupo SPALdehiscencia, 1 paciente (9.1%) experimentó una dehiscencia de la herida a las 2 semanas que llevó a la exposición parcial de las roscas del implante en la reentrada. Este hallazgo se compara con la incidencia de dehiscencia de la herida y la consiguiente exposición de la membrana tras procedimientos de GBR para corregir la dehiscencia ósea peri-implantaria en el momento de la colocación, como se informó en un metaanálisis reciente realizado en estudios prospectivos y retrospectivos (Garcia et al., 2018). En particular, la exposición de la membrana ocurrió con una incidencia que varió del 16.7% (Tawil, El-Ghoule, & Mawla, 2001) al 62.8% (Gher, Quintero, Assad, Monaco, & Richardson, 1994), y se asoció con una cobertura de dehiscencia significativamente más baja (Garcia et al., 2018). Las limitaciones de este informe preliminar incluyen el diseño retrospectivo, el tamaño de muestra pequeño y el corto tiempo de seguimiento de 6 meses después de la restauración de los implantes. Además, el impacto de factores relacionados con el paciente (por ejemplo, grosor del tejido blando en el área edéntula, hábito de fumar, diabetes) y complicaciones relacionadas con la cirugía (por ejemplo, perforaciones de la capa periosteal y/o mucosa) en los resultados clínicos no se ha analizado de manera integral. Además, se han seleccionado condiciones clínicas específicas (es decir, PBBP delgada o dehiscencia ósea peri-implantaria de dimensión vertical limitada) para el tratamiento SPAL. Se necesitan más estudios para evaluar qué condiciones/lesiones clínicas pueden ser tratadas efectivamente con la técnica SPAL o si se debería preferir un tratamiento más convencional (por ejemplo, GBR).
En conclusión, los resultados del presente estudio mostraron que, después de 6 meses de carga protésica, los pacientes tratados con la técnica SPAL muestran una inflamación mucosa peri-implantaria limitada en asociación con una PD superficial y un KM adecuado. Sin embargo, en los implantes que recibieron la técnica SPAL, se encontró RBL interproximal apical a su posición ideal. Se necesita evaluar si y en qué medida los favorables resultados a corto plazo observados tras la técnica SPAL podrían ser beneficiosos para las condiciones saludables a largo plazo de los tejidos peri-implantarios y la estabilidad del perfil mucoso bucal.
Leonardo Trombelli, Mattia Pramstraller, Mattia Severi, Anna Simonelli, Roberto Farina
Referencias
- Ainamo, J., & Bay, I. (1975). Problemas y propuestas para el registro de gingivitis y placa. International Dental Journal, 25, 229–235.
- Aizcorbe-Vicente, J., Peñarrocha-Oltra, D., Canullo, L., Soto-Peñaloza, D., & Peñarrocha-Diago, M. (2020). Influencia del grosor del hueso facial después de la colocación del implante en las crestas curadas sobre el hueso facial remodelado y considerando la recesión del tejido blando: Una revisión sistemática. International Journal of Oral and Maxillofacial Implants, 35, 107–119. https://doi.org/10.11607/jomi.7259
- Benic, G. I., Bernasconi, M., Jung, R. E., & Hammerle, C. H. F. (2017). Comparación clínica y radiográfica intra-sujeto de implantes colocados con o sin regeneración ósea guiada: Resultados a 15 años. Journal of Clinical Periodontology, 44, 315–325. https://doi.org/10.1111/jcpe.12665
- Benić, G. I., Jung, R. E., Siegenthaler, D. W., & Hämmerle, C. H. F. (2009). Comparación clínica y radiográfica de implantes en hueso regenerado o nativo: Resultados a 5 años. Clinical Oral Implant Research, 20, 507–513. https://doi.org/10.1111/j.1600-0501.2008.01583.x
- Berglundh, T., Armitage, G., Araujo, M. G., Avila-Ortiz, G., Blanco, J., Camargo, P. M., Zitzmann, N. (2018). Enfermedades y condiciones peri-implantarias: Informe de consenso del grupo de trabajo 4 del Taller Mundial de Clasificación de Enfermedades y Condiciones Periodontales y Peri-Implantarias 2017. Journal of Clinical Periodontology, 45(Suppl 20), S286–S291. https://doi.org/10.1034/j.1600-0501.1994.050409.x
- Cardaropoli, G., Lekholm, U., & Wennstrom, J. L. (2006). Alteraciones tisulares en reemplazos de dientes individuales soportados por implantes: Un estudio clínico prospectivo de 1 año. Clinical Oral Implant Research, 17, 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x
- Chung, D. M., Oh, T. J., Shotwell, J. L., Misch, C. E., & Wang, H. L. (2006). Significado de la mucosa queratinizada en el mantenimiento de implantes dentales con diferentes superficies. Journal of Periodontology, 77, 1410–1420. https://doi.org/10.1902/jop.2006.050393
- Cohen, J. (1988). Análisis del poder estadístico para las ciencias del comportamiento, 2ª ed. Mahwah, NJ: Lawrence Erlbaum Associated Publishers.
- Farina, R., Filippi, M., Brazzioli, J., Tomasi, C., & Trombelli, L. (2017). Sangrado al sondear alrededor de implantes dentales: Un estudio retrospectivo de factores asociados. Journal of Clinical Periodontology, 44, 115–122. https://doi.org/10.1111/jcpe.12647
- Franceschetti, G., Farina, R., Minenna, L., Riccardi, O., Stacchi, C., Di Raimondo, R., … Trombelli, L. (2019). El impacto de la remodelación del injerto en el soporte óseo peri-implantario en implantes colocados concomitantemente con elevación del piso del seno transcrestal: Una serie de casos retrospectiva multicéntrica. Clinical Oral Implant Research, 31(2), 1–16. https://doi.org/10.1111/clr.13541
- Garcia, J., Dodge, A., Luepke, P., Wang, H. L., Kapila, Y., & Lin, G. H. (2018). Efecto de la exposición de la membrana en la regeneración ósea guiada: Una revisión sistemática y metaanálisis. Clinical Oral Implants Research, 29, 328–338. https://doi.org/10.1111/clr.13121
- Gher, M. E., Quintero, G., Assad, D., Monaco, E., & Richardson, A. C. (1994). Injerto óseo y regeneración ósea guiada para implantes dentales inmediatos en humanos. Journal of Periodontology, 65, 881–891. https://doi.org/10.1902/jop.1994.65.9.881
- Hämmerle, C. H., Chen, S. T., & Wilson, T. G. Jr (2004). Declaraciones de consenso y procedimientos clínicos recomendados respecto a la colocación de implantes en alvéolos de extracción. International Journal of Oral and Maxillofacial Implants, 19(suppl), 26–28.
- Jepsen, S., Rühling, A., Jepsen, K., Ohlenbusch, B., & Albers, H. K. (1996). Peri-implantitis progresiva. Incidencia y predicción de la pérdida de inserción peri-implantaria. Clinical Oral Implants Research, 7, 133–142. https://doi.org/10.1034/j.1600-0501.1996.070207.x
- Jung, R. E., Herzog, M., Wolleb, K., Ramel, C. F., Thoma, D. S., & Hammerle, C. H. F. (2017). Un ensayo clínico controlado aleatorio que compara pequeños defectos de dehiscencia bucal alrededor de implantes dentales tratados con regeneración ósea guiada o dejados para curación espontánea. Clinical Oral Implants Research, 28, 348–354. https://doi.org/10.1111/clr.12806
- Luterbacher, S., Mayfield, L., Brägger, U., & Lang, N. P. (2000). Características diagnósticas de pruebas clínicas y microbiológicas para el monitoreo de las condiciones de los tejidos mucosos periodontales y peri-implantarios durante la terapia periodontal de soporte (SPT). Clinical Oral Implants Research, 11, 521–529. https://doi.org/10.1034/j.1600-0501.2000.011006521.x
- Merheb, J., Vercruyssen, M., Coucke, W., Beckers, L., Teughels, W., & Quirynen, M. (2017). El destino del hueso bucal alrededor de implantes dentales. Un estudio de seguimiento de 12 meses después de la carga. Clinical Oral Implants Research, 28, 103–108. https://doi.org/10.1111/clr.12767
- Monje, A., Chappuis, V., Monje, F., Muñoz, F., Wang, H. L., Urban, I. A., & Buser, D. (2019). El grosor crítico de la pared ósea bucal peri-implantaria revisitado: Un estudio experimental en el perro Beagle. Int J Oral Maxillofac Implants, 34, 1328–1336. https://doi.org/10.11607/jomi.7657
- Nader, N., Aboulhosn, M., Berberi, A., Manal, C., & Younes, R. (2016). Remodelación ósea marginal alrededor del pilar de cicatrización vs colocación del pilar final en la cirugía de segundo tiempo: Un ensayo clínico aleatorio de 12 meses. Journal of Contemporary Dental Practice, 17, 7–15. https://doi.org/10.5005/jp-journals-10024
- O'Leary, T. J., Drake, R. B., & Naylor, J. E. (1972). El registro de control de placa. Journal of Periodontology, 43, 38. https://doi.org/10.1902/jop.1972.43.1.38
- Perussolo, J., Souza, A. B., Matarazzo, F., Oliveira, R. P., & Araújo, M. G. (2018). Influencia de la mucosa queratinizada en la estabilidad de los tejidos peri-implantarios y la incomodidad al cepillarse: Un estudio de seguimiento de 4 años. Clinical Oral Implant Research. Journal of Clinical Periodontology, 29, 1177–1185. https://doi.org/10.1111/clr.13381
- Pontoriero, R., Tonelli, M. P., Carnevale, G., Mombelli, A., Nyman, S. R., & Lang, N. P. (1994). Mucositis peri-implantaria inducida experimentalmente. Un estudio clínico en humanos. Clinical Oral Implants Research, 5, 254–259. https://doi.org/10.1034/j.1600-0501.1994.050409.x
- Renvert, S., Persson, G. R., Pirih, F. Q., & Camargo, P. M. (2018). Salud peri-implantaria, mucositis peri-implantaria y peri-implantitis: Definiciones de casos y consideraciones diagnósticas. Journal of Clinical Periodontology, 45(Suppl 20), S278–S285. https://doi.org/10.1111/jcpe.12956
- Saleh, M. H. A., Ravidà, A., Suárez-López Del Amo, F., Lin, G.-H., Asa'ad, F., & Wang, H.-L. (2018). El efecto de la posición de la unión implante-pilar en la pérdida ósea crestal: Una revisión sistemática y metaanálisis. Clinical Implant Dentistry and Related Research, 20, 617–633. https://doi.org/10.1111/cid.12600
- Salvi, G. E., Aglietta, M., Eick, S., Sculean, A., Lang, N. P., & Ramseier, C. A. (2012). Reversibilidad de la mucositis peri-implantaria experimental en comparación con la gingivitis experimental en humanos. Clinical Oral Implants Research, 23, 182–190. https://doi.org/10.1111/j.1600-0501.2011.02220.x
- Salvi, G. E., Monje, A., & Tomasi, C. (2018). Complicaciones biológicas a largo plazo de los implantes dentales colocados ya sea en sitios prístinos o aumentados: Una revisión sistemática y metaanálisis. Clinical Oral Implant Research, 29(Suppl. 16), 294–310. https://doi.org/10.1111/clr.13123
- Sanz-Sánchez, I., Carrillo de Albornoz, A., Figuero, E., Schwarz, F., Jung, R., Sanz, M., & Thoma, D. (2018). Efectos de los procedimientos de aumento óseo lateral en la salud o enfermedad peri-implantaria: Una revisión sistemática y metaanálisis. Clinical Oral Implants Research, 29, 18–31. https://doi.org/10.1111/clr.13126
- Sanz-Sánchez, I., Ortiz-Vigón, A., Sanz-Martín, I., Figuero, E., & Sanz, M. (2015). Efectividad del aumento óseo lateral en la dimensión de la cresta alveolar: Una revisión sistemática y metaanálisis. Journal of Dental Research, 94, 1s–15s. https://doi.org/10.1177/0022034515594780
- Schwarz, F., Sahm, N., & Becker, J. (2012). Impacto del resultado de la regeneración ósea guiada en defectos tipo dehiscencia sobre la estabilidad a largo plazo de la salud peri-implantaria: Observaciones clínicas a los 4 años. Clinical Oral Implants Research, 23, 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x
- Spray, J. R., Black, C. G., Morris, H. F., & Ochi, S. (2000). La influencia del grosor óseo en la respuesta ósea marginal facial: Colocación de la etapa 1 a través de la etapa 2 de descubrimiento. Annals of Periodontology, 5, 119–128. https://doi.org/10.1902/annals.2000.5.1.119
- Tawil, G., El-Ghoule, G., & Mawla, M. (2001). Evaluación clínica de una membrana de colágeno de dos capas (bio-gide) soportada por injertos autólogos en el tratamiento de defectos óseos alrededor de implantes. The International Journal of Oral & Maxillofacial Implants, 16, 857–863.
- Thoma, D. S., Bienz, S. P., Figuero, E., Jung, R. E., & Sanz-Martín, I. (2019). Efectos de los procedimientos de aumento de tejido blando en la salud o enfermedad peri-implantaria: Una revisión sistemática y metaanálisis. Journal Clinical Periodontology, 46(Suppl 21), 257–276. https://doi.org/10.1111/jcpe.13050
- Trombelli, L., Farina, R., Ferrari, S., Pasetti, P., & Calura, G. (2009). Comparación entre dos métodos para la evaluación del riesgo periodontal. Minerva Stomatologica, 58, 277–287.
- Trombelli, L., Minenna, L., Toselli, L., Zaetta, A., Checchi, L., Checchi, V., … Farina, R. (2017). Valor pronóstico de un método simplificado para la evaluación del riesgo periodontal durante la terapia periodontal de soporte. Journal of Clinical Periodontology, 44, 51–57. https://doi.org/10.1111/jcpe.12645
- Trombelli, L., Severi, M., Farina, R., & Simonelli, A. (2020). Técnica de capa aumentada sub-perióstica peri-implantaria para tratar lesiones de peri-implantitis. Clinical Advances in Periodontics. https://doi.org/10.1002/ cap.10107. [Epub ahead of print].
- Trombelli, L., Severi, M., Pramstraller, M., & Farina, R. (2018). Técnica de capa aumentada sub-perióstica peri-implantaria para aumento óseo horizontal en la colocación de implantes. Minerva Stomatologica, 67, 217–224. https://doi.org/10.23736/S0026-4970.18.04161-4
- Trombelli, L., Severi, M., Pramstraller, M., & Farina, R. (2019). Una gestión simplificada de tejido blando para el aumento óseo peri-implantario. International Journal of Oral and Maxillofacial Implants, 34, 197–204. https://doi.org/10.11607/jomi.6959
- Urban, I. A., Wessing, B., Alández, N., Meloni, S., González-Martin, O., Polizzi, G., … Zechner, W. (2019). Un ensayo clínico controlado aleatorio multicéntrico utilizando una nueva membrana de colágeno para la regeneración ósea guiada en sitios de implantes dehiscente: Resultado en la entrega protésica y en el seguimiento a 1 año. Clinical Oral Implant Research, 30, 487–497. https://doi.org/10.1111/clr.13426
- Zitzmann, N. U., Schärer, P., & Marinello, C. P. (2001). Resultados a largo plazo de implantes tratados con regeneración ósea guiada: Un estudio prospectivo de 5 años. International Journal of Oral and Maxillofacial Implants, 16, 355–366.