Aumento óseo peri-implantario mediante la técnica de capa aumentada subperióstica y un bloque óseo de origen bovino: un informe de caso
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Antecedentes: Cuando se utiliza con mineral óseo bovino desproteinizado (DBBM) entregado en forma de partículas, la técnica de capa aumentada subperióstica peri-implantaria (SPAL) fue efectiva en corregir completamente hasta el 92% de las dehiscencias óseas bucales peri-implantarias. Sin embargo, el uso de un bloque de DBBM (bDBBM) puede resultar en una mejora de la dehiscencia ósea peri-implantaria así como un relevante aumento óseo lateral, ya que sus propiedades mecánicas pueden asegurar una mejor estabilidad dimensional durante la manipulación del colgajo que el DBBM en partículas. El objetivo del presente informe de caso prueba de principio es investigar si SPAL puede ser utilizado con éxito para obtener aumento óseo en sitios de dehiscencia peri-implantaria cuando se utiliza con bDBBM.
Presentación del caso: Se realizó un aumento óseo lateral utilizando la técnica SPAL en dos implantes que mostraban una dehiscencia ósea peri-implantaria bucal inmediatamente después de su colocación. Se elevó un colgajo de grosor parcial, dejando la capa periosteal en la placa ósea cortical bucal. La capa periosteal fue, a su vez, elevada para crear un bolsillo, que se utilizó para estabilizar un injerto de bDBBM en las dehiscencias óseas bucales peri-implantarias. En la reentrada, las superficies expuestas de los implantes estaban completamente cubiertas por nuevo tejido duro grueso hasta su porción más coronal. Se utilizó un injerto de tejido epitelial-conectivo libre para aumentar el fenotipo de tejido blando peri-implantario.
Conclusión: Cuando se utiliza para acomodar bDBBM sobre la porción más coronal de un implante expuesto, SPAL puede llevar con éxito a un aumento en el grosor del tejido bucal peri-implantario. Clin Adv Periodontics 2022;12:39–43.
Antecedentes
Se propuso recientemente una técnica simplificada para aumentar el componente óseo del fenotipo peri-implantario en la colocación del implante, a saber, la capa aumentada subperióstica peri-implantaria (SPAL). SPAL se basa en la separación del colgajo bucal en dos capas: una capa perióstica, que crea un espacio “osteogénico” protegido para estabilizar un injerto en una placa ósea bucal peri-implantaria delgada o deficiente, y una capa mucosa, que se moviliza para proporcionar una curación por intención primaria. Estudios previos han demostrado que SPAL puede resultar en una corrección sustancial de dehiscencia, proporcionando así condiciones para la salud peri-implantaria en los implantes tratados. Además, se ha demostrado que SPAL es efectivo en el tratamiento de defectos de peri-implantitis tipo dehiscencia asociados con un componente interproximal o circunferencial.
En todos los casos tratados con SPAL, un mineral óseo bovino desproteinizado (DBBM) – entregado en forma de partículas – se ha acomodado entre la capa periosteal y la superficie expuesta del implante. Aunque se ha demostrado que es efectivo como un andamiaje osteoconductivo para obtener una cobertura completa de las dehiscencias óseas periimplantarias, el DBBM particulado podría estar asociado con un aumento limitado en el grosor de la placa ósea bucal.
Los estudios preclínicos y clínicos parecen sugerir que la regeneración ósea guiada (GBR) puede resultar en una mejora de la dehiscencia ósea periimplantaria, así como en una relevante augmentación ósea lateral cuando se utiliza con un bloque de DBBM (bDBBM). El presente estudio consiste en un informe de caso de prueba de principio destinado a investigar si SPAL puede ser utilizado con éxito para obtener augmentación ósea en sitios de dehiscencia periimplantaria cuando se utiliza con bDBBM.
Aspectos éticos
El presente informe fue aprobado por el Comité Ético del Área Vasta Emilia Centro, Italia (protocolo n°637/2018/Oss/UniFe, fecha de aprobación 12.12.2018). La paciente proporcionó un consentimiento informado por escrito antes del tratamiento quirúrgico. Todos los procedimientos clínicos se han realizado de acuerdo con la Declaración de Helsinki y las Buenas Prácticas Clínicas.
Presentación Clínica, Manejo del Caso y Resultados Clínicos
En octubre de 2020, una paciente femenina de 50 años, no fumadora y sistemáticamente sana, se presentó para la rehabilitación de un área edéntula (#18 y #19; Figuras 1A,B). Después de un tratamiento para la periodontitis en etapa III, la paciente presentó un índice de sangrado al sondeo <10% y ningún sitio con profundidad de sondeo ≥ 5 mm y fue inscrita en un programa de apoyo
programa de cuidado periodontal. Se programó una rehabilitación soportada por implantes en el área #18 y #19.
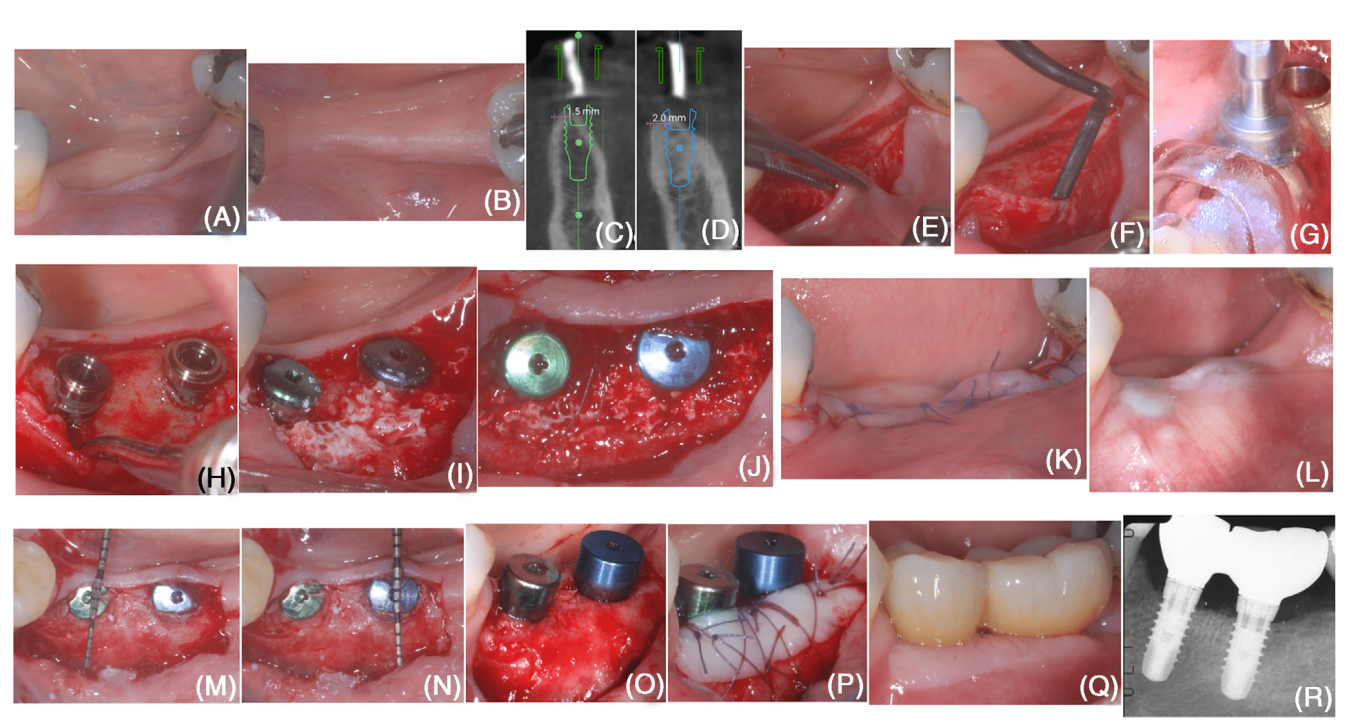
La posición del implante fue planificada digitalmente en un examen de tomografía computarizada de haz cónico, y se fabricó una guía quirúrgica (Figura). La planificación digital previó la formación de una dehiscencia bucal en la colocación de ambos implantes, sugiriendo la necesidad de un procedimiento de aumento óseo horizontal (Figuras 1C,D).
Se administraron 2 g de amoxicilina + ácido clavulánico 1 h antes de la cirugía. Se logró anestesia local utilizando articaína con 1:100,000 de epinefrina administrada por infiltración local.
En el aspecto bucal, se levantó un colgajo de espesor parcial (creando la “capa mucosa”), dejando intacta la capa periosteal en la cresta edéntula (Figura 1E). Luego, la capa periosteal se elevó de la cresta ósea mediante un elevador periosteal microsúrgico y cuchillos de tunelización con bordes afilados angulados variados (Figura 1F). En el aspecto lingual, se elevó un colgajo de espesor completo. La elevación se extendió en dirección apical para desprender las fibras superficiales del músculo milohioideo y obtener un colgajo lingual sin tensión.
Los sitios de implante se prepararon utilizando la guía quirúrgica asistida por computadora (Figura 1G), y se posicionaron dos implantes a nivel de tejido (Figura 1H). Los implantes presentaron una dehiscencia bucal (medida como la distancia entre el margen apical del collar pulido del implante y la cresta ósea en el aspecto bucal del implante) de 3 mm en el #19 y 2 mm en el #18. Se realizaron perforaciones corticales utilizando una fresa de carburo.
El bDBBM se recortó utilizando una fresa de diamante de alta velocidad para obtener un grosor homogéneo de 3–4 mm y se adaptó debajo de la capa periosteal para cubrir completamente la superficie expuesta del implante (Figura 1I). Utilizando una sutura reabsorbible 6/0, se estabilizó la capa periosteal al colgajo lingual mediante suturas internas en colchón (Figura 1J). La capa mucosa se avanzó coronariamente para lograr el cierre primario de la herida (Figura 1K).
Se instruyó al paciente para evitar cualquier compresión del sitio quirúrgico y no masticar ni cepillarse en el área tratada durante 2 semanas. Se prescribió un enjuague bucal de clorhexidina al 0.12% (enjuague de 1 minuto dos veces al día durante 3 semanas). Se retiraron los puntos a las 2 semanas después de la cirugía.
A los 6 meses de la colocación del implante (Figura 1L), se realizó un procedimiento de reingreso para la exposición del implante utilizando un colgajo bucal de grosor parcial. Las superficies del implante previamente expuestas fueron completamente cubiertas por nuevo tejido que tenía al menos 3 mm de grosor en la porción más coronal de ambos implantes (Figuras 1M–O). El tejido reconstruido ofreció una clara resistencia a la penetración con una sonda periodontal cuando esta se utilizó con una fuerza de sondeo de aproximadamente 50 N por el operador capacitado. Se utilizó un injerto libre de epitelio y tejido conectivo para aumentar el fenotipo de tejido blando peri-implantario (Figura 1P).
Se tomó una impresión digital 4 semanas después de la exposición del implante. La forma y el perfil de emergencia de la restauración final fueron planificados digitalmente. Se fresaron dos coronas atornilladas de un monobloque de zirconia y se cementaron en los insertos de titanio de acuerdo con las instrucciones del fabricante. La restauración final se atornilló 4 semanas después de la impresión.
Las condiciones del tejido peri-implantario parecieron adecuadas tanto en el examen clínico como radiográfico (Figuras 1Q–R).
Discusión
El presente informe de caso sugiere que el bDBBM puede representar una alternativa adecuada al DBBM particulado al aplicar la técnica SPAL para la augmentación ósea en sitios de dehiscencia peri-implante.
En la técnica SPAL, la estabilización del injerto en el espacio subperióstico se asegura mediante la sutura de su parte más coronal (limitando así la acción perjudicial de las fuerzas mecánicas disruptivas sobre la mezcla de coágulo/injerto y favoreciendo el contacto íntimo de este último con la estructura altamente vascularizada del periostio) y la posterior cobertura por la capa mucosa. Uno de los posibles inconvenientes al usar DBBM particulado es el desplazamiento y/o compresión potencial de las partículas del injerto alrededor de la porción coronal del implante durante la sutura. Esta consideración está bien fundamentada en la literatura para la asociación de DBBM particulado y GBR. En contraste, el bDBBM puede actuar como un andamiaje osteoconductivo eficaz mientras que sus propiedades mecánicas asegurarían una mejor estabilidad dimensional durante la manipulación del colgajo. Estudios preclínicos y clínicos anteriores parecen corroborar nuestros hallazgos. Por otro lado, la rigidez del injerto en bloque requiere una adaptación pasiva ideal de la capa mucosa para minimizar el riesgo de perforación del colgajo y exposición del injerto.
La exposición del implante se realizó a través de un colgajo de espesor parcial, evitando así la inspección directa de los tejidos reconstruidos bajo el periostio. Junto con la falta de un análisis histológico y/o una evaluación radiográfica tridimensional postoperatoria del espacio peri-implantario, se impide la posibilidad de sacar cualquier conclusión sobre la naturaleza de los tejidos reconstruidos en el aspecto bucal previamente expuesto de los implantes. Aunque el grosor del tejido (≥ 3 mm) y su alta resistencia a la penetración de la sonda en la reentrada podrían ser sugestivos de la presencia de un componente mineralizado en una etapa de maduración avanzada, cualquier consideración sobre la calidad de los tejidos subperiósticos sigue siendo especulativa, basándose exclusivamente en la percepción mecánica del operador durante la inspección con sonda. Los datos disponibles derivados de estudios experimentales y muestras histológicas humanas de 6 meses donde se utilizó bDBBM para la augmentación ósea lateral mostraron una formación de nuevo hueso más limitada, principalmente ubicada en la interfaz hueso nativo-bDBBM, en comparación con DBBM particulado. Estas observaciones parecen reforzar la necesidad de mejorar las condiciones osteogénicas de la herida (por ejemplo, perforaciones corticales, uso de factores de crecimiento adicionales) y/o esperar un tiempo de maduración más prolongado antes de la exposición del implante cuando se utiliza bDBBM. Las observaciones clínicas derivadas del presente informe de caso se acumulan con evidencia previa de informes de casos y series de casos retrospectivos sobre la técnica SPAL. En general, los datos demuestran que SPAL se puede utilizar con éxito para la augmentación ósea peri-implantaria con un xenoinjerto de origen bovino en una variedad de escenarios clínicos en términos de topografía del implante (es decir, sextante anterior/posterior y arco maxilar/mandibular) así como condiciones de la placa ósea bucal en el momento de la colocación del implante. En particular, se informó de una augmentación clínicamente relevante para implantes con dehiscencia ósea bucal o una placa ósea bucal intacta pero delgada en el momento de la colocación. Dentro de los implantes con dehiscencia ósea, se corrigieron con éxito profundidades de defecto de hasta 6 mm con SPAL. Desafortunadamente, aunque alentadores, los datos disponibles no son suficientes para delinear claramente las indicaciones/contraindicaciones locales de la técnica SPAL ni aclarar qué factores pueden influir en los resultados clínicos del procedimiento.
Conclusión
El presente informe de caso de prueba de principio indica que la técnica SPAL puede ser utilizada con éxito para acomodar bDBBM sobre la porción más coronal de un implante expuesto y lograr un aumento en el grosor del tejido bucal peri-implantario.
Leonardo Trombelli, Mattia Severi, Luca Ortensi y Roberto Farina
Referencias
- Avila-Ortiz G, Gonzalez-Martin O, Couso-Queiruga E, Wang HL. El fenotipo peri-implantario. J Periodontol. 2020;91:283-288.
- Trombelli L, Severi M, Pramstraller M, Farina R. Técnica de capa aumentada subperióstica peri-implantaria para la augmentación ósea horizontal en la colocación de implantes. Minerva Stomatol. 2018;67:217-224.
- Trombelli L, Severi M, Pramstraller M, Farina R. Un manejo simplificado de tejidos blandos para la augmentación ósea peri-implantaria. Int J Oral Maxillofac Implants. 2019;34:197-204.
- Trombelli L, Pramstraller M, Severi M, Simonelli A, Farina R. Condiciones del tejido peri-implantario en implantes tratados con la técnica de Capa Aumentada Subperióstica: una serie de casos retrospectiva. Clin Oral Impl Res. 2020;31:992-1001.
- Trombelli L, Severi M, Farina R, Simonelli A. Técnica de Capa Aumentada Subperióstica para tratar lesiones de peri-implantitis. Clin Adv Periodontics. 2020;10:169-174.
- Benic GI, Thoma DS, Munoz F, Martin IS, Jung RE, Hämmerle CHF. Regeneración ósea guiada de defectos peri-implantarios con sustitutos óseos xenogénicos particulados y en bloque. Clin Oral Impl Res. 2016;27:567-576.
- Benic GI, Thoma DS, Sanz-Martin I, et al. Regeneración ósea guiada en implantes dentales de zirconia y titanio: una investigación histológica piloto. Clin Oral Impl Res. 2017;00:1-9.
- Benic GI, Eisner BM, Jung RE, Basler T, Schneider D, Hämmerle CHF. Cambios en el tejido duro después de la regeneración ósea guiada de defectos peri-implantarios comparando sustitutos óseos en bloque versus particulados: resultados de 6 meses de un ensayo clínico controlado aleatorio. Clin Oral Impl Res. 2019;30:1016-1026.
- Ainamo J, Bay I. Problemas y propuestas para registrar gingivitis y placa. Int Dent J. 1975;25:229-235.
- Mir-Mari J, Wui H, Jung RE, Hämmerle CHF, Benic GI. Influencia del cierre de heridas a ciegas sobre la estabilidad del volumen de diferentes materiales GBR: un examen tomográfico por cono en vitro. Clin Oral Impl Res. 2015;27:258-265.
- Naenni N, Berner T, Waller T, Huesler J, Hammerle CHF, Thoma DS. Influencia del cierre de heridas sobre la estabilidad del volumen con la aplicación de diferentes materiales GBR: un estudio tomográfico por cono en vitro. J Periodontal Implant Sci. 2019;49:14-24.
- Laass A, Hämmerle CHF, Jung RE, Thoma DS, Benic GI. Resultados histológicos después de la regeneración ósea guiada de defectos peri-implantarios comparando sustitutos óseos en bloque moldeados individualmente versus particulados. Int J Periodontics Restorative Dent. 2020;40:519-527.
- Araujo MG, Sonohara M, Hayacibara R, Cardaropoli G, Lindhe J. Aumento del reborde lateral mediante el uso de injertos compuestos de hueso autólogo o un biomaterial. Un experimento en el perro. J Clin Periodontol. 2002;29:1122-1131.
- Oda A, Kinoshita K, Ueda M. Efectos de la perforación del hueso cortical en la distracción periostal: un estudio experimental en la mandíbula del conejo. J Oral Maxillofac Surg. 2009;67:1478-1485.
- Schwarz F, Rothamel D, Herten M, Ferrari D, Sager M, Becker J. Aumento del reborde lateral utilizando sustitutos óseos particulados o en bloque biocubiertos con rhGDF-5 y rhBMP-2: un estudio inmunohistoquímico en perros. Clin Oral Impl Res. 2008;19:642-652.