Colonización microbiana en la interfaz implante-abutment y su posible influencia en la periimplantitis: Una revisión sistemática y metaanálisis
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Propósito: El objetivo de esta revisión sistemática y metaanálisis fue evaluar la colonización microbiana en las interfaces implante-pilar (IAI) en implantes a nivel óseo e identificar posibles asociaciones con condiciones peri-implantarias.
Selección de estudios: La pregunta central buscó responder si los implantes oseointegrados de dos piezas, en funcionamiento durante al menos 1 año, en humanos, se relacionan con un mayor recuento bacteriano y la aparición de periimplantitis, en comparación con condiciones peri-implantarias saludables. La estrategia de búsqueda abarcó la literatura en línea (MedLine, Google Scholar, biblioteca Cochrane) desde 1990 hasta marzo de 2015 publicada en inglés utilizando combinaciones de MeSH (Términos Médicos en Inglés) y términos de búsqueda. La evaluación de calidad de los artículos de texto completo seleccionados se realizó de acuerdo con las directrices de la declaración ARRIVE y CONSORT. Para el análisis de datos, se calculó el recuento total de bacterias de Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola, Prevotella intermedia y Fusobacterium nucleatum y se comparó con IAI con o sin patología peri-implantaria.
Resultados: Un total de 14 artículos, que informan datos de 1126 implantes, cumplieron con los criterios de inclusión y fueron sometidos a evaluación de calidad. Los estudios seleccionados revelaron contaminación del IAI, en pacientes que recibieron sistemas de implantes de dos piezas. El meta-análisis indicó una diferencia significativa en el recuento total de bacterias entre los implantes afectados por periimplantitis versus tejidos periimplantarios sanos (0.387 0.055; IC del 95% 0.279–0.496). Se identificaron menos recuentos bacterianos en el IAI sano para todas las bacterias gramnegativas investigadas, excepto para T. forsythia.
Introducción
Los microespacios en la interfaz implante-abutment (IAI) son típicos de los sistemas de implantes dentales osseointegrados de dos piezas y parecen desempeñar un papel significativo en la colonización bacteriana en el surco periimplantario. Esto, a su vez, puede dar lugar a reacciones inflamatorias periimplantarias y, posteriormente, a la pérdida de hueso de soporte. La fuga bacteriana en el IAI junto con los ensamblajes de tornillos de abutment que actúan como reservorios bacterianos pueden desencadenar una respuesta del huésped con tejidos blandos inflamados y posible pérdida marginal de hueso periimplantario.
La colonización bacteriana del espacio en el IAI también se ha implicado en el establecimiento del ancho biológico fisiológico. La mayor parte de la pérdida ósea marginal se informó durante el primer año después de la colocación del implante, después de lo cual, en pacientes con niveles adecuados de higiene oral, los niveles óseos marginales se estabilizaron a lo largo de los años. La microfiltración en el espacio entre el implante y el pilar puede permitir el paso de ácidos, enzimas, bacterias y/o sus productos metabólicos que afectan directamente el tejido periodontal, causando sangrado, hinchazón y olor. Sin embargo, se supone que las conexiones de morse taper presentan niveles más bajos de microfiltración y pérdida ósea marginal que los implantes de conexión externa.
Una revisión reciente de la literatura describió Porphyromonas gingivalis, Treponema denticola y Tannerella forsythia, encontrados en muestras de biofilm subgingival, como microorganismos que tienen una evidencia moderada de asociación con el inicio de la periimplantitis. Por el contrario, solo se encontró alguna evidencia para Prevotella intermedia y Campylobacter rectus. En las condiciones anaerobias, como las presentes dentro del IAI, las cifras microbiológicas podrían ser responsables de la selección, a medio-largo plazo, de especies microbiológicas capaces de desencadenar el proceso de periimplantitis.
Los objetivos de esta revisión sistemática y metaanálisis fueron evaluar la colonización microbiológica en la interfaz implante-pilar en implantes de dos piezas a nivel óseo, independientemente de la configuración de la conexión, e investigar si se relaciona con la aparición de periimplantitis.
Selección del estudio
Esta revisión sistemática se ajustó a las pautas de los Elementos Preferidos para Informes de Revisiones Sistemáticas y Metaanálisis (PRISMA) (http://www.prisma-statement.org). El protocolo de esta revisión sistemática ha sido publicado en el registro prospectivo internacional de revisiones sistemáticas (PROSPERO, http://www.crd.york.ac.uk/PROSPERO/) con el número de registro CRD42016037481. La pregunta focal de la revisión fue identificar si existe una relación entre la presencia de un mayor recuento bacteriano y la aparición de periimplantitis, en comparación con condiciones periimplantarias saludables en pacientes con implantes oseointegrados de dos piezas después de al menos 1 año de función. La periimplantitis se definió por la presencia de una profundidad de sondaje peri-implantaria ≥5 mm asociada con sangrado al sondear y/o supuración, y imágenes radiográficas de pérdida ósea ≥3 mm, en comparación con radiografías iniciales en el momento de la entrega de la restauración protésica.
2.1. Fuentes de información
Se buscaron artículos publicados solo en inglés que informaran sobre la colonización microbiana en el IAI y su relación con el inicio de la periimplantitis, publicados desde 1990 hasta marzo de 2015 en la base de datos PubMed de la Biblioteca Nacional de Medicina de EE. UU. (http://www.ncbi.nlm.nih.gov/pubmed/), Google Scholar (http://www.google.com) y la Biblioteca Cochrane (http://www.cochranelibrary.com/). Además, se revisaron manualmente las referencias de los artículos incluidos para encontrar artículos adicionales.
2.2. Estrategia de búsqueda
Inicialmente, la pregunta PICOS (Población (P), Intervención (I), Comparación (C), Resultados y Diseño del Estudio (O), Tipo de Estudio (S)) definió la estrategia de búsqueda, donde P=Implantes oseointegrados de dos piezas con un diagnóstico de periimplantitis después de al menos 1 año de función; I=Colonización microbiana en el IAI; C=Condiciones periimplantarias saludables; O=Tasa de supervivencia; S=Ensayos clínicos controlados aleatorios (ECA) y estudios de seguimiento clínico.
Las bases de datos electrónicas se buscaron utilizando combinaciones de términos MeSH (Términos Médicos de Asunto), términos de búsqueda y sus combinaciones: “implantes dentales” [MeSH] Y “contaminación bacteriana” O “presencia de bacterias” O “filtración dental/microbiología” [MeSH] O “microfiltración” O “hallazgos microbiológicos” O “colonización microbiológica” O “microbiota” O “microflora peri-implantaria” Y “periimplantitis” [MeSH] O “patología peri-implantaria” O “enfermedad peri-implantaria” Y “Abutments Dentales*/microbiología” [MeSH] “conexión, implante-abutment” O “diseño de implante-abutment dental” [MeSH] O “unión implante-abutment” O “microgap implante-abutment” O “espacio interno de los implantes dentales” O “parte interna de los implantes dentales”.
2.3. Selección de estudios y criterios de elegibilidad
Todos los títulos y resúmenes de los estudios seleccionados se evaluaron primero según los siguientes criterios de inclusión: (1) Artículos escritos en inglés; (2) estudios con un examen clínico de los pacientes; (3) estudios que evalúan los recuentos de diferentes especies bacterianas (recuento bacteriano, BC) a nivel de IAI en pacientes que recibieron sistemas de implantes de nivel óseo de dos etapas, independientemente de la configuración de la conexión; (4) Ensayos clínicos controlados aleatorios (RCTs), estudios de cohorte prospectivos o estudios transversales que informan sobre implantes en función durante al menos 1 año.
Después de evaluar el texto completo de los artículos de acuerdo con los criterios de exclusión definidos previamente, no se consideraron elegibles los artículos con las siguientes características, sin restricción en los idiomas: (a) Cartas, revisiones narrativas o históricas; (2) estudios en animales y en vitro; (3) Informes sobre sitios y/o condiciones comprometidos local o sistémicamente (es decir, defecto óseo mayor antes de la implantación, patologías óseas, radioterapia de cabeza y cuello, tratamiento con bisfosfonatos); (4) informes sobre pacientes que recibieron desbridamiento mecánico en los 3 meses anteriores o antibióticos en los últimos 6 meses antes del análisis.
2.4. Proceso de recolección de datos
Dos revisores calibrados (M.C. y L.C.) examinaron y recolectaron los datos de los artículos seleccionados en tablas estructuradas. Se calcularon los valores de Kappa de Cohen entre los examinadores tanto en la primera como en la segunda etapa de la investigación. Las discrepancias se resolvieron por consenso y se consultó a un tercer examinador (M.T.).
Se seleccionaron artículos sin resúmenes pero con títulos relacionados con los objetivos de esta revisión y se evaluó su texto completo para determinar su elegibilidad. Las listas de referencias de los artículos seleccionados se revisaron adicionalmente en busca de posibles artículos adicionales. Además, se realizaron búsquedas manuales en las bibliografías de revisiones sistemáticas seleccionadas, limitadas a las siguientes revistas: Clinical Implant Dentistry and Related Research; Clinical Oral Implants Research; International Journal of Oral and Maxillofacial Implants; Journal of Clinical Periodontology; Journal of Periodontology.
2.5. Evaluación de la calidad, heterogeneidad y riesgo de sesgo de estudios individuales
Los mismos revisores evaluaron el riesgo de sesgo en la muestra incluida de acuerdo con las directrices proporcionadas por la declaración CONSORT para la evaluación de ensayos controlados aleatorios (http://www.consort-statement.org), la declaración STROBE para estudios observacionales (http://www.strobe-statement.org), así como los ítems modificados de la herramienta de la Colaboración Cochrane para evaluar el riesgo de sesgo (Tabla 1).
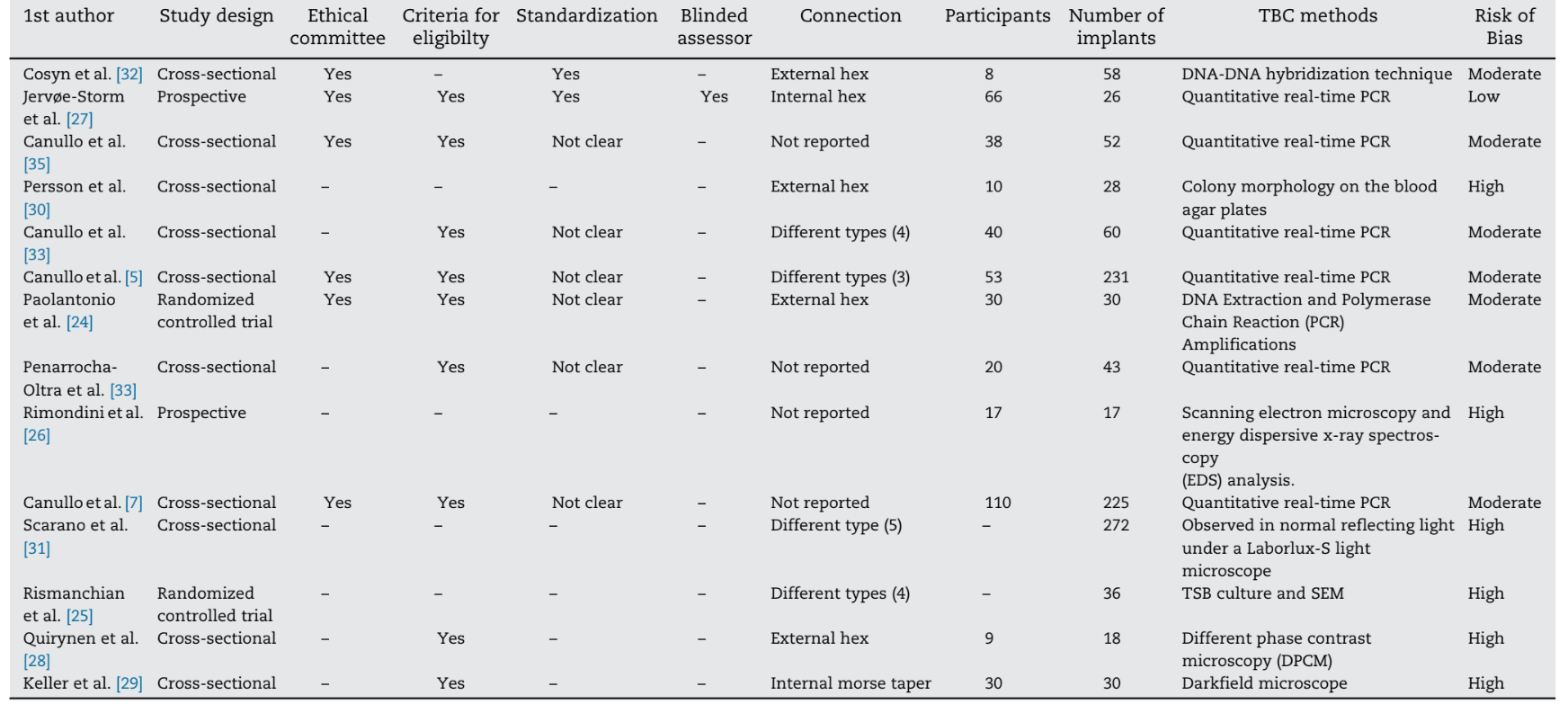
Considerando la adecuación en los respectivos estudios, los ítems fueron calificados y se calculó el porcentaje de ítems calificados positivamente. La evaluación de calidad se realizó en dos fases diferentes, a saber, la fase I donde la evaluación de calidad se basó en los artículos de texto completo publicados realizados de forma independiente por ambos revisores y en la fase II donde se resolvieron los desacuerdos tras la discusión. Después de recopilar las puntuaciones en la fase II de la evaluación de calidad, se completó una estimación general del riesgo plausible de sesgo (bajo, moderado o alto) para cada estudio seleccionado. Mientras que se estimó un bajo riesgo de sesgo cuando se cumplieron todos los criterios, se consideró un riesgo moderado cuando uno o más criterios se cumplieron parcialmente y se estimó un alto riesgo de sesgo cuando uno o más criterios no se cumplieron (Manual Cochrane para Revisiones Sistemáticas de Intervenciones, versión 5.1.0. http://www.cochrane.org/resources/handbook).
2.6. Medidas y análisis de resultados
Se realizaron estadísticas descriptivas, metarregresión y metaanálisis, basados en los estudios comparables que informan las mismas medidas de resultado. Se consideró la microbiota presente en el IAI de implantes en función durante al menos 1 año para el análisis de datos. Se extrajeron y definieron como variable de resultado primaria los BCs de bacterias gramnegativas asociadas con la periodontitis crónica (P. gingivalis, T. forsythia, T. denticola, P. intermedia y Fusobacterium nucleatum). La microbiota incluida para el análisis se detecta regularmente en sitios de periimplantitis y se ha encontrado que aumenta el riesgo de pérdida ósea periimplantaria y progresión de la enfermedad. Las diferencias medias se combinaron utilizando modelos de efectos aleatorios. La heterogeneidad entre estudios, análisis de subgrupos, metaanálisis y gráficos de bosque se calcularon utilizando un programa de software (Comprehensive Meta-Analysis V3; Biostat, Englewood, NJ, EE. UU.).
Resultados
3.1. Selección del estudio
Se encontraron un total de 523 títulos y resúmenes potencialmente relevantes después de la búsqueda electrónica y manual. Durante la primera etapa de selección, se excluyeron 309 artículos basados en los títulos y resúmenes (k=0.72). Durante la segunda fase, se evaluaron los artículos completos de texto completo de las 212 publicaciones restantes y se excluyeron 198 artículos ya que no cumplían con los criterios de inclusión (k=0.98). Finalmente, se seleccionaron un total de 14 artículos, que informaron datos de 1126 implantes, que cumplían con los criterios de inclusión y la evaluación de calidad requeridos para esta revisión sistemática (Fig. 1).
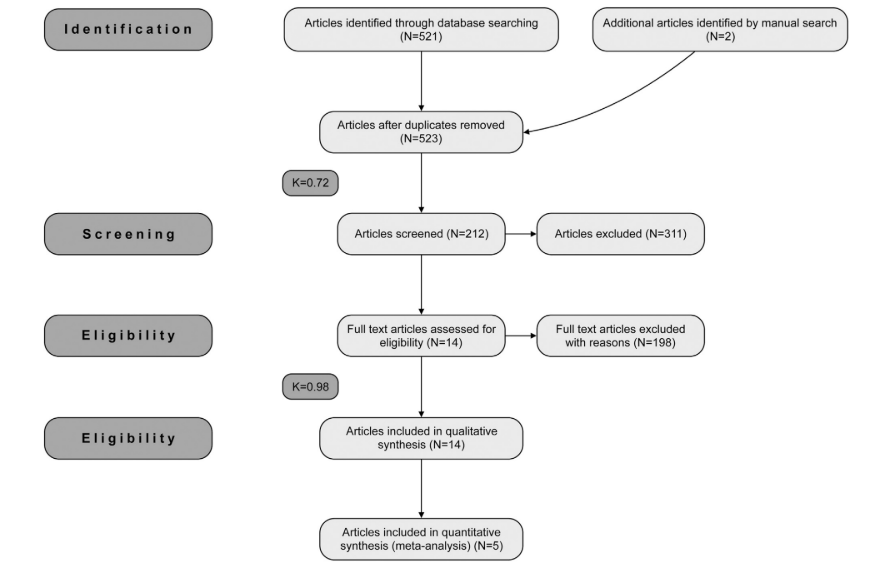
3.2. Características del estudio
Los 14 artículos seleccionados se publicaron entre 1993 y marzo de 2015, de los cuales dos fueron ensayos controlados aleatorios, dos estudios de cohorte prospectivos y diez estudios transversales. Solo un estudio clínico prospectivo se redactó siguiendo la declaración STROBE para estudios observacionales (http://www.strobe-statement.org). Por lo tanto, no fue posible realizar una comparación directa entre los artículos seleccionados.
3.3. Riesgo de sesgo dentro de los estudios
Ninguno de los estudios retrospectivos pudo cumplir con todos los requisitos. Una publicación se asoció con un bajo riesgo de sesgo, siete con un riesgo moderado de sesgo y seis con un alto riesgo de sesgo. Los artículos incluidos recibieron una calificación mínima al evaluar la presentación a comités éticos (6/14), la presencia de evaluadores cegados (2/14), la estandarización de los procedimientos (1/14) y la presencia de criterios de elegibilidad (9/14) (Tabla 1).
3.4. Medidas y análisis de meta-regresión
3.4.1. Filtración bacteriana en el IAI
Todos los estudios seleccionados informaron sobre la contaminación del IAI y la superficie del pilar en pacientes que recibieron el ensamblaje de un sistema de implante de dos etapas. Se llevó a cabo una reacción en cadena de la polimerasa (PCR) cuantitativa en tiempo real para BC en 7 de los 14 estudios donde se analizaron los siguientes patógenos: Aggregatibacter actinomycetemcomitans, P. gingivalis, T. forsythia, T. denticola, P. intermedia, Parvimonas micra, F. nucleatum, C. rectus, Eikenella corrodens, Candida albicans, Enterococcus faecalis, y Porphyromonas aeruginosa. Mientras que en un estudio se utilizó la técnica de hibridación de ADN-ADN en cuadrícula, en otros seis estudios se utilizaron diferentes técnicas, incluida la microscopía electrónica de barrido, para examinar la morfología de las colonias. En un estudio, se describió la colonización progresiva por bacterias patógenas periodontales en las porciones internas de los implantes de dos piezas. En otro estudio, los componentes intra-coronales de las restauraciones fijas retenidas por tornillos estaban altamente contaminados en todos los especímenes. La contaminación de los tornillos de los pilares probablemente ocurrió desde el surco peri-implantario a través del IAI y la interfaz pilar-prótesis. Asimismo, se observaron diferencias significativas en las bacterias nosocomiales resistentes a antibióticos (E. faecalis y P. aeruginosa) en los componentes internos y externos del implante entre los surcos peri-implantarios sanos y los implantes comprometidos con periimplantitis. Con respecto a la ausencia/presencia de las bacterias analizadas, no se encontraron diferencias relevantes entre el análisis en el surco peri-implantario y las conexiones dentro de las superficies de los pilares. La composición microbiana en los dientes vecinos se asemejaba a la encontrada en el surco peri-implantario con una alta frecuencia de P. gingivalis, T. forsythia, P. intermedia, P. micra y E. corrodens.
Dos estudios comparativos entre condiciones periimplantarias saludables versus implantes afectados por periimplantitis, reportaron contaminación bacteriana en ambos grupos. Las especies del complejo naranja (P. intermedia, P. micra, F. nucleatum) fueron las más prevalentes en todos los sitios analizados para ambos grupos. Dentro de la conexión del implante, la prevalencia de las especies analizadas fue más predominante en el grupo de periimplantitis y varió del 1.1% A. actinomycetemcomitans al 98.9% F. nucleatum. Las especies con ≥50% de prevalencia fueron: P. gingivalis, T. denticola, P. intermedia, F. nucleatum, C. rectus, E. corrodens, T. forsythia y P. micra.
3.4.2. Fugas bacterianas en el IAI en relación con el diseño de conexión del pilar
La muestra seleccionada mostró una mayor heterogeneidad respecto al tipo de IAI. Cuatro estudios informaron sobre conexiones de hexágono externo y dos estudios sobre hexágonos internos o conexiones de morse taper. Cuatro estudios utilizaron diferentes diseños de IAI, mientras que el tipo de IAI no fue reportado en los otros 4 manuscritos.
La evaluación de cuatro IAIs diferentes implicó que todas las conexiones analizadas presentaron contaminación después de 5 años de carga funcional. También pareció que el diseño de la conexión podría haber influido en los niveles de BC cualitativa y cuantitativamente, especialmente dentro de las conexiones del implante, mostrando mejores resultados para la conexión cónica. De manera similar, diferentes tipos de pilares mostraron una variación significativa en el tamaño medio de microgap dentro de las primeras 5 horas de carga. Sin embargo, no se encontró una influencia significativa de la microfiltración a las 24 h, 48 h y 14 días sobre los niveles de BC. Sin embargo, el uso de pilares estándar disminuyó significativamente el tamaño del microgap en comparación con los personalizados. El estudio concluyó que la microfiltración en el área de conexión fue comparable para todos los pilares analizados.
3.4.3. Meta-regresión y análisis de subgrupos
Cinco estudios, que incluían un total de 622 implantes (n=223 con periimplantitis; n=399 con condiciones periimplantarias sanas) en función durante al menos 1 año, fueron incluidos en el meta-análisis. El BC de anaerobios gram negativos mostró relevancia para la periodontitis crónica y se encontró que aumentaba el riesgo de pérdida ósea periimplantaria y progresión de la enfermedad debido a la presencia de patógenos periodontales (P. gingivalis, T. forsythia, T. denticola, P. intermedia, F. nucleatum) (Tabla 2)]. El meta-análisis consideró las bacterias que fueron evaluadas en todos los estudios seleccionados. Dos de cinco estudios compararon el BC en condiciones periimplantarias sanas frente a implantes afectados por periimplantitis. El meta-análisis reveló valores medios más altos para el BC de todas las bacterias gram negativas analizadas, excepto para T. forsythia en implantes con periimplantitis (Fig. 2). En general, las diferencias medias en BC fueron estadísticamente significativas entre los dos grupos analizados, con valores más altos en implantes con periimplantitis (diferencia: 0.387 ± 0.055; IC 95% 0.279–0.496, p=0.000).
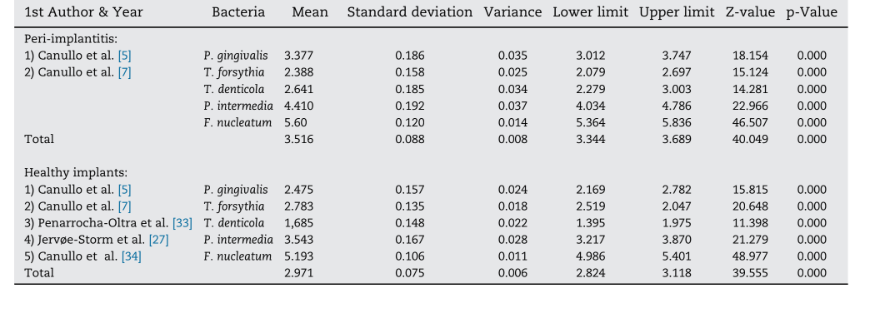
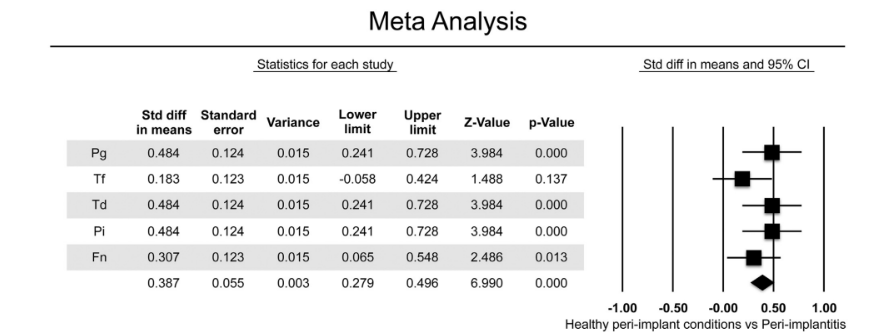
Discusión
Esta revisión sistemática evaluó la colonización microbiana en el IAI en implantes de nivel óseo y la relacionó con el posible inicio de la periimplantitis. Se excluyeron los implantes de una sola pieza del análisis debido a la posición supracrestal de su IAJ: de hecho, esta ubicación, debido al ambiente aeróbico, conduce a una composición microbiológica completamente diferente.
En la presente revisión, excepto por T. forsythia, se identificó un BC significativamente más alto en implantes afectados por periimplantitis en comparación con los sulcos periimplantarios sanos para todos los patógenos periodontales gram-negativos plausibles. Para el T. forsythia, solo se detectó una tendencia hacia un BC más alto.
Los estudios incluidos evaluaron la microbiota a nivel de IAI en pacientes que recibieron sistemas de implantes de nivel óseo de dos etapas con varios diseños de conexión implante-abutment. Sin embargo, dos estudios informaron sobre la contaminación del IAI independientemente del diseño de conexión. No se pudo hacer una distinción entre restauraciones retenidas por tornillo y por cemento asumiendo que la unión corona-abutment se encuentra más coronal, y que el espacio se llena con cemento. Además, los manuscritos incluidos no encontraron diferencias entre implantes sumergidos y no sumergidos en la colonización microbiana.
La presencia de contaminación bacteriana en el IAI colocado a nivel del hueso alveolar se demostró que estaba asociada con una infiltración significativa de células inflamatorias y pérdida ósea. La acumulación aumentada de células inflamatorias agudas adyacentes al IAI sugiere la persistencia de estímulos quimiotácticos de esta región que sostienen el reclutamiento continuo de granulocitos neutrofílicos. Además, la presencia de una infiltración inflamatoria del tejido peri-implantario en las interfaces del fixture-abutment también fue provocada por contaminación interna microbiana.
Varios estudios informaron que la contaminación microbiana podría ocurrir a nivel del IAI tanto en implantes con condiciones de tejido sano como enfermo. A pesar de que no había signos clínicos de periimplantitis, la presencia de las especies bacterianas asociadas con esta condición estaba claramente elevada. Cuando se evaluaron las características clínicas y microbiológicas en sujetos e implantes con condiciones de tejido sano o periimplantitis y se compararon los datos de sitios de implantes sanos y enfermos dentro del mismo sujeto (534 pacientes; 1507 implantes dentales), se observaron tendencias claras. El análisis microbiano obtenido de tres ubicaciones (sulcus peri-implantario (PIS), partes internas de las conexiones del implante (PI), sulcus gingival de los dientes vecinos) junto con parámetros clínicos (sangrado al sondeo, profundidad de sondaje, índice de placa), la presencia de periimplantitis fue evidente en el 10.3% de los pacientes y en el 7.3% de los implantes. El análisis microbiano dentro de los 53 pacientes afectados por periimplantitis no reveló diferencias relevantes entre el análisis en el PIS y el PI.
El microespacio en el IAI también puede dar lugar a complicaciones mecánicas y biológicas, incluyendo fracturas de tornillos de pilar y enfermedades periimplantarias. El tamaño del microespacio y la fuga microbiana en diferentes momentos en el IAI de 4 diferentes pilares a implantes Straumann mostraron un efecto significativo en el tamaño medio del microespacio (p<0.001) y en el número medio de colonias bacterianas (CFU/mL) que se filtraban del IAI dentro de las primeras 5 horas del experimento (p=0.012). Sin embargo, la microfuga a las 24 h, 48 h y 14 días ya no se vio influenciada significativamente (p=0.145).
Las diferencias clínicas y microbianas entre condiciones periimplantarias saludables y periimplantitis revelaron que la prevalencia microbiana era mayor en el grupo de periimplantitis en tres ubicaciones y las diferencias en la prevalencia entre diferentes tipos de bacterias eran más marcadas dentro de la conexión que en el PIS (57 pacientes; 122 implantes).
Cuando se identificaron patógenos oportunistas (E. faecalis, P. aeruginosa) en presencia de enfermedad periimplantaria a nivel del PIS de cada implante, el surco gingival de los dientes adyacentes y la conexión y pilar en la porción interna de cada implante, se detectaron diferencias significativas en la presencia y cantidad de bacterias nosocomiales alrededor de implantes enfermos. Esto podría sugerir la importancia de la descontaminación de la conexión en caso de tratamiento de periimplantitis.
Se propusieron diferentes intentos para reducir la colonización bacteriana en el IAI en caso de implantes sanos. Sin embargo, la aplicación de una solución de clorhexidina al 0.2% en cirugías de dos etapas se considera una práctica más común. Sin embargo, existen opiniones controvertidas sobre la efectividad de la solución de clorhexidina en la prevención de la colonización microbiana en el IAI. Los endotoxinas bacterianas típicamente penetran en el IAJ, pero la solución de clorhexidina al 0.2% no pudo eliminar significativamente la penetración, al menos a largo plazo. Por otro lado, no se proporcionaron indicaciones en la literatura en caso de implantes afectados por periimplantitis.
No solo la fuga microbiana a través de la brecha entre la supraestructura y el pilar, sino también los diseños y materiales de los implantes pueden afectar el riesgo potencial de albergar microorganismos orales. Típicamente, las conexiones de morse taper desarrollaron menos bacterias en comparación con la conexión cónica interna de cuatro ranuras. De manera similar, las conexiones de morse taper presentaron resultados favorables en este aspecto en comparación con la conexión cementada trilobulada. Por otro lado, la microbiota bacteriana presente dentro de la conexión del implante y en el fluido PIS de implantes con condiciones periimplantarias saludables con cuatro sistemas de implantes diferentes después de al menos 5 años de carga funcional, demostraron contaminación microbiológica en todos los tipos de conexiones independientemente del sitio (sulcus periimplantario, porción interna de la conexión, superficie del pilar y sulcus gingival de los dientes vecinos).
Desde un punto de vista clínico, la evidencia actual puede sugerir la eliminación del complejo corona/abutment y la desinfección/esterilización de las unidades de conexión tanto en el implante como en el aspecto del abutment, en caso de enfermedad peri-implantaria, como un complemento a los regímenes de mantenimiento de los implantes dentales.
Conclusiones
Este meta-análisis indicó que las bacterias podrían colonizar fácilmente la interfaz implante-abutment. Es evidente desde un punto de vista clínico que las porciones internas de IAI siempre deben considerarse contaminadas, incluso en condiciones clínicamente saludables.
Marco Tallarico, Luigi Canullo, Martina Caneva, Mutlu Özcan
Referencias
- Hermann JS, Buser D, Schenk RK, Schoolfield JD, Cochran DL. Ancho biológico alrededor de implantes de titanio de una y dos piezas. Clin Oral Implants Res 2001;12:559–71.
- Tsuge T, Hagiwara Y, Matsumura H. Ajuste marginal y microgaps de la interfaz implante-abutment con configuración interna de anti-rotación. Dent Mater J 2008;27:29–34.
- Schwarz F, Hegewald A, Becker J. Impacto de la conexión implante-abutment y la posición del collar/microgap mecanizado en los cambios del nivel óseo crestal: una revisión sistemática. Clin Oral Implants Res 2014;25:417–25.
- Weng D, Nagata MJH, Bell M, Bosco AF, de Melo LGN, Richter EJ. Influencia de la ubicación y configuración del microgap en la morfología ósea periimplantaria en implantes sumergidos. Un estudio experimental en perros. Clin Oral Implants Res 2008;19:1141–7.
- Canullo L, Penarrocha-Oltra D, Covani U, Botticelli D, Serino G, Peñarrocha M. Hallazgos clínicos y microbiológicos en pacientes con periimplantitis: un estudio transversal. Clin Oral Implants Res 2015;27:376–82.
- Canullo L, Peñarrocha D, Clementini M, Iannello G, Micarelli C. Impacto del tratamiento de limpieza con plasma de argón en abutments de implantes en pacientes con antecedentes de enfermedad periodontal y biotipo delgado: resultados radiográficos a los 24 meses de seguimiento de un RCT. Clin Oral Implants Res 2015;26:8–14.
- Canullo L, Peñarrocha D, Covani U, Rossetti PHO. Hallazgos microbiológicos y clínicos de implantes en condiciones saludables y con periimplantitis. J Oral Maxillofac Implants 2015;30:834–42.
- Quirynen M, Bollen CM, Eyssen H, van Steenberghe D. Penetración microbiana a lo largo de los componentes del implante del sistema Brånemark. Un estudio in vitro. Clin Oral Implants Res 1994;5:239–44.
- Passos SP, Gressler May L, Faria R, Özcan M, Bottino MA. Espacio entre implante-abutment versus colonización microbiana: Significado clínico basado en una revisión de la literatura. J Biomed Mater Res B Appl Biomater 2013;101:1321–8.
- Callan DP, Cobb CM, Williams KB. Identificación de bacterias que colonizan superficies internas de la interfaz implante-abutment mediante sonda de ADN: un estudio preliminar. J Periodontol 2005;76:115–20.
- Hermann JS, Schoolfield JD, Schenk RK, Buser D, Cochran DL. Influencia del tamaño del microgap en los cambios óseos crestal alrededor de implantes de titanio. Una evaluación histométrica de implantes no sumergidos y no cargados en la mandíbula canina. J Periodontol 2001;72:1372–83.
- Piattelli A, Scarano A, Paolantonio M, Assenza B, Leghissa GC, Di Bonaventura G. Fluidos y penetración microbiana en la parte interna de conexiones implante-abutment retenidas por cemento versus retenidas por tornillo. J Periodontol 2001;72:1146–50.
- Pérez-Chaparro PJ, Duarte PM, Shibli JA, Montenegro S, Lacerda Heluy S, Figueiredo LC, et al. El peso actual de la evidencia del perfil microbiológico asociado con la periimplantitis: una revisión sistemática. J Periodontol 2016;87:1295–304.
- Monje A, Suarez F, Galindo-Moreno P, García-Nogales A, Fu JH, Wang HL. Una revisión sistemática sobre la pérdida ósea marginal alrededor de implantes dentales cortos (<10mm) para prótesis fijas soportadas por implantes. Clin Oral Implants Res 2014;25:1119–24.
- Moher D, Liberati A, Tetzlaff J, Altman DG, The PRISMA Group. Métodos de revisiones sistemáticas y elementos de informe preferidos para revisiones sistemáticas y meta-análisis: la declaración PRISMA. J Clin Epidemiol 2009;62:1006–12.
- Lindhe J, Meyle J, Grupo D del Taller Europeo de Periodontología. Enfermedades periimplantarias: informe de consenso del sexto taller europeo sobre periodontología. J Clin Periodontol 2008;35:282–5.
- Lang NP, Berglundh T, Grupo de Trabajo 4 del Séptimo Taller Europeo sobre Periodontología. Enfermedades periimplantarias: ¿dónde estamos ahora? Consenso del Séptimo Taller Europeo sobre Periodontología. J Clin Periodontol 2001;38:178–81.
- Miller SA, Forrest JL. Mejorando su práctica a través de la toma de decisiones basada en evidencia: PICO, aprendiendo a hacer buenas preguntas. J Evid Based Dent Pract 2001;1:136–41.
- Graziani F, Figuero E, Herrera D. Revisión sistemática de la calidad del informe, mediciones de resultados y métodos para estudiar la eficacia de enfoques preventivos y terapéuticos para enfermedades periimplantarias. J Clin Periodontol 2012;39:224–44.
- Pjetursson BE, Zwahlen M, Lang NP. Calidad del informe de estudios clínicos para evaluar y comparar el rendimiento de restauraciones soportadas por implantes. J Clin Periodontol 2012;39:139–59.
- Mombelli A, Décaillet F. Las características de los biofilms en la enfermedad periimplantaria. J Clin Periodontol 2011;38:203–13.
- Mombelli A. Microbiología y terapia antimicrobiana de la periimplantitis. Periodontol 2000 2002;28:177–89.
- Leonhardt Å, Dahlén G, Renvert S. Resultado clínico, microbiológico y radiológico a cinco años tras el tratamiento de la periimplantitis en humanos. J Periodontol 2003;74:1415–22.
- Paolantonio M, Perinetti G, D’Ercole S, Graziani F, Catamo G, Sammartino G. Descontaminación interna de implantes dentales: un ensayo microbiológico aleatorizado in vivo de 6 meses sobre los efectos de un gel de clorhexidina. J Periodontol 2008;79:1419–25.
- Rismanchian M, Hatami M, Badrian H, Khalighinejad N, Goroohi H. Evaluación del tamaño del microgap y fuga microbiana en el área de conexión de 4 abutments con implante Straumann (ITI). J Oral Implantol 2012;38:677–85.
- Rimondini L, Marin C, Brunella F, Fini M. Contaminación interna de un sistema de implante de 2 componentes después de la carga oclusal y reconstrucción provisionalmente cementada con o sin un dispositivo de arandela. J Periodontol 2001;72:1652–7.
- Jervøe-Storm PM, Jepsen S, Jöhren P, Mericske-Stern R, Enkling N. Colonización bacteriana interna de implantes: asociación con pérdida ósea periimplantaria. Clin Oral Implants Res 2015;26:957–63.
- Quirynen M, van Steenberghe D. Colonización bacteriana de la parte interna de implantes de dos etapas: un estudio in vivo. Clin Oral Implants Res 1993;4:158–61.
- Keller W, Brägger U, Mombelli A. Microflora periimplantaria de implantes con suprastructuras cementadas y retenidas por tornillo. Clin Oral Implants Res 1998;9:209–17.
- Persson LG, Lekholm U, Leonhardt A, Dahlén G, Lindhe J. Colonización bacteriana en superficies internas de componentes de implante del sistema Brånemark. Clin Oral Implants 1996;7:90–5.
- Scarano A, Assenza B, Piattelli M, Iezzi G, Leghissa GC, Quaranta A. Un estudio de 16 años del microgap entre 272 implantes de titanio humanos y sus abutments. J Oral Implantol 2005;31:269–75.
- Cosyn J, Van Aelst L, Collaert B, Persson GR, De Bruyn H. El surco periimplantario comparado con componentes internos de implante y suprastructura: un análisis microbiológico. Clin Implant Dent Relat Res 2009;13:286–95.
- Penarrocha-Oltra D, Rossetti PHO, Covani U, Galluccio F, Canullo L. Microfugas en la conexión implante/abutment debido a maniobras de inserción del implante: análisis microbiológico transversal en implantes después de 5 años de carga. J Oral Implantol 2014;41:e292–6.
- Canullo L, Penarrocha-Oltra D, Soldini C, Mazzocco F, Penarrocha M, Covani U. Evaluación microbiológica de la interfaz implante-abutment en diferentes conexiones: estudio transversal después de 5 años de carga funcional. Clin Oral Implants res 2014;26:426–34.
- Canullo L, Rossetti PHO, Peñarrocha D. Identificación de Enterococcus faecalis y Pseudomonas aeruginosa en implantes en individuos con enfermedad periimplantaria: un estudio transversal. Int J Oral Maxillofac Implants 2015;30:583–7.
- Socransky SS, Haffajee AD, Ximenez-Fyvie LA, Feres M, Mager D. Consideraciones ecológicas en el tratamiento de infecciones periodontales por Actinobacillus actinomycetemcomitans y Porphyromonas gingivalis. Periodontol 2000 1999;20:341–62.
- Socransky SS, Haffajee AD, Smith C, Duff GW. Parámetros microbiológicos asociados con polimorfismos del gen IL-1 en pacientes con periodontitis. J Clin Periodontol 2000;27:810–8.
- Broggini N, McManus LM, Hermann JS, Medina R, Schenk RK, Buser D. Inflamación periimplantaria definida por la interfaz implante-abutment. J Dent Res 2006;85:473–8.
- Broggini N, McManus LM, Hermann JS, Medina RU, Oates TW, Schenk RK. Inflamación aguda persistente en la interfaz implante-abutment. J Dent Res 2003;82:232–7.
- Cosyn J, Eghbali A, De Bruyn H, Collys K, Cleymaet R, De Rouck T. Implantes inmediatos de un solo diente en el maxilar anterior: resultados a 3 años de una serie de casos sobre la respuesta de tejidos duros y blandos y estética. J Clin Periodontol 2011;38:746–53.
- Tesmer M, Wallet S, Koutouzis T, Lundgren T. Colonización bacteriana de la interfaz del fixture-abutment del implante: un estudio in vitro. J Periodontol 2009;80:1991–7.
- Nascimento CD, Pita MS, Fernandes FHNC, Pedrazzi V, de Albuquerque Junior RF, Ribeiro RF. Adhesión bacteriana en las superficies de abutment de titanio y zirconia. Clin Oral Implants Res 2014;25:337–43.
- Koutouzis T, Wallet S, Calderon N, Lundgren T. Colonización bacteriana de la interfaz implante-abutment utilizando un modelo de carga dinámica in vitro. J Periodontol 2011;82:613–8.
- Assenza B, Tripodi D, Scarano A, Perrotti V, Piattelli A, Lezzi G. Fuga bacteriana en implantes con diferentes conexiones implante-abutment: un estudio in vitro. J Periodontol 2012;83:491–7.
- Paolantonio M, Perinetti G, D’Ercole S, Graziani F, Catamo G, Sammartino G, et al. Descontaminación interna de implantes dentales: un ensayo microbiológico aleatorizado in vivo de 6 meses sobre los efectos de un gel de clorhexidina. J Periodontol 2008;79:1419–25.
- Romanos GE, Biltucci MT, Kokaras A, Paster BJ. Composición bacteriana en la conexión implante-abutment bajo carga in vivo. Clin Implant Dent Relat Res 2016;18:138–45.
