Elevación del seno crestal utilizando un implante con canal interno en forma de L: resultados a 1 año después de la carga de un estudio de cohorte prospectivo
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Propósito: Evaluar los resultados clínicos y radiográficos de un procedimiento de elevación de seno crestal en una sola etapa utilizando un sistema de implantes endoóseos autoperforantes (iRaise, Maxillent, Herzliya, Israel) desarrollado para la augmentación del seno, 1 año después de la carga.
Materiales y métodos: Pacientes que necesitaban restauración en el maxilar posterior con un crest alveolar residual de 3 a 8 mm de altura y 5 mm de ancho distal al canino, medido en la tomografía computarizada (CBCT), fueron tratados utilizando el sistema de elevación de seno iRaise. Las medidas de resultado fueron: fallos de implante y prótesis, cualquier complicación, aumento de la altura ósea (iBH), pérdida ósea marginal (MBL), cociente de estabilidad del implante (ISQ), patrones de remodelación de tejido radiográfico utilizando el índice de remodelación de injertos de seno (SGRI), mediciones volumétricas del injerto de seno, hinchazón postquirúrgica autoinformada por el paciente, consumo de medicamentos para el dolor y análisis histológico.
Resultados: Un total de 30 participantes consecutivos con una edad media de 54.2 ± 9.4 años se sometieron a una elevación transcrestal de la membrana sinusal, inserción de injerto óseo y colocación de implantes. Se colocaron un total de 50 implantes (30 implantes del sistema iRaise y 20 implantes auxiliares iSure, Maxillent). El seguimiento medio fue de 15.8 ± 2.1 meses después de la carga del implante. Un paciente abandonó el estudio en el examen de seguimiento a 1 año después de la carga. No hubo fallos de implantes ni de prótesis durante todo el seguimiento. Un paciente experimentó un pequeño desgarro de la membrana. Antes de la inserción del implante, la altura media del reborde alveolar residual fue de 4.64 ± 0.86 mm (rango: 3.4–6.4 mm; IC 95%: 4.39–5.01 mm). Un año después de la carga, la altura ósea fue de 16.86 ± 3.13 mm (IC 95% 15.83–18.07 mm). En el seguimiento a 1 año después de la carga, la media de MBL fue de 0.19 ± 1.05 mm (IC 95% 0.02–0.78 mm). La media de ISQ en la colocación del implante fue de 65.2 ± 5.4 (IC 95% 63.6–67.4) y aumentó durante el período de cicatrización alcanzando el valor medio de 73.6 ± 3.7 (IC 95% 73.1–75.9; rango 62–79). La diferencia fue estadísticamente significativa (8.4 ± 5.3; IC 95% 5.9–39.7; P = 0.0000). Un año después de la carga, se evaluó el puntaje SGRI en 23 implantes. En general, el valor medio de SGRI fue de 2.29 ± 2.41 mm (IC 95% 1.22–2.98 mm). El volumen óseo en la colocación del implante fue de 2.41 ± 0.25 CC (IC 95% 2.22–2.48 CC). Durante el período de cicatrización sumergida de 6 meses, se observó una ligera contracción ósea del 11.3% (2.13 ± 0.24 CC; IC 95% 2.02–2.26; diferencia = 0.27 ± 0.25 CC; IC 95% 0.10–0.36; P = 0.0011). En el primer año posterior a la carga, el injerto óseo se mantuvo estable (2.11 ± 0.22 CC; IC 95% 2.02–2.24). La diferencia no fue estadísticamente significativa (0.02 ± 0.07 CC; IC 95% 0.01–0.04; P = 0.2166). Desde el punto de vista del paciente, el valor medio del dolor fue de 0.52 ± 0.74 (rango 0–3); el valor medio de hinchazón fue de 0.27 ± 0.52 (rango 0–2); y el consumo medio de analgésicos fue de 0.87 ± 4.94 tabletas (rango 0–4) 3 días después de la cirugía. Los análisis morfológicos e histomorfométricos mostraron que todas las muestras tenían una estructura normal sin infiltrado inflamatorio, seis meses después de la cicatrización. Se encontraron las siguientes fracciones (%): hueso (hueso inmaduro + hueso maduro): 44.07 ± 4.91; biomaterial residual: 23.98 ± 2.64; espacios medulares: 31.95 ± 3.16.
Conclusiones: La augmentación del suelo del seno maxilar se puede llevar a cabo con éxito mediante un enfoque transcrestal utilizando un sistema de implantes dedicado. Se experimentó una contracción fisiológica del 11.3% del volumen original del injerto óseo durante los primeros 6 meses de curación; después de eso, no se observó reducción adicional del volumen del injerto. Se necesitan estudios clínicos a largo plazo para confirmar estos resultados preliminares.
Introducción
La elevación del suelo del seno en etapas es la solución común para la colocación de implantes en maxilares atrofiados severos. Sin embargo, la elevación del suelo del seno maxilar utilizando un enfoque lateral implica la ejecución de un gran colgajo mucoso periosteal que afecta inevitablemente la recuperación postoperatoria y el costo adicional del procedimiento de augmentación. Las perforaciones de la membrana sinusal, hemorragias nasales, dolor postoperatorio, hinchazón, hematomas e infecciones sinusales son posibles complicaciones.
La elevación del suelo del seno maxilar a través de la cresta alveolar (transalveolar) fue descrita por primera vez por Tatum a finales de la década de 1970 y fue publicada por primera vez por Boyne en 1980. La técnica ha sido modificada repetidamente. Las principales preocupaciones de esta técnica son la cantidad limitada de aumento óseo, la falta de acceso visual al sitio, el riesgo de perforación de la membrana de Schneider y los síntomas postoperatorios.
Una elevación hidráulica transcrestal cerrada de la membrana de Schneider y un aumento simultáneo del injerto óseo se pueden lograr utilizando un implante dental dedicado. Este enfoque se diferencia principalmente de las técnicas hidráulicas descritas anteriormente porque la elevación de la membrana de Schneider y el injerto óseo se realizan a través del implante.
En general, los procedimientos de elevación de seno aumentan adecuadamente la dimensión vertical del proceso alveolar reabsorbido en el maxilar posterior, permitiendo así la colocación de implantes de longitud suficiente. La tasa de contracción del volumen del injerto reportada en la literatura varía del 20% al 50% tanto para hueso autógeno como para sustitutos óseos, como el injerto óseo desmineralizado liofilizado (DFDBA), el injerto óseo mineralizado liofilizado (FDBA) y los xenoinjertos. En años más recientes, los biocerámicos reabsorbibles, hechos de una mezcla de hidroxiapatita y fosfato de tricalcio beta, han ganado popularidad, demostrando bioactividad y osteoconductividad en diferentes estudios histológicos. Sin embargo, el uso de sustitutos óseos es cuestionable cuando hay más de 3 mm de altura ósea presente.
Un informe provisional de 6 meses de este estudio sobre los primeros 18 pacientes mostró una contracción fisiológica del 13.9% del volumen original del injerto óseo utilizando el Sistema de Elevación de Seno iRaise. El presente estudio evaluó los resultados clínicos y radiográficos de un procedimiento de elevación de seno crestal en una sola etapa utilizando un sistema de implantes endóseos autoperforantes (iRaise, Maxillent, Herzliya, Israel) desarrollado para la augmentación del seno, utilizando tomografía computarizada de haz cónico (CBCT), 1 año después de la carga. Este estudio siguió la declaración de Fortalecimiento de la Presentación de Estudios Observacionales en Epidemiología (STROBE) para mejorar la calidad de los estudios observacionales (http://www.strobe-statement.org).
Materiales y métodos
Este estudio fue diseñado como un estudio observacional prospectivo. Los pacientes fueron tratados en una práctica privada en Roma, Italia, entre septiembre y diciembre de 2014. Todos los pacientes fueron informados sobre la naturaleza del estudio y dieron su consentimiento por escrito para los procedimientos quirúrgicos y protésicos y para el uso de datos clínicos y radiológicos. Los procedimientos quirúrgicos fueron realizados por dos clínicos (MT y SMM) que tienen amplia experiencia en la colocación de implantes y procedimientos de augmentación de seno.
Se consideraron elegibles para inclusión a pacientes consecutivos de 18 años o más, capaces de firmar un consentimiento informado, que requerían restauraciones soportadas por implantes para rehabilitar su maxilar posterior atrófico. El sitio seleccionado debía tener una cresta alveolar residual de al menos 3 a 8 mm de altura y 5 mm de ancho distal al canino, según se midió en una tomografía computarizada (CBCT).
Los criterios de exclusión fueron:
- Contraindicaciones generales a la cirugía de implantes;
- Sometido a irradiación en el área de cabeza y cuello < 1 año antes de la implantación;
- Diabetes no controlada;
- Embarazada o en período de lactancia;
- Abuso de sustancias;
- Fumador pesado (≥ 11 cigarrillos/día);
- Terapia psiquiátrica o expectativas poco realistas;
- Inmunosuprimido o inmunocomprometido;
- Tratado o en tratamiento con aminobisfosfonatos orales o intravenosos;
- Falta de dentición/protesis ocluyente opuesta en el área destinada para la colocación del implante;
- Bruxismo severo o apretamiento;
- Sitios cicatrizados (al menos 3 meses después de la extracción de dientes);
- Periodontitis no tratada;
- Mala higiene oral y motivación (sangrado en toda la boca al sondaje e índice de placa en toda la boca > 25%);
- Pacientes que participan en otros estudios, si esto impide que se siga adecuadamente el presente protocolo.
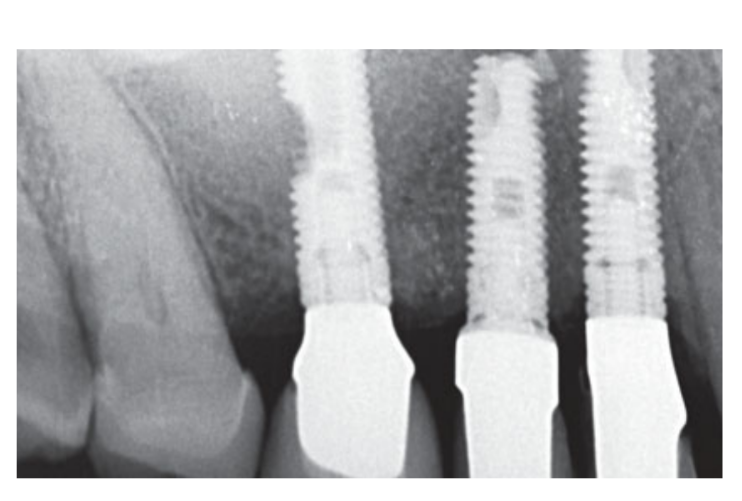
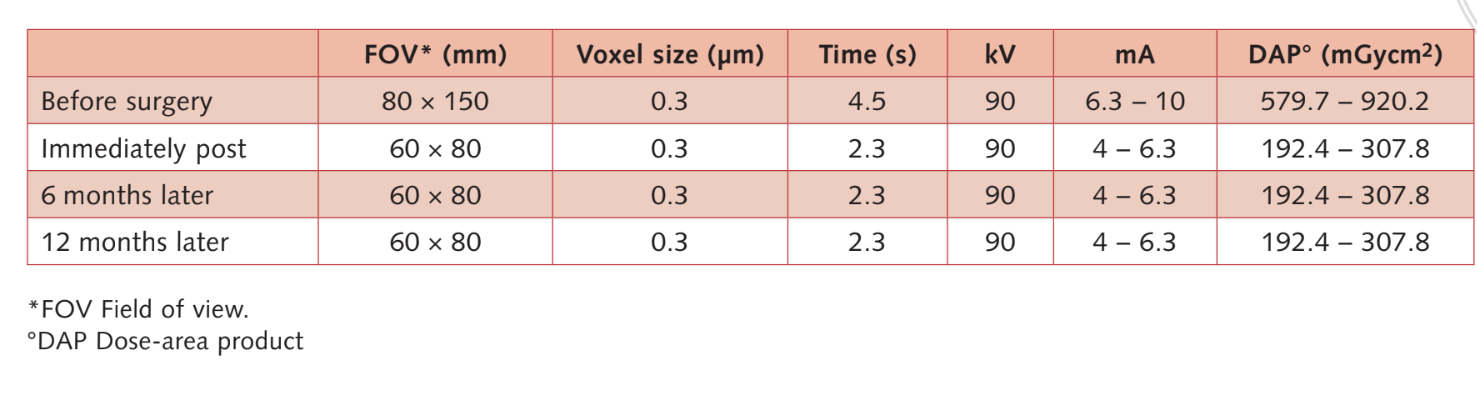
Se incluyeron fumadores moderados y los pacientes fueron categorizados como no fumadores o fumadores moderados (≤ 10 cigarrillos/día). Se utilizaron radiografías panorámicas o periapicales preoperatorias y fotografías para el cribado inicial (Figs 1 y 2). Se realizaron tomografías computarizadas de haz cónico para cada paciente dentro de las 2 semanas anteriores a la cirugía (campo de visión 80 A~ 150 mm; tamaño de voxel 0.3 μm; 4.5 s; 90 kV; 6.3–10 mA; 579.7–920.9 mGy cm2), inmediatamente después del procedimiento, 6 meses después de la colocación del implante y 1 año después de la carga (campo de visión 60 Å~ 80 mm; tamaño de voxel 0.3μm; 2.3 s; 90 kV; 5–8 mA; 192.4–307.8 mGy cm2) como parte del protocolo de tratamiento regular. Los parámetros de exposición se establecieron lo más bajos posible razonablemente.
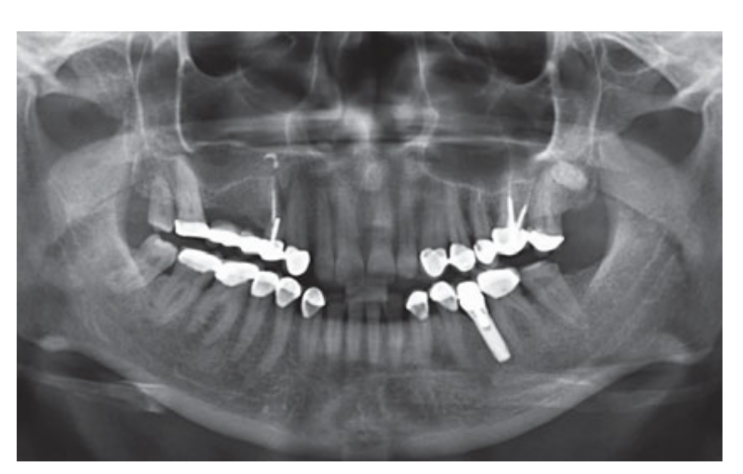
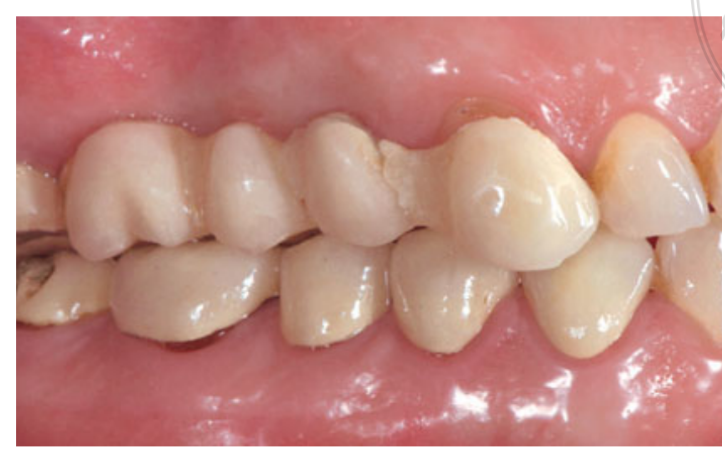
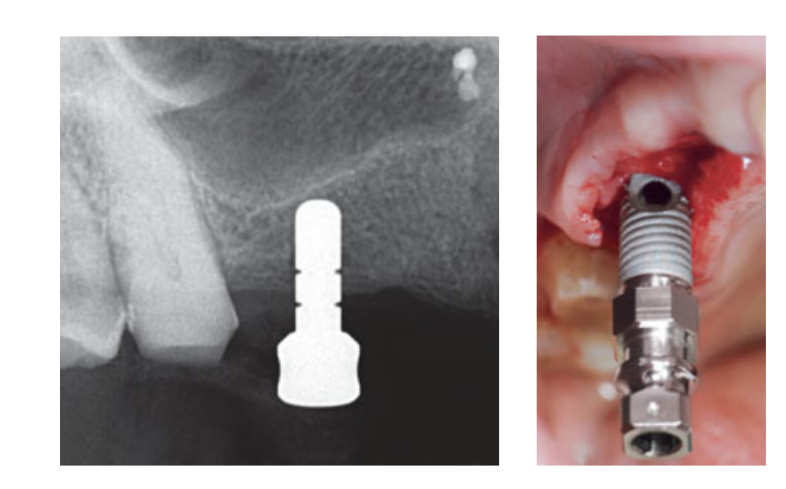
Se administró terapia de aerosol intranasal (acetilcisteinato de glicina de tiamina 810 mg/4 mL) y cortisona (betametasona 1 mg) dos veces al día comenzando el día antes de la cirugía. El día de la cirugía, se administró una dosis única de antibiótico (2 g de amoxicilina y ácido clavulánico, o 600 mg de clindamicina, si era alérgico a la penicilina) de forma profiláctica 1 h antes de la cirugía. Se administró un enjuague bucal de clorhexidina al 0.2% durante 1 min antes de la cirugía. Se administró anestesia local utilizando articaína con adrenalina 1:100,000. Se realizó una incisión en la línea media y se elevó un colgajo mucoperióstico de grosor completo. Se prepararon los sitios receptores de implantes de acuerdo con el protocolo de perforación sugerido por el fabricante (Fig 3a). Se utilizaron topes de perforación y guías de profundidad para lograr un control preciso y seguro de la profundidad de la osteotomía. La longitud del implante (que varía de 13 a 16 mm) se seleccionó de antemano en función de la altura ósea residual, medida utilizando las tomografías computarizadas preoperatorias, desde la cresta ósea hasta el suelo del seno a lo largo del eje planeado del implante, y confirmada mediante herramientas radiográficas dedicadas (Maxillent). Los implantes iRaise Sinus Lift (Maxillent) se insertaron en los sitios de osteotomía alineando la abertura en el implante en la parte media bucal y dejando un hilo de tornillo visible por encima de la abertura (Fig 3b). El conector de tubo de un solo uso se atornilló al puerto de tubería del implante. El conector no toca el implante excepto por el anillo de silicona (silicona médica destinada a la implantación). Luego, se inyectaron suavemente de 2 a 3 mL de solución salina en el seno a través del conector de tubo y el canal interno en forma de L del implante (diámetro 1.5 mm), aislado de la conexión protésica, y por lo tanto de la cavidad oral. La solución salina se retractó de nuevo en la jeringa y se notó un ligero sangrado fisiológico en la solución salina retractada. Posteriormente, se mezcló una jeringa llena con 1 mL de material de injerto óseo fluido (MBCP Gel, Biomatlante, Vigneux-de-Bretagne, Francia) con 0.1 mL de solución salina estéril al 0.9%, que se inyectó lentamente a través del mismo puerto. El MBCP Gel es un sustituto óseo inyectable 100% sintético compuesto por 60% de fosfato de calcio bifásico y 40% de hidroxiapatita suspendida en un polímero soluble, con una granulometría que varía de 80 a 200 μm. Después de completar el procedimiento de injerto, se desconectó el sistema hidráulico y se insertó toda la longitud del implante en el sitio de osteotomía y la cavidad del seno injertada y se dejó sanar durante 6 meses, de acuerdo con un protocolo sumergido. Se colocaron implantes adicionales (iSure, Maxillent) en el área tratada después de completar la secuencia quirúrgica iRaise (Maxillent), o 6 meses después en casos donde los pacientes tenían una altura ósea residual ≤ 3 mm en el sitio planeado.
La terapia de aerosol intranasal (acetilcisteinato de glicina de tiamina 810 mg/4 mL) y cortisona (betametasona 1 mg) se continuaron durante 10 días después de la cirugía. Los antibióticos se continuaron durante 7 días (1 g de amoxicilina y ácido clavulánico o 300 mg de clindamicina dos veces al día) después de la cirugía. Se utilizó enjuague bucal de clorhexidina al 0.2% durante 1 min dos veces al día durante 2 semanas, y se recomendó una dieta blanda durante 1 mes. Se administró ibuprofeno 400 mg o paracetamol 1 g en caso de dolor. Se retiraron los puntos después de 1 semana y se reforzaron las instrucciones de higiene oral.
Seis meses después de la colocación del implante y la augmentación del seno, se conectaron los pilares de cicatrización. En pacientes que requieren implantes en etapas, se utilizó una fresa trepanadora calibrada con un diámetro externo de 3.0 mm para preparar el sitio y se tomó una muestra de núcleo para análisis histológico.
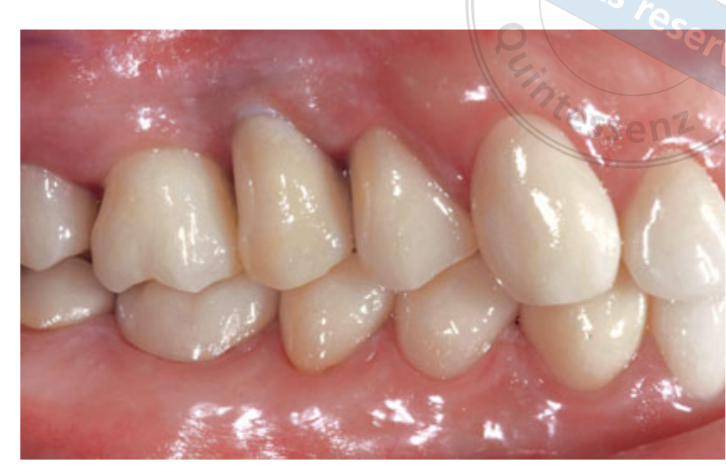
Dos semanas después de la segunda cirugía, se tomó una impresión con bandeja abierta con un material de polietero (Impregum, 3M ESPE, Seefeld, Alemania). No se utilizaron restauraciones temporales. Las restauraciones finales se fabricaron mediante tecnología de diseño asistido por computadora (CAD) / fabricación asistida por computadora (CAM) y se entregaron de 4 (coronas individuales) a 6 semanas (prótesis fijas) después. Luego se verificó cuidadosamente la oclusión. Se programaron citas de seguimiento para el mantenimiento de la higiene oral cada 4 meses después de la carga. La oclusión también se evaluó en cada visita (Figs 4 y 5).
Medidas de resultado
Las medidas de resultado de este estudio fueron:
- Un implante se consideró un fracaso si presentaba alguna movilidad, evaluada al golpear o mover la cabeza del implante con las manijas metálicas de dos instrumentos, y/o infección que dictara la extracción del implante o cualquier complicación mecánica (por ejemplo, fractura del implante) que hiciera que el implante fuera inútil, aunque aún mecánicamente estable en el hueso. La evaluación radiográfica utilizó una radiografía intraoral tomada con una técnica de paralelogramo estrictamente perpendicular a la interfaz implante-hueso.
- Una prótesis se consideró un fracaso si necesitaba ser reemplazada por una prótesis alternativa.
- Cualquier complicación biológica (dolor, hinchazón o supuración, etc.) y/o mecánica (aflojamiento de tornillos o fractura del armazón y/o del material de recubrimiento, etc.).
- Los cambios en el nivel óseo marginal se evaluaron mediante radiografías periapicales digitales intraorales (dispositivo Digora Optime, Soredex, Tuusula, Finlandia; placa de imagen, PSP [placa de fósforo fotoestimulable] tamaño 2, tamaño de píxel 30 μm, resolución 17 lp/mm.) realizadas con la técnica de paralelogramo utilizando soportes de película disponibles comercialmente (Rinn XCP; Dentsply Rinn, Elgin, IL, EE. UU.) en la colocación del implante (línea base), carga del implante y 1 año después de la carga. En caso de que una radiografía no fuera legible, se tomó la radiografía nuevamente. Todas las radiografías se mostraron en un paquete de software de análisis de imágenes (DfW 2.8 para Windows, Soredex) que fue calibrado utilizando la longitud o diámetro conocido de los implantes dentales. La distancia desde el margen más coronal del collar del implante hasta la parte superior de la cresta ósea se midió con una precisión de 0.01 mm, y se tomó como el nivel óseo marginal. Los valores mesiales y distales se promediaron para cada implante. La diferencia negativa entre los puntos de tiempo se tomó como pérdida ósea marginal (MBL).
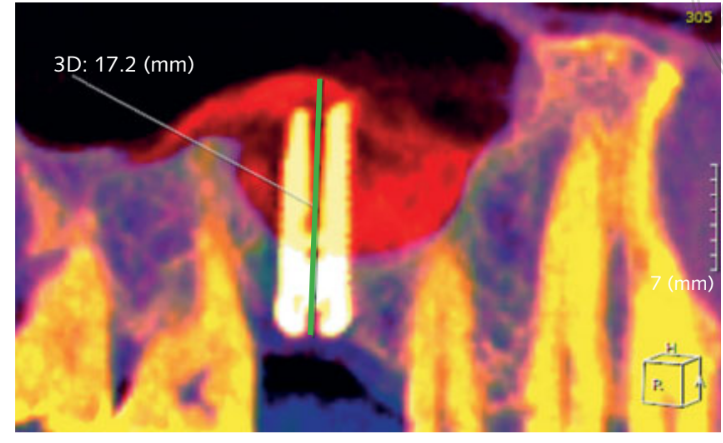
- La altura ósea incrementada (iBH) se calculó en la tomografía CBCT como la distancia entre la cresta ósea y el signo radiopaco más superior del material de injerto, medida a lo largo del eje largo del implante. La ganancia ósea se determinó por la diferencia entre la iBH y la altura ósea residual preoperatoria (aBH), calculada como la distancia entre la cresta ósea y el suelo del seno, medida a lo largo del eje largo en la posición ideal del implante (Fig 6).
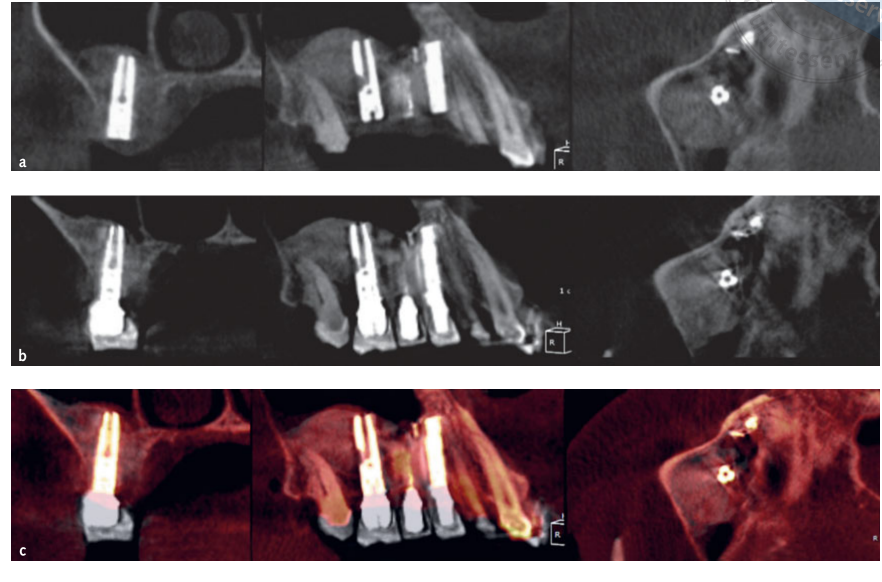
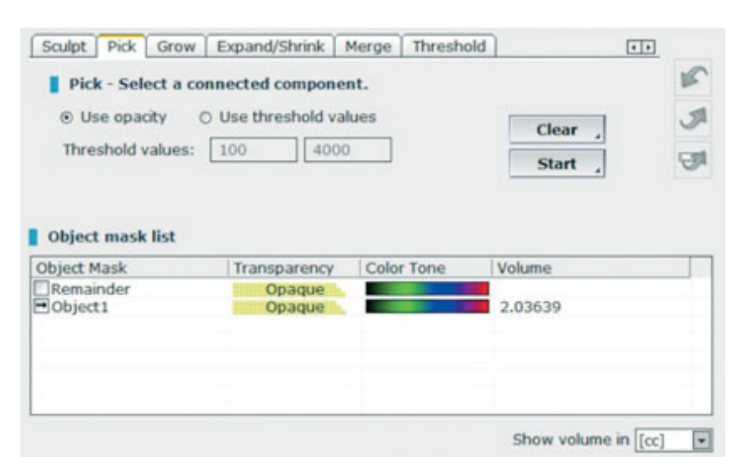
- Las mediciones volumétricas de los injertos de seno se realizaron en la tomografía CBCT utilizando el software OnDemand 3D, módulo adjunto Fusion (Cybermed, Yuseong-gu, Daejeon, Corea) (Fig 7). Fusion es una herramienta de visualización que utiliza una técnica de registro avanzada para superponer datos de volumen utilizando información de vóxeles. La tecnología detrás de Fusion, conocida como MI o Información Mutua, calcula la dependencia estadística entre dos volúmenes, los valores de intensidad y correlación de la entropía y compara la diferencia en la entropía de la suma de imágenes individuales y la entropía conjunta de imágenes combinadas para fusionar datos. Las superposiciones de los datos DICOM del paciente post-operación y pre-operación se realizaron automáticamente dibujando un volumen de interés (VOI) sobre un área que involucraba puntos de referencia anatómicos inalterados (por ejemplo, dientes, cráneo basal, implantes) y se verificaron manualmente para una coincidencia completa asegurando la máxima precisión para la superposición. A continuación, se calcularon los volúmenes del material injertado por segmento en la cavidad del seno utilizando la herramienta de segmentación (OnDemand 3D, Cybermed). Esta herramienta proporciona información volumétrica basada en la opacidad del material injertado (Figs 8 y 9). El área segmentada incluía implantes e injerto. Sin embargo, los implantes podían distinguirse claramente de los materiales injertados por su densidad y estructura y se excluyeron de las mediciones. Las tomografías CBCT se tomaron antes de la colocación del implante, inmediatamente después y en los seguimientos de 6 y 12 meses de acuerdo con el principio ALARA (tan bajo como razonablemente alcanzable) (Tabla 1). Se utilizó la tecnología SMAR (Reducción de Artefactos Metálicos Soredex) para minimizar la dispersión de artefactos metálicos. El mismo clínico, que no había estado involucrado previamente en el estudio, evaluó todas las mediciones radiográficas en 2 y 3 dimensiones.
- El torque de inserción se registró en la colocación del implante utilizando la unidad quirúrgica (iChiro Pro, BienAir, Bienne, Suiza).
- El cociente de estabilidad del implante (ISQ) fue registrado por el cirujano utilizando análisis de frecuencia de resonancia (dispositivo Osstell Mentor, Osstell, Göteborg, Suecia). Se tomaron dos mediciones para cada implante: una bucopalatal desde el lado bucal y una mesiodistal desde el lado mesial. Ambas mediciones se promediaron, y el resultado fue mostrado por el dispositivo en unidades ISQ, que van de 1 a 100. Los valores se registraron en la colocación del implante (línea base) y en el seguimiento de 6 meses.
- El paciente autoinformó el dolor postquirúrgico, en una escala ordinal (0 = sin dolor; 1 = dolor leve; 2 = dolor moderado; 3 = dolor severo): evaluado 3 días después de la cirugía en el chequeo postoperatorio por un evaluador ciego.
- El paciente autoinformó la hinchazón postquirúrgica, en una escala ordinal (0 = sin hinchazón; 1 = hinchazón leve; 2 = hinchazón moderada; 3 = hinchazón severa): evaluado 3 días después de la cirugía en el chequeo postoperatorio por el evaluador ciego.
- Consumo de analgésicos: número de tabletas utilizadas (de 12 tabletas proporcionadas [Ibuprofeno 400 mg, o paracetamol 1 g para aquellos alérgicos a los AINEs]): registrado 3 días después de la cirugía en el chequeo postoperatorio por el evaluador ciego.
- Se utilizó análisis histomorfométrico para calcular las fracciones de volumen de tejido (expresadas como un porcentaje del volumen total) que componían la muestra (hueso, biomaterial, tejido blando). Se recolectaron muestras histológicas y se fijaron en formalina al 10% y luego se deshidrataron en cantidades crecientes de alcohol (70%, 80%, 90%, 96%, 100%), infiltradas en resina de alcohol en una relación decreciente (3 alcohol:1 resina, 1:1, 1:3, resina pura), y finalmente se incrustaron en resina de metacrilato de metilo puro (Technovit 7200 VLC, Exact Kulzer, Bio-Optica, Milano, Italia). Después de eso, las muestras se cortaron por la mitad con una cuchilla de diamante para obtener dos secciones para cada muestra. Estas secciones se pegaron en portaobjetos de plástico, se lijaron hasta un grosor de 100 μm y finalmente se pulieron con óxido de aluminio al 0.1%. Las muestras se tiñeron con una tinción dicromática compuesta de azul de toluidina y amarillo de pironina, que resalta todas las diferentes fracciones de tejido. Los portaobjetos se observaron y fotografiaron con un microscopio de luz y polarizado (Nikon Eclipse, Nikon Instruments S.p.A, Florencia, Italia).
Análisis estadístico
Todo el análisis de datos se llevó a cabo de acuerdo con un plan de análisis preestablecido. Se realizó un análisis descriptivo utilizando la media ± desviación estándar (DE), mediana e intervalo de confianza (IC) del 95% (SPSS para Mac OS X versión 22.0, IBM Corporation, Armonk, Nueva York, EE. UU.). Se realizaron comparaciones entre los diversos puntos finales de seguimiento y las mediciones basales mediante una prueba t de Student emparejada para detectar cualquier cambio. Todas las comparaciones estadísticas se realizaron al nivel de significancia de 0.05. Los pacientes se utilizaron como la unidad estadística.
Resultados
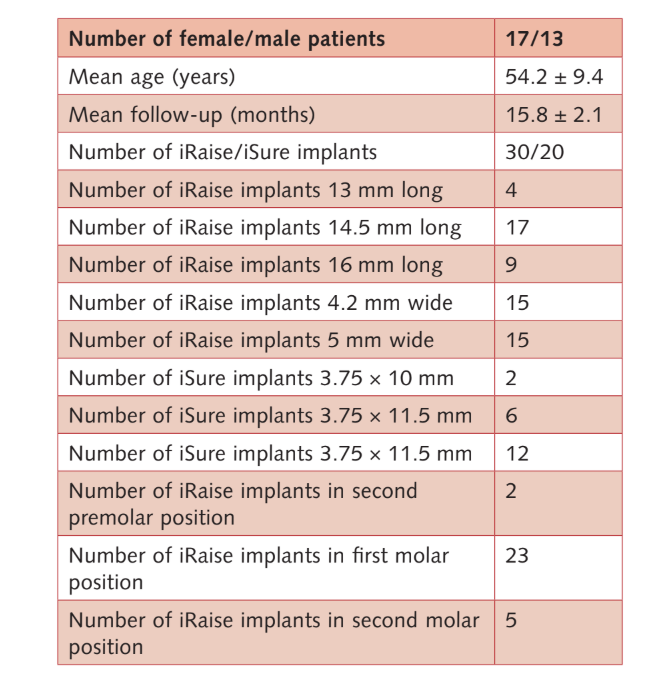
En total, se evaluaron 33 pacientes para determinar su elegibilidad, pero tres luego se negaron a participar en el protocolo de investigación. Por lo tanto, 30 participantes consecutivos (17 mujeres, 13 hombres) con una edad media de 54.2 ± 9.4 años (rango: 28–75) y atrofia severa del maxilar posterior se sometieron a elevación transcrestal de la membrana sinusal, inserción de injerto óseo y colocación de implantes en el sitio planificado, sin desviaciones del protocolo original. El seguimiento medio fue de 15.8 ± 2.1 meses después de la carga del implante (rango: 12–18). Las principales características de los pacientes y los implantes se informan en la Tabla 2.
Se colocaron un total de 50 implantes (30 sistemas de implantes iRaise y 20 implantes iSure adjuntos. Un paciente se retiró en el examen de seguimiento de 1 año después de la carga (el paciente no quiso regresar para las evaluaciones). No se produjeron fallos de implantes ni de prótesis durante el período de seguimiento. Un paciente experimentó un pequeño desgarro en la membrana que fue sellado con una esponja de colágeno (Parasorb Cone, RESORBA Medical GmbH, Núremberg, Alemania). El procedimiento fue abortado y se repitió con éxito 2 meses después. No se observaron otros eventos adversos intraoperatorios o postoperatorios.
Antes de la inserción del implante, la altura media del reborde alveolar residual fue de 4.64 ± 0.86 mm (rango: 3.4–6.4 mm; IC del 95%: 4.39 a 5.01 mm). Inmediatamente después de la colocación del implante, la altura ósea fue de 17.92 ± 2.63 mm (IC del 95% 17.02 a 18.90). Un año después de la carga, la altura ósea se mantuvo estable, con un valor medio de 16.86 ± 3.13 mm (IC del 95% 15.83 a 18.07). La diferencia fue de 1.09 ± 1.60 mm (IC del 95% 0.00 a 1.16; P = 0.0010). La ganancia ósea media (iBH - aBH) en comparación con la línea base fue de 12.15 ± 2.96 mm (IC del 95% 11.22 a 13.38; P = 0.0000).
El nivel medio de hueso marginal en la colocación del implante fue de -0.16 ± 0.86 mm (IC del 95% -0.41 a -0.21).
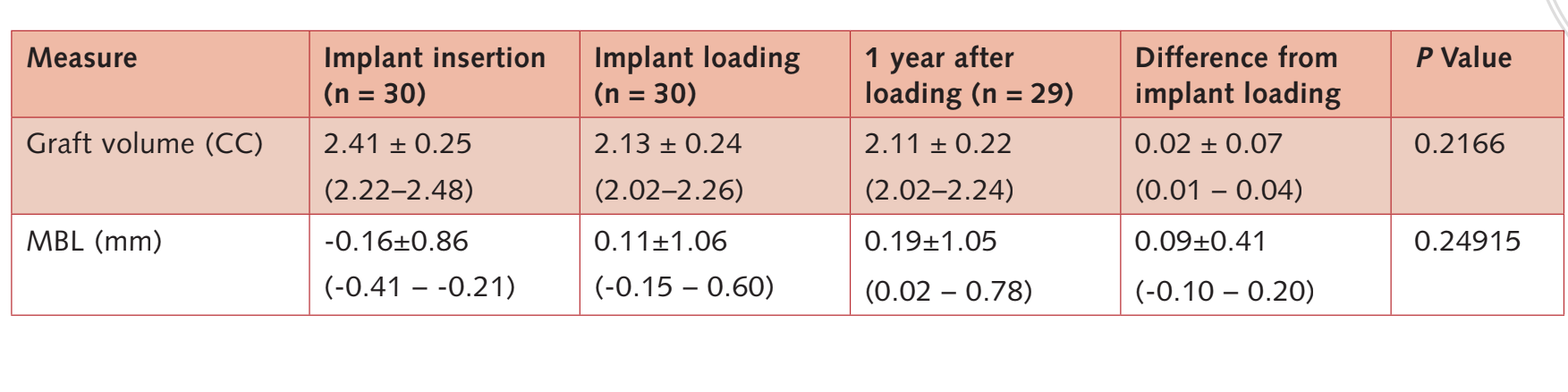
En la carga del implante, el nivel medio de hueso marginal fue de 0.11 ± 1.06 mm (IC del 95% -0.15 a 0.60). En el seguimiento a 1 año después de la carga, el MBL medio fue de 0.19 ± 1.05 mm (IC del 95% 0.02 a 0.78). La diferencia con respecto a la línea base fue de 0.36 ± 0.53 mm; IC del 95% 0.08 a 0.47; P = 0.00095). Los datos se informan en la Tabla 3.
El torque medio de inserción en la colocación del implante fue de 31.6 ± 8.1 Ncm (IC del 95% 29.9 a 35.7) (iChiro Pro, BienAir). El ISQ medio en la colocación del implante fue de 65.2 ± 5.4 (IC del 95% 63.6 a 67.4) y aumentó durante el período de cicatrización alcanzando un valor medio de 73.6 ± 3.7 (IC del 95% 73.1 a 75.9; rango 62–79) en la conexión del pilar de cicatrización (6 meses después de la colocación del implante). La diferencia fue estadísticamente significativa (8.4 ± 5.3; IC del 95% 5.9 a 39.7; P = 0.0000).
En la colocación del implante, 24 de 30 implantes presentaron injerto óseo sobre el ápice del implante. En general (n = 30), el valor medio fue de 2.95 ± 2.56 mm (IC del 95% 2.18 a 4.0). Un año después de la carga, se observó injerto óseo medio sobre la parte superior del ápice en 23 implantes. En general (n = 29), el valor medio fue de 2.29 ± 2.41 mm (IC del 95% 1.22 a 2.98).
El volumen óseo en la colocación del implante fue de 2.41 ± 0.25 CC (IC del 95% 2.22 a 2.48). Durante el período de cicatrización sumergido de 6 meses, se observó una ligera contracción ósea del 11.3%. (2.13 ± 0.24 CC; IC del 95% 2.02 a 2.26; diferencia = 0.27 ± 0.25 CC; IC del 95% 0.10 a 0.36; P = 0.0011). Durante el primer año del período post-carga, el injerto óseo se mantuvo estable (2.11 ± 0.22 CC; IC del 95% 2.02 a 2.24).
La diferencia no fue estadísticamente significativa (0.02 ± 0.07 CC; 95% CI 0.01 a 0.04; P = 0.2166).
Los datos se informan en la Tabla 3.
Los pacientes informaron sobre sus experiencias después de la cirugía. El valor medio del dolor fue de 0.52 ± 0.74 (rango 0–3); el valor medio de hinchazón fue de 0.27 ± 0.52 (rango 0–2); y el consumo medio de analgésicos fue de 0.87 ± 4.94 tabletas (rango 0–4).
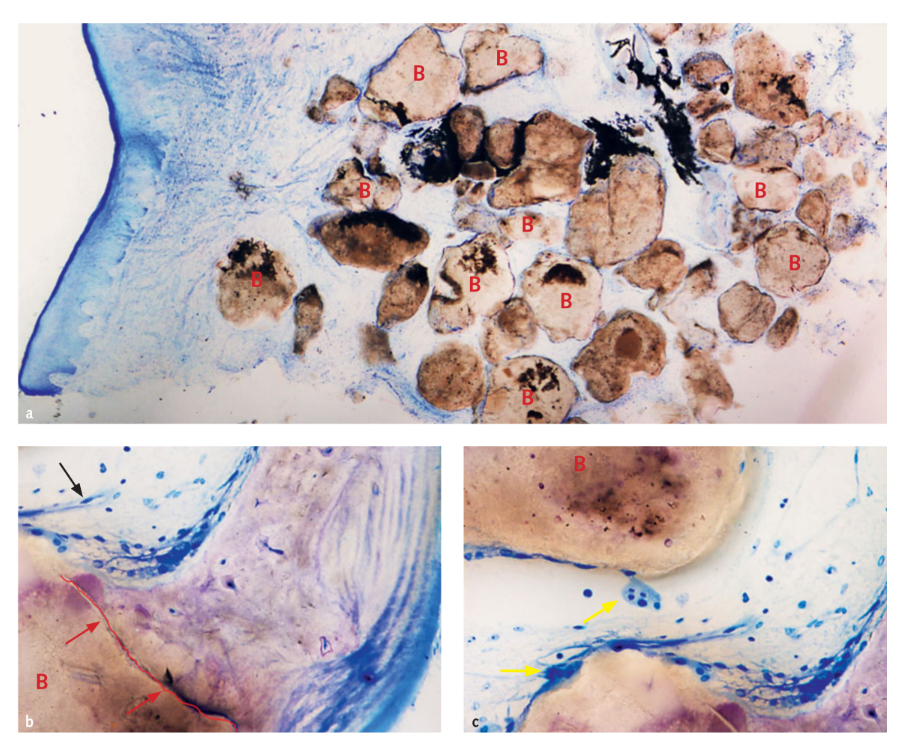
En tres casos donde se colocó un implante adicional en etapas, se tomó una muestra de injerto para análisis histológico. Los análisis morfológicos e histomorfométricos mostraron que después de 6 meses de curación, todas las muestras tenían una estructura normal sin la presencia de un infiltrado inflamatorio (Fig 10). El biomaterial parecía estar rodeado por una matriz mineralizada indicativa de grandes áreas de mineralización tanto a baja (Fig 10a) como a alta magnificación. En la figura 10b, la microfotografía revela el contacto cercano entre el injerto y la nueva matriz ósea. Los vasos sanguíneos eran evidentes en los espacios medulares, presumiblemente para sostener el tejido durante las fases de formación y organización (Figs 10b y 10c). Se detectaron muchas células óseas, en particular células similares a osteoblastos en los bordes del nuevo hueso trabecular en contacto cercano con células osteoclasto durante la fase activa de formación y remodelación del nuevo hueso (Fig 10c). El análisis histomorfométrico mostró las siguientes fracciones de tejido (%): hueso (hueso inmaduro + hueso maduro): 44.07% ± 4.91; biomaterial residual: 23.98% ± 2.64; espacios medulares: 31.95% ± 3.16.
Discusión
El objetivo del presente estudio prospectivo fue reportar los datos de 1 año después de la carga sobre un nuevo sistema de implantes que permite la colocación simultánea de injertos de seno e implantes utilizando un enfoque transcrestal. Debido a que se diseñó como un estudio de cohorte prospectivo, la principal limitación es la falta de un grupo de control. Sin embargo, el presente estudio es uno de los primeros en evaluar datos clínicos y radiográficos de un procedimiento de elevación de seno crestal utilizando un implante dedicado con un canal interno en forma de L 1 año después de la carga. Otra limitación del presente estudio podría ser la tecnología utilizada para medir la contracción del volumen óseo. Aunque esta tecnología permite la superposición y segmentación de diferentes volúmenes óseos, no hay evidencia científica presente. Por lo tanto, los datos deben interpretarse con precaución.
Durante todo el período de seguimiento, no hubo fallos de implantes, y solo se experimentó una rotura de membrana, sin otros eventos adversos. Por lo tanto, la principal consideración clínica de este estudio prospectivo fue que la elevación de la membrana del seno se puede realizar de manera segura utilizando presión hidráulica directamente a través del canal del implante, permitiendo el injerto óseo (también a través del canal) y la colocación del implante al mismo tiempo. El enfoque presentado se puede realizar con un mínimo de hueso residual de 3 mm entre la cresta ósea y el suelo del seno.
Según la reciente revisión de Cochrane de Esposito et al sobre procedimientos de elevación de seno, el uso de sustitutos óseos es cuestionable cuando hay más de 3 mm de altura ósea presente. Sin embargo, una variedad de materiales de injerto, ya sea solos o en combinación, han sido validados para su uso efectivo en procedimientos de aumento de seno, incluyendo hueso autógeno, hueso alogénico, hueso xenogénico y materiales aloplásticos (por ejemplo, hidroxiapatita [HA], fosfato tricálcico beta [β-TCP]). En el presente estudio, se utilizó una mezcla de 60% de HA y 40% de β-TCP. Un manuscrito provisional que reporta los datos a los 6 meses después de la colocación del implante en 18 pacientes concluyó que se experimentó una contracción fisiológica del 13.9% del volumen original del injerto durante el período de curación. El presente estudio analizó el tamaño total de la muestra de 30 pacientes reportando una ligera contracción ósea del 11.3% durante el período de 6 meses de curación sumergida. Posteriormente, el injerto óseo permaneció estable, con una contracción del 0.95%. Una revisión sistemática reciente de Shanbhag et al sobre procedimientos de aumento de seno realizados con un enfoque lateral convencional reportó reducciones en los volúmenes de aumento durante la curación temprana que oscilaban entre el 18% y el 22% al usar sustitutos óseos, sin diferencias significativas entre los materiales de injerto. Específicamente, en un ensayo controlado aleatorio de Kühl et al, dentro de los primeros 6 meses de aumento del seno maxilar, el volumen disminuyó en un 15% para el fosfato de calcio bifásico (BCP, 60% de HA y 40% de β-TCP) y un 18% cuando los investigadores añadieron hueso autólogo particulado en el sitio de prueba, sin diferencias estadísticamente significativas entre los dos grupos. Varios otros estudios también confirmaron una reducción en el volumen del material de injerto. Hatano et al sugirieron que el hueso autógeno o el sustituto óseo tiene una contracción dimensional en altura del 20% hasta 2 años. Aunque el hueso autólogo se considera el estándar de oro de acuerdo con Wiltfang, muchas preocupaciones están relacionadas con una resorción impredecible observada. Esta afirmación fue confirmada por Shanbhag et al en una revisión sistemática al usar bloques de hueso autólogo que redujeron su volumen en un 45% con el tiempo después de 6 a 24 meses. Los mismos autores confirmaron que el hueso bovino anorgánico utilizado solo o en combinación con hueso autólogo mostró un cambio de volumen del 15% al 21%, sugiriendo una mejor estabilidad de volumen en comparación con el hueso autólogo solo. Los resultados de estos estudios apoyan los hallazgos de este estudio.
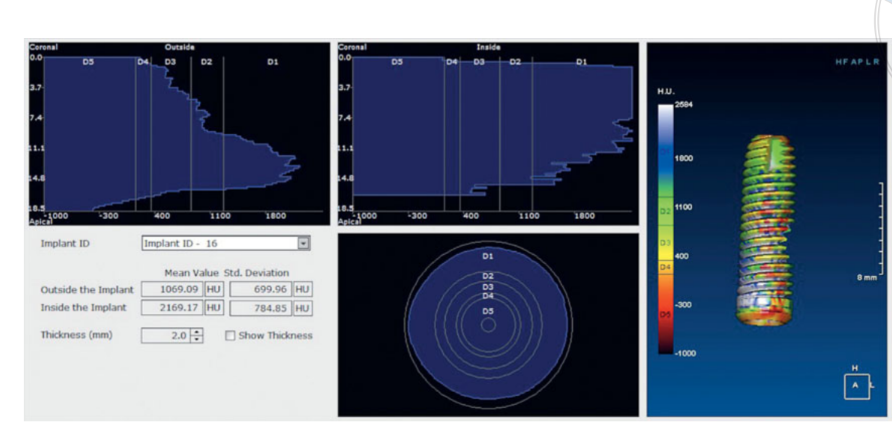
La histología mostró que después de 6 meses, las muestras se caracterizaban por un 44.07% ± 4.91 de hueso en diferentes etapas de mineralización, un 23.98% ± 2.64 de partículas de injerto residuales y un 31.95% ± 3.16 de espacios medulares. Aunque aproximadamente la mitad del material injertado original aún estaba presente 6 meses después de la cicatrización sumergida, los datos radiológicos de un estudio preliminar anterior23 indicaron que la densidad del injerto mejoró significativamente de 322.0 ± 100.42 Unidades Hounsfield (UH) (rango: 177–449 UH; IC 95%: 246.4 a 377.6) a 1,062.0 ± 293.7 UH (rango: 573–1,489 UH; IC 95%: 876.12 a 1,259.88). Esta diferencia fue estadísticamente significativa (740.0 ± 295.35 UH; rango: 324–1,231; IC 95%: 426.04 a 811.96; P = 0.0001).
Las Unidades Hounsfield se refieren a una escala D1-D5, que se basa en valores de tomografía computarizada médica y no son completamente fiables cuando se trata de escaneos CBCT. Sin embargo, según Cassetta et al, la UH era igual a los valores de densidad en gris multiplicados por una relación de conversión de 0.7. Por lo tanto, la investigación preliminar anterior del presente estudio indicó una densidad media del injerto (Figura 11) comparable a un valor D2 según la clasificación de Lekholm y Zarb. Además, los datos clínicos mostraron que la ISQ media en la colocación del implante fue de 65.2 ± 5.4 (IC 95% 63.6 a 67.4) y aumentó durante el período de cicatrización alcanzando el valor medio de 73.6 ± 3.7 (IC 95% 73.1 a 75.9; rango 62–79). La diferencia fue estadísticamente significativa (8.4 ± 5.3; IC 95% 5.9 a 39.7; P = 0.0000). Todos estos datos están de acuerdo con las altas tasas de supervivencia de los implantes, sin fallos experimentados durante todo el período de seguimiento.
Se han sugerido implantes cortos como una alternativa a los procedimientos de elevación de seno. Las ventajas de los implantes cortos incluyen una operación menos técnicamente exigente, por lo tanto, potencialmente menos complicaciones y un menor costo (sin injerto óseo). Los datos de varios ensayos controlados aleatorios mostraron que los implantes cortos de 4 a 8 mm podrían ser una alternativa adecuada, más simple, más económica y más rápida que los implantes más largos colocados en hueso aumentado. También se ha demostrado que los procedimientos de elevación de seno utilizando presión hidráulica proporcionan una alta predictibilidad en los resultados clínicos, junto con una morbilidad extremadamente baja y tejidos quirúrgicos acortados. Por lo tanto, tanto los implantes cortos como los más largos colocados en conjunto con la elevación hidráulica del seno representan opciones de tratamiento viables. Sin embargo, se necesitan ensayos controlados aleatorios, y los períodos de seguimiento aún son demasiado cortos para sacar conclusiones definitivas sobre el mejor tratamiento para indicaciones específicas.
Conclusiones
La augmentación del suelo del seno maxilar se puede lograr con éxito mediante un enfoque transcrestal utilizando un sistema de implantes dedicado que permite la elevación hidráulica de la membrana de Schneider, la inyección de un material de injerto óseo fluido y la colocación simultánea de implantes dentales, con un mínimo de incomodidad para el paciente. Durante la cicatrización, se experimentó una contracción fisiológica del 11.3% del volumen original del injerto óseo. Posteriormente, no se observó reducción adicional del volumen del injerto. Se necesitan estudios clínicos a largo plazo para confirmar estos resultados.
Marco Tallarico, David L Cochran, Erta Xhanari, Claudia Dellavia, Elena Canciani, Eitan Mijiritsky, Silvio Mario Meloni
Referencias
- Nickenig HJ, Wichmann M, Zoller JE, Eitner S. Elevación lateral del seno maxilar mínimamente invasiva basada en 3-D en un solo tiempo: un estudio piloto clínico prospectivo aleatorizado con evaluación ciega de los cambios visibles en el volumen de los tejidos blandos faciales postoperatorios. J Craniomaxillofac Surg 2014;42:890–895.
- Bechara S, Kubilius R, Veronesi G, Pires JT, Shibli JA, Mangano FG. Implantes dentales cortos (6 mm) versus elevación del suelo del seno maxilar y colocación de implantes dentales más largos (≥10 mm): un ensayo controlado aleatorizado con un seguimiento de 3 años. Clin Oral Implants Res 2016 Jul 12. doi: 10.1111/ clr.12923. [Epub ahead of print].
- Katranji A, Fotek P, Wang HL. Complicaciones de la augmentación del seno: Etiología y tratamiento. Implant Dent 2008;17: 339–349.
- Tatum H Jr. Reconstrucciones de implantes maxilares y de seno. Dent Clin North Am 1986;30:207–229.
- Boyne PJ, James RA. Injerto del suelo del seno maxilar con médula y hueso autógeno. J Oral Surg 1980;38:613–616.
- Misch CE. Augmentación del seno maxilar para implantes endosteales. Planes de tratamientos alternativos organizados. Int J Oral Implantol 1987;4:49–58.
- Smiler DG, Holmes RE. Procedimiento de elevación del seno utilizando hidroxiapatita porosa: un informe preliminar. J Oral Implantol 1987;13:239–253.
- Wood R, Moor P. Injerto del seno maxilar con hueso autógeno cosechado intraoralmente antes de la colocación del implante. Int J Oral Maxillofac Implants 1988;3:209–214.
- Kent JN, Block MS. Injerto óseo del suelo del seno maxilar y colocación de implantes recubiertos de hidroxiapatita simultáneamente. J Oral Maxillofac Surg 1989;47:238–242.
- Misch CE, Dietsh F. Materiales de injerto óseo en odontología implantológica. Implant Dent 1993;2:158–167.
- Better H, Slavescu D, Barbu H, Cochran DL, Chaushu G. Dispositivo de implante de elevación del seno mínimamente invasivo: resultados preliminares de un ensayo multicéntrico de seguridad y eficacia. Clin Implant Dent Relat Res 2014;16:520–526.
- Johansson B, Grepe A, Wannfors K, Hirsch JM. Un estudio clínico de los cambios en el volumen de los injertos óseos en el maxilar atrófico. Dentomaxillofac Radiol 2001;30:157–161.
- Hallman M, Sennerby L, Zetterqvist L, Lundgren S. Un estudio prospectivo de seguimiento de 3 años de prótesis fijas soportadas por implantes en pacientes sometidos a elevación del suelo del seno maxilar con una mezcla 80:20 de hueso bovino desproteinizado y hueso autógeno. Análisis clínico, radiográfico y de frecuencia de resonancia. Int J Oral Maxillofac Surg 2005;34:273–280.
- Wanschitz F, Figl M, Wagner A, Rolf E. Medición de cambios de volumen después de la elevación del suelo del seno con un hidroxiapatita psicogénica. Int J Oral Maxillofac Implants 2006;21:433–438.
- Kirmeier R, Payer M, Wehrschuetz M, Jakse N, Platzer S, Lorenzoni M. Evaluación de cambios tridimensionales después de la elevación del suelo del seno con diferentes materiales de injerto. Clin Oral Implants Res 2008;19:366–372.
- Klijn RJ, van den Beucken JJ, Bronkhorst EM, Berge SJ, Meijer GJ, Jansen JA. Valor predictivo de las dimensiones de la cresta sobre la resorción del injerto óseo autólogo en cirugía de elevación del seno maxilar en etapas utilizando Cone-Beam CT. Clin Oral Implants Res 2012;23:409–415.
- Umanjec-Korac S, Wu G, Hassan B, Liu Y, Wismeijer D. Un análisis retrospectivo de la tasa de resorción del hueso bovino desproteinizado como material de injerto del seno maxilar en tomografía computarizada de haz cónico. Clin Oral Implants Res 2014;25:781–785.
- Meloni SM, Jovanovic SA, Lolli FM, Cassisa C, De Riu G, Pisano M, Lumbau A, Luglie PF, Tullio A. Injerto después de la elevación del seno con hueso bovino anorgánico solo en comparación con una mezcla 50:50 de hueso bovino anorgánico y hueso autógeno: resultados de un ensayo piloto aleatorizado a un año. Br J Oral Maxillofac Surg 2015;53:436–441.
- Frayssinet P, Trouillet JL, Rouquet N, Azimus E, Autefage A. Osteointegración de cerámicas de fosfato de calcio macroporosas con diferente composición química. Biomaterials 1993;14:423–429.
- Daculsi G, Laboux O, Malard O, Weiss P. Estado actual de las biocerámicas de fosfato de calcio bifásicas. J Mater Sci Mater Med 2003;14:195–200.
- Le Nihouannen D, Saffarzadeh A, Aguado E, Goyenvalle E, Gauthier O, Moreau F, Pilet P, Spaethe R, Daculsi G, Layrolle P. Propiedades osteogénicas de cerámicas de fosfato de calcio y compuestos a base de pegamento de fibrina. J Mater Sci Mater Med 2007;18:225–235.
- Esposito M, Felice P, Worthington HV. Intervenciones para reemplazar dientes perdidos: procedimientos de augmentación del seno maxilar. Cochrane Database Syst Rev 2014;13:CD008397.
- Tallarico M, Meloni SM, Xhanari E, Pisano M, Cochran DL. Procedimiento de augmentación del seno mínimamente invasivo utilizando un dispositivo de implante de elevación hidráulica del seno: un estudio de serie de casos prospectivo sobre resultados clínicos, radiológicos y centrados en el paciente. Int J Periodontics Restorative Dent 2017;37: 125–135.
- Tallarico M, Better H, De Riu G, Meloni SM. Un nuevo sistema de implantes dedicado a la elevación hidráulica de la membrana de Schneider y simultáneamente a la augmentación del injerto óseo: un estudio clínico retrospectivo de hasta 45 meses. J Craniomaxillofac Surg. 2016;44:1089–1094.
- Shanbhag S, Shanbhag V, Stavropoulos A. Cambios de volumen de las augmentaciones del seno maxilar a lo largo del tiempo: una revisión sistemática. Int J Oral Maxillofac Implants 2014;29:881–892.
- Kühl S, Payer M, Kirmeier R, Wildburger A, Acham S, Jakse N. La influencia del hueso autógeno particulado en la estabilidad temprana del volumen de los injertos del seno maxilar con fosfato de calcio bifásico: un ensayo clínico aleatorizado. Clin Implant Dent Relat Res 2015;17:173–178.
- Hatano N, Shimizu Y, Ooya K. Una evaluación radiográfica clínica a largo plazo de los cambios en la altura del injerto después de la elevación del suelo del seno maxilar con una mezcla 2:1 de hueso autógeno/xenoinjerto y colocación simultánea de implantes dentales. Clin Oral Implants Res 2004;15:339–345.
- Wiltfang J, Schultze-Mosgau S, Nkenke E, Thorwarth M, Neukam FW, Schlegel KA. Augmentación onlay versus procedimiento de elevación del seno en el tratamiento del maxilar severamente reabsorbido: un estudio longitudinal comparativo de 5 años. Int J Oral Maxillofac Surg 2005;34:885–889.
- Lekholm U, Zarb GA. Selección y preparación del paciente. En: Brånemark PI, Zarb GA, Albrektsson T, editores. Prótesis integradas en tejidos: osteointegración en odontología clínica. Chicago: Quintessence Publishing Co. 1985;1–356.
- Cassetta M, Stefanelli LV, Pacifici A, Pacifici L, Barbato E. ¿Qué tan precisa es la CBCT en la medición de la densidad ósea? Un estudio comparativo in vitro de CBCT-CT. Clin Implant Dent Relat Res 2014;16:471–478.
- Esposito M, Pellegrino G, Pistilli R, Felice P. Rehabilitación de mandíbulas edéntulas atróficas posteriores: prótesis soportadas por implantes cortos de 5 mm o por implantes más largos en hueso augmentado? Resultados de un año de un ensayo clínico piloto aleatorizado. Eur J Oral Implantol 2011;4:21–30.
- Pistilli R, Felice P, Cannizzaro G, Piatelli M, Corvino V, Barausse C, Buti J, Soardi E, Esposito M. Mandíbulas atróficas posteriores rehabilitadas con prótesis soportadas por implantes de 6 mm de largo y 4 mm de ancho o por implantes más largos en hueso augmentado. Resultados de un año después de la carga de un ensayo clínico piloto aleatorizado controlado. Eur J Oral Implantol 2013;6:359–372.
- Pistilli R, Felice P, Piattelli M, Gessaroli M, Soardi E, Barausse C, Buti J, Corvino V. Mandíbulas atróficas posteriores rehabilitadas con prótesis soportadas por implantes de 5 x 5 mm con una superficie de titanio incorporada con calcio de nueva estructura nano o por implantes más largos en hueso augmentado. Resultados de un año de un ensayo clínico controlado aleatorizado. Eur J Oral Implantol 2013;6:343–357.
- Gulje FL, Raghoebar GM, Vissink A, Meijer HJ. Coronas individuales en el maxilar posterior reabsorbido soportadas por implantes de 6 mm o por implantes de 11 mm combinados con cirugía de elevación del suelo del seno: un ensayo controlado aleatorizado de 1 año. Eur J Oral Implantol 2014;7:247–255.
- Esposito M, Barausse C, Pistilli R, Sammartino G, Grandi G, Felice P. Implantes cortos versus augmentación ósea para colocar implantes más largos en maxilares atróficos: resultados de un año después de la carga de un ensayo clínico piloto aleatorizado controlado. Eur J Oral Implantol 2015;8:257–268.
- Esposito M, Pistilli R, Barausse C, Felice P. Resultados de tres años de un ensayo clínico controlado aleatorizado comparando prótesis soportadas por implantes de 5 mm de largo o por implantes más largos en hueso augmentado en mandíbulas edéntulas atróficas posteriores. Eur J Oral Implantol 2014;7:383–395.