Una revisión sistemática sobre la definición de periimplantitis: Límites relacionados con los diversos diagnósticos propuestos
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivo: El objetivo de esta revisión sistemática integral fue presentar las diferentes definiciones de periimplantitis propuestas en la literatura.
Materiales y métodos: Se realizaron búsquedas electrónicas y manuales en la literatura por tres revisores independientes para identificar manuscritos que informaran datos sobre la definición de periimplantitis con diagnóstico clínico, escritos en inglés y publicados hasta octubre de 2015. Se referenciaron varias bases de datos, incluyendo PubMed, Embase, la Biblioteca Cochrane y la Base de Datos de Literatura Gris.
Resultados: Cuarenta y nueve artículos fueron considerados adecuados para la revisión. La evidencia actual sugiere el uso de definiciones de caso inequívocas para la periimplantitis, definidas por cambios en el nivel de hueso crestal, presencia de sangrado al sondeo y/o supuración, con o sin un concomitante aumento de la profundidad de los bolsillos periimplantarios. Sin embargo, se utilizaron varios puntos de referencia para medir estos cambios, incluyendo diferentes niveles de gravedad y años de seguimiento.
Conclusión: La literatura científica disponible sugiere una ausencia de una definición unánime de periimplantitis. Se deben considerar futuros estudios que apliquen definiciones de casos consistentes.
Introducción
El término “periimplantitis” se introdujo a principios de la década de 1960 para describir condiciones patológicas infecciosas del tejido periimplantario. Hoy en día, la periimplantitis es la complicación más frecuente de los implantes dentales y ocurre con una frecuencia que varía del 1% al 47% a nivel del implante. A diferencia de la mucositis periimplantaria (definida como la presencia de un infiltrado inflamatorio de tejido blando reversible, sin pérdida ósea adicional más allá de la remodelación ósea fisiológica inicial), la periimplantitis se ha descrito como caracterizada por un proceso inflamatorio alrededor de un implante, que incluye tanto inflamación de tejido blando como pérdida progresiva de hueso de soporte más allá de la remodelación ósea crestal fisiológica. Sin embargo, como se ha destacado en revisiones de literatura recientes y conferencias de consenso, se han reportado diferentes definiciones de periimplantitis. Esto puede deberse en parte a la falta de consenso sobre la terminología, etiología, diagnóstico y sistemas de pronóstico.
La periimplantitis ha sido descrita como una enfermedad con un componente infeccioso que es similar a la periodontitis crónica. El 8.º Taller Europeo sobre Periodontología ha acordado que se deben adoptar las definiciones publicadas en 200810 y 20118. La definición sugerida debe incluir lo siguiente: cambios en el nivel del hueso crestal, sangrado positivo al sondeo (BOP) y/o supuración (SUP), con o sin la presencia de bolsas periimplantarias concomitantes (profundidad de sondaje de la bolsa, PPD). Hoy en día, aunque la acumulación de placa sigue siendo considerada el principal factor etiológico, se ha demostrado que existen otros factores de riesgo potencial relacionados con la enfermedad, incluidos factores del paciente, quirúrgicos y protésicos que pueden contribuir sin duda a su desarrollo.
En la base de datos MeSH (Medical Subject Headings), el término “periimplantitis” fue introducido en 2011 y definido como un proceso inflamatorio con pérdida de hueso de soporte en el tejido que rodea implantes dentales funcionales. A pesar de esta definición de enfermedad muy clara y completa, surgen inconsistencias y confusiones al aplicar la terminología clínicamente. Todos estos factores juntos han llevado a diferentes interpretaciones y definiciones de esta enfermedad emergente común. Además, recientemente, la hipótesis de reacción no infecciosa por cuerpo extraño ha complicado aún más la comprensión de este problema. El objetivo de la presente revisión sistemática fue presentar las diferentes definiciones de periimplantitis propuestas en la literatura.
Materiales y métodos
El presente documento fue preparado en cumplimiento parcial de una declaración de consenso celebrada en Roma, Italia, en enero de 2016. Esta revisión sistemática fue redactada de acuerdo con las directrices PRISMA (Elementos de Informe Preferidos para Revisiones Sistemáticas y Metaanálisis) (http://www.prisma-statement.org/PRISMAStatement/PRISMA-Statement.aspx).
La pregunta enfocada fue: ¿Existe una definición unánime de periimplantitis, incluyendo el diagnóstico clínico? La pregunta de investigación fue adaptada al formato PICO:
P = población: pacientes humanos derivados de estudios clínicos, revisiones sistemáticas, revisiones narrativas, declaraciones de consenso, comentarios o editoriales, que presentaron al menos un implante dental en función durante un mínimo de un año, afectados por periimplantitis;
I = intervención: datos clínicos recopilados con el objetivo de establecer la gravedad de la enfermedad periimplantaria y de definir nuevos criterios para clasificar las enfermedades periimplantarias;
C = comparador/control: resultados clínicos de la periimplantitis comparados con signos clínicos de periodontitis, así como con pacientes sanos;
O = resultados: parámetros clínicos y evaluación radiográfica de la periimplantitis: BOP, PPD, índice de sangrado, presencia de SUP y pérdida ósea marginal (MBL).
Estrategia de búsqueda
Se realizó una estrategia de búsqueda inicial que abarcaba la literatura en inglés desde 1967 hasta octubre de 2015 para identificar estudios relevantes que cumplieran con los criterios de inclusión. Se consultaron las siguientes bases de datos electrónicas: la base de datos PubMed de la Biblioteca Nacional de Medicina de EE. UU., Embase (Excerpta Medica dataBASE) y la Biblioteca Cochrane. De acuerdo con la lista de verificación AMSTAR (A Measurement Tool to Assess Systematic Reviews), se revisó la Base de Datos de Literatura Gris en el Informe de Literatura Gris de la Academia de Medicina de Nueva York para encontrar posibles trabajos no publicados. La revisión se realizó de manera independiente y simultánea por dos examinadores (MT y AM). Un tercer revisor (LC) reevaluó los estudios incluidos y excluidos. Se buscaron en las bases de datos electrónicas utilizando una combinación de palabras clave booleanas, incluyendo MeSH y varios términos de texto libre (Tabla 1).
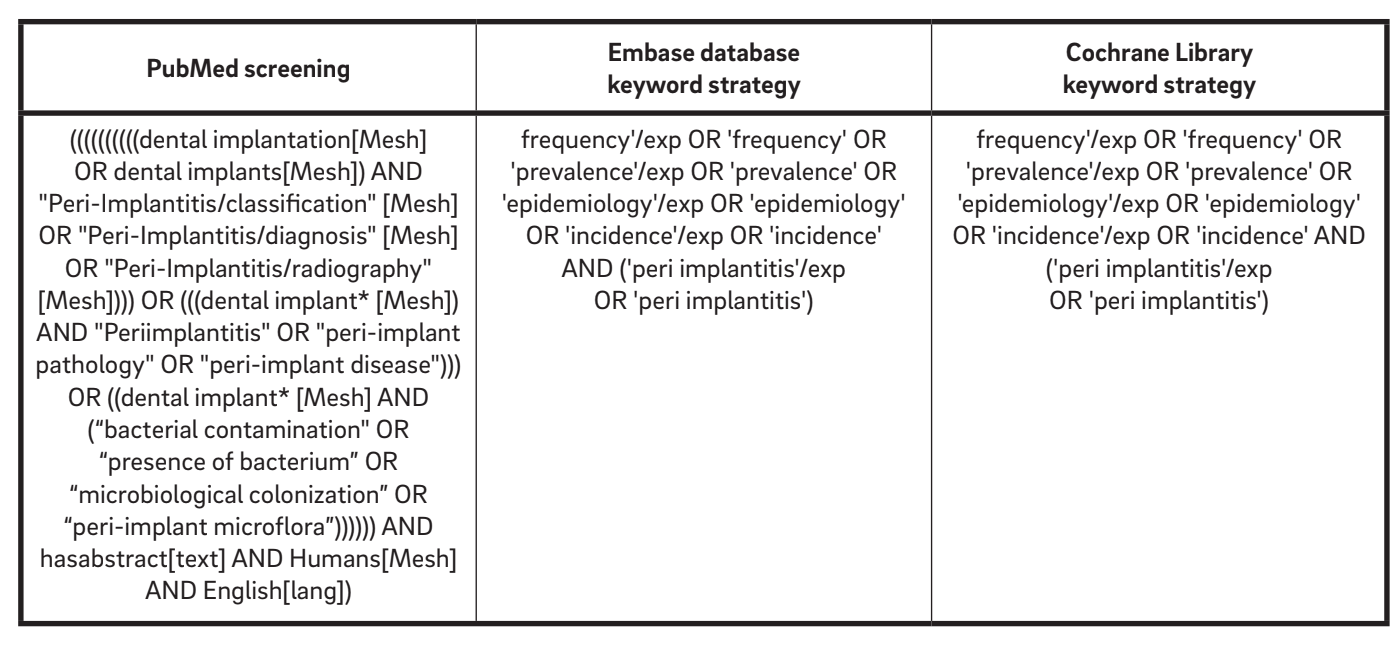
Criterios de elegibilidad
Se definieron los siguientes criterios de inclusión para la selección de artículos:
- escritos en inglés;
- que impliquen examen clínico de pacientes humanos;
- ensayos clínicos controlados aleatorios de implantes de ≥ 1 año en función;
- estudios de cohortes prospectivos y retrospectivos de implantes de ≥ 1 año en función;
- estudios transversales de ≥ 1 año en función; y
- revisiones sistemáticas, revisiones narrativas, declaraciones de consenso, comentarios o editoriales.
Se excluyeron los artículos si eran
- estudios en animales;
- in vitro estudios;
- informes de sitios y/o condiciones comprometidos local o sistémicamente;
- informes con < 15 casos;
- informes que involucren mini-implantes, implantes de una sola pieza o implantes de cuchilla; o
- informes sobre implantes < 1 año en función.
Se seleccionaron artículos sin resúmenes, pero con títulos relacionados con los objetivos de esta revisión, para que se pudiera evaluar el texto completo en busca de elegibilidad. Se obtuvieron textos completos para todos los resúmenes y títulos que parecían cumplir con los criterios de inclusión y fueron evaluados para su inclusión por los mismos dos examinadores. Las listas de referencias de los estudios seleccionados se revisaron en busca de artículos adicionales que pudieran haber cumplido con los criterios de elegibilidad del estudio. Además, se realizaron búsquedas manuales en las listas de referencias de revisiones sistemáticas seleccionadas, limitadas a las siguientes revistas: Clinical Implant Dentistry and Related Research, Clinical Oral Implants Research, International Journal of Oral and Maxillofacial Implants, Journal of Clinical Periodontology y Journal of Periodontology. Cualquier desacuerdo entre los dos revisores se resolvió después de una discusión adicional. Además, se calculó el acuerdo entre investigadores en la segunda etapa. Un revisor final (LC) evaluó posibles inconsistencias entre los dos revisores. Todos los textos completos de los artículos seleccionados se almacenaron en carpetas compartidas accesibles para todos los revisores.
Evaluación cualitativa de parámetros para definir la periimplantitis
Se realizó una evaluación descriptiva para analizar cualitativamente el rango de parámetros considerados para definir la periimplantitis como una condición inflamatoria irreversible que resulta en la degradación del tejido duro. En consecuencia, se evaluaron los siguientes parámetros comunes: PPD, BOP, SUP y MBL radiográfico. Tales parámetros de los diversos artículos se agruparon para analizar la variación o uniformidad entre las definiciones de casos reportadas de periimplantitis. Se generaron gráficos para presentar la variación. Mientras que el PPD se clasificó en tres grupos diferentes (< 3 mm, 3–5 mm y > 5 mm), el MBL radiográfico se categorizó en cuatro rangos principales, dependiendo de la referencia principal tomando la entrega de prótesis como la línea base: ≤ 1 mm, > 1–2 mm, > 3–4 mm y ≥ 5 mm.
Resultados
Proceso de selección
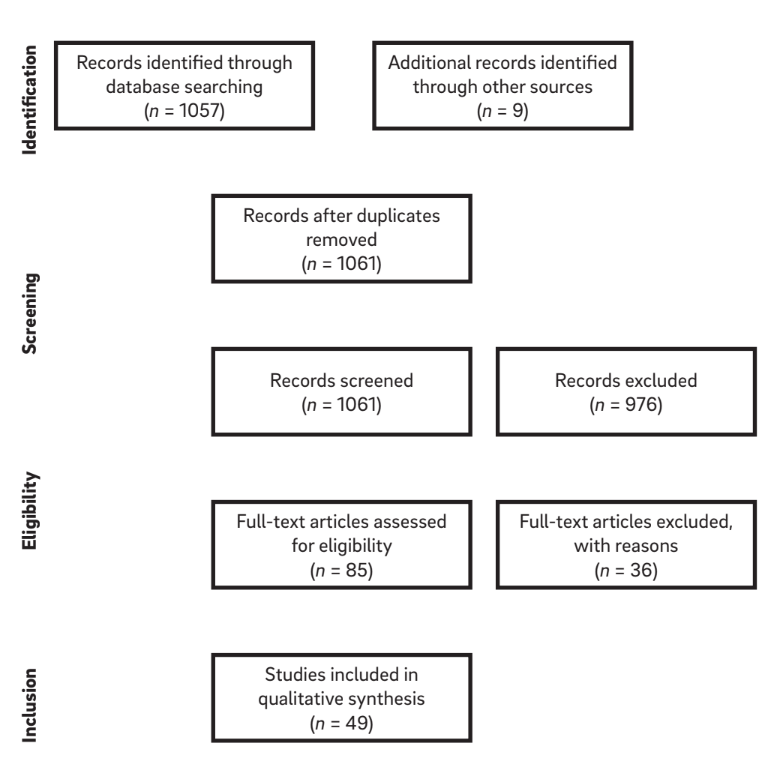
Las combinaciones de términos de búsqueda y una búsqueda manual de referencias en artículos seleccionados resultaron en una lista de 1,061 títulos. De estos, 976 artículos fueron excluidos en base a la evaluación del título y el resumen, dejando 85 artículos elegibles para inclusión (k = 0.84). Después de la aplicación de los criterios de elegibilidad, un total de 49 artículos fueron considerados para revisión. Tras la selección y lectura de los artículos en texto completo, se extrajo la información relevante de cada artículo. Un diagrama de la estrategia de búsqueda se muestra en Figura 1.
Definiciones de “periimplantitis”
Se seleccionaron dieciocho manuscritos, incluidos revisiones narrativas y sistemáticas, declaraciones de consenso y artículos originales, y se extrajeron datos. En 1965, Levignac informó de una inflamación de los tejidos blandos periimplantarios con posterior destrucción del hueso y la etiquetó como “periimplantitis.” En 1987, Mombelli et al. describieron la periimplantitis como una enfermedad infecciosa que comparte características con la periodontitis crónica.13 El mismo autor enfatizó la naturaleza infecciosa de esta condición patológica, centrándose en la carga bacteriana de la superficie del implante y la posterior aparición de una reacción inflamatoria de los tejidos blandos adyacente a los implantes dentales que a veces resultaba en la pérdida de hueso de soporte. Al igual que la periodontitis, se demostró que la etiopatogenia de la periimplantitis era desencadenada por una infección bacteriana que activa una cascada de citoquinas, lo que lleva a la pérdida ósea inflamatoria.
“La periimplantitis” se convirtió en un término aceptado en el informe de consenso del 1er Taller Europeo sobre Periodontología en 1993. Se ha descrito como una reacción inflamatoria destructiva irreversible alrededor de implantes en función que resulta en la pérdida de hueso de soporte. El 6to Taller Europeo sobre Periodontología presentó una definición modificada, no solo para reconocer que la periimplantitis es una condición tratable, sino también para incluir el término colectivo de “enfermedad peri-implantaria” tanto para la mucositis periimplantaria como para la periimplantitis.
Con el fin de mejorar la calidad de la investigación sobre enfermedades periimplantarias, el 7mo Taller Europeo sobre Periodontología recomendó el uso de definiciones de casos inequívocas: cambios en el nivel de hueso crestal y presencia de BOP y/o SUP, con o sin profundización concomitante de los bolsillos periimplantarios.8 Finalmente, la Academia Americana de Periodontología en 2013 definió “periimplantitis” como una reacción inflamatoria asociada con la pérdida de hueso de soporte más allá de la remodelación ósea biológica inicial alrededor de un implante en función.
La extensión y gravedad de las enfermedades periimplantarias rara vez se han reportado. Froum y Rosen propusieron una combinación de BOP y/o SUP, PPD y la extensión de MBL radiográfico alrededor del implante para clasificar la periimplantitis en categorías de enfermedad temprana, moderada o avanzada. Asimismo, Decker et al. propusieron un sistema de pronóstico basado en el diagnóstico para cada categoría siguiendo la clasificación de pronóstico de Kwok y Caton para la dentición natural. En su estudio, los autores afirmaron que PPD, la extensión de MBL radiográfico, la presencia de SUP y la movilidad del implante se encontraron como los factores más críticos para categorizar los casos como con un pronóstico favorable, cuestionable, desfavorable o desesperanzador.
Recientemente, Albrektsson et al. modificaron el concepto de periimplantitis como una pérdida de hueso que rodea un implante como una reacción desfavorable clínicamente, desbalanceada del cuerpo extraño, afirmando específicamente que la oseointegración es un proceso mediante el cual el hueso reacciona al implante dental formando una estructura calcificada adyacente a él. De hecho, en ocasiones, esta reacción del cuerpo extraño puede resultar en actividad osteoclástica que puede destruir el hueso de soporte. Los autores creen que el término “periimplantitis” es bastante apropiado, porque no es una enfermedad primaria, sino una complicación de una reacción desfavorable clínicamente, desbalanceada del cuerpo extraño que es el punto de partida del proceso patológico y las consiguientes secuelas tisulares.
Actualmente, como se prevé por el consenso del 7º Taller Europeo sobre Periodoncia, se asume que la infección en sí siempre es causada por la placa y sus productos; sin embargo, se reconocen numerosos factores de riesgo que están específicamente asociados con la periimplantitis, como factores relacionados con la cirugía o la prótesis, características del implante, tabaquismo y respuesta del huésped.
Definición de periimplantitis con diagnóstico clínico y radiográfico
Se seleccionaron treinta y un manuscritos (Tabla 2) y se extrajeron datos. Se analizaron informaciones de 1,711 pacientes con 5,432 implantes. El término “periimplantitis” se ha utilizado generalmente para describir cualquier implante con diversos grados de pérdida ósea, y una definición clara no se presentó o se extrajo directamente de la terminología.
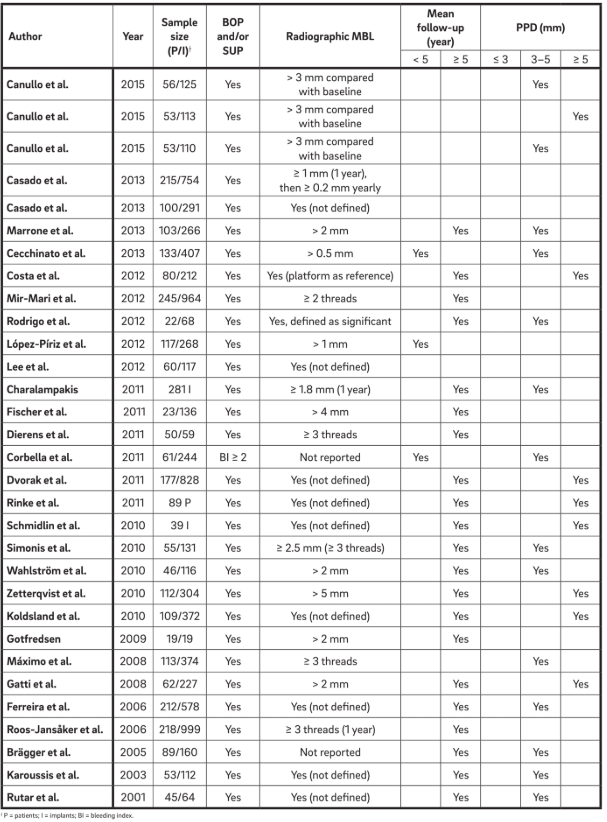
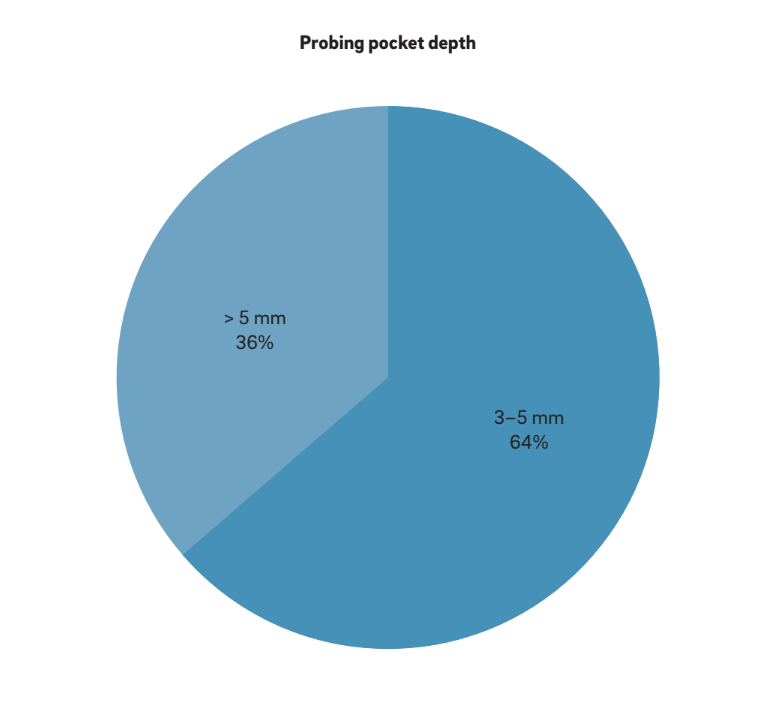
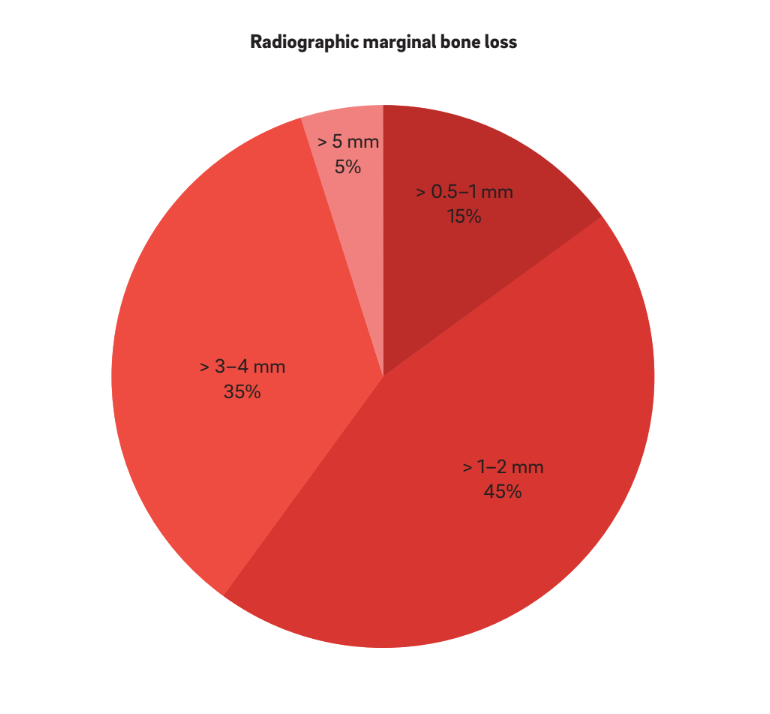
Se han utilizado cuatro características principales para definir “periimplantitis”. Curiosamente, todos los autores consideran BOP y SUP como indicadores de periimplantitis. Este enfoque considera la periimplantitis inducida puramente por placa y cuerpos extraños, donde a menudo se desencadena una respuesta inflamatoria por el biofilm o sus productos y/o sustancias extrañas, como el cemento residual. Además, 22 estudios informaron claramente que el PPD es un parámetro crucial para determinar la periimplantitis. Ningún estudio consideró PPD < 3 mm como indicativo de periimplantitis. Mientras que la gran mayoría (64%) de los estudios definieron PPD = 3–5 mm como indicativo de periimplantitis, el 36% restante consideró PPD > 5 mm como la referencia (Fig. 2). Un MBL radiográfico ≥ 0.5–1 mm, > 1–2 mm, > 3–4 mm y ≥ 5 mm, tomando la entrega de la prótesis como base, se consideró como definitorio de periimplantitis en el 15%, 45%, 35% y 5% de los estudios, respectivamente (Fig. 3). Así, se especuló que un MBL radiográfico < 1 mm debería considerarse como remodelación ósea fisiológica.
BOP y/o SUP fueron requisitos previos en todos los estudios analizados. En la mayoría de los estudios, se utilizó la combinación de mediciones clínicas y radiográficas para la definición de casos. En dos estudios prospectivos, no se reportaron los MBL radiográficos, y se utilizaron solo mediciones clínicas para evaluar complicaciones biológicas. En estos casos, la presencia de BOP y/o SUP al sondeo y PPD ≥ 4 mm fueron requisitos previos para un diagnóstico de periimplantitis. En nueve estudios, un ensayo controlado aleatorio, tres estudios prospectivos y cinco estudios retrospectivos, se realizaron evaluaciones de BOP y radiográficas por separado, sin reportar ninguna medición de PPD. En estos casos, un MBL que varía de 0.5 mm a > 4 mm34 se consideró asociado con periimplantitis.
Antes de 2012, los cambios en el nivel del hueso crestal no estaban definidos o no se reportaban claramente, lo que dificultaba el diagnóstico de periimplantitis. Sin embargo, incluso en estudios que definieron la entidad de MBL, se utilizaron diferentes criterios diagnósticos. En un estudio a largo plazo, la periimplantitis se definió como la presencia de BOP, PPD ≥ 4 mm y MBL > 0.5 mm. Sin embargo, otro estudio utilizó MBL > 4 mm como valor de referencia.34 La mayoría de los estudios consideraron MBL > 2 mm para el diagnóstico de periimplantitis. Anteriormente, nuestro grupo utilizó un MBL radiográfico > 3 mm, a partir de la radiografía basal tomada en el momento de la entrega de la prótesis, para diagnosticar periimplantitis. En tres estudios adicionales, se consideró el MBL en relación con el tiempo que la prótesis estuvo en función. Todos los estudios menos cinco calcularon el MBL en milímetros. En los otros estudios, se utilizaron las roscas del implante como referencia.
Ocho estudios aplicaron PPD > 5 mm para el diagnóstico de periimplantitis. Marrone et al. definieron la periimplantitis como la presencia de BOP, PPD > 5 mm y MBL > 2 mm. Charalampakis et al. aplicaron los criterios de la presencia de BOP y/o SUP, PPD ≥ 5 mm y MBL ≥ 1.8 mm después de un año en función. Zetterqvist et al. incluyeron casos de PPD > 5 mm y MBL ≥ 3 mm. Dos estudios más, uno prospectivo y uno retrospectivo, aplicaron la presencia de BOP y/o SUP, PPD > 5 mm y signos radiográficos de MBL, sin especificar el nivel óseo basal. BOP positivo y/o SUP, MBL radiográfico ≥ 3 mm y PPD ≥ 6 mm fueron utilizados por Koldsland et al.
En el 7º y 8º Taller Europeo sobre Periodoncia, la mucositis periimplantaria y la periimplantitis fueron descritas de la siguiente manera: “cambios en el nivel del hueso crestal, presencia de sangrado al sondeo y/o supuración; con o sin un concomitante aumento de la profundidad de los bolsillos periimplantarios.” La mucositis periimplantaria fue definida con BOP positivo y/o SUP y la periimplantitis con BOP positivo y/o SUP, en combinación con MBL radiográfico ≥ 2 mm. Los mismos parámetros fueron utilizados por Zitzmann y Berglundh para definir la periimplantitis. Sin embargo, Atieh et al. utilizaron los mismos criterios, más PPD ≥ 5 mm, como la definición de periimplantitis en su artículo de revisión sistemática.
Discusión
Las enfermedades periimplantarias se presentan en dos formas: mucositis periimplantaria y periimplantitis. Ambas se caracterizan por una reacción inflamatoria en el tejido que rodea un implante. La mucositis periimplantaria se ha definido como una reacción inflamatoria reversible en el tejido blando que rodea un implante en función, mientras que la periimplantitis se ha definido como una lesión inflamatoria más profunda caracterizada por un bolsillo periimplantario profundizado y pérdida de hueso de soporte alrededor de un implante funcional.
Estudios publicados a principios de 2010 sugirieron que la mucositis y la periimplantitis son equivalentes a la periodontitis, ya que ambas se describen como un desequilibrio entre la carga bacteriana y la respuesta del huésped. Basado en esto, ambas enfermedades están estrechamente relacionadas con la formación de un biofilm que contiene una microbiota rica en bacterias Gram-negativas en presencia de un huésped susceptible. Sin embargo, se ha demostrado que los microorganismos pueden estar presentes, pero no son una necesidad para la periimplantitis. Además, tanto la periodontitis como la periimplantitis comparten varios factores de riesgo sistémicos o indicadores comunes (por ejemplo, fumar, mala higiene oral, diabetes o antecedentes de periodontitis, osteoporosis). De manera similar, la periimplantitis, al igual que ocurre con la periodontitis, parece estar influenciada por un perfil genético particular (es decir, polimorfismo de interleucina-1). Otros han rechazado la descripción de una enfermedad comparable a la periodontitis, debido a las diferencias anatómicas que existen entre las estructuras periodontales y periimplantarias (por ejemplo, diferente orientación de las fibras de colágeno [perpendicular vs. horizontal], vascularidad o capacidad de reparación, y la resiliencia mecánica proporcionada por el ligamento periodontal). De hecho, la periodontitis se caracteriza por la destrucción inflamatoria del aparato de soporte de la dentición (periodonto), incluyendo el ligamento periodontal y el hueso alveolar. Debido a la diferente composición de los dos tejidos de soporte, reacciones tisulares similares alrededor de un implante y un diente parecen muy poco probables. El término “osseo-insuficiencia” fue propuesto por Zarb y Koka para describir la diferencia entre la periimplantitis y la pérdida ósea inducida por periodontitis. La imagen anatómica de la resorción ósea debido a la periodontitis o la periimplantitis difiere, en muchas situaciones, con cráteres óseos muy amplios siendo típicos para el implante pero no para el diente. Por lo tanto, la periimplantitis puede considerarse distinta de la periodontitis en que difiere significativamente en cuanto a inicio y progresión y tiene una baja predictibilidad de tratamiento; en consecuencia, su tratamiento debe centrarse en el diagnóstico temprano y el control de los factores de riesgo o indicadores para prevenir su aparición.
Hasta la fecha, no ha habido parámetros estandarizados para diferenciar clínicamente las diversas etapas y severidades de la periimplantitis. Los criterios utilizados para diagnosticar la periimplantitis siguen siendo inconclusos. La mayoría de los estudios existentes utilizaron parámetros clínicos en combinación con hallazgos radiográficos para definir la periimplantitis. Sin embargo, los parámetros clínicos como BOP y PPD alrededor de los implantes son menos predecibles, ya que están influenciados por más factores confusos en comparación con la dentición natural. Además, cualquier factor que facilite la formación de placa (por ejemplo, mala higiene oral) o la capacidad de defensa del huésped (por ejemplo, hábito de fumar, consumo excesivo de alcohol, rasgos genéticos, historial de periodontitis o uso de bifosfonatos) podría contribuir al desarrollo de la periimplantitis. El diagnóstico y la progresión de la periimplantitis pueden caracterizarse por un aumento en las mediciones de los parámetros clínicos (PPD, BOP, SUP o incluso movilidad), MBL y microbiología. En cuanto a los parámetros clínicos, el PPD es un método de evaluación válido, ya que existe correlación entre los niveles óseos registrados y la penetración de la sonda radiográfica. Sin embargo, en un estudio transversal, los niveles óseos periimplantarios medidos intraoperatoriamente eran más apicales que los niveles óseos radiográficos. El SUP ocurre con más frecuencia en implantes con pérdida ósea progresiva que en aquellos sin pérdida ósea, particularmente en fumadores, y puede estar asociado con episodios de destrucción activa del tejido. En una revisión sistemática, Berglundh et al. definieron la periimplantitis como tener un PPD ≥ 6 mm o MBL ≥ 2.5 mm. Lang y Berglundh, en el consenso de la Federación Europea de Periodontología de 2011, afirmaron que los datos clínicos y radiográficos deberían obtenerse de manera rutinaria después de la instalación de prótesis en implantes para establecer una línea base para el diagnóstico de periimplantitis durante el mantenimiento de pacientes con implantes. Un metaanálisis de Derks y Tomasi mostró claramente una relación positiva entre la prevalencia de la periimplantitis y el tiempo de función. La presencia de pérdida ósea y PPD por sí sola puede no ser suficiente para establecer un diagnóstico de periimplantitis. Un factor importante que potencialmente influye en la amplia gama de prevalencia de la periimplantitis es la falta de consenso respecto a los parámetros clínicos. Por ejemplo, un estudio informó que si se utilizaba PPD > 4 mm como criterio, entonces el 74.8% de los individuos tenía periimplantitis, pero si esta medición se cambiaba a > 6 mm, entonces la prevalencia caía al 43.9%. Cuando se consideró MBL radiográfico para definir la periimplantitis, el 25.3% de los individuos mostró > 2 mm, mientras que el 13.1% tenía > 3 mm. De hecho, si se considera el PPD, se puede encontrar una mayor heterogeneidad. La sondeo alrededor de los implantes está influenciado por muchos factores, como el tamaño de la sonda, la fuerza de sondeo, la dirección de la sonda, la salud y el grosor del tejido blando periimplantario, y el diseño del cuello del implante y la superestructura.1 De hecho, el diseño de plataforma cambiada, así como las restauraciones defectuosas, pueden complicar el sondeo y, por lo tanto, ocultar la verdadera extensión de la periimplantitis. Además, la presencia de discrepancias en los niveles de tejido duro y blando bucolingual puede resultar en diferentes lecturas de PPD.
Debido a la falta de parámetros estándar para determinar la presencia y gravedad de la enfermedad periimplantaria, es difícil desarrollar una estrategia clínica basada en el PPD para manejar este problema común en la odontología de implantes. Sin embargo, Froum y Rosen propusieron un sistema de clasificación para determinar la gravedad de la periimplantitis basado en PPD, MBL y signos clínicos de BOP y/o SUP,28 pero este sistema aún debe ser validado. Además, en una serie de estudios realizados por Merli et al., el acuerdo entre evaluadores en el diagnóstico de la enfermedad periimplantaria se consideró simplemente bueno, debido a la definición poco clara de periimplantitis y mucositis, con un acuerdo completo obtenido solo en la mitad de los casos (52%).
La gran mayoría (45%) de los estudios incluidos en la presente revisión encontraron MBL radiográfico > 1–2 mm después de la carga protésica. Por lo tanto, se proponen los siguientes criterios para definir la periimplantitis: un MBL radiográfico > 1 mm después de la entrega de la prótesis de implante o 2 mm al menos seis meses después de la colocación de la prótesis de implante como un buen indicador de periimplantitis. El BOP no posee un alto valor predictivo debido a la débil conexión de tejido blando alrededor de los implantes dentales. Asimismo, el PPD depende en gran medida del diseño del implante (nivel óseo vs. nivel de tejido), posición apicocoronal y biotipo. A partir de los datos extraídos, parece lógico considerar el MBL radiográfico como el indicador más uniforme y preciso de la periimplantitis. Aunque el valor de corte depende del patrón inflamatorio del paciente, el tipo de cirugía, la posición apicocoronal del implante, el macro diseño del implante y el módulo crestal, considerando la rápida progresión de la enfermedad a lo largo del tiempo, se debe seguir un control radiográfico estricto si se detecta algún síntoma clínico. Además, el clínico debe utilizar una combinación de los muchos parámetros clínicos disponibles, como PPD, estado inflamatorio de la mucosa, BOP en sondaje ligero, MBL radiográfico y posiblemente biomarcadores bacterianos y/o de líquido crevicular periimplantario para establecer un diagnóstico preciso de periimplantitis. A diferencia del caso de la periodontitis, las pruebas bacterianas pueden no ser confiables en el diagnóstico de periimplantitis. Esto sugiere que los ecosistemas periodontal y periimplantario difieren significativamente y, por lo tanto, la enfermedad periimplantaria podría no abordarse siempre como una enfermedad infecciosa. De manera similar, se ha demostrado que tal diferencia se aplica a la patogénesis. Además, no se encontró evidencia de que una infección primaria causara reabsorción ósea marginal.
Conclusión
La literatura científica disponible sugiere una ausencia de una definición unánime de periimplantitis. Las definiciones actuales de periimplantitis se basan únicamente en parámetros clínicos sin considerar otros factores de riesgo potenciales relacionados con la enfermedad. Se deben considerar futuros estudios que apliquen definiciones de casos consistentes.
Marco Tallarico, Alberto Monje, Hom-Lay Wang, Pablo Galindo Moreno, Erta Xhanarid & Luigi Canulloe
Referencias
- Levignac J. [Osteólisis periimplantaria— periimplantosis—periimplantitis]. Rev Fr Odontostomatol. 1965 Oct;12(8):1251–60. Francés.
- Hämmerle CH, Glauser R. Evaluación clínica del tratamiento con implantes dentales. Periodontol 2000. 2004 Feb;34:230–9.
- Schwarz F, Becker K, Sager M. Eficacia de la eliminación de placa administrada profesionalmente con o sin medidas adyuvantes para el tratamiento de la mucositis periimplantaria. Una revisión sistemática y metaanálisis. J Clin Periodontol. 2015 Apr;42 Suppl 16:S202–13.
- Atieh MA, Alsabeeha NH, Faggion CM, Duncan WJ. La frecuencia de enfermedades periimplantarias: una revisión sistemática y metaanálisis. J Periodontol. 2013 Nov;84(11):1586–98.
- Zitzmann NU, Margolin MD, Filippi A, Weiger R, Krastl G. Evaluación y diagnóstico del paciente en el tratamiento con implantes. Aust Dent J. 2008 Jun;53 Suppl 1:S3–10.
- Sanz M, Chapple IL; Grupo de Trabajo 4 del VIII Taller Europeo sobre Periodoncia. Investigación clínica sobre enfermedades periimplantarias: informe de consenso del Grupo de Trabajo 4. J Clin Periodontol. 2012 Feb;39 Suppl 12:202–6.
- Academia Americana de Periodoncia. Informe de la Academia: mucositis periimplantaria y periimplantitis: una comprensión actual de sus diagnósticos e implicaciones clínicas. J Periodontol. 2013 Apr;84(4):436–43.
- Lang NP, Berglundh T; Grupo de Trabajo 4 del Séptimo Taller Europeo sobre Periodoncia. Enfermedades periimplantarias: ¿dónde estamos ahora?—Consenso del Séptimo Taller Europeo sobre Periodoncia. J Clin Periodontol. 2011 Mar;38 Suppl 11:178–81.
- Chan HL, Lin GH, Suarez F, MacEachern M, Wang HL. Manejo quirúrgico de la periimplantitis: una revisión sistemática y metaanálisis de los resultados del tratamiento. J Periodontol. 2014 Aug;85(8):1027–41.
- Lindhe J, Meyle J; Grupo D del Taller Europeo sobre Periodoncia. Enfermedades periimplantarias: informe de consenso del Sexto Taller Europeo sobre Periodoncia. J Clin Periodontol. 2008 Sep;35(8 Suppl):282–5.
- Mombelli A, Müller N, Cionca N. La epidemiología de la periimplantitis. Clin Oral Implants Res. 2012 Oct;23 Suppl 6:67–76.