Resultados del tratamiento con implantes dentales en pacientes bajo terapia activa con alendronato: resultados de seguimiento a 3 años de un estudio observacional multicéntrico prospectivo
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivo: Evaluar los datos clínicos y radiográficos a 3 años de prótesis dental fija soportada por implantes entregadas a pacientes que han tomado alendronato 35–70 mg semanalmente durante al menos 3 años antes de la colocación del implante.
Materiales y Métodos: Cuarenta pacientes consecutivos tratados con bisfosfonatos orales y que requerían una restauración soportada por implantes fueron reclutados en dos centros privados entre enero de 2008 y diciembre de 2011. Los implantes se insertaron mediante un enfoque mínimamente invasivo bajo tratamiento antibacteriano y antibiótico, 6 meses después de detener la administración de alendronato. Después de 4 meses de cicatrización sumergida, los implantes fueron sometidos a carga protésica. El mantenimiento de la higiene y las evaluaciones clínicas se programaron cada 4 meses durante 3 años. Las medidas de resultado fueron las siguientes: éxito del implante y de la prótesis, tasas de supervivencia, cualquier complicación clínica observada, remodelación ósea marginal, profundidad de sondaje y sangrado al sondear.
Resultados: Al final del estudio, ocho pacientes abandonaron. El tamaño final de la muestra resultó en 32 pacientes parcialmente o completamente edéntulos (32 mujeres; edad media 64.6 años) con 98 implantes sumergidos. En solo un paciente, el implante maxilar falló durante el período de cicatrización. Ninguna prótesis falló durante todo el seguimiento, y no se registraron complicaciones mayores. El éxito de los implantes y prótesis resultó en una tasa de supervivencia general del 98, 98% y 100%, respectivamente. La pérdida ósea marginal media a tres años fue de 1.35 ± 0.21 (IC 95% 1.24–1.38). Se encontraron parámetros de tejido blando exitosos alrededor de todos los implantes.
Conclusiones: La terapia con bisfosfonatos orales no pareció afectar significativamente la supervivencia y el éxito del implante en caso de una selección precisa del tiempo de tratamiento, un enfoque quirúrgico mínimamente invasivo y un seguimiento constante. Se requieren más estudios prospectivos que involucren tamaños de muestra más grandes y duraciones de seguimiento más largas para confirmar estos resultados.
Introducción
La osteoporosis es una enfermedad esquelética sistémica progresiva caracterizada por baja masa ósea y deterioro microarquitectónico del tejido óseo, con un consiguiente aumento de la fragilidad ósea y la susceptibilidad a fracturas (Kanis et al. 2008). El tratamiento médico más común para la osteoporosis implica el uso de bisfosfonatos (BPs) (Bernabei et al. 2014). En 2009, la Administración de Alimentos y Medicamentos aprobó la inyección anual de ácido zoledrónico para la prevención de la osteoporosis en poblaciones menopáusicas (Khosla 2009). Los bisfosfonatos son análogos estables de los pirofosfatos inorgánicos que ocurren de forma natural y se clasifican como medicamentos antiresortivos (Fleisch et al. 1966), utilizados para disminuir la actividad de los osteoclastos, prevenir la resorción ósea y reducir su recambio (Reszka & Rodan 2004). Se utilizan comúnmente para tratar enfermedades que afectan el metabolismo óseo, incluyendo el mieloma múltiple, la hipercalcemia secundaria causada por tumores malignos, las metástasis óseas en cánceres de próstata o mama metastásicos, la enfermedad de Paget, así como la osteoporosis (Sarzi Amadè et al. 2008).
La acción de un BP depende de la estructura química del fármaco. Tradicionalmente, los BPs se dividen en fármacos que no contienen nitrógeno (non-N-BPs) y que contienen nitrógeno (N-BPs). Los bisfosfonatos no nitrogenados se metabolizan en la célula en compuestos que reemplazan el grupo pirofosfato terminal del ATP, formando una molécula no funcional que compite con el trifosfato de adenosina (ATP) en el metabolismo energético celular. El osteoclasto inicia la apoptosis y muere, lo que lleva a una disminución general en la descomposición del hueso. La adición de un grupo amino al final de una cadena lateral aumenta la potencia del fármaco; sin embargo, el mecanismo de los BPs que contienen nitrógeno es menos conocido. Según Reszka & Rodan (2004), los N-BPs inhiben la enzima farnesil difosfato sintasa de la vía de biosíntesis del colesterol y interrumpen la vía de ramificación de la isoprenilación, lo que inhibe proteínas y otros factores que desempeñan un papel limitante en la reabsorción ósea por parte de los osteoclastos. Los N-BPs se acumulan en la máxima concentración en la matriz ósea y en los osteoclastos, principalmente durante las primeras 24–48 h de medicación. El resultado final es la disfunción celular del osteoclasto y la muerte (Jones et al. 2001). La inhibición resultante de la reabsorción ósea normal conduce a una reducción en el recambio óseo, un aumento en la densidad ósea, una mejor mineralización y una reducción del riesgo de fractura (Jones et al. 2001).
El alendronato es un bisfosfonato que contiene nitrógeno y que ha sido ampliamente utilizado para el tratamiento de la osteoporosis (Tsetsenekou et al. 2012). Los efectos del alendronato administrado local y/o sistémicamente sobre la oseointegración han sido evaluados extensamente con experimentos realizados en animales (Abtahi et al. 2013). Sin embargo, según un grupo de trabajo establecido por la Sociedad Americana de Investigación Ósea y Mineral, hay poca información disponible sobre los efectos secundarios de los N-BPs orales (Kos et al. 2010).
Dos revisiones sistemáticas recientes de la literatura sugieren que la ingesta de BPs orales no influyó en las tasas de supervivencia de implantes a corto plazo (1–4 años), incluso cuando ocurrieron complicaciones (Madrid & Sanz 2009; Ata-Ali et al. 2014). No obstante, aún faltan estudios prospectivos que informen sobre las tasas de supervivencia y éxito de los implantes. Dado que no se han publicado pautas universalmente aceptadas, la gestión clínica de la ONJ relacionada con bisfosfonatos sigue siendo controvertida (Rupel et al. 2014). Desde 2003, se han publicado informes sobre la necrosis de los huesos de la mandíbula que podrían estar asociadas con la administración de bisfosfonatos (Hasegawa et al. 2012). Ha habido discusión sobre los riesgos asociados con la realización de procedimientos quirúrgicos orales, particularmente injertos óseos y colocación de implantes, en pacientes que están tomando BPs orales (Sarzi Amadè et al. 2008; Memon et al. 2012; Kwon et al. 2014). Los mismos autores concluyeron que la prevención de la ONJ relacionada con BPs no es completamente posible, pero que los procedimientos preventivos no invasivos podrían ayudar a disminuir su incidencia (Sarzi Amadè et al. 2008; Memon et al. 2012; Kwon et al. 2014). La Asociación Americana de Cirujanos Orales y Maxilofaciales recomienda que los pacientes suspendan los BPs 3 meses antes y 3 meses después de la cirugía oral si es posible, especialmente si un paciente ha estado usando BPs durante más de 3 años (Ruggiero et al. 2009; Allen & Ruggiero 2014). Para los pacientes con un historial de tratamiento con bisfosfonatos orales que exceda los 3 años y aquellos que reciben tratamiento concomitante con prednisona, se deben considerar pruebas adicionales y opciones de tratamiento alternativo (Grant et al. 2008).
El propósito de este estudio observacional prospectivo multicéntrico fue presentar los datos a 3 años sobre la supervivencia y tasas de éxito de implantes y prótesis, así como la pérdida ósea peri-implantaria después de la colocación de una prótesis dental fija soportada por implantes entregada a pacientes que toman bisfosfonatos orales (tableta de alendronato de 70 mg una vez a la semana o 5–10 mg una vez al día) durante al menos 3 años antes de la colocación del implante. Este estudio siguió las directrices STROBE (Fortalecimiento del Informe de estudios observacionales en Epidemiología).
Material y métodos
Diseño del estudio
Este estudio observacional prospectivo multicéntrico fue diseñado para evaluar el resultado clínico y radiológico de la prótesis dental fija soportada por implantes entregada a pacientes que toman tableta de alendronato de 70 mg una vez a la semana o 5–10 mg una vez al día, durante al menos 3 años antes de la colocación del implante. Cuarenta pacientes fueron seleccionados y tratados en dos centros privados (20 en Roma, 20 en Sassari, Italia), entre enero de 2008 y diciembre de 2011. Dos clínicos experimentados realizaron todos los procedimientos de implantes y prótesis. La investigación se llevó a cabo de acuerdo con los principios consagrados en la Declaración de Helsinki de 1964 para la investigación biomédica que involucra sujetos humanos, según enmendada en 2008. Los pacientes fueron informados sobre los procedimientos clínicos, materiales a utilizar, beneficios, riesgos potenciales y complicaciones, así como las evaluaciones de seguimiento requeridas para el ensayo clínico, y dieron su consentimiento por escrito para participar en este estudio.
Cualquier paciente sano <90 años, mayor de 18 años en el momento de la colocación del implante, que necesitara una prótesis soportada por implantes fue invitado a participar en la investigación en un orden consecutivo. Los pacientes fueron incluidos en el estudio después de cumplir con los criterios de inclusión y no cumplir con ninguno de los criterios de exclusión.
Los criterios de exclusión fueron los siguientes:
- Contraindicaciones médicas generales (clase III o IV de la Sociedad Americana de Anestesiólogos, ASA) y/o psiquiátricas;
- Embarazo o lactancia;
- Abuso de alcohol o drogas;
- Fumador pesado (>10 cigarrillos/día);
- Terapia de radiación en la región de la cabeza o cuello en los últimos 5 años;
- Alta y moderada actividad parafuncional;
- Ausencia de dientes/prótesis en la mandíbula opuesta;
- Periodontitis no tratada;
- Implantes post-extracción;
- Sangrado en toda la boca e índice de placa en toda la boca mayor o igual al 25%;
- <10 mm de altura y 5 mm de ancho de hueso para permitir implantes;
- No disponibilidad para seguimientos regulares.
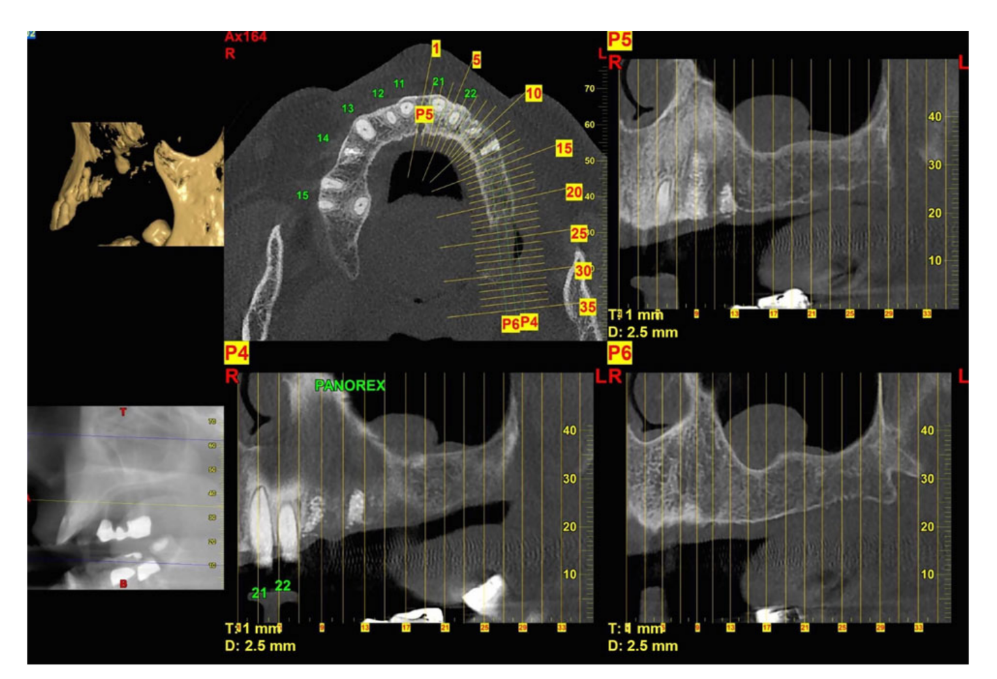
Todos los pacientes fueron tratados de acuerdo a un protocolo diagnóstico y terapéutico de dos pasos (Fig. 1). Los pasos diagnósticos son los siguientes:
- Anamnesis;
- Examen clínico y fotografías;
- Examen radiográfico que incluye radiografías periapicales y panorámicas, tomografía computarizada (TC) o tomografía computarizada de haz cónico (CBCT);
- Examen periodontal (sondeo y medición de los índices de salud oral);
- Documentación fotográfica;
- Información al paciente (medicamentos a tomar y posibles consecuencias).
Procedimientos clínicos
Protocolo terapéutico (Tabla 1):
- Higiene profesional;
- Eliminación de todos los focos de infección (raíces residuales, caries, terapia periodontal):
- tratamiento no restaurador-quirúrgico de todos los dientes comprometidos o con un mal pronóstico;
- tratamiento restaurador de dientes afectados por caries;
- tratamiento periodontal y terapia de soporte;
- evaluación de la adecuación de las prótesis removibles y fijas. En particular, se evaluó el sellado de las estructuras protésicas y la estabilidad de la prótesis removible, que deben ser atraumáticas.
Al final de la etapa de prevención, se motivó a los pacientes a seguir un protocolo de higiene oral doméstica escrupuloso y a cumplir con los recordatorios profesionales.
Dos cirujanos experimentados (MT & SMM) realizaron todas las intervenciones. Cuando estaba planeado, se realizó la extracción dental atraumática al menos 8 semanas antes de la colocación del implante. Las coronas de los dientes multirradiculares fueron seccionadas. Las raíces fueron luego extraídas individualmente y, si era necesario, con la ayuda de un periotomo. Las cavidades de extracción residuales fueron desbridadas a fondo de tejido de granulación y fibras residuales del ligamento periodontal con curetas.
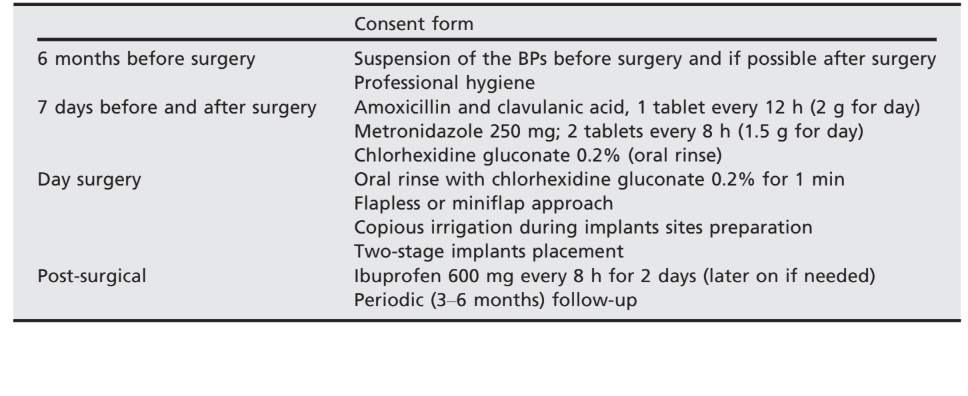
El protocolo prequirúrgico requería la suspensión de los BPs 6 meses antes de la cirugía y hasta la curación completa 4–6 meses después de la instalación del implante. Se administraron antibióticos de manera profiláctica 7 días antes de la cirugía y continuaron durante 7 días (Sarzi Amadè et al. 2008):
- Amoxicilina y ácido clavulánico, una tableta cada 12 h (2 g por día);
- Metronidazol 250 mg; dos tabletas cada 8 h (1.5 g por día).
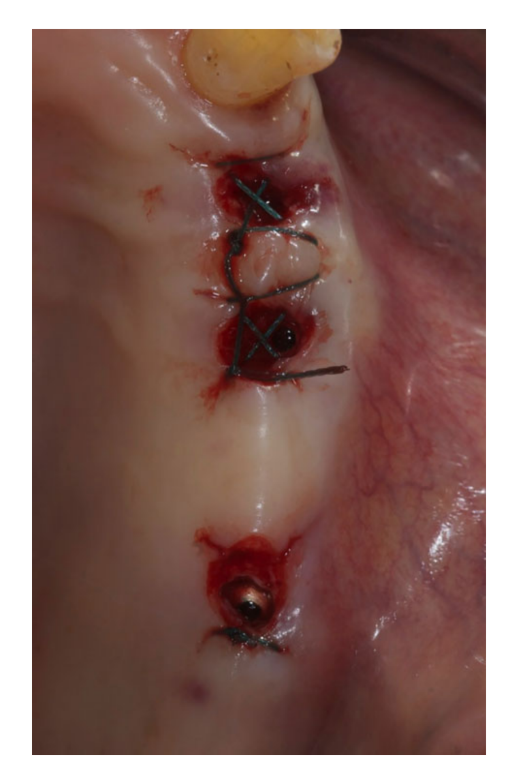
Antes del inicio de la cirugía, los pacientes enjuagaron con enjuague bucal de clorhexidina al 0.2% durante 1 min. Se indujo anestesia local utilizando una solución de articaína al 4% con epinefrina 1 : 100.000 (Ubistein; 3M Italy SpA, Milán, Italia). Los implantes se colocaron en los sitios anatómicos planificados utilizando un enfoque sin colgajo o un minicolgajo, (Fig. 2). La densidad ósea se evaluó durante la fase de perforación según la experiencia y sensación del clínico, y se basó en la clasificación de Lekholm y Zarb (Brånemark et al. 1985). Cada broca se utilizó bajo abundante irrigación de acuerdo con el protocolo recomendado por el fabricante. La plataforma del implante se posicionó al nivel de la cresta alveolar o ligeramente por debajo en el área estética.
Después de la colocación del implante, todos los pacientes recibieron recomendaciones orales y escritas sobre medicación, mantenimiento de la higiene oral y dieta. El tratamiento analgésico postquirúrgico se realizó con ibuprofeno de 100 mg, administrado cada 8 h durante 2 días después de la cirugía, y posteriormente si era necesario. Se instruyó a los pacientes a enjuagarse con enjuague bucal de clorhexidina al 0.2% dos veces al día sin cepillar el área del implante hasta la extracción de los puntos (10–14 días después).
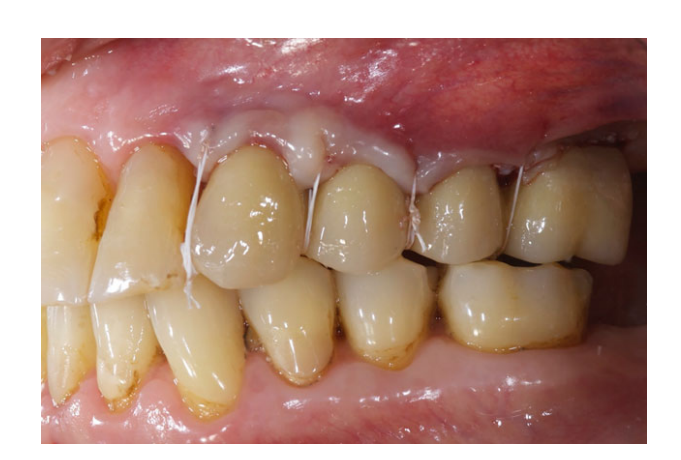
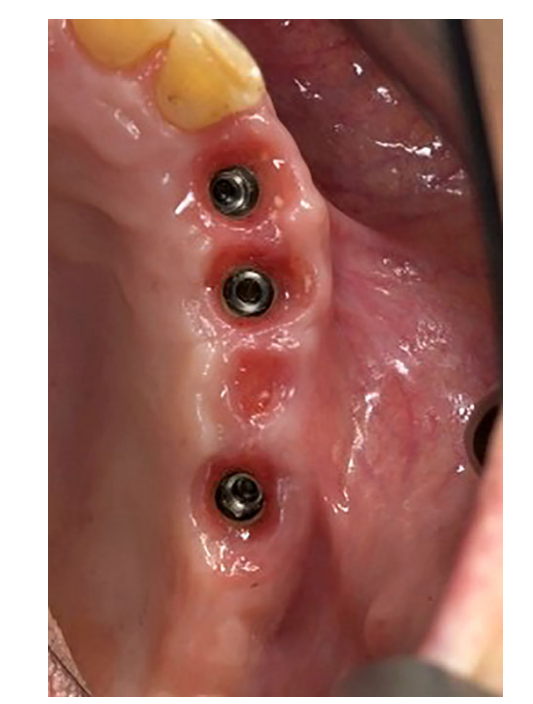
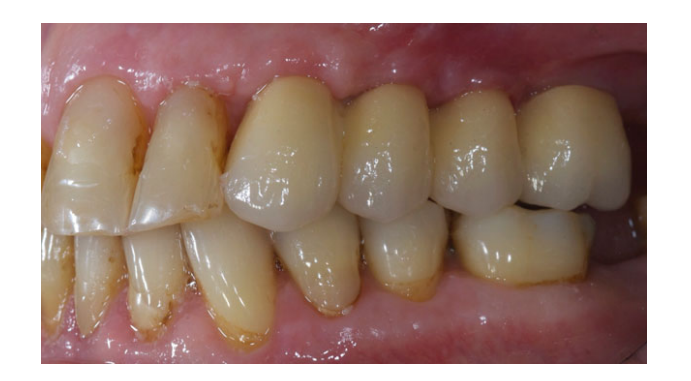
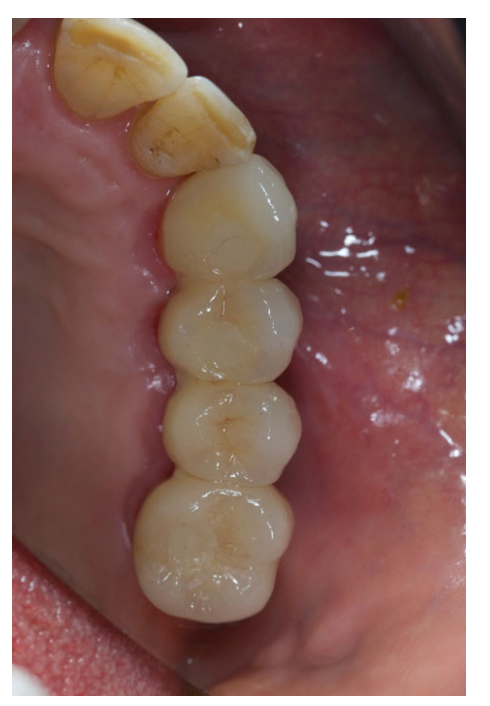
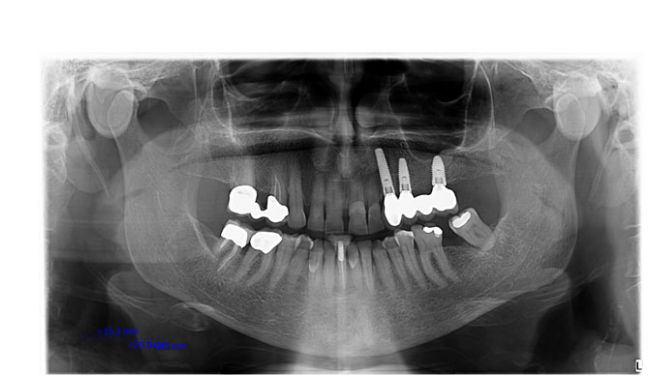
Todos los implantes se colocaron sumergidos. Los implantes fueron expuestos 3 meses después de la colocación del implante (Figs 3 y 4). Se tomaron impresiones con bandeja abierta utilizando un material de poliether (ImpregumTM, 3M ESPE, Seefeld, Alemania) con una bandeja abierta personalizada (Diatray Top, Dental Kontor, Stockelsdorf, Alemania). En el momento de la entrega de la prótesis (Figs 5 y 6), se ajustó la oclusión y las restauraciones se atornillaron o cementaron utilizando cemento de óxido de zinc sin eugenol (Temp Bond NE, Kerr Corporation, Orange, CA, EE. UU.) 12 semanas después de la primera cirugía, de acuerdo con un protocolo de carga convencional (Gallucci et al. 2013). Se programaron visitas de seguimiento de 1 a 6 meses y luego anualmente hasta 3 años de función (Fig. 7). En cada visita de seguimiento, se realizó un ajuste oclusal de la prótesis dental si era necesario. Los pacientes se sometieron a una limpieza profesional por un higienista dental cada 4–6 meses. Se obtuvieron radiografías periapicales anualmente después de la entrega de la prótesis definitiva con el mismo soporte Rinn personalizado (Rinn, Elgin, IL, EE. UU.).
Medidas de resultado
Las medidas de resultado primarias fueron las tasas de éxito y supervivencia del implante. En cada examen de seguimiento, se examinó los implantes para la integración de tejidos de acuerdo con los estrictos parámetros definidos por Buser et al. (1990). Específicamente, la integración se consideró exitosa si se cumplían los siguientes parámetros: (1) ausencia de infección peri-implantaria recurrente con supuración; (2) ausencia de quejas subjetivas persistentes como dolor, sensación de cuerpo extraño y/o disestesia, (3) ausencia de radiolucidez continua alrededor del implante y (4) ausencia de cualquier movilidad detectable del implante. Estos criterios han demostrado ser efectivos para definir el éxito de un sistema de implantes y evaluar los resultados a largo plazo en ensayos clínicos. El éxito de la prótesis se evaluó siguiendo una modificación de los criterios de evaluación, sugeridos por la Asociación Dental de California (CDA (Asociación CD 1976)).
Los resultados secundarios fueron los siguientes: cualquier complicación quirúrgica y protésica ocurrida durante todo el seguimiento, pérdida ósea marginal, profundidad de sondaje de bolsillo (PPD) y sangrado al sondear (BOP).
- Complicaciones: Se consideraron cualquier complicación técnica (fractura del armazón y/o del material de recubrimiento, aflojamiento del tornillo, etc.) y/o biológica (dolor, hinchazón, supuración, etc.).
- Pérdida ósea marginal: La distancia desde el margen más coronal del collar del implante y el punto más coronal de contacto hueso-implante se tomaron como nivel óseo marginal (MBL). El MBL alrededor de los implantes se evaluó en radiografías digitales intraorales tomadas con la técnica de paralelogramo utilizando un soporte de película (Rinn XCP, Dentsply, Elgin, IL, EE. UU.) en la colocación del implante (línea base) y después de 12, 24 y 36 meses. Las radiografías fueron aceptadas o rechazadas para evaluación según la claridad de las roscas del implante. Todas las radiografías legibles se mostraron en un programa de análisis de imágenes (DFW2.8 para Windows, Soredex, Tuusula, Finlandia) en una pantalla LCD de 24 pulgadas (iMac, Apple, Cupertino, CA, EE. UU.) y se evaluaron bajo condiciones estandarizadas (SO 12646:2004). El software fue calibrado para cada imagen utilizando la distancia conocida del diámetro o longitud del implante. Se realizaron mediciones del nivel de cresta ósea mesial y distal adyacente a cada implante hasta el 0.1 mm más cercano y se promediaron a nivel del paciente.
- La PPD y el BoP fueron medidos por un operador ciego con una sonda periodontal (PCP-UNC 15; Hu-Friedy Manufacturing, Chicago, IL, EE. UU.) a los 6, 12, 24 y 36 meses. Se recogieron tres valores vestibulares y tres linguales para cada implante y se promediaron a nivel del paciente.
Dos dentistas independientes y completamente cegados (LC y EX) para cada centro evaluaron la supervivencia e índice de éxito de los implantes y prótesis. Las complicaciones fueron evaluadas y tratadas por los clínicos tratantes (MT y SMM) que no estaban cegados. La pérdida ósea marginal (DMBL) fue evaluada por un radiólogo independiente. Un higienista independiente realizó todas las mediciones periodontales.
Análisis estadístico
El análisis estadístico se realizó para parámetros numéricos como el nivel óseo marginal y los parámetros de tejidos blandos utilizando SPSS para Mac OS X versión 22.0 (SPSS, Chicago, IL, EE. UU.). Se realizó un análisis descriptivo utilizando la media, la desviación estándar (DE) y la mediana con un intervalo de confianza (IC) del 95%. Las tasas de supervivencia y éxito acumulativas se calcularon utilizando los implantes y prótesis como la unidad estadística de los análisis. Las diferencias de los niveles óseos marginales medios entre seguimientos, promediados a nivel de paciente, se compararon mediante la prueba de rangos con signo de Wilcoxon para muestras emparejadas. El nivel de significancia estadística se estableció en 0.05. Las comparaciones entre centros se realizaron mediante análisis de varianza de un solo factor (ANOVA).
Resultados
Al final del estudio, ocho pacientes (20%) con 18 implantes (15.5%) abandonaron. Un paciente en el centro de Roma murió de cáncer hepático. Cinco pacientes (dos en el centro de Roma y tres en el centro de Sassari) tuvieron problemas de salud graves no relacionados con la terapia de implantes dentales, por lo que no pudieron asistir a los exámenes de seguimiento programados. Dos pacientes se mudaron al extranjero. Sin embargo, basándose en una entrevista telefónica, todos estos pacientes tenían sus implantes en función sin complicaciones relacionadas con el paciente (dolor, hinchazón). El tamaño final de la muestra resultó en un total de 98 implantes con superficie oxidada rugosa y diseño de implante de cuerpo cónico (NobelReplace, Nobel Biocare AB) que fueron colocados en 32 pacientes edéntulos consecutivos (32 mujeres) con una edad media de 64.6 (rango 46–80). Cada centro trató el mismo número de 16 pacientes. Cada paciente fue seguido durante ≥3 años de función (rango 36–72 meses; media 47.6 meses). No hubo desequilibrios aparentes en la línea base entre los dos grupos, aparte de un mayor número de implantes más largos utilizados por el centro de Roma y la presencia de más casos tratados utilizando cirugía asistida por computadora basada en plantillas en el centro de Cerdeña. No se produjo ninguna desviación del protocolo original. Todos los datos recopilados se incluyeron en el análisis estadístico.
- Uno de 98 implantes (1.02%) falló durante el período de cicatrización, antes de la entrega de las prótesis finales, resultando en una tasa de supervivencia acumulativa de implantes del 98.98% en el seguimiento a 3 años. El único fallo del implante ocurrió en un paciente del centro de Cerdeña (implante de plataforma estrecha de 10 mm de longitud). El implante no fue reemplazado.
- En el examen de seguimiento a 3 años, ninguna de las prótesis definitivas había fallado, resultando en una tasa de supervivencia prostética acumulativa del 100%.
- No se observó ninguna complicación protésica. No se registraron complicaciones biológicas mayores. Tres pacientes presentaron inflamación mucosa peri-implantaria con sangrado al sondaje (BoP) después de 6 meses. La mejora en la higiene oral redujo la inflamación peri-implantaria, sin ninguna intervención quirúrgica.
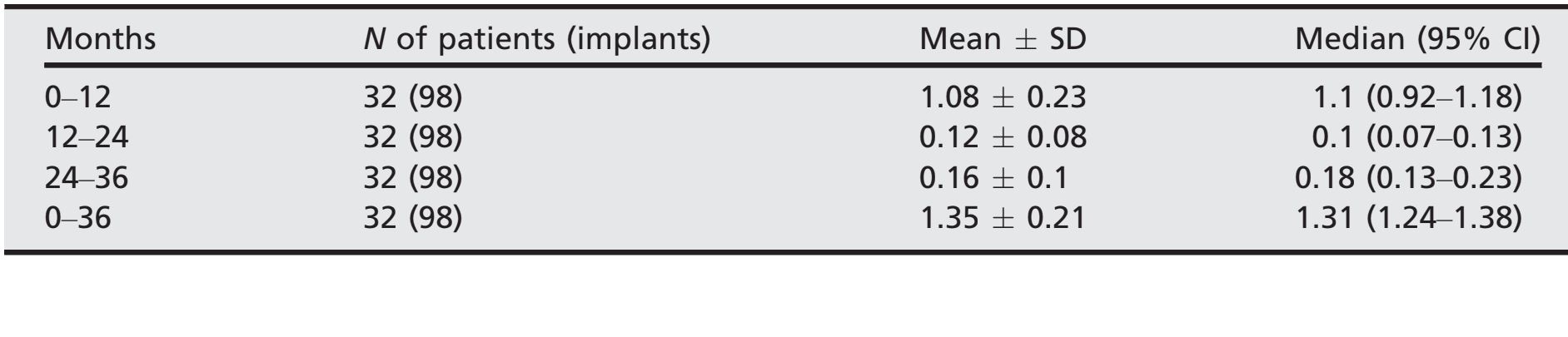
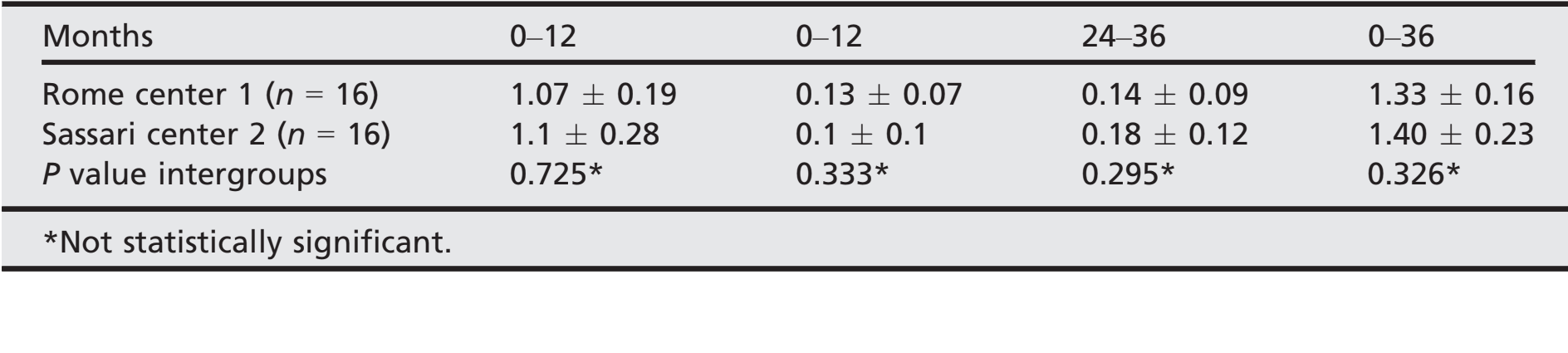
- Después de una pérdida ósea marginal inicial media de 1.08 ± 0.23 (mediana 1.1; IC 95% 0.92–1.18), todos los implantes perdieron una media de 0.12 ± 0.08 (mediana 0.1; IC 95% 0.07–0.13) entre el seguimiento de 1 y 2 años, y 0.16 ± 0.1 (mediana 0.18; IC 95% 0.13–0.23) entre el seguimiento de 2 y 3 años, sin diferencia estadísticamente significativa (P = 0.059). En el seguimiento a 3 años, la pérdida ósea marginal media fue de 1.35 0.21 (mediana 1.31; IC 95% 1.24–1.38). Todos los datos se reportan en la Tabla 2. En cada seguimiento, los cambios en el nivel óseo fueron similares para ambos centros (P ≥ 0.05). Todos los datos se reportan en la Tabla 3.
- En el examen de seguimiento a 3 años, los valores medios de PPD fueron 2.71 0.38 mm (IC 95% = 2.54–2.86). Los valores medios de BoP fueron 1.29 ± 0.76 (IC 95% = 0.93–1.63).
Discusiones
El presente estudio observacional prospectivo fue diseñado para evaluar los resultados clínicos y radiográficos a 3 años de una prótesis dental fija soportada por implantes entregada a pacientes que tomaban alendronato 70 mg en tabletas una vez a la semana o 5–10 mg una vez al día durante al menos 3 años antes de la colocación del implante.
En el examen de seguimiento a 3 años, los resultados del presente estudio mostraron una tasa de supervivencia de implantes y prótesis del 99% y 100%, respectivamente. Los cambios óseos marginales, así como los valores de BOP y PPD parecen ser estables después de 3 años, confirmando que la terapia con implantes en pacientes que toman BPs orales es un tratamiento viable de acuerdo con el protocolo terapéutico propuesto. Estos resultados son consistentes con otros estudios que investigan el mismo tema. En un estudio retrospectivo, Memon et al. (2012) concluyeron que los bisfosfonatos no afectaron el éxito temprano del implante ni los cambios en el hueso crestal. Jeffcoat (2006) y Russo Dello et al. (2007), en dos estudios prospectivos, informaron que los BPs orales no parecían aumentar la incidencia de ONJ. Grant et al. (2008) en un estudio retrospectivo sobre 115 pacientes (468 implantes) informaron que la terapia con bisfosfonatos orales no parecía afectar significativamente el éxito del implante.
Las principales limitaciones de este estudio son el número limitado de participantes, que fueron seguidos durante un corto período. Sin embargo, a pesar de que ocho pacientes abandonaron, se colocaron 98 implantes en 32 pacientes tratados con el mismo protocolo, y seguidos durante al menos 3 años, lo que permite generalizar los resultados del presente estudio a una población más grande con características similares.
El estudio en animales mostró que la administración de BPs interfiere con el remodelado óseo normal después de la extracción dental, poniendo en peligro la curación a largo plazo alrededor de los implantes (Kim et al. 2013). Una de las complicaciones más graves aunque infrecuentes es la osteonecrosis de los maxilares relacionada con bisfosfonatos (BRONJ) (Kwon et al. 2014). La frecuencia de BRONJ puede variar dependiendo de la vía de administración y la potencia de los medicamentos utilizados. La Asociación Americana de Cirujanos Orales y Maxilofaciales informó que la prevalencia de BRONJ era de aproximadamente 0.8% a 12% cuando los BPs se administran por vía intravenosa (Ruggiero et al. 2009; Allen & Ruggiero 2014). Se informa que la prevalencia es más baja cuando los BPs se administran por vía oral. Sin embargo, se sugirió que se debe prestar especial atención cuando los pacientes reciben tratamiento con BPs durante más de 3 años porque la prevalencia de BRONJ aumenta a lo largo del período de tratamiento con BPs (Sarzi Amade` et al. 2008). Después de unos pobres resultados preliminares entusiastas basados en estudios retrospectivos no controlados, algunas revisiones sistemáticas sugirieron resultados más entusiastas. Madrid & Sanz (2009) concluyeron que un paciente que recibe bisfosfonatos orales durante un período de <5 años es “seguro” para someterse a procedimientos dentales, específicamente implantes dentales (Madrid & Sanz 2009). Además, hay un consenso general sobre la no contraindicación de la colocación de implantes en pacientes no oncológicos bajo BPs orales, prescritos principalmente para la osteoporosis (Madrid & Sanz 2009). Más recientemente, Kumar & Honne (2012) evaluando la supervivencia de implantes dentales en usuarios de bisfosfonatos vs. no usuarios concluyeron que la terapia a corto plazo con BPs no aumenta ni disminuye la tasa de supervivencia de los implantes dentales en comparación con los no usuarios.
Aunque la técnica sumergida no es un requisito previo para la oseointegración (Tallarico et al. 2011), en el presente estudio todos los implantes se colocaron sumergidos, sin complicaciones quirúrgicas. Esto podría representar uno de los factores clave junto con un tratamiento antibiótico significativo y la interrupción temporal de la administración de alendronato, previniendo la contaminación bacteriana del sitio del implante.
En el presente estudio, aunque el número limitado de pacientes, la cirugía de implantes no resultó en osteonecrosis de la mandíbula relacionada con bisfosfonatos después de 3 años de la colocación del implante. Sin embargo, existe suficiente evidencia para sugerir que todos los pacientes que se someten a la colocación de implantes deben ser interrogados sobre la terapia con bisfosfonatos, incluyendo el medicamento tomado, la dosis y la duración del tratamiento antes de la cirugía. Los riesgos potenciales de BRONJ deben ser explicados a los pacientes antes de la instalación del implante. Para los pacientes con antecedentes de tratamiento oral con bisfosfonatos que exceden los 3 años y aquellos que reciben tratamiento concomitante con prednisona, se deben considerar pruebas adicionales y opciones de tratamiento alternativo, y la prevención sigue siendo el medio más efectivo para evitar posibles complicaciones. Además, la ubicación anatómica del implante y la duración de la terapia farmacológica en el momento de la colocación no fueron factores significativos en la tasa de éxito o cambios óseos.
Conclusión
Dentro de las limitaciones de este estudio, de acuerdo con el protocolo terapéutico propuesto y realizando una cirugía sumergida mínimamente invasiva, la terapia con bisfosfonatos orales no pareció afectar significativamente la supervivencia y el éxito de los implantes en el seguimiento a medio plazo. Estas conclusiones deben ser confirmadas por estudios prospectivos adicionales que involucren tamaños de muestra más grandes y duraciones de seguimiento más largas.
Marco Tallarico, Luigi Canullo
Referencias
- Abtahi, J., Agholme, F., Sandberg, O. & Aspenberg, P. (2013) Efecto de la entrega local vs. sistémica de bisfosfonatos en la fijación de implantes dentales en un modelo de osteonecrosis de la mandíbula. Journal of Dental Research 92: 279–283.
- Allen, M.R. & Ruggiero, S.L. (2014) Una revisión de agentes farmacéuticos y salud ósea oral: cómo la osteonecrosis de la mandíbula ha afectado el campo. International Journal of Oral and Maxillofacial Implants 29: e45–e57.
- Ata-Ali, J., Ata-Ali, F., Penarrocha-Oltra, D. & Galindo-Moreno, P. (2014) ¿Cuál es el impacto de la terapia con bisfosfonatos en la supervivencia de los implantes dentales? Una revisión sistemática y meta-análisis. Clinical Oral Implants Research doi: 10.1111/clr.12526. [Epub ahead of print].
- Bernabei, R., Martone, A.M., Ortolani, E., Landi, F. & Marzetti, E. (2014) Detección, diagnóstico y tratamiento de la osteoporosis: una breve revisión. Clinical Cases in Mineral and Bone Metabolism 11: 201–207.
- Brånemark, P.I., Zarb, G.A. & Albrektsson, T. (1985) Prótesis Integradas en Tejido: Osteointegración en Odontología Clínica. Chicago: Quintessence ed.
- Buser, D., Weber, H.P. & Lang, N.P. (1990) Integración de tejidos de implantes no sumergidos. Resultados de 1 año de un estudio prospectivo con 100 implantes de cilindro hueco e implantes de tornillo hueco ITI. Clinical Oral Implants Research 1: 33–40.
- California Dental Association, Task Force on Quality Evaluation. (1976) Evaluación de Calidad para la Atención Dental: Directrices para la Evaluación de la Calidad Clínica y el Rendimiento Profesional y los Estándares para el Diseño del Programa para Asegurar la Calidad de la Atención. Los Ángeles: California Dental Association ed. Chicago.
- Fleisch, H., Russell, R. & Straumann, F. (1966) Efecto del pirofosfato sobre la hidroxiapatita y sus implicaciones en la homeostasis del calcio. Nature 212: 901–903.
- Grant, B.T., Amenedo, C., Freeman, K. & Kraut, R.A. (2008) Resultados de la colocación de implantes dentales en pacientes que toman bisfosfonatos orales: una revisión de 115 casos. Journal of Oral and Maxillofacial Surgery 66: 223–230.
- Hasegawa, Y., Kawabe, M., Kimura, H., Kurita, K., Fukuta, J. & Urade, M. (2012) Influencia de las prótesis dentales en el sitio de ocurrencia inicial sobre el pronóstico de la osteonecrosis de mandíbula relacionada con bisfosfonatos: un estudio retrospectivo. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology 114: 318–824.
- Jeffcoat, M.K. (2006) Seguridad de los bisfosfonatos orales: estudios controlados sobre el hueso alveolar. International Journal of Oral and Maxillofacial Implants 21: 349–353.
- Jones, D.H., Nakashima, T., Sanchez, O.H., Kozieradzki, I., Komarova, S.V., Sarosi, I., Morony, S., Rubin, E., Sarao, R., Hojilla, C.V., Komnenovic, V., Kong, Y.Y., Schreiber, M., Dixon, S.J., Sims, S.M., Khokha, R., Wada, T. & Penninger, J.M. (2006) Regulación de la migración de células cancerosas y metástasis ósea por RANKL. Nature 440: 692–696.
- Kanis, J.A., McCloskey, E.V., Johansson, H., Oden, A., Melton, L.J. & Khaltaev, N. (2008) Un estándar de referencia para la descripción de la osteoporosis. Bone 42: 467–475.
- Khosla, S. (2009) Aumento de opciones para el tratamiento de la osteoporosis. New England Journal of Medicine 361: 818–820.
- Kim, I., Ki, H., Lee, W., Kim, H. & Park, J.B. (2013) El efecto de los bisfosfonatos administrados sistémicamente sobre la curación ósea después de la extracción dental y la osteointegración de implantes dentales en el maxilar de conejos. International Journal of Oral and Maxillofacial Implants 28: 1194–1200.
- Kos, M., Brusco, D., Kuebler, J. & Engelke, W. (2010b) Comparación clínica de pacientes con osteonecrosis de las mandíbulas, con y sin antecedentes de administración de bisfosfonatos. International Journal of Oral and Maxillofacial Surgery 39: 1097–1102.
- Kos, M., Kuebler, J.F., Luczak, K. & Engelke, W. (2010a) Osteonecrosis de las mandíbulas relacionada con bisfosfonatos: una revisión de 34 casos y evaluación del riesgo. Journal of Cranio-Maxillofacial Surgery 38: 255–259.
- Kumar, M.N. & Honne, T. (2012) Supervivencia de implantes dentales en usuarios de bisfosfonatos frente a no usuarios: una revisión sistemática. The European Journal of Prosthodontics and Restorative Dentistry 20: 159–162.
- Kwon, T.G., Lee, C.O., Park, J.W., Choi, S.Y., Rijal, G. & Shin, H.I. (2014) Osteonecrosis asociada con implantes dentales en pacientes en tratamiento con bisfosfonatos. Clinical Oral Implants Research 25: 632–640.
- Madrid, C. & Sanz, M. (2009) ¿Qué impacto tienen los bisfosfonatos administrados sistémicamente en la terapia de implantes orales? Una revisión sistemática. Clinical Oral Implants Research 20: 87–95.
- Memon, S., Weltman, R.L. & Katancik, J.A. (2012) Bisfosfonatos orales: éxito temprano de implantes dentales endóseos y cambios en el hueso crestal. Un estudio retrospectivo. International Journal of Oral and Maxillofacial Implants 27: 1216–1222.
- Reszka, A.A. & Rodan, G.A. (2004) Mecanismo de acción de los bisfosfonatos que contienen nitrógeno. Mini Reviews in Medicinal Chemistry 4: 711–719.
- Ruggiero, S.L., Dodson, T.B., Assael, L.A., Landesberg, R., Marx, R.E. & Mehrotra, B. (2009) Documento de posición de la Asociación Americana de Cirujanos Orales y Maxilofaciales sobre la osteonecrosis de la mandíbula relacionada con bisfosfonatos – actualización 2009. Australian Endodontic Journal 35: 119–130.
- Rupel, K., Ottaviani, G., Gobbo, M., Contardo, L., Tirelli, G., Vescovi, P., Di Lenarda, R. & Biasotto, M. (2014) Una revisión sistemática de enfoques terapéuticos en la osteonecrosis de la mandíbula relacionada con bisfosfonatos (BRONJ). Oral Oncology 50: 1049–1057. Russo Dello, N.M., Jeffcoat, M.K., Marx, R.E. & Fugazzotto, P. (2007) Osteonecrosis en las mandíbulas de pacientes que utilizan bisfosfonatos orales para tratar la osteoporosis. International Journal of Oral and Maxillofacial Implants 22: 146–153.
- Sarzi Amadè, D., Tallarico, M., Loreti, M.C., Montecchi, P.P. & Niccoli, A. (2008) Guías clínicas para la prevención de la osteonecrosis de las mandíbulas en pacientes en tratamiento con bisfosfonatos: revisión de la literatura e informe de tres casos. Minerva Stomatologica 57: 429–446.
- Tallarico, M., Vaccarella, A. & Marzi, G.C. (2011) Resultados clínicos y radiológicos de la colocación de implantes en 1 vs. 2 etapas: resultados de 1 año de un ensayo clínico aleatorizado. European Journal of Oral Implantology 4: 13–20.
- Tsetsenekou, E., Papadopoulos, T., Kalyvas, D., Papaioannou, N., Tangl, S. & Watzek, G. (2012) La influencia del alendronato en la osteointegración de implantes dentales tratados con nano en conejos de Nueva Zelanda. Clinical Oral Implants Research 23: 659–666.