Análisis Histológico de la Anchura Biológica y Orientación de Fibras de Colágeno Alrededor de Abutments Hemisféricos sin Tornillo, de Cono Morse, a las 8 y 16 Semanas Después de la Exposición del Implante: Un Estudio Clínico Observacional
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivos: Este estudio tuvo como objetivo evaluar histológicamente, en humanos, la orientación de las fibras de colágeno alrededor de los pilares de base hemisférica, sin tornillos, de Morse taper.
Métodos: Este estudio fue diseñado como un ensayo clínico observacional, caso-control, para evaluar la orientación histológica de las fibras de colágeno alrededor de los implantes. Se realizaron biopsias del tejido peri-implantario 8 (grupo A, control) o 16 (grupo B, prueba) semanas después de la exposición del implante, y se analizaron histológicamente bajo un microscopio óptico utilizando tinciones histoquímicas de Hematoxilina y Eosina, Masson y Picro Sirius, así como un microscopio electrónico de barrido.
Resultados: Ocho pacientes fueron incluidos en este estudio y se realizaron 16 biopsias. Todas las biopsias fueron analizadas correctamente. El examen histológico de secciones transversales del tejido tomadas 8 semanas después de la exposición del implante mostró la casi completa ausencia de revestimiento epitelial, mientras que los haces de tejido conectivo en la porción superficial mostraron un patrón circular más bajo. El examen histoquímico de la sección transversal del tejido tomado 16 semanas después de la exposición del implante mostró la presencia parcial de revestimiento epitelial no queratinizado en el sitio del implante y los haces de colágeno mostraron una mayor organización, con un curso circunferencial alrededor del pilar. A las 8 semanas, el análisis histológico final mostró una altura promedio de 1.01 mm para el epitelio queratinizado, 0.83 mm para el epitelio no queratinizado y 1.39 mm para el tejido conectivo. Mientras que, a las 16 semanas, los valores fueron 1.20 mm, 0.48 mm y 1.11 mm, respectivamente. No se encontraron diferencias estadísticamente significativas entre los grupos (p > 0.05).
Conclusiones: Histológicamente, no hubo diferencias en la altura y el perfil de la encía entre 8 y 16 semanas de curación después de la entrega de la prótesis. Se encontró una mayor organización de las fibras de colágeno con un curso circunferencial alrededor del pilar en el grupo de prueba (16 semanas) en comparación con el grupo de control (8 semanas).
Introducción
El éxito de un tratamiento de implantes se determina en primer lugar por la oseointegración, pero sobre todo se determina por el mantenimiento de la estabilidad tanto del hueso marginal como de los tejidos blandos periimplantarios a lo largo del tiempo. Se puede esperar un remodelado óseo marginal fisiológico estable en el seguimiento a medio-largo plazo cuando se utilizan superficies y conexiones de implantes modernos. En la última década, el concepto de ancho biológico ha sido ampliamente discutido en la implantación oral. Las características de la mucosa periimplantaria se determinan durante el establecimiento del ancho biológico que ocurre tras varias semanas de curación después de conectar los pilares de cicatrización o componentes protésicos. El ancho biológico alrededor de un implante es un sistema complejo de 3–4 mm de tamaño. Se extiende desde la parte superior de la mucosa periimplantaria hasta el primer contacto hueso-implante, consistiendo en epitelio sulcular, epitelio de unión y tejido conectivo fibroso. Sin embargo, se ha demostrado que la disposición diferente de las fibras del tejido conectivo alrededor de los implantes es diferente en comparación con los dientes naturales, con disposiciones circulares o en forma de anillo paralelas al eje largo e implantadas. El papel del ancho biológico es crear una barrera biológica contra los productos tóxicos de las bacterias, protegiendo el hueso subyacente. En los últimos años, este concepto se ha vuelto muy popular en la implantología dental moderna, que está más orientada hacia las necesidades de manejo de tejidos blandos. El manejo de tejidos blandos se puede llevar a cabo con diferentes técnicas quirúrgicas y en diferentes momentos durante los tratamientos de implantes, basándose en el defecto inicial, el área anatómica y consideraciones estéticas. En resumen, se puede realizar un aumento de tejido queratinizado para obtener una banda de tejido queratinizado alrededor de los implantes que mejora sus resultados estéticos y reduce el riesgo de acumulación de placa. Por el contrario, se puede realizar un aumento del grosor del tejido blando para aumentar el grosor de los tejidos blandos supracrestales periimplantarios que son cruciales para obtener un perfil de emergencia natural para la restauración protésica y para asegurar un resultado estético satisfactorio. Además, un biotipo o fenotipo delgado a menudo va en contra de la reabsorción para restaurar el ancho biológico correcto. Los microespacios y los micromovimientos en la interfaz implante-pilar también juegan un papel importante en la estabilidad de los tejidos duros y blandos periimplantarios. La microfiltración en la interfaz implante-pilar puede determinar el paso bacteriano y la liberación de pequeñas partículas de titanio que inducen inflamación en los tejidos periimplantarios. Por tales razones, hoy en día, los implantes con conexión de cono Morse y sin tornillo de conexión pueden representar una buena opción.
El aparato de fibras supragingivales consiste en una densa red de haces de fibras de colágeno
que conectan la encía con los dientes y el hueso, mientras conectan las papilas interdental vestibular y oral [9]. Esta red de fibras proporciona resistencia mecánica, permitiendo que la encía soporte fuerzas de fricción de la masticación. El epitelio de unión forma la parte coronal de la unión dentogingival, mientras que la porción apical consiste en fibras de tejido conectivo dentogingival que se extienden hacia el cemento radicular, asegurando la unión del tejido conectivo. La mucosa peri-implantaria alrededor de implantes endoóseos exitosos comparte muchas similitudes con los tejidos que rodean los dientes naturales. La lámina propia se extiende coronariamente desde el hueso alveolar y está cubierta por epitelio oral queratinizado. En condiciones saludables, se forma un surco poco profundo revestido por epitelio sulcular. Entre los tejidos en contacto con el implante, el epitelio de unión se asemeja más al de un diente natural, formando una unión biológica a través de la lámina basal y hemidesmosomas. Sin embargo, existen diferencias en cómo los tejidos conectivos interactúan con los implantes debido a la ausencia de cemento radicular. Mientras que las fibras dentogingivales en dientes naturales se adhieren perpendicular u oblicuamente al cemento mineralizado, su adhesión directa a los implantes sigue siendo objeto de debate. La mayoría de las fibras de tejido conectivo corren paralelas a la superficie del implante, ya sea en dirección coronal-apical o circunferencialmente. Algunos estudios sugieren la presencia de fibras orientadas perpendicular u oblicuamente a la superficie del implante, particularmente en superficies transmucosas microtexturizadas en lugar de lisas.
El objetivo de este ensayo clínico fue evaluar preliminarmente, en humanos, la medida del ancho biológico y la orientación de las fibras de colágeno alrededor de bases hemisféricas sin tornillo, de tipo Morse, a las 8 y 16 semanas después de la exposición del implante. El siguiente manuscrito ha sido redactado de acuerdo con las directrices STROBE para la presentación de ensayos clínicos observacionales.
Materiales y Métodos
Este estudio fue diseñado como un ensayo clínico observacional, de casos y controles, y tenía como objetivo evaluar la altura y el perfil del ancho biológico, así como la orientación de las fibras de colágeno alrededor de conexiones implante-abutment sin tornillo, de tipo Morse, entre los participantes a las 8 y 16 semanas después de la exposición del implante. Este estudio se llevó a cabo de acuerdo con los principios establecidos en la Declaración de Helsinki para la Investigación Biomédica que Involucra Sujetos Humanos, enmendada en 2018. El protocolo de investigación recibió aprobación ética de la Universidad de Bucarest en Rumanía (número de protocolo 15/2024, 16 de diciembre de 2024) y fue registrado en una base de datos en línea de estudios de investigación clínica (número de registro: NCT06862505; 5 de marzo de 2025). Cualquier paciente de 18 años o más, afectado por edentulismo parcial de elementos posteriores (premolares y molares), que necesitara al menos dos rehabilitaciones con implantes individuales sin necesidad de aumento de tejidos blandos y/o duros, y que pudiera entender y firmar un formulario de consentimiento informado, fue considerado elegible para este estudio. Se excluyó a los pacientes si se presentaba alguno de los siguientes criterios de exclusión: contraindicaciones sistémicas o locales para la colocación de implantes; enfermedad periodontal no tratada; tabaquismo; osteoporosis; diabetes no controlada; rechazo a la rehabilitación con implantes; rechazo a la recolección de biopsias; y patologías sistémicas que pudieran comprometer la cicatrización de los tejidos peri-implantarios. Todos los pacientes seleccionados fueron informados sobre todos los procedimientos quirúrgicos y protésicos, incluidos los beneficios y los riesgos y complicaciones potenciales de esta investigación, y se obtuvo el consentimiento informado por escrito antes de la inscripción final.
2.1. Protocolo Prequirúrgico y Quirúrgico
Los pacientes fueron inicialmente sometidos a investigaciones clínicas e instrumentales para determinar su estado de salud general y elegibilidad. Las pruebas instrumentales requeridas por el departamento como parte del protocolo normal fueron las siguientes: análisis de sangre, ECG y examen cardiológico, y Tomografía Computarizada de Haz Cónico del arco dental. Aproximadamente 10 días antes de la colocación del implante, todos los pacientes se sometieron a sesiones de higiene oral profesional. Todos los pacientes recibieron terapia antibiótica profiláctica: 2 g de amoxicilina 1 h antes de la intervención o clindamicina 600 mg 1 h antes de la colocación del implante si eran alérgicos a la penicilina. Todos los pacientes enjuagaron con enjuague bucal de clorhexidina al 0.2% durante 1 min antes de cualquier procedimiento quirúrgico. Se administró anestesia local (Septanest con adrenalina, 1/100,000, Septodont, Mataró, España) con una técnica infiltrativa. Se realizó la incisión y elevación de un colgajo mucoperióstico trapezoidal en el sitio del implante elegido. Una vez expuesto el hueso, se realizó la osteotomía con una guía piloto de 2.0 mm de diámetro, a 1100 rpm, con irrigación fría externa. La osteotomía inicial se amplió de acuerdo con las instrucciones del fabricante. Se insertaron implantes dentales cortos (sistema Bicon, Boston, MA, EE. UU.) para reemplazos de dientes individuales y múltiples a 2 a 3 mm por debajo del nivel de la cresta ósea marginal, y se utilizaron tapones de cicatrización. El colgajo fue reposicionado y suturado pasivamente para permitir la cicatrización por intención primaria. Se utilizó un protocolo quirúrgico en dos etapas. Tres meses después de la colocación del implante, se realizó anestesia local (Septanest con adrenalina, 1/100,000, Septodont, Mataró, España) con una técnica infiltrativa con un vasoconstrictor. Todos los implantes fueron descubiertos haciendo incisiones lineales mínimamente invasivas en la cresta y eliminando todos los tejidos de crecimiento por encima. Una vez retirado el tapón de cicatrización, se tomó una impresión de ajuste.
Después de eso, se insertó un pilar de cicatrización de policarbonato de 4 (premolares) o 5 (molares) mm de diámetro y se fijó a los implantes. Los pacientes fueron aleatorizados en grupos que recibieron sus restauraciones definitivas 8 (control) o 16 (prueba) semanas después de la conexión del pilar de cicatrización con el fin de evaluar la cicatrización de los tejidos blandos peri-implantarios en diferentes intervalos de tiempo. Se realizó un examen radiográfico intraoral del sitio del implante para todos los pacientes con el fin de evaluar la correcta fijación del pilar de cicatrización inicialmente y su restauración definitiva más tarde. Se utilizó el sistema de alineación Rinn.
2.2. Técnica de Recolección de Biopsia
En ambos grupos, en diferentes intervalos de tiempo, se recolectó una biopsia del tejido blando peri-implantario inmediatamente antes de la entrega de la prótesis definitiva. Se realizó anestesia con una técnica infiltrativa a 10 mm del sitio de la muestra. Se utilizó un mucótomo de 5 (premolares) o 6.5 (molares) mm de diámetro alrededor de los pilares de base hemisférica. Cada muestra incluía los tejidos blandos formados alrededor de los pilares durante el período de cicatrización de 8 o 16 semanas (Figura 1). Las muestras se seccionaron en dos partes idénticas. Las primeras partes de tejido recolectadas se fijaron en formalina tamponada neutra al 10% para examen óptico. Las segundas partes se fijaron en glutaraldehído al 2.5% en PBS 0.1 M pH 7.4 durante al menos 4 días para observación en microscopio electrónico de barrido. Se prescribió tratamiento analgésico postquirúrgico con ibuprofeno 600 mg según fuera necesario. Todos los pacientes fueron estrictamente monitoreados durante los siguientes seis meses para evaluar la cicatrización completa del tejido blando recolectado.
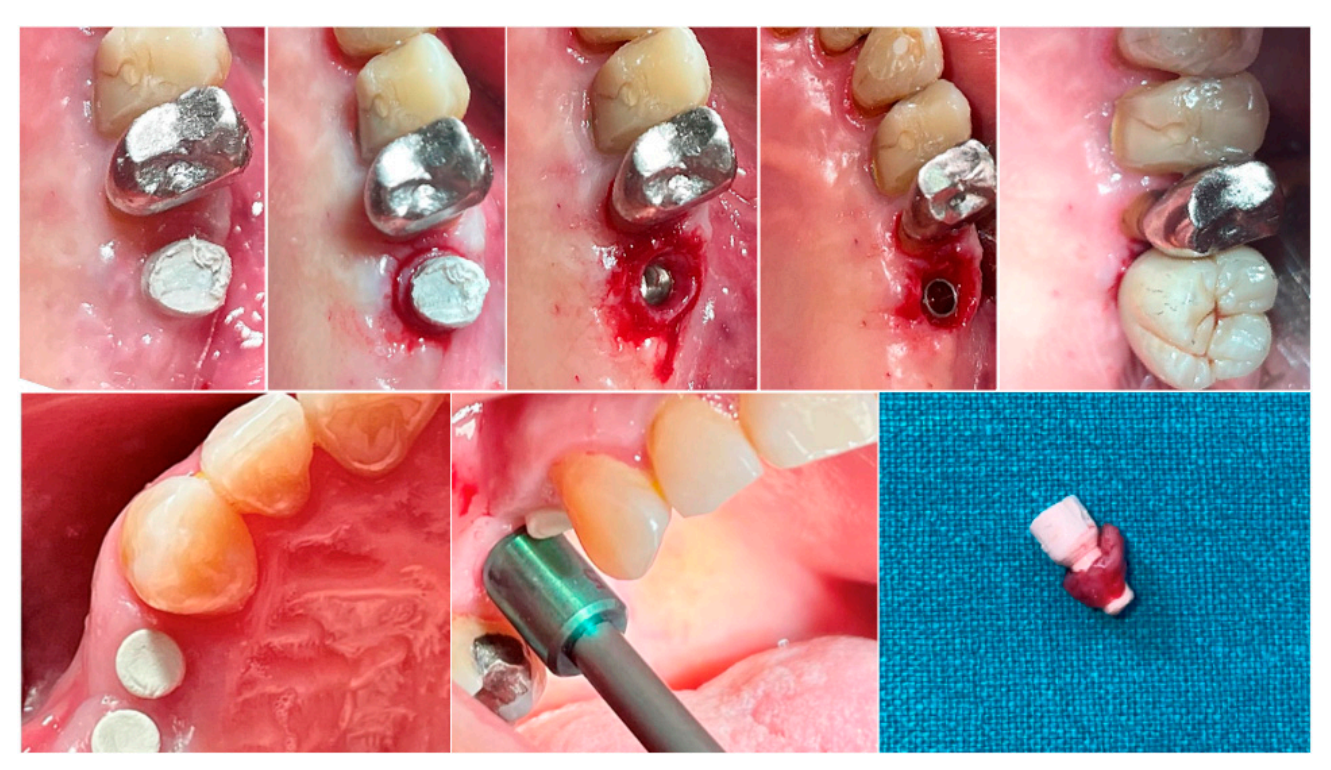
2.3. Medidas de Resultado
El resultado primario fue el fallo del implante, definido como movilidad, infección, fractura y/o cualquier otro problema mecánico o biológico que determinara su extracción. Además, se registraron cualquier complicación biológica (por ejemplo, dolor resistente a medicamentos, hinchazón, MBL excesivo, supuración, etc.) y/o técnica (por ejemplo, fractura del material de recubrimiento y/o estructura, aflojamiento de tornillos, etc.) durante el seguimiento.
Los resultados secundarios fueron el análisis histológico con histomorfometría y análisis con microscopio electrónico de barrido (SEM).
Todas las muestras histológicas fueron analizadas en el Departamento de Ciencias Radiológicas, Oncológicas y Patológicas, “La Sapienza”, Universidad de Roma, Italia. Para el diagnóstico histológico, se definieron dos grupos: aquellos que se sometieron a 8 o 16 semanas de cicatrización después de la exposición del implante. Para el análisis histológico, las muestras recolectadas se dividieron en dos partes para exámenes transversales y longitudinales. Todas las muestras fueron incrustadas en parafina y cortadas con un microtomo para obtener secciones transversales y longitudinales que se utilizarían para los análisis morfológicos. Para cada muestra fijada en formalina, se incrustaron dos partes en cera de parafina, la primera cortada a lo largo del eje longitudinal para ver todos los ejes largos del espécimen, y la segunda a lo largo del eje semicircunferencial para ver el eje corto del espécimen. Las secciones histológicas fueron teñidas con Hematoxilina y Eosina, tricrómico de Masson y Picro Sirius, y observadas con un microscopio óptico Leica (Cámara Leitz, Wetzlar, Alemania).
La organización de las fibras de colágeno se evaluó a través de un examen histológico de las secciones transversales teñidas con Hematoxilina y Eosina, tricrómico de Masson y Picro Sirius (con y sin luz polarizada) y observadas con un microscopio óptico Leica. El ancho biológico se midió como la altura y el perfil de las secciones histológicas longitudinales analizadas con análisis microscópico de luz y teñidas histoquímicamente con Hematoxilina y Eosina y observadas con un microscopio óptico Leica. La organización de las fibras de colágeno también se evaluó con un microscopio electrónico de barrido (ZEISS EVO 40, ZEISS, Oberkochen, Alemania).
Las medidas cuantitativas e histomorfométricas se evaluaron en las secciones longitudinales utilizando el software ImageJ 1.54 (Instituto Nacional de Salud, Bethesda, MD, EE. UU.) a 1.6× magnificación. La estandarización del microscopio se aseguró utilizando el mismo microscopio óptico Leica para los análisis morfológicos, y dos investigadores expertos (R.C., C.D.G.), cegados al tipo de muestra, realizaron las evaluaciones y las medidas histomorfológicas.
Para el análisis por microscopía electrónica de barrido, las muestras fueron sometidas a un post-fijación en solución de tetróxido de osmio al 2% en H2O durante 2 h. Las muestras fueron luego lavadas en H2O dos veces durante 20 min para eliminar la solución de post-fijación. Se realizó una deshidratación en una serie ascendente de soluciones alcohólicas (30–50–70–95–100%). Con el fin de preservar sus detalles ultrastructurales de superficie, las muestras se secaron en un aparato de “secado a punto crítico” Emitech K850 (Emitech Ltd., Ashford, Kent, Inglaterra). Las muestras secas fueron montadas con pegamento de plata sobre soportes de aluminio y luego recubiertas por pulverización con platino (2 min, 15 mA) utilizando un pulverizador Emitech K 550 (Emitech Ltd., Ashford, Kent, Inglaterra). Las muestras fueron observadas en condiciones de alto vacío a 12 kV mediante un microscopio electrónico de barrido Hitachi SU3500 (Hitachi Ltd., Hitachi, Japón).
2.4. Tamaño de la Muestra y Aleatorización
No se realizó un cálculo del tamaño de la muestra debido a que el presente estudio fue considerado un ensayo clínico piloto y observacional. Se creó una lista de aleatorización generada por computadora. Solo uno de los investigadores, no involucrado en la selección y tratamiento de los pacientes, conocía la secuencia de aleatorización. Los códigos aleatorizados se encerraron en sobres opacos, idénticos y sellados, numerados secuencialmente. Los sobres se abrieron secuencialmente inmediatamente después de tomar la impresión; por lo tanto, la asignación del tratamiento se mantuvo oculta para los investigadores durante la inscripción y el tratamiento de los pacientes.
2.5. Análisis Estadístico
Todos los análisis se llevaron a cabo de acuerdo con un plan de análisis preestablecido utilizando el software SPSS para Mac OS X (versión 22.0; SPSS, Chicago, IL, EE. UU.). Un dentista (M.T.) analizó los datos. Se realizó un análisis descriptivo para los parámetros numéricos utilizando medias ± DE. Las diferencias en las composiciones medias de tejido (altura y perfil) a las 8 y 16 semanas se compararon utilizando pruebas t pareadas. El paciente fue la unidad estadística de los análisis. Todas las comparaciones estadísticas se realizaron con un nivel de significancia de 0.05.
Resultados
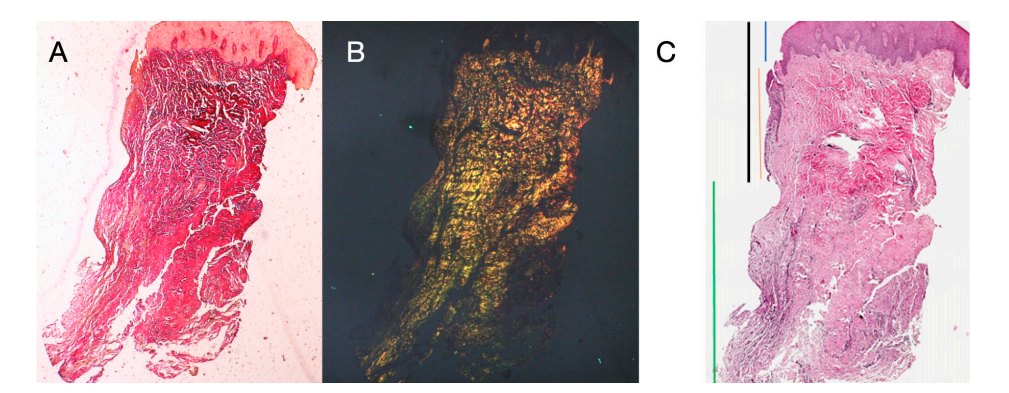
Se seleccionaron ocho pacientes con edades entre 38 y 63 años, cuatro mujeres y cuatro hombres (edad media 51.5 ± 9 años). Cada paciente recibió dos biopsias en dos sitios diferentes según la aleatorización. Tanto a las 8 como a las 16 semanas después de la exposición del implante, el examen clínico mostró tejidos peri-implantarios sanos. Ningún paciente abandonó el estudio. No hubo fallos en los implantes durante la oseointegración y no se experimentaron complicaciones biológicas o técnicas hasta seis meses después de la entrega de la prótesis. En el análisis microscópico de luz, los tejidos mostraron una ausencia total de inflamación y una mayor organización de las fibras de colágeno dispuestas circunferencialmente alrededor del pilar. La cantidad de tejido incluida en las muestras permitió la preparación de varias secciones con diferentes coloraciones tanto para microscopía de luz como para microscopía electrónica de barrido. El examen histológico de las secciones transversales tomadas 8 semanas después de la exposición del implante mostró la casi completa ausencia de revestimiento epitelial en el sitio del implante, que estaba compuesto de tejido conectivo laxo con pequeños vasos recién formados en presencia de extravasaciones hemorrágicas focales e infiltrado inflamatorio linfocítico. El tejido conectivo adyacente apareció más denso, con una abundante infiltración inflamatoria compuesta por linfocitos y células plasmáticas predominantemente dispuestas alrededor de pequeñas estructuras vasculares. Además, los haces de tejido conectivo en la porción superficial mostraron un patrón circular. Durante el examen con tricrómico de Masson y Picro Sirius, este último, observado bajo un microscopio óptico con luz polarizada, demostró la presencia casi exclusiva de colágeno tipo I (Figura 2).
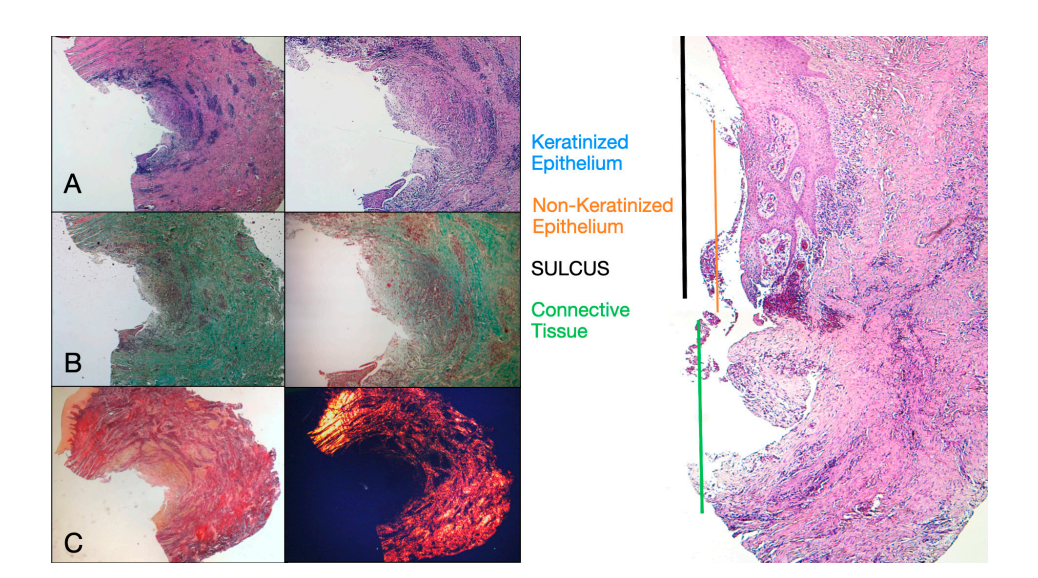
El tejido analizado en las secciones longitudinales mostró cómo el área del surco se divide en dos partes, caracterizadas por un área que comienza en el margen gingival revestida por epitelio malpighiano queratinizante y un área revestida por epitelio con queratinización menos evidente. Este último es continuo con un área de-epitelializada que consiste exclusivamente en tejido conectivo laxo con vasos recién formados. En el contexto del tejido conectivo, hay un infiltrado inflamatorio de linfocitos y células plasmáticas en las áreas subepiteliales y perivasculares (Figura 1). La tinción de Picro Sirius de la sección longitudinal tomada 8 semanas después de la exposición del implante muestra la presencia de algunos haces de colágeno, originados de la porción de tejido conectivo adyacente al hueso, que corren verticalmente hacia el margen libre de la encía, junto con una sustancial desorganización de las otras fibras de colágeno (Figura 3).
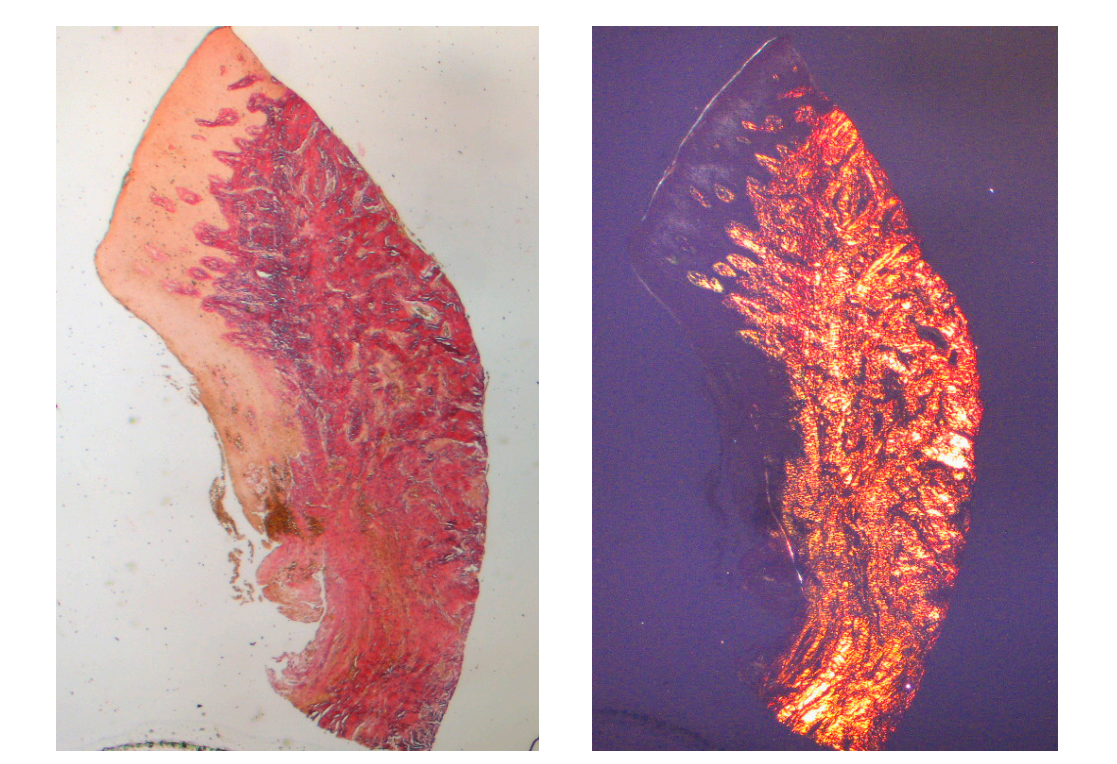
El examen histoquímico de la sección transversal del tejido tomado 16 semanas después de la exposición del implante muestra la presencia parcial de un revestimiento epitelial no queratinizado en el sitio del implante, que está compuesto de tejido conectivo laxo maduro libre de infiltrado inflamatorio. El tejido conectivo más externo está más organizado que en la muestra anterior. Los haces de colágeno mostraron una mayor organización con un curso circunferencial alrededor del pilar. La tinción con tricrómico de Masson y Picro Sirius, este último también observado con luz polarizada, demostró la presencia casi exclusiva de colágeno tipo I. Las imágenes obtenidas con estas tinciones muestran más claramente la organización y orientación de las fibras circulares. La tinción de la sección longitudinal con Picro Sirius muestra, a pesar de los artefactos, la organización vertical de las fibras de colágeno en la porción inferior de la pieza (Figura 4).
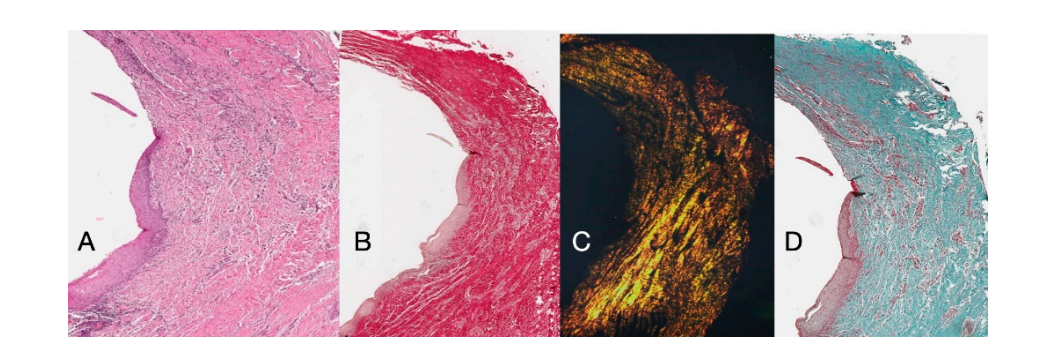
Las secciones longitudinales histoquímicas tomadas 16 semanas después de la exposición del implante mostraron áreas del surco divididas en un área que comienza desde el margen gingival revestida con epitelio malpighiano queratinizante y un área revestida con epitelio no queratinizado. Este último es continuo con un área de-epitelializada que consiste exclusivamente en tejido conectivo. Se demostró que el tejido conectivo estaba compuesto de colágeno tipo I y libre de infiltrado inflamatorio (Figura 5).
Finalmente, el análisis histológico no mostró diferencias estadísticamente significativas entre la composición de los tejidos blandos en ambos intervalos de tiempo tanto para la altura como para el perfil. Los anchos biológicos medios medidos a las 8 y 16 semanas fueron de 3.2 y 3.1 mm, en altura, y 5.5 en perfil en ambos seguimientos (Tabla 1).
La observación con microscopio electrónico de baja magnificación (Figura 6A) de las muestras muestra que la mucosa peri-implantaria está libre de inflamación, edema o extravasación de sangre. Alrededor del pilar de cicatrización, se observa la presencia de tejido conectivo maduro, rico en fibras de colágeno organizadas de manera ordenada. A mayores aumentos (Figura 6B,C) se pueden ver fibras de colágeno onduladas, organizadas de manera ordenada y paralela; tienen una organización predominantemente circular alrededor del pilar.
Para analizar esta matriz densa con más detalle, se capturaron imágenes a 300× y 500× de aumento con un microscopio electrónico de barrido. A estos aumentos, se pueden observar fácilmente fibras de colágeno finas que surgen de la membrana basal (Figura 6D,E) y que se proyectan como fibras individuales no organizadas en haces.

Discusión
Hoy en día, los implantes dentales son un procedimiento común y extremadamente efectivo para restaurar dientes perdidos. La investigación sobre los factores que mantienen los tejidos peri-implantarios en un estado saludable y estable a largo plazo ha sido el enfoque principal de la investigación sobre implantes. Para reducir la pérdida ósea marginal y mantener los niveles de tejido blando peri-implantario, se han establecido diferentes enfoques, incluidos diseños de micro y macro implantes, procedimientos quirúrgicos y prostodónticos, cambio de plataforma y conexiones implante-abutment.
La función principal de los tejidos periodontales, además de unir el diente a la mandíbula, es la protección gingival; es decir, su función es proporcionar un sello contra el ambiente contaminado de la cavidad oral, resistir las fuerzas de fricción de la masticación y defender la interfaz entre los dientes y el tejido blando contra invasores extraños. El ancho biológico alrededor del implante es diferente al de los dientes naturales en muchos aspectos, incluidos concepto, formación, remodelación, tamaño y estructura, y tiene un papel importante en la remodelación de los tejidos blandos y duros peri-implantarios. En el presente estudio, se realizaron cosechas de tejido blando peri-implantario a las 8 y 16 semanas después de la exposición del implante y la colocación de un abutment de curación hemisférico de policarbonato. Se eligieron ocho semanas de curación como la condición de control. La presencia de una barrera natural de tejido conectivo y epitelio a las 8 semanas está de acuerdo con varios estudios que realizaron experimentos en animales. Sin embargo, las cosechas tomadas a las 8 semanas mostraron una remodelación modesta, con infiltrado linfocítico y de células plasmáticas perivascular y los tejidos peri-implantarios presentando características morfoestructurales superpuestas a tejidos sanos. Las muestras a las 16 semanas mostraron una ausencia total de inflamación y una mayor organización de las fibras de colágeno dispuestas de manera circunferencial al abutment. Además, en las secciones histológicas longitudinales había un patrón morfoestructural donde el área del surco se dividía en dos partes, con un área que comenzaba desde el margen gingival revestida por epitelio malpighiano queratinizante y un área revestida por epitelio con queratinización menos obvia (JE). La disposición principal de las fibras era paralela en los cortes longitudinales (Figura 4), con respecto al eje del implante, y circular en las secciones transversales (Figura 3). A mayores aumentos, 300× y 500× (Figura 6B,C) se podían observar fibras de colágeno onduladas dispuestas de manera ordenada y paralela. Estas fibras exhibieron principalmente una organización circular alrededor del abutment. Fibras de colágeno finas que surgían de la membrana basal y se proyectaban como fibras individuales no organizadas en haces podían ser fácilmente observadas en las imágenes SEM a 3000× y 5000× (Figura 6D,E).
El presente estudio mostró que un diseño de pilar hemisférico facilita la formación de un manguito de tejido conectivo estructurado con fibras altamente alineadas, en comparación con la distribución aleatoria observada en pilares de paredes paralelas. Esto sugiere que la organización de la MEC puede ser influenciada por la geometría del tejido a macroescala, guiando la disposición de las fibras y la morfogénesis. Estudios similares han descrito este efecto en implantes de cambio de plataforma, donde la orientación del colágeno proporciona retención mecánica para las fibras periodontales. Modelos animales también han reportado redes de fibras de colágeno circulares supracrestales comparables a los ligamentos gingivales.
Un estudio preclínico reciente demostró que un diseño transmucosal cóncavo podría promover una mayor deposición y crecimiento de tejido conectivo en comparación con un diseño recto. Los hallazgos indicaron un aumento en el grosor del tejido conectivo, una red peri-implantaria más densa y alineación de las fibras de colágeno hacia el collar del pilar, formando una amplia estructura circular de colágeno alrededor de la plataforma del implante. El presente estudio apoya estas observaciones, ya que la introducción de un perfil hemisférico facilitó la disposición de las fibras de colágeno en haces paralelos bien organizados.
La orientación de las fibras de colágeno es un factor biomecánico clave, que refleja las fuerzas que actúan sobre el tejido conectivo, particularmente a través de los haces de colágeno. La investigación ha demostrado que una acumulación excesiva de colágeno orientado al azar puede llevar a la formación de tejido fibroso disfuncional. La organización direccional de las fibras de colágeno es crucial para la estabilidad del tejido blando peri-implantario, como lo señalaron Karjalainen et al.
En el presente estudio, los anchos biológicos medios fueron de 3.2 y 3.1 mm a las 8 y 16 semanas, respectivamente. Al comparar los resultados presentes con otros estudios similares, en un estudio de Tommasi et al., a las 8 semanas después de la exposición, el valor promedio fue de 2.7 mm, incluyendo 1.5 mm de epitelio y 1.2 mm de tejido conectivo, mientras que la dimensión del perfil fue de 3.6 mm. En el presente estudio, los anchos biológicos medios fueron un poco más altos tanto en epitelio como en tejido conectivo. Sin embargo, se encontró un gran aumento en el perfil general. La principal diferencia es que, en el estudio de Tommasi, el segundo seguimiento fue a las 12 semanas en lugar de a las 16 semanas. Una posible explicación para esta diferencia es que los tejidos continúan creciendo durante al menos 4 meses después de la reapertura.
A través de SEM también es posible encontrar fibras de colágeno onduladas organizadas de manera ordenada y paralela, con una organización predominantemente circular alrededor del pilar.
En relación a esto, se puede suponer que las organizaciones predominantes de las bandas de colágeno circulares y las bandas de colágeno verticales estaban organizadas en relación al diseño del pilar. Desde este punto de vista, la posibilidad de utilizar implantes o sistemas de implante–corona que favorezcan la estabilidad del sellado mucoso representa un área importante de investigación. Esta solución desplaza el sellado conectivo apicalmente en relación a los componentes protésicos, cuyos micro-movimientos—que a menudo impiden la formación estable de tejido conectivo—sin comprometer la estabilización final del sellado. La principal limitación de la presente investigación fue el pequeño tamaño de la muestra, debido a que no se realizó un cálculo del tamaño de la muestra. Se necesitan más ensayos clínicos con muestras más grandes para confirmar estos resultados preliminares.
Conclusiones
Histológicamente, no hubo diferencias en la altura y el perfil de la encía entre 8 y 16 semanas de curación después de la exposición del implante. A las 16 semanas, se encontró más tejido en ambos grupos. Se observó una mayor organización de las fibras de colágeno en cursos circunferenciales alrededor de los pilares en el grupo de prueba (16 semanas) en comparación con el grupo de control (8 semanas).
Fabrizio Zaccheo, Giulia Petroni, Marco Tallarico, Cherana Gioga, Raffaella Carletti, Cira Rosaria Tiziana Di Gioia, Vincenzo Petrozza, Silvio Mario Meloni, Dario Melodia, Milena Pisano y Andrea Cicconetti
Referencias:
- Tallarico, M.; Lumbau, A.M.I.; Meloni, S.M.; Ieria, I.; Park, C.-J.; Zadroz˙ny, L.; Xhanari, E.; Pisano, M. Estudio prospectivo de cinco años sobre el fracaso de implantes y remodelación ósea marginal esperada utilizando implantes de nivel óseo con superficie arenada/ácido grabada y conexión cónica. Eur. J. Dent. 2022, 16, 787–795. [CrossRef]
- Zheng, Z.; Ao, X.; Xie, P.; Jiang, F.; Chen, W. El ancho biológico alrededor del implante. J. Prosthodont. Res. 2021, 65, 11–18. [CrossRef]
- Berglundh, T.; Lindhe, J. Dimensión de la mucosa periimplantaria. Análisis del ancho biológico. J. Clin. Periodontol. 1996, 23, 971–973. [CrossRef]
- Schierano, G.; Ramieri, G.; Cortese, M.; Aimetti, M.; Preti, G. Organización de la barrera de tejido conectivo alrededor de los pilares de implantes cargados a largo plazo en humanos. Clin. Oral Implant. Res. 2002, 13, 460–464. [CrossRef]
- Rodríguez, X.; Navajas, A.; Vela, X.; Fortuño, A.; Jimenez, J.; Nevins, M. Disposición de las fibras de tejido conectivo periimplantario alrededor de implantes con cambio de plataforma y pilares cónicos y su relación con el hueso subyacente: Un estudio histológico humano. Int. J. Periodontics Restor. Dent. 2016, 36, 533–540. [CrossRef]
- van Eekeren, P.; van Elsas, P.; Tahmaseb, A.; Wismeijer, D. La influencia del grosor mucoso inicial en el cambio del hueso crestal en implantes de geometría macro similar: Un ensayo clínico aleatorizado prospectivo. Clin. Oral Implant. Res. 2017, 28, 214–218. [CrossRef]
- Mishra, S.K.; Chowdhary, R.; Kumari, S. Microfiltración en la interfaz de diferentes pilares de implante: Una revisión sistemática. J. Clin. Diagn. Res. 2017, 11, ZE10–ZE15. [CrossRef]
- Tallarico, M.; Canullo, L.; Caneva, M.; Özcan, M. Colonización microbiana en la interfaz implante-pilar y su posible influencia en la periimplantitis: Una revisión sistemática y metaanálisis. J. Prosthodont. Res. 2017, 61, 233–241. [CrossRef]
- Schroeder, H.E.; Listgarten, M.A. Los tejidos gingivales: La arquitectura de la protección periodontal. Periodontology 2000 1997, 13, 91–120. [CrossRef]
- Schupbach, P.; Glauser, R. La arquitectura de defensa de la mucosa periimplantaria humana: Un estudio histológico. J. Prosthet. Dent. 2007, 97 (Suppl. S6), S15–S25, Erratum en J. Prosthet. Dent. 2008, 99, 167. [CrossRef]
- James, R.A.; Schultz, R.L. Hemidesmosomas y la adhesión de las células epiteliales de unión a implantes metálicos—Un informe preliminar. J. Oral Implantol. 1974, 4, 294–302.
- Atsuta, I.; Ayukawa, Y.; Kondo, R.; Oshiro, W.; Matsuura, Y.; Furuhashi, A.; Tsukiyama, Y.; Koyano, K. Sellado de tejidos blandos alrededor de implantes dentales basado en la interpretación histológica. J. Prosthodont. Res. 2016, 60, 3–11. [CrossRef]
- Berglundh, T.; Abrahamsson, I.; Welander, M.; Lang, N.P.; Lindhe, J. Morfogénesis de la mucosa periimplantaria: Un estudio experimental en perros. Clin. Oral Implant. Res. 2007, 18, 1–8. [CrossRef] [PubMed]
- Moraschini, V.; Poubel, L.d.C.; Ferreira, V.; Barboza, E.d.S. Evaluación de las tasas de supervivencia y éxito de implantes dentales reportadas en estudios longitudinales con un período de seguimiento de al menos 10 años: Una revisión sistemática. Int. J. Oral Maxillofac. Surg. 2015, 44, 377–388. [CrossRef]
- Atieh, M.A.; Ibrahlm, H.M.; Atieh, H.A. Cambio de plataforma para la preservación del hueso marginal alrededor de implantes dentales: Una revisión sistemática y metaanálisis. J. Periodontol. 2010, 81, 1350–1366.
- Bateli, M.; Att, W.; Strub, J.R. Configuraciones del cuello del implante para la preservación del nivel óseo marginal: Una revisión sistemática. Int. J. Oral Maxillofac. Implant. 2011, 26, 290–303.
- Schwarz, F.; Hegewald, A.; Becker, J. Impacto de la conexión implante-pilar y la posición del collar/microgap mecanizado en los cambios del nivel óseo crestal: Una revisión sistemática. Clin. Oral Implant. Res. 2014, 25, 417–425. [CrossRef]
- Tetè, S.; Mastrangelo, F.; Bianchi, A.; Zizzari, V.; Scarano, A. Orientación de las fibras de colágeno alrededor de cuellos de implantes dentales de titanio y zirconia mecanizados: Un estudio animal. Int. J. Oral Maxillofac. Implant. 2009, 24, 52–58.
- Schwarz, F.; Herten, M.; Sager, M.; Bieling, K.; Sculean, A.; Becker, J. Comparación de defectos óseos periimplantarios de aparición natural y inducidos por ligadura en humanos y perros. Clin. Oral Implant. Res. 2007, 18, 161–170, Erratum en Clin. Oral Implant. Res. 2007, 18, 397. [CrossRef] [PubMed]
- Vignoletti, F.; Johansson, C.; Albrektsson, T.; De Sanctis, M.; Roman, F.S.; Sanz, M. Curación temprana de implantes colocados en alvéolos de extracción frescos: Un estudio experimental en el perro beagle. Formación de nuevo hueso. J. Clin. Periodontol. 2009, 36, 265–277. [CrossRef] [PubMed]
- Liu, Y.; Wang, J. Influencias del microgap y micromovimiento de la interfaz implante-pilar en la pérdida ósea marginal alrededor del cuello del implante. Arch. Oral Biol. 2017, 83, 153–160. [CrossRef] [PubMed]
- Rodríguez, X.; Vela, X.; Calvo-Guirado, J.L.; Nart, J.; Stappert, C.F.J. Efecto del cambio de plataforma en la orientación de las fibras de colágeno y la resorción ósea alrededor de implantes dentales: Un estudio histológico animal preliminar. Int. J. Oral Maxillofac. Implant. 2012, 27, 1116–1122.
- Nelson, C.M. Control geométrico de la morfogénesis tisular. Biochim. Biophys. Acta BBA Mol. Cell Res. 2009, 1793, 903–910. [CrossRef] [PubMed]
- López-López, P.J.; Mareque-Bueno, J.; Boquete-Castro, A.; Aguilar-Salvatierra Raya, A.; Martínez-González, J.M.; Calvo-Guirado, J.L. Los efectos de los pilares de cicatrización de diferente tamaño y forma anatómica colocados inmediatamente en alvéolos de extracción sobre los tejidos duros y blandos periimplantarios. Un estudio piloto en perros foxhound. Clin. Oral Implant. Res. 2016, 27, 90–96. [CrossRef]
- Covani, U.; Giammarinaro, E.; Di Pietro, N.; Boncompagni, S.; Rastelli, G.; Romasco, T.; Velasco-Ortega, E.; Jimenez-Guerra, A.; Iezzi, G.; Piattelli, A.; et al. Análisis de microscopía electrónica (EM) de fibras de colágeno en los tejidos blandos periimplantarios alrededor de dos pilares diferentes. J. Funct. Biomater. 2023, 14, 445. [CrossRef]
- Belloni, A.; Belloni, A.; Furlani, M.; Furlani, M.; Greco, S.; Greco, S.; Notarstefano, V.; Notarstefano, V.; Pro, C.; Pro, C.; et al. Leiomioma uterino como modelo útil para desvelar el estado morfométrico y macromolecular del colágeno y su deterioro en enfermedades fibróticas: Un estudio ex-vivo en humanos. Biochim. Biophys. Acta BBA Mol. Basis Dis. 2022, 1868, 166494. [CrossRef]
- Karjalainen, V.-P.; Kestilä, I.; Finnilä, M.; Folkesson, E.; Turkiewicz, A.; Önnerfjord, P.; Hughes, V.; Tjörnstrand, J.; Englund, M.; Saarakkala, S. Análisis cuantitativo tridimensional de la orientación del colágeno del cuerno posterior del menisco humano en salud y osteoartritis utilizando microtomografía computarizada. Osteoarthr. Cartil. 2021, 29, 762–772. [CrossRef]
- Tomasi, C.; Tessarolo, F.; Caola, I.; Wennström, J.; Nollo, G.; Berglundh, T. Morfogénesis de la mucosa periimplantaria revisitada: Un estudio experimental en humanos. Clin. Oral Implant. Res. 2014, 25, 997–1003. [CrossRef]