El uso del tratamiento de superficie por plasma al vacío para mejorar la hidrofobicidad y la humectabilidad de los sustitutos de injertos óseos y membranas reabsorbibles: un estudio in vitro
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Antecedentes/Objetivos: Deseábamos evaluar in vitro si el tratamiento de superficie con plasma al vacío de sustitutos de injertos óseos y membranas reabsorbibles podría mejorar la hidrofobicidad y la humectabilidad de los materiales probados.
Métodos: Se consideraron un total de 28 muestras esterilizadas para esta investigación y se dividieron en tres grupos. Seis muestras se utilizaron para el análisis SEM-EDS. Las otras 22 muestras se asignaron aleatoriamente a los grupos de prueba (tratadas con plasma, n = 11) y control (sin tratamiento, n = 11). El tratamiento de superficie con plasma al vacío se realizó en el grupo de prueba antes del análisis SEM-EDS utilizando el ACTILINK reborn con un soporte de material (Plasmapp Co., Ltd., Daejeon, República de Corea). Se utilizaron tintas de Plasmatreat (Plasmatreat, Steinhagen, Alemania) para evaluar las diferencias en la hidrofobicidad entre los grupos de prueba y control. Las medidas de resultado fueron el tiempo de absorción, el grado de humectabilidad y el grado de descontaminación después de diferentes ciclos de tiempo.
Resultados: Después del tratamiento de superficie con plasma al vacío, el tiempo de absorción de las tintas disminuyó estadísticamente en todos los subgrupos (p < 0.05), mientras que el grado de humectabilidad aumentó. Los análisis SEM-EDS mostraron una tasa de reducción de impurezas de carbono aumentada después de hasta tres ciclos de tratamiento de superficie con plasma al vacío. Además, el análisis SEM-EDS no reveló áreas de daño causadas por los múltiples tratamientos.
Conclusiones: Dentro de las limitaciones de este estudio in vitro, el tratamiento de superficie con plasma al vacío aumentó la hidrofobicidad y la humectabilidad de los biomateriales probados. El injerto óseo en partículas y los bloques óseos deben ser tratados utilizando programas de tiempo más largos. Se necesitan más ensayos clínicos aleatorizados bien conducidos con cálculos de tamaño de muestra para confirmar estos resultados preliminares.
Introducción
La implantología oral es reconocida como una metodología clínica segura y predecible capaz de garantizar resultados a largo plazo en el campo de la rehabilitación oral. La oseointegración de los implantes dentales tiene su origen a principios de la década de 1950, cuando el Prof. Per-Ingvar Brånemark, un cirujano ortopédico sueco, realizó originalmente experimentos ortopédicos en las patas de conejos. Actualmente, un implante se considera oseointegrado cuando no hay progresión
movimiento relativo entre el implante y el hueso con el que debería tener contacto directo. En el pasado, uno de los aspectos más importantes para lograr la oseointegración fue la estabilidad primaria durante la colocación del implante. Desde sus orígenes hasta hoy, la literatura se ha centrado en principios orientados puramente a lo biológico. En relación con lo anterior, se han investigado e implementado numerosos métodos de tratamiento de superficie para mejorar las características biológicas de la superficie de los implantes, incluyendo modificaciones en la rugosidad de la superficie del implante y mejoras en la hidrofobicidad dentro del proceso de oseointegración. Según estudios recientes, ambos tratamientos parecen mejorar el mecanismo de oseointegración, con una formación ósea más fuerte y rápida, permitiendo una oseointegración más rápida y resultados exitosos a largo plazo.
Varios estudios han evaluado el tratamiento de superficie de implantes dentales y pilares. La activación de la superficie de un implante de titanio a través de tratamiento con plasma podría representar una estrategia positiva para eliminar contaminantes de los pilares dentales y minimizar la resorción ósea peri-implantaria, así como aumentar los porcentajes de nuevo hueso en estrecho contacto con la superficie del implante. Este fenómeno se ha demostrado que es mediado in vitro por el aumento de la adsorción de proteínas y la adhesión de osteoblastos en la superficie de titanio. Sin embargo, hasta donde saben los autores y en el momento de escribir, ninguna investigación ha evaluado tratamientos que sean capaces de aumentar la energía superficial de los sustitutos óseos y membranas. En un estudio en animales, Ho Jik Yang et al. evaluaron el efecto del tratamiento de superficie con plasma al vacío en una matriz dérmica acelular humana, destacando el efecto potencial del tratamiento en la mejora de los resultados de la cirugía reconstructiva. El tratamiento de superficie con plasma al vacío también ha demostrado una mejora en la adhesión celular, modificando la humectabilidad de la superficie de la placa de titanio, con una reducción en el ángulo de contacto entre los fluidos biológicos y la superficie del implante que favorece la difusión de células osteoblásticas y no deja residuos después del tratamiento. Se han reportado algunos cambios en las características fisicoquímicas, como la energía libre de superficie, el contenido de hidrocarburos y los grupos hidroxilo funcionales, que podrían influir potencialmente en la respuesta inflamatoria en el tejido peri-implantario. En un ensayo clínico controlado aleatorio, el tratamiento con plasma de argón demostró una reducción en el remodelado óseo peri-implantario, con resultados estadísticamente más fuertes hasta 5 años de seguimiento.
El objetivo principal de este estudio in vitro fue evaluar si el tratamiento de superficie con plasma al vacío de sustitutos de injertos óseos y membranas reabsorbibles, comúnmente utilizados para la preservación de alvéolos y procedimientos de GBR, podría mejorar la energía superficial (hidrofobicidad) y la humectabilidad de los materiales probados. La hipótesis nula era que el tratamiento de superficie con plasma al vacío no tenía efecto en el tiempo de absorción ni en la humectabilidad. Un objetivo secundario fue evaluar, utilizando análisis SEM-EDS, el grado de descontaminación después de diferentes ciclos de tiempo. Este estudio fue reportado de acuerdo con las pautas CRIS (Lista de verificación para la presentación de estudios in vitro).
Materiales y Métodos
2.1 Muestras
Se consideraron un total de 28 muestras esterilizadas en esta investigación in vitro aleatorizada (test y control). No se realizó cálculo del tamaño de la muestra debido a que no hay otros estudios en la literatura científica que hayan comparado biomateriales con y sin tratamiento de superficie con plasma al vacío. Se utilizó el número máximo de muestras de acuerdo con la disponibilidad del departamento. Las muestras incluyeron diferentes biomateriales comúnmente utilizados durante la preservación de alvéolos y/o procedimientos de GBR y se reportan de la siguiente manera:
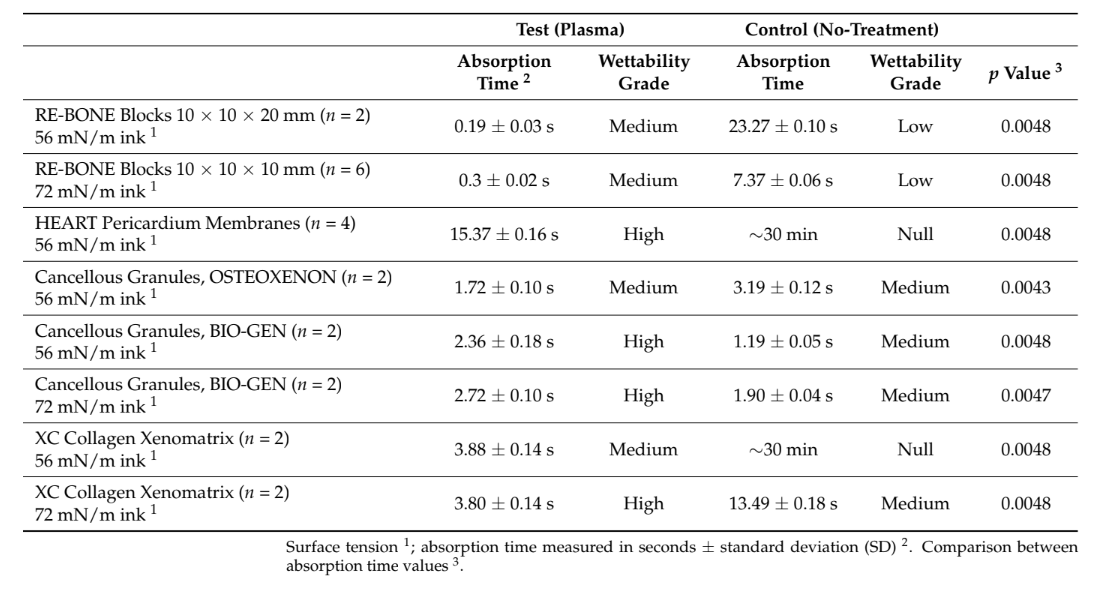
- Catorce bloques de RE-BONE de 10 × 10 × 10 (8) y 10 × 10 × 20 (6) mm (UBGEN SRL, Vigonza, Italia);
- Cuatro membranas de pericardio HEART (Bioteck SPA, Arcugnano, Italia);
- Dos gránulos esponjosos, 0.5 g~1 cc, 0.25–1 mm, OSTEOXENON (Bioteck SPA, Italia);
- Cuatro gránulos esponjosos, 0.5 g, 0.25–1 mm (no colágeno), BIO-GEN (Bioteck SPA, Italia);
- Cuatro Xeno-matrices de colágeno XC (Bioteck SPA).
Un total de 6 de 28 muestras (bloques de RE-BONE [UBGEN SRL, Vigonza, Italia]) se utilizaron para el análisis SEM-EDS. Las otras 22 muestras se dividieron aleatoriamente en dos grupos iguales de 11 muestras (prueba, tratadas con plasma, y control, sin tratamiento) y se probaron para evaluar los tiempos de absorción y los grados de humectabilidad. Todas las mediciones se realizaron en el Departamento de Medicina, Cirugía y Farmacia, Universidad de Sassari, Italia. El análisis SEM-EDS de tres de los bloques de RE-BONE tratados con plasma (UBGEN SRL) se realizó en el Centro de I+D de Plasmapp (Plasmapp Co, República de Corea).
El ACTILINK renacido con un soporte de material (Plasmapp Co., Ltd., Daejeon, República de Corea) se utilizó para tratar las muestras. Se utilizaron tintas de Plasmatreat (Plasmatreat, Steinhagen, Alemania) con diferentes tensiones superficiales. La energía superficial de diferentes biomateriales estériles con (prueba) y sin (control) tratamiento de superficie por plasma al vacío se evaluó midiendo el ángulo de contacto (para evaluar la humectabilidad) y el tiempo de absorción (para evaluar la hidrofobicidad) de las tintas utilizadas.
2.2 Tratamiento de Superficie por Plasma al Vacío
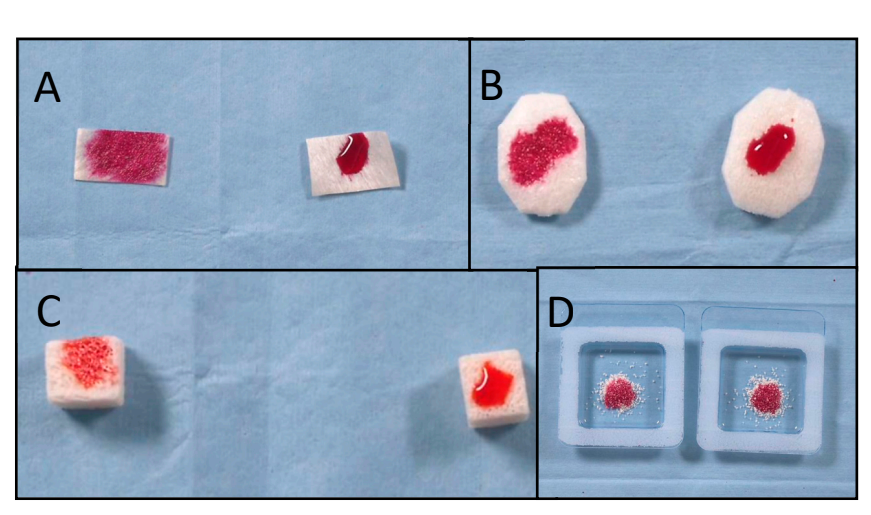
En el grupo de prueba, el tratamiento de superficie por plasma al vacío se realizó utilizando la máquina ACTILINK renacida (Figura 1) con un soporte personalizado (un soporte de vórtice), diseñado para un uso fácil. De acuerdo con el protocolo de los fabricantes, el tiempo de ciclo del tratamiento de superficie por plasma al vacío, denominado modo VORTEX PLASMA, fue de 30 s. Todos los biomateriales en el grupo de prueba pasaron por el mismo tiempo de ciclo de tratamiento de superficie por plasma al vacío. Por el contrario, ninguno de los biomateriales en el grupo de control recibió ningún tipo de tratamiento. En el grupo de prueba, después de abrir la caja estéril, el biomaterial probado se tomó con unas pinzas estériles y se insertó en el soporte de vórtice estéril, y finalmente, se colocó en la máquina ACTILINK para el tratamiento de superficie por plasma al vacío. Una vez finalizado el tratamiento, tanto los biomateriales tratados como los no tratados se insertaron utilizando unas pinzas estériles en el soporte esterilizado, y se dejaron caer cinco gotas de las tintas de Plasmatreat, con dos tensiones superficiales diferentes (56 y 72 mN/m), sobre cada muestra. Inmediatamente después, se registraron, fotografiaron y compararon críticamente el tiempo de absorción y el grado de humectabilidad para evaluar la hidrofobicidad y el ángulo de contacto entre la tinta y la superficie de los biomateriales utilizados. Se utilizaron tensiones superficiales de 56 y 72 mN/m porque el valor de 56 mN/m era el más cercano al de la sangre humana.

2.3 Análisis SEM
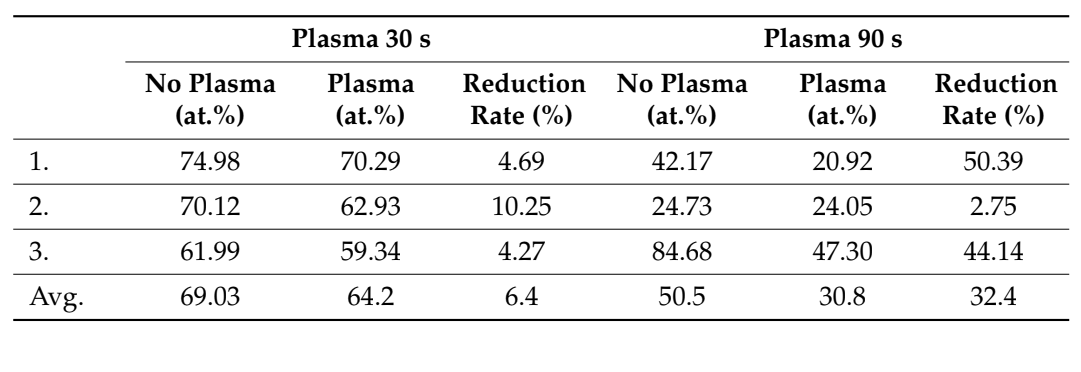
Con el fin de evaluar el efecto del tiempo de tratamiento por plasma al vacío en la descontaminación (reducción de las impurezas de carbono) de la superficie de un bloque óseo, se analizaron tres bloques RE-BONE (UBGEN SRL) utilizando el sistema SEM-EDS después de hasta tres ciclos de tratamiento de superficie por plasma al vacío. Se utilizaron seis bloques RE-BONE de 10 × 10 × 20 mm (UBGEN SRL) para el examen SEM-EDS. Dos bloques RE-BONE (UBGEN SRL) fueron tratados bajo tres ciclos diferentes cada uno ([A] 30 s, [B] 60 s y [C] 90 s) antes del tratamiento de superficie por plasma al vacío. Se utilizó la máquina ACTILINK renacida con el modo VORTEX PLASMA. Después de cada ciclo de tratamiento, los bloques óseos fueron analizados bajo un microscopio electrónico de barrido (SEM, Thermo Fisher Scientific, Phenom XL, Waltham, MA, EE. UU.) conectado a un espectroscopio de rayos X de dispersión de energía (EDS) para permitir un análisis dirigido de las superficies de las muestras.
2.4 Medidas de Resultado
El tiempo de absorción y el grado de humectabilidad se evaluaron a partir de videos grabados durante los procedimientos (Blackmagic Design Pocket Cinema Camera 4K, Blackmagic, Fremont, CA, EE. UU.). Los grupos de prueba y control se evaluaron en comparación al mismo tiempo. Dos investigadores realizaron todas las pruebas (M.T. y M.T).
- El tiempo de absorción se definió como el intervalo, en segundos, desde el momento en que la última gota tocó la superficie del biomaterial hasta el momento en que todas las gotas de tinta habían sido absorbidas por el biomaterial. El video grabado se evaluó utilizando una aplicación de edición de video (iMovie para MacOS), y el tiempo de absorción se midió utilizando la línea de tiempo expandida. Todas las mediciones se repitieron tres veces por dos operadores diferentes (M.T. y M.T.). Se calcularon el valor medio y la desviación estándar (DE).
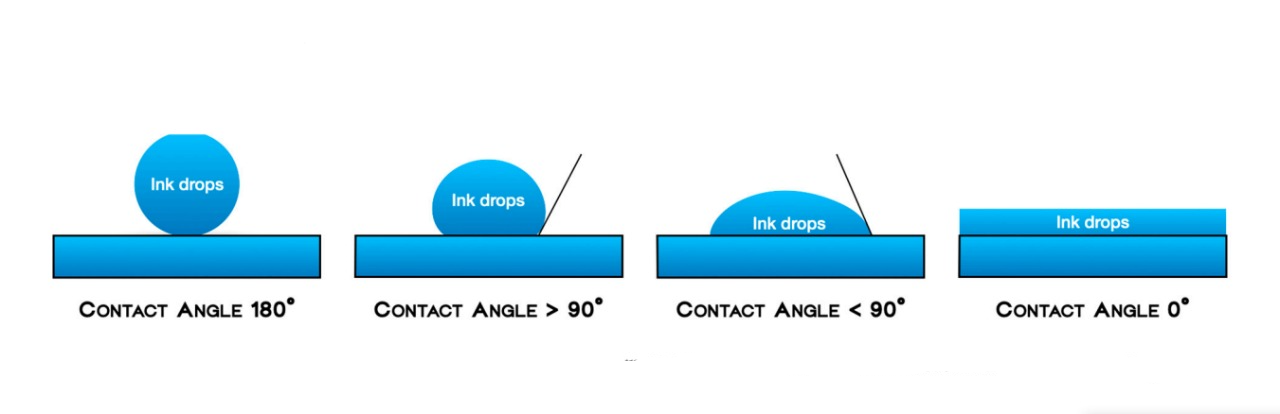
- La humectabilidad (generalmente referida como hidrofobicidad) se definió como la extensión de las gotas de tinta sobre las superficies de los biomateriales, medida por la planitud de una gota en la superficie sólida. Los cuatro grados de humectabilidad se definieron de la siguiente manera:
Grado nulo: Las gotas de tinta permanecieron en la misma posición en la que fueron dejadas con un ángulo de contacto de 180°; Grado bajo: Cuando la mancha de tinta se amplió ligeramente en la superficie, con un ángulo de contacto > 90°; Grado medio: Cuando la expansión moderada de la mancha de tinta en la superficie era apreciable y el ángulo de contacto era <90°; Grado alto: Cuando la mancha de tinta había sido definitivamente absorbida, con un ángulo de contacto de 0° (Figura 2).
- Análisis SEM. Se empleó la microscopía electrónica de barrido para visualizar imágenes de alta resolución de las superficies de las muestras. Usando el SEM, se analizó la topografía de la superficie en las imágenes. En particular, se utilizaron las imágenes del SEM para evaluar la tasa de reducción de impurezas de carbono con tres diferentes tiempos de ciclo. Se utilizó el detector de espectroscopia de rayos X por dispersión de energía (EDS) para medir la energía de los fotones emitidos en el espectro electromagnético de rayos X y obtener información química (el porcentaje atómico).
2.5 Análisis Estadístico
Todo el análisis de datos se llevó a cabo de acuerdo con un plan de análisis preestablecido. Un bioestadístico con experiencia en odontología analizó los datos utilizando el software Ky Plot 2.0, Informer Technologies, Inc. NY, EE. UU., sin conocer los códigos de grupo. Se calcularon los valores medios y las desviaciones estándar para cada medición. Se utilizó una calculadora de prueba de Kolmogorov–Smirnov de dos muestras para comparar el tiempo de absorción entre grupos. Se realizaron comparaciones estadísticas al nivel de significancia de 0.05.
Resultados
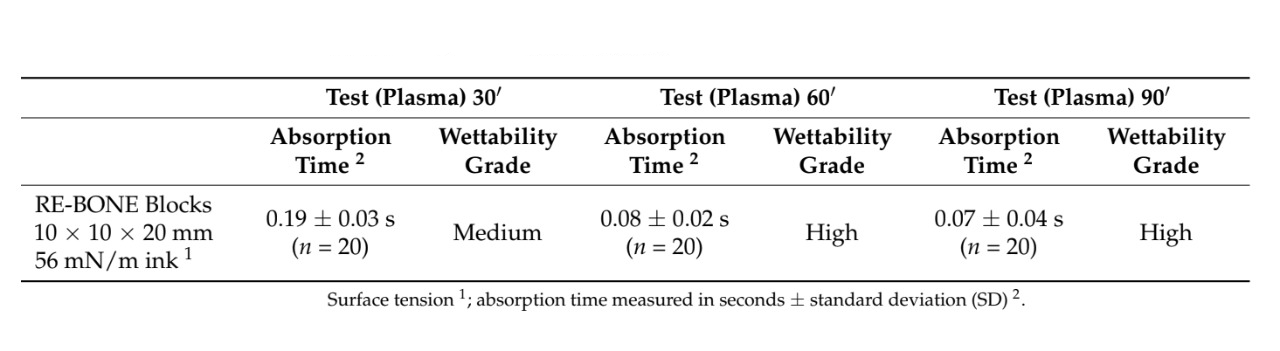
Se utilizaron un total de 28 muestras. Se evaluaron el tiempo de absorción y la humectabilidad de 22 muestras después de que se les aplicaron diversas tintas con diferentes tensiones superficiales en ambos grupos. El tratamiento de superficie con plasma al vacío redujo estadísticamente el tiempo de absorción en todas las muestras tratadas (p valor < 0.05, Tabla 1). Además, para todas las muestras excepto para los gránulos de osteoxenón con tinta de 56 mN/m, la humectabilidad en el grupo de prueba fue de mayor grado en comparación con la del grupo de control. La mayor diferencia en humectabilidad se encontró para la membrana de pericardio, con un alto grado en el grupo de prueba en comparación con un grado nulo en el grupo de control. Los mejores resultados se encontraron para el tratamiento de superficie con plasma al vacío de los bloques óseos, membranas de colágeno, membranas de pericardio y injertos óseos de colágeno, respectivamente. Todos los datos se informan en la Tabla 1. Las imágenes explicativas se informan en Figura 3.
Se evaluaron seis bloques óseos (tres después de tratamientos de superficie con plasma al vacío y tres sin ningún tratamiento) en el análisis SEM-EDS tras uno, dos y tres ciclos de tiempo, respectivamente. La tasa de reducción de impurezas de carbono tendió a aumentar después de tres ciclos de tiempo en comparación con la de uno y dos ciclos de tiempo. Además, el análisis SEM-EDS no mostró daño a los biomateriales después de múltiples (hasta tres veces, 90 s, Figura 4) tratamientos de superficie con plasma al vacío, mientras que la parte superior de la superficie mostró mejor humectabilidad después de tres ciclos de tiempo (Figura 5). Todos estos datos se informan en las Tablas 2 y 3.


Discusión
Este estudio tuvo como objetivo evaluar si el efecto del tratamiento de superficie con plasma al vacío en varios biomateriales utilizados para la preservación de alvéolos y procedimientos de GBR podría mejorar su hidrofobicidad y mojabilidad. La hidrofobicidad se midió a través del tiempo de absorción de tinta y el grado de mojabilidad. El tiempo de absorción de tinta de las muestras tratadas con plasma fue significativamente más corto que el de las muestras no tratadas. Por lo tanto, la hipótesis nula de que no hay diferencia fue parcialmente rechazada. Estas pruebas iniciales in vitro indicaron que el tratamiento de superficie con plasma al vacío tuvo un efecto positivo en los bloques óseos, membranas de pericardio, matrices de colágeno y injertos óseos de colágeno en términos tanto del tiempo de absorción como del grado de mojabilidad. Por el contrario, el tratamiento de superficie con plasma al vacío no logró reducir el tiempo de absorción para injertos óseos no colagenosos. Esto indica que el tratamiento de superficie con plasma al vacío convirtió las superficies de los biomateriales secos de hidrofóbicas a superficies altamente hidrofílicas. Sin embargo, las características superficiales iniciales son importantes para definir los resultados esperados.
Aumentar el tiempo total de tratamiento, hasta tres ciclos de tiempo, mejoró los resultados. Una posible explicación es que las impurezas de carbono tienden a disminuir después de tres ciclos de tiempo. In vivo, el tratamiento de superficie con plasma al vacío de una matriz dérmica acelular humana mostró una mayor infiltración de fibroblastos, lo que indica una mejor biocompatibilidad. En la presente investigación, el tratamiento de superficie con plasma al vacío exhibió algunos efectos positivos en términos de descontaminación de los biomateriales tratados y en términos de activación de las superficies, reduciendo las impurezas y aumentando su hidrofobicidad.
Varios estudios en la literatura han confirmado la efectividad de los tratamientos con plasma en términos de adhesión celular y actividad de fibroblastos. Sin embargo, los temas principales de estos estudios fueron los pilares dentales y las superficies de implantes.
La humectabilidad de la superficie es uno de los parámetros más importantes que afectan la respuesta biológica a un material implantado, afectando la adsorción de proteínas, la adhesión/activación de plaquetas, la coagulación sanguínea y la adhesión de células y bacterias. En la presente investigación, se utilizaron tintas para medir el tiempo de absorción y el grado de humectabilidad de los biomateriales probados. La tensión superficial de la sangre juega un papel importante en el cuerpo humano. Según Hrncír y Rosina, la tensión superficial de la sangre, evaluada en un grupo de 71 sujetos sanos utilizando el método de gota a una temperatura de 22 grados Celsius, fue de 55.89 × 10(−3) N × m(−1), con una SD = 3.57 × 10(−3) N × m(−1). Considerando que los cambios en el comportamiento de la tensión superficial de los fluidos biológicos humanos son característicos en algunas enfermedades, para la presente investigación, se utilizaron tintas con tensiones superficiales de 56 mN/m y 72 mN/m.
Analizando los datos recopilados en la presente investigación, se encontró que en el grupo de control, la tinta con una mayor tensión superficial (72 mN/m) fue absorbida más rápidamente que la tinta con una menor tensión superficial (56 mN/m) tanto por los bloques de hueso como por las Xenomatrices de colágeno, pero no por los injertos óseos no colagenosos. Por el contrario, en el grupo de prueba, la diferencia no fue relevante. Estos resultados pueden significar que después del tratamiento de superficie con plasma al vacío, las variaciones en la tensión superficial podrían ser menos relevantes para el proceso de curación.
Después de hasta tres ciclos de tiempo, la imagen SEM de la topografía de la superficie no reveló cambios bajo los tratamientos de superficie con plasma al vacío, y no se observó daño físico. El aumento en la hidrofobicidad, la reducción en el grado de impureza y la preservación de la estructura original, sin ningún daño físico a los bloques de hueso tratados con plasma, deben considerarse evidencia de la mejorada biocompatibilidad y potencial biointegración de los materiales probados.
El tratamiento de plasma al vacío se utiliza ampliamente en medicina para mejorar la biocompatibilidad y biointegración en cirugías reconstructivas. Los hallazgos de una investigación in vitro similar destacan el potencial del tratamiento de plasma para mejorar el rendimiento de los hADMs en entornos clínicos, ofreciendo una vía prometedora para mejorar los resultados de la cirugía reconstructiva. Además, el tratamiento de plasma al vacío también se utiliza en otros campos, como para aumentar las propiedades eléctricas de las películas de organosilicato o la humectabilidad de los polímeros de polieteretercetona (PEEK).
La principal limitación de la presente investigación es el pequeño número de muestras y, por supuesto, su naturaleza in vitro. Otra limitación es que se debería haber proporcionado el ángulo de contacto de humectabilidad en lugar del nivel de grado de humectabilidad. Incluso si los resultados de la presente investigación son alentadores para el tratamiento de superficie con plasma al vacío, los datos in vitro no nos permiten sacar conclusiones clínicas definitivas. Sin embargo, el análisis de los datos del análisis SEM-EDS reveló que la tasa de impurezas de carbono en las superficies de los bloques óseos tendía a disminuir al aumentar el número de ciclos de tiempo; por lo tanto, se podría sugerir aumentar los ciclos de tiempo hasta tres dependiendo de los sustitutos de injerto óseo utilizados. Además, el tiempo de absorción y el grado de humectabilidad también mejoraron después de dos y tres ciclos de tiempo. En relación con lo anterior, las membranas de pericardio y los injertos óseos, particularmente los injertos óseos no colágenos, podrían ser tratados aumentando el número de ciclos a dos o tres para reducir el grado de impurezas de carbono y aumentar su hidrofobicidad. Sin embargo, se necesitan más ensayos clínicos controlados aleatorios para confirmar estos resultados preliminares. Otra limitación de esta investigación es que, dado que no había muchos estudios similares en la literatura científica, no fue fácil definir un criterio para interpretar los resultados, especialmente en lo que respecta al grado de humectabilidad de los sustitutos de injerto óseo y las membranas reabsorbibles probadas. Los datos de estudios in vitro e in vivo similares han confirmado el efecto positivo del tratamiento de plasma en implantes y pilares al utilizar plasma de argón. En relación con lo anterior, los datos de esta investigación in vitro deben considerarse un informe preliminar para alentar evaluaciones clínicas adicionales.
Conclusiones
El tratamiento de superficie con plasma al vacío aumentó estadísticamente la hidrofobicidad de la mayoría de los biomateriales probados, reduciendo el tiempo de absorción y aumentando el grado de humectabilidad. Además, la tasa de impurezas de carbono podría reducirse al aumentar el tiempo del ciclo. Sin embargo, se necesitan más estudios controlados aleatorios con cálculos de tamaño de muestra para confirmar estos resultados preliminares.
Marco Tallarico, Silvio Mario Meloni, Michele Troia, Carlotta Cacciò, Aurea Inmacolata Lumbau, Ieva Gendviliene, Francesco Mattia Ceruso y Milena Pisano
Referencias
- Busenlechner, D.; Fürhauser, R.; Haas, R.; Watzek, G.; Mailath, G.; Pommer, B. Éxito a largo plazo de implantes en la Academia de Implantología Oral: seguimiento de 8 años y análisis de factores de riesgo. J. Periodontal Implant. Sci. 2014, 44, 102–108. [CrossRef] [PubMed]
- Kim, T.-I. Un homenaje al Dr. Per-Ingvar Brånemark. J. Periodontal Implant. Sci. 2014, 44, 265. [CrossRef] [PubMed]
- Mavrogenis, A.F.; Dimitriou, R.; Parvizi, J.; Babis, G.C. Biología de la oseointegración del implante. J. Musculoskelet. Neuronal Interact. 2009, 9, 61–71. [PubMed]
- Peñarrocha, D.M.; Cavani, U.; Cuadrado, L. Atlas de Carga Inmediata de Implantes Dentales; Springer International Publishing: Berlín/Heidelberg, Alemania, 2019; ISBN 9783030055462, 3030055469.
- Wong, M.; Eulenberger, J.; Schenk, R.; Hunziker, E. Efecto de la topología de la superficie en la oseointegración de materiales de implante en hueso trabecular. J. Biomed. Mater. Res. 1995, 29, 1567–1575. [CrossRef]
- Wennerberg, A.; Albrektsson, T. Sobre las superficies de implantes: una revisión del conocimiento y opiniones actuales. Int. J. Oral Maxillofac. Implant. 2010, 25, 63–74. [PubMed]
- Wennerberg, A.; Albrektsson, T. Efectos de la topografía de la superficie de titanio en la integración ósea: una revisión sistemática. Clin. Oral Implant. Res. 2009, 20, 172–184. [CrossRef]
- Beutner, R.; Michael, J.; Schwenzer, B.; Scharnweber, D. Nano-funcionalización biológica de superficies de biomateriales a base de titanio: una caja de herramientas flexible. J. R. Soc. Interface 2010, 7, S93–S105. [CrossRef]
- Sun, X.D.; Liu, T.T.; Wang, Q.Q.; Zhang, J.; Cao, M.S. Modificación de superficie y funcionalidades para implantes dentales de titanio. ACS Biomater. Sci. Eng. 2023, 9, 4442–4461. [CrossRef] [PubMed]
- Canullo, L.; Tallarico, M.; Peñarrocha, M.; Corrente, G.; Fiorellini, J.; Peñarrocha, D. Tratamiento de limpieza con plasma de argón en pilares de implantes en pacientes periodontalmente sanos: resultados a seis años post-carga de un ensayo controlado aleatorio. Int. J. Periodontics Restor. Dent. 2017, 37, 683–690. [CrossRef]
- Canullo, L.; Tallarico, M.; Botticelli, D.; Alccayhuaman, K.A.A.; Neto, E.C.M.; Xavier, S.P. Cambios en tejidos duros y blandos alrededor de implantes activados mediante plasma de argón: un estudio histomorfométrico en perros. Clin. Oral Implant. Res. 2018, 29, 389–395. [CrossRef]
- Yang, H.J.; Lee, B.; Shin, C.; You, B.; Oh, H.S.; Lee, J.; Lee, J.; Oh, S.K.; Oh, S.H. Mejora en la biocompatibilidad y biointegración de la matriz dérmica acelular humana a través del tratamiento de superficie con plasma al vacío. Bioengineering 2024, 11, 359. [CrossRef] [PubMed]
- Kawai, H.; Shibata, Y.; Miyazaki, T. El pretratamiento de plasma de descarga luminosa mejora la diferenciación y supervivencia de osteoclastos en placas de titanio. Biomaterials 2004, 25, 1805–1811. [CrossRef]
- Shibata, Y.; Hosaka, M.; Kawai, H.; Miyazaki, T. El tratamiento de plasma de descarga luminosa de placas de titanio mejora la adhesión de células similares a osteoblastos a las placas a través del mecanismo mediado por integrinas. Int. J. Oral Maxillofac. Implant. 2002, 17, 771–777. [PubMed]
- Canullo, L.; Genova, T.; Mandracci, P.; Mussano, F.; Abundo, R.; Fiorellini, J.P. Cambios morfométricos inducidos por el tratamiento con plasma de argón frío en osteoblastos cultivados en diferentes superficies de implantes dentales. Int. J. Periodontics Restor. Dent. 2017, 37, 541–548. [CrossRef] [PubMed]
- Noro, A.; Kaneko, M.; Murata, I.; Yoshinari, M. Influencia de la topografía de la superficie y la fisicoquímica de la superficie en la humectabilidad de la zirconia (zirconia tetragonal policristalina). J. Biomed. Mater. Res. Biomater. 2013, 101, 355–363. [CrossRef]
- Canullo, L.; Tallarico, M.; Peñarrocha-Oltra, D.; Monje, A.; Wang, H.; Peñarrocha-Diago, M. Limpieza de pilares de implantes mediante plasma de argón: seguimiento de 5 años de un ensayo controlado aleatorio. J. Periodontol. 2016, 87, 434–442. [CrossRef]
- Krithikadatta, J.; Gopikrishna, V.; Datta, M. Directrices CRIS (Lista de verificación para la presentación de estudios in vitro): una nota conceptual sobre la necesidad de directrices estandarizadas para mejorar la calidad y transparencia en la presentación de estudios in vitro en la investigación dental experimental. J. Conserv. Dent. 2014, 17, 301–304. [CrossRef]
- Canullo, L.; Genova, T.; Chinigò, G.; Iacono, R.; Pesce, P.; Menini, M.; Mussano, F. Dispositivo de tratamiento con plasma al vacío para mejorar la actividad de fibroblastos en superficies de titanio mecanizadas y rugosas. Dent. J. 2024, 12, 71. [CrossRef]
- Jeon, H.J.; Jung, A.; Kim, H.J.; Seo, J.S.; Kim, J.Y.; Yum, M.S.; Gweon, B.; Lim, Y. Adhesión y proliferación de osteoblastos mejoradas en la superficie de implante tratada con plasma al vacío. Appl. Sci. 2022, 12, 9884. [CrossRef]
- Pesce, P.; Menini, M.; Santori, G.; Giovanni, E.D.; Bagnasco, F.; Canullo, L. Activación foto y plasma de superficies de titanio de implantes dentales. Una revisión sistemática con metaanálisis de estudios preclínicos. J. Clin. Med. 2020, 9, 2817. [CrossRef]
- Lee, H.; Jeon, H.J.; Jung, A.; Kim, J.; Kim, J.Y.; Lee, S.H.; Kim, H.; Yeom, M.S.; Choe, W.; Gweon, B.; et al. Mejora de la eficacia de oseointegración del implante de titanio a través del tratamiento de superficie con plasma. Biomed. Eng. Lett. 2022, 12, 421–432. [CrossRef] [PubMed]
- Fathi-Azarbayjani, A.; Jouyban, A. Tensión superficial en la fisiopatología humana y su aplicación como herramienta de diagnóstico médico. Bioimpacts 2015, 5, 29–44. [CrossRef] [PubMed]
- Hrncír, E.; Rosina, J. Tensión superficial de la sangre. Physiol. Res. 1997, 46, 319–321. [PubMed]
- Baklanov, M.R.; Gismatulin, A.A.; Naumov, S.; Perevalov, T.V.; Gritsenko, V.A.; Vishnevskiy, A.S.; Rakhimova, T.V.; Vorotilov, K.A. Revisión integral sobre el impacto de la composición química, el tratamiento con plasma y la irradiación ultravioleta al vacío (VUV) en las propiedades eléctricas de películas de organosilicato. Polímeros 2024, 16, 2230. [CrossRef]
- Primc, G. Estrategias para mejorar la humectabilidad de polímeros de polieteretercetona (PEEK) mediante tratamiento con plasma no equilibrado. Polímeros 2022, 14, 5319. [CrossRef]
