Influencia de la instrumentación de un solo archivo reciprocante y rotatorio en la reducción bacteriana en conductos radiculares infectados
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivo: Comparar la reducción bacteriana lograda con sistemas reciprocantes y rotatorios durante la preparación del conducto radicular.
Metodología: Se contaminaron sesenta conductos radiculares distobucales de molares maxilares con cultivo en caldo de Enterococcus faecalis. Después de un período de incubación de 21 días, se recolectaron muestras bacterianas y se cultivaron en placas de agar m-Enterococcus. Los conductos radiculares se dividieron en cinco grupos, según el sistema utilizado para la instrumentación: WaveOne, Reciproc, ProTaper, Mtwo y instrumentación manual. Los controles negativos consistieron en cinco conductos radiculares no contaminados que fueron sometidos a las mismas instrumentaciones que cada uno de los grupos experimentales. Se recolectaron muestras bacterianas inmediatamente y 7 días después de la instrumentación. Se realizó un análisis estadístico mediante pruebas t pareadas y pruebas ANOVA.
Resultados: En comparación con las muestras antes de la instrumentación, el recuento bacteriano se redujo significativamente después de la instrumentación en todos los grupos, sin diferencia significativa en la reducción del recuento bacteriano entre las técnicas reciprocantes, rotatorias y manuales. Sin embargo, las muestras analizadas 7 días después de la instrumentación mostraron recuentos bacterianos significativamente más altos que las muestras analizadas inmediatamente después de la instrumentación.
Introducción
La presencia de bacterias es la principal causa de infección periodontal y desarrollo de periodontitis apical (Kakehashi et al. 1965). Entre las diversas especies de bacterias encontradas en infecciones endodónticas, Enterococcus faecalis se destaca por su resistencia, supervivencia en entornos pobres en nutrientes y asociación con periodontitis apical persistente (Sedgley et al. 2005, Sakamoto et al. 2007). Aunque los agentes químicos son importantes en la instrumentación del conducto radicular, algunos agentes no son completamente eficaces contra todas las especies bacterianas en biofilms (Pappen et al. 2010). Además, los biofilms maduros son más resistentes a las acciones de los químicos (Shen et al. 2011).
La eliminación mecánica mediante instrumentación es particularmente efectiva para interrumpir el biofilm bacteriano y reducir la presencia de bacterias en el conducto radicular principal (Aydin et al. 2007, Machado et al. 2010, Gorduysus et al. 2011, Matos Neto et al. 2012). Aunque la instrumentación manual es comúnmente utilizada por los profesionales, los sistemas rotatorios automatizados están asociados con varias ventajas en comparación con las técnicas manuales, incluyendo procedimientos más rápidos (Guelzow et al. 2005, Yin et al. 2010), preparaciones más centradas (Taşdemir et al. 2005, Aguiar et al. 2009) y menos extrusión apical de desechos (Madhusudhana et al. 2010). En particular, los sistemas ProTaper (Dentsply Maillefer, Ballaigues, Suiza) y Mtwo (VDW, Múnich, Alemania) han demostrado proporcionar una geometría adecuada (Yang et al. 2011) y una reducción sustancial de bacterias en el conducto radicular (Machado et al. 2010).
Recientemente, se ha propuesto la instrumentación con un archivo único reciprocante. Los sistemas que utilizan este enfoque incluyen WaveOne (Dentsply Maillefer) y Reciproc (VDW), que difieren esencialmente en su sección transversal, pero son similares a ProTaper y Mtwo, respectivamente. Estudios iniciales han mostrado que el uso de Reciproc o Mtwo resulta en canales más limpios en el tercio apical en comparación con el uso de WaveOne o ProTaper (Bürklein et al. 2012). Además, se demostró que el uso de WaveOne reduce la modificación morfológica del canal en comparación con el uso de ProTaper (Berutti et al. 2012). Sin embargo, pocos estudios han evaluado la acción mecánica de estos sistemas en canales infectados.
El objetivo de este estudio fue comparar la reducción bacteriana lograda por sistemas reciprocantes y rotatorios en conductos radiculares contaminados con E. faecalis. Se utilizó la técnica manual como referencia para la comparación. La hipótesis nula probada fue que no hay diferencias en la reducción bacteriana promovida por sistemas reciprocantes y rotatorios.
Material y métodos
Preparación de muestras
La aprobación para este estudio fue obtenida del Comité Ético de la Escuela de Odontología de la Universidad de São Paulo (194/2010). Se estandarizaron sesenta y cinco conductos radiculares distobucales de los molares maxilares a 12 mm e instrumentados a una longitud de trabajo de 11 mm hasta un tamaño de 15 K-file (Dentsply Maillefer) bajo irrigación con agua destilada. Los conductos radiculares se llenaron con 17% de EDTA (Fórmula & Acão, São Paulo, SP, Brasil) durante 3 min para eliminar la capa de lodo y se lavaron con 5 mL de agua destilada. El ápice se cubrió con resina compuesta (3M, Saint Paul, MN, EE. UU.), y la superficie externa de la raíz se selló con resina epóxica (Araldite; Brascola, Joinvile, SC, Brasil). Las muestras se fijaron en placas de microtitulación de poliestireno de 24 pocillos con resina acrílica y se esterilizaron con óxido de etileno (Acecil, Campinas, SP, Brasil).
Contaminación de muestras
Se preparó y estandarizó una suspensión de E. faecalis (ATCC 29212) en caldo de soja triptícico (TSB; Difco, Le Pont-de-Claix, RA, Francia) a 4 en la escala de McFarland. Sesenta conductos radiculares fueron contaminados con la suspensión de E. faecalis mediante una jeringa de insulina. Los cinco conductos radiculares restantes se llenaron con TSB. Las muestras se incubaron a 37 °C durante 21 días. El contenido de los conductos radiculares se reemplazó con TSB fresco cada 48 h.
Después del período de incubación, los conductos radiculares se llenaron con agua destilada. Se recolectaron muestras (S1) con tres puntos de papel esterilizados de tamaño 15 (Dentsply Maillefer), que se insertaron en los conductos radiculares durante 1 min cada uno. Los puntos se almacenaron en tubos que contenían 500 IL de agua peptonada, y se prepararon diluciones seriadas. Diferentes diluciones se sembraron en triplicado en medio de cultivo de agar m-Enterococcus (Difco). Las placas se incubaron a 37 °C durante 48 h, y se midió el recuento bacteriano (en UFC mL—1).
Instrumentación de muestras
Las muestras contaminadas se dividieron en cinco grupos, como se describe a continuación.
- El grupo 1 se preparó con el archivo WaveOne Primary (tamaño de punta 25, 0.08 de conicidad) (Dentsply Maillefer). Con el motor en movimiento reciprocante (Dentsply Maillefer), el archivo se insertó suavemente en el tercio cervical y se retiró. El archivo se insertó en el tercio medio y se retiró. Por último, el archivo se insertó en el tercio apical hasta la longitud de trabajo con un movimiento de cepillado realizado contra las paredes.
- El grupo 2 se preparó con el Reciproc R25 (tamaño de punta 25, 0.08 de conicidad) (VDW) de manera similar al grupo 1.
- El grupo 3 se preparó con el sistema ProTaper (Dentsply Maillefer). El tercio cervical se amplió con brocas Gates-Glidden 1, 2 y 3 (Dentsply Maillefer) y luego con la secuencia de instrumentos SX y S2. Los tercios medio y apical se instrumentaron con S1, S2, F1 y F2 (tamaño de punta 25, 0.08 de conicidad).
- El grupo 4 se preparó con el sistema Mtwo (VDW). El tercio cervical se amplió con brocas Gates-Glidden 1, 2 y 3. Los archivos se introdujeron directamente a la longitud de trabajo con ligeros movimientos de vaivén, mientras que la presión en dirección apical se aumentó gradualmente, y luego se realizó un movimiento de cepillado contra las paredes. La secuencia de los archivos fue tamaño 10, 0.04 de conicidad, tamaño 15, 0.05 de conicidad, tamaño 20, 0.06 de conicidad y tamaño 25, 0.06 de conicidad.
- El grupo 5 (control positivo) se preparó mediante la técnica manual de corona hacia abajo. Los tercios cervical y medio se ampliaron con brocas Gates-Glidden 1, 2 y 3, y luego se insertó un archivo K de tamaño 20 suavemente hasta la longitud de trabajo utilizando movimientos de cuarto de vuelta y limado contra las paredes. Este movimiento se repitió hasta que el instrumento ya no encontró resistencia y el archivo quedó libre. Estas maniobras se repitieron posteriormente con archivos K de tamaño 25, 30 y 35.
Los controles negativos consistieron en cinco especímenes no contaminados que fueron instrumentados de acuerdo con cada grupo.
La irrigación durante la instrumentación se realizó con un total de 10 mL de agua destilada utilizando una jeringa y un NaviTip de calibre 29 (Ultradent Products, South Jordan, UT, EE. UU.), que se introdujo hasta 3 mm antes de la longitud de trabajo mediante un movimiento de entrada y salida para un mejor flujo. En los grupos 1 y 2, la irrigación y exploración con un K-file de tamaño 15 se realizaron cada vez después de retirar el instrumento. En los grupos 3, 4 y 5, la irrigación se repitió con cada intercambio de un instrumento.
Recolección de datos después de la instrumentación
Para determinar el recuento bacteriano (en UFC mL—1) inmediatamente después de la instrumentación (S2), se introdujeron 5 mL adicionales de agua destilada después de la irrigación final. Luego se realizó el limado con un filete Hedström de tamaño 25, introduciéndolo en el canal hasta la longitud de trabajo con movimientos de limado circunferenciales en todas las superficies del conducto radicular. El filete se seccionó por debajo del mango y se dejó caer en un tubo que contenía 500 IL de agua peptonada. Se insertaron tres puntos de papel esterilizados de tamaño 15 en el conducto radicular durante 1 min cada uno y se almacenaron en el mismo tubo que el filete.
Los conductos radiculares se llenaron con TSB e incubaron a 37°C durante 7 días. Se realizó un tercer muestreo de la misma manera que para S2 para determinar el recuento bacteriano a los 7 días después de la instrumentación (S3).
Análisis estadístico
Cada recuento bacteriano fue transformado en logaritmo para el análisis estadístico. Se utilizó la prueba t pareada para el análisis intragrupo, y el análisis de varianza (ANOVA) se utilizó para el análisis intergrupo. El nivel de significancia para todos los análisis fue P < 0.05.
Resultados
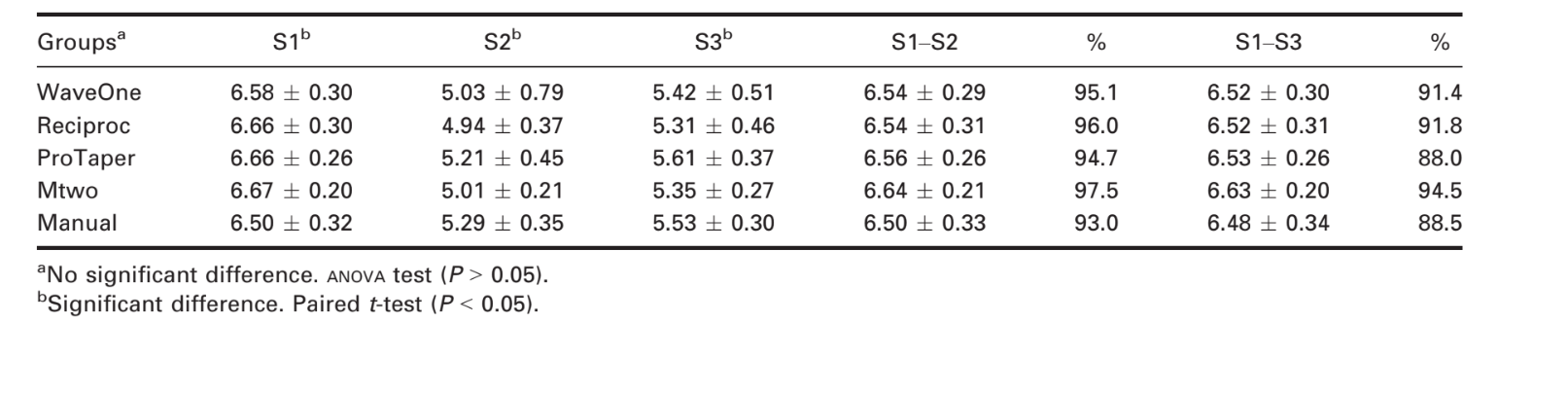
La Tabla 1 muestra los resultados de la reducción bacteriana. Los recuentos bacterianos en S2 y S3 se redujeron en comparación con S1 para todos los grupos (P < 0.0001 por la prueba t). Este resultado demostró que todas las técnicas de preparación fueron efectivas para reducir el recuento bacteriano. Sin embargo, una comparación de los recuentos bacterianos en S2 y S3 reveló crecimiento bacteriano en los 7 días después de la instrumentación (P < 0.01 por la prueba t). El control negativo no mostró ningún crecimiento bacteriano, lo que indicó que se mantuvieron condiciones asépticas durante el experimento. Las técnicas recíprocas, rotativas y manuales tuvieron resultados similares inmediatamente y 7 días después de la instrumentación (P = 0.78 y P = 0.76, respectivamente, por ANOVA).
Discusión
La eliminación microbiológica es de suma importancia en la terapia endodóntica, porque la presencia de bacterias es la principal causa de fracaso endodóntico (Kakehashi et al. 1965, Sakamoto et al. 2007). Se han utilizado muchas metodologías para estudiar este concepto. En el presente estudio, se examinaron las raíces de los molares. El WaveOne Primary, Reciproc R25 y ProTaper F2 tienen el mismo tamaño de punta y conicidad, lo que es una limitación en términos de desinfección de conductos de gran diámetro. Se realizó instrumentación manual hasta un tamaño 35, K-file de conicidad 0.02. Sin embargo, desde una perspectiva microbiológica, se ha informado que el uso de diferentes tamaños de punta y conicidades resulta en recuentos bacterianos similares (Machado et al. 2010).
Similar a muchos estudios previos (Siqueira et al. 1999, Aydin et al. 2007, Machado et al. 2010, Singla et al. 2010, Siqueira et al. 2010, Alves et al. 2011, Gorduysus et al. 2011, Alves et al. 2012, Matos Neto et al. 2012, Paranjpe et al. 2012), se utilizó el método de cultivo en placa. Alves et al. (2011) observaron resultados similares con la técnica de reacción en cadena de la polimerasa como lo hicieron con el método de cultivo en placa. Aunque otros autores han comparado el crecimiento bacteriano antes y después de la instrumentación del conducto radicular sin limado (Siqueira et al. 1999, Machado et al. 2010, Singla et al. 2010, Gorduysus et al. 2011, Matos Neto et al. 2012), el limado es necesario debido a la presencia de una capa de lodo, restos de biofilm y áreas no instrumentadas que podrían influir en las comparaciones entre grupos (Aydin et al. 2007, Siqueira et al. 2010, Alves et al. 2011, 2012, Paranjpe et al. 2012).
La tercera toma de muestras a los 7 días (S3) se utilizó para verificar el crecimiento bacteriano en el conducto radicular entre citas (Siqueira et al. 2007). Los recuentos bacterianos mostraron una reducción bacteriana significativa en todas las técnicas de instrumentación tanto en S2 como en S3 en comparación con los controles. Sin embargo, la comparación entre S2 y S3 reveló un crecimiento bacteriano significativo en el conducto principal. Este hallazgo contradice los resultados encontrados por Siqueira et al. (2007), quienes utilizaron medicación intracanal entre las citas. Las bacterias restantes dentro de los túbulos dentinarios en nuestro estudio podrían haberse multiplicado y entrado en el conducto principal. El uso de un caldo de cultivo rico en nutrientes en el conducto radicular durante 7 días favoreció claramente el crecimiento bacteriano.
No se observaron diferencias estadísticamente significativas entre técnicas y sistemas, consistente con los resultados de ensayos que comparan técnicas manuales con sistemas rotatorios (Dalton et al. 1998, Siqueira et al. 1999, Chuste-Guillot et al. 2006, Matos Neto et al. 2012). Estudios previos han observado reducciones bacterianas medias del 81.94% para ProTaper y 84.29% para Mtwo (P > 0.05) (Machado et al. 2010). Aunque el presente estudio también no encontró diferencia entre estos sistemas, las reducciones medias fueron del 94.71% para ProTaper y 97.43% para Mtwo.
En el presente informe, ninguna de las muestras estaba totalmente libre de bacterias. En contraste, Coldero et al. (2002) observaron que el 81% de las muestras preparadas por la técnica manual estaban libres de bacterias. Esta diferencia debe considerarse a la luz del hecho de que el crecimiento bacteriano muy pequeño no puede ser detectado por métodos de cultivo tradicionales (Siqueira & Rôcas 2005).
En el presente estudio, se lograron reducciones en el recuento bacteriano del 95.1% inmediatamente después y del 91.4% a los 7 días después de la instrumentación mediante los sistemas reciprocantes sin el uso de agentes químicos. Estos resultados fueron comparables a los obtenidos con técnicas convencionales (es decir, 94.7% y 88%, respectivamente, para sistemas rotatorios y 93% y 88.5%, respectivamente, para sistemas manuales). Por lo tanto, los sistemas reciprocantes de un solo archivo resultaron en reducciones bacterianas similares en comparación con las obtenidas con sistemas rotatorios o con la técnica manual.
Conclusión
Se puede concluir que todos los sistemas probados redujeron los recuentos bacterianos a un nivel similar.
M. E. L. Machado, C. K. Nabeshima, M. F. P. Leonardo, F. A. S. Reis, M. L. B. Britto & S. Cai
Referencias:
- Aguiar CM, Mendes DA, Câmara AC, Figueiredo JAP (2009) Evaluación de la capacidad de centrado del sistema rotatorio ProTaper Universal en raíces curvadas en comparación con los archivos Nitiflex. Revista Australiana de Endodoncia 35, 174–9.
- Alves FRF, Almeida BM, Neves MAS, Rôças IN, Siqueira JFJr (2011) Efectos antibacterianos dependientes del tiempo del archivo autoadaptable utilizado con dos concentraciones de hipoclorito de sodio. Revista de Endodoncia 37, 1451–5.
- Alves FRF, Rôças IN, Almeida BM, Neves MAS, Zoffoli J, Siqueira JF Jr (2012) Análisis cuantitativo molecular y de cultivo de la eliminación bacteriana en conductos radiculares de forma ovalada mediante una técnica de instrumentación con un solo archivo. Revista Internacional de Endodoncia 45, 871–7.
- Aydin C, Tunca YM, Senses Z, Baysallar M, Kayaoglu G, Ørstavik D (2007) Reducción bacteriana mediante instrumentación de conductos radiculares extensa versus conservadora in vitro. Acta Odontológica Escandinava 65, 167–70.
- Berutti E, Chiandussi G, Paolino DS et al. (2012) Conformación del canal con archivos reciprocantes WaveOne Primary y sistema ProTaper: un estudio comparativo. Revista de Endodoncia 38, 505–9.
- Bürklein S, Hinschitza K, Dammaschke T, Schäfer E (2012) Capacidad de conformación y efectividad de limpieza de dos sistemas de un solo archivo en conductos radiculares severamente curvados de dientes extraídos: Reciproc y WaveOne versus Mtwo y ProTaper. Revista Internacional de Endodoncia 45, 449–61.
- Chuste-Guillot M-P, Badet C, Peli J-F, Perez F (2006) Efecto de tres técnicas de archivo rotatorio de níquel-titanio en la reducción de la dentina radicular infectada. Cirugía Oral, Medicina Oral, Patología Oral, Radiología Oral y Endodoncia 102, 254–8.
- Coldero LG, McHugh S, Mackenzie D, Saunders WP (2002) Reducción de bacterias intracanal durante la preparación del conducto radicular con y sin ensanchamiento apical. Revista Internacional de Endodoncia 35, 437–46.
- Dalton BC, Ørstavik D, Pettiette M, Trope M (1998) Reducción bacteriana con instrumentación rotatoria de níquel-titanio. Revista de Endodoncia 24, 763–7.
- Gorduysus M, Nagas E, Torun OY, Gorduysus O (2011) Comparación de tres sistemas rotatorios y técnica de instrumentación manual para la eliminación de Enterococcus faecalis del conducto radicular. Revista Australiana de Endodoncia 37, 128–33.
- Guelzow A, Stamm O, Martus P, Kielbassa AM (2005) Estudio comparativo de seis sistemas rotatorios de níquel-titanio y la instrumentación manual para la preparación del conducto radicular. Revista Internacional de Endodoncia 38, 743–52.
- Kakehashi S, Stanley HR, Fitzgerald RJ (1965) Los efectos de las exposiciones quirúrgicas de las pulpas dentales en ratas de laboratorio libres de gérmenes y convencionales. Cirugía Oral, Medicina Oral, Patología Oral 20, 340–9.
- Machado MEL, Sapia LAB, Cai S, Martins GHR, Nabeshima CK (2010) Comparación de dos sistemas rotatorios en la preparación del conducto radicular respecto a la desinfección. Revista de Endodoncia 36, 1238–40.
- Madhusudhana K, Mathew VB, Reddy NM (2010) Extrusión apical de desechos e irrigantes utilizando sistemas de instrumentación manual y tres rotatorios – un estudio in vitro. Odontología Clínica Contemporánea 1, 234–6.
- Matos Neto M, Santos SSF, Leão MVP, Habitante SM, Rodrigues JRDD, Jorge AOC (2012) Efectividad de tres sistemas de instrumentación para eliminar Enterococcus faecalis de los conductos radiculares. Revista Internacional de Endodoncia 45, 435–8.
- Pappen FG, Shen Y, Qian W, Leonardo MR, Giardino L, Haapasalo M (2010) Acción antibacteriana in vitro de Tetraclean, MTAD y cinco soluciones de irrigación experimentales. Revista Internacional de Endodoncia 43, 528–35.
- Paranjpe A, Gregorio C, Gonzalez AM et al. (2012) Eficacia del sistema de archivo autoadaptable en la limpieza y conformación de canales ovalados: una evaluación microbiológica y microscópica. Revista de Endodoncia 38, 226–31.
- Sakamoto M, Siqueira JF Jr, Rôças IN, Benno Y (2007) Reducción bacteriana y persistencia después de los procedimientos de tratamiento endodóntico. Microbiología Oral e Inmunología 22, 19–23.
- Sedgley CM, Lennan SL, Appelbe OK (2005) Supervivencia de Enterococcus faecalis en conductos radiculares ex vivo. Revista Internacional de Endodoncia 38, 735–42.
- Shen Y, Stojicic S, Haapasalo M (2011) Eficacia antimicrobiana de la clorhexidina contra bacterias en biofilms en diferentes etapas de desarrollo. Revista de Endodoncia 37, 657–61.
- Singla M, Aggarwal V, Logani A, Shah N (2010) Evaluación comparativa de ProTaper rotatorio, Profile y técnica convencional de retroceso en la reducción de unidades formadoras de colonias de Enterococcus faecalis y resistencia a fracturas verticales de los conductos radiculares. Cirugía Oral, Medicina Oral, Patología Oral, Radiología Oral y Endodoncia 109, e105–10.
- Siqueira JF Jr, Rôças IN (2005) Aprovechando métodos moleculares para explorar infecciones endodónticas: parte 1: tecnologías moleculares actuales para diagnóstico microbiológico. Revista de Endodoncia 31, 411–23.
- Siqueira JF Jr, Lima KC, Magalhães FAC, Lopes HP, Uzeda M (1999) Reducción mecánica de la población bacteriana en el conducto radicular mediante tres técnicas de instrumentación. Revista de Endodoncia 25, 332–5.
- Siqueira JF Jr, Paiva SSM, Rôças IN (2007) Reducción en la población bacteriana cultivable en conductos radiculares infectados mediante un protocolo antimicrobiano a base de clorhexidina. Revista de Endodoncia 33, 541–7.
- Siqueira JF Jr, Alves FRF, Almeida BM, Oliveira JCM, Rôças IN (2010) Capacidad de la preparación quimio-mecánica con instrumentos rotatorios o archivo autoadaptable para desinfectar conductos radiculares de forma ovalada. Revista de Endodoncia 36, 1860–5.
- Taşdemir T, Aydemir H, Inan U, Ünal O (2005) Preparación del canal con instrumentos rotatorios de Ni-Ti Hero 642 en comparación con K-file manual de acero inoxidable evaluada mediante tomografía computarizada. Revista Internacional de Endodoncia 38, 402–8.
- Yang G, Yuan G, Yun X, Zhou X, Liu B, Wu H (2011) Efectos de dos sistemas de instrumentos de níquel-titanio, Mtwo versus ProTaper universal, en la geometría del conducto radicular evaluados por micro-tomografía computarizada. Revista de Endodoncia 37, 1412–6.
- Yin X, Cheung GS, Zhang C, Masuda YM, Kimura Y, Matsumoto K (2010) Comparación micro-tomográfica de instrumentos rotatorios de níquel-titanio versus instrumentos tradicionales en un sistema de conducto radicular en forma de C. Revista de Endodoncia 36, 708–12.
