Caracterización de los sonidos de cortejo de especies del subgrupo fasciola (Diptera, Drosophilidae, grupo Drosophila repleta): análisis interespecíficos e interpopulacionales
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
El objetivo de este trabajo fue caracterizar el patrón de canto de cortejo masculino de varias especies del subgrupo fasciola y determinar el nivel de variación tanto dentro como entre especies. Los parámetros analizados fueron el intervalo intrapulso (PI), el intervalo interpulso (IPI) y la frecuencia intrapulso (IF). Se analizaron seis especies diferentes: D. coroica (tres poblaciones), D. ellisoni, D. fascioloides, D. moju, D. onca y D. rosinae (una población cada una). Hubo diferencias significativas entre las seis especies para estos tres parámetros del canto de cortejo. El IPI fue el parámetro más variable entre estas especies, lo que sugiere que este parámetro es importante para la discriminación femenina. Cuatro hipótesis diferentes podrían explicar esta variación: 1. diferentes presiones de selección con ausencia de flujo génico; 2. selección sexual intraespecífica; 3. efectos simpátricos en la evolución del canto; y 4. deriva genética. El PI fue el único parámetro que fue significativamente diferente entre las tres poblaciones de D. coroica. Se observó una baja variabilidad entre poblaciones dentro de la misma especie que ya se había observado para otros subgrupos y podría explicarse por las siguientes hipótesis: fuerte selección actuando sobre los parámetros del canto, flujo génico o colonización reciente de una fuente común. Estudios adicionales del canto de cortejo de otras especies del subgrupo fasciola, así como para otros subgrupos del grupo repleta, y estudios utilizando marcadores moleculares que se centren en la base genética de las diferencias entre estas especies en el canto de cortejo nos permitirían evaluar la asociación entre el canto de cortejo y el aislamiento sexual en estas especies, y también nos ayudarían a entender la evolución de estas diferencias conductuales.
Introducción
Sonidos de cortejo
El comportamiento de cortejo de las moscas del género Drosophila es importante para el reconocimiento de especies. Después de que Shorey (1962) mostró que los machos de D. melanogaster emitían sonidos durante el cortejo sexual, se realizaron muchos estudios con los diversos grupos y subgrupos del género Drosophila, describiendo la naturaleza específica de los tipos de sonido. Estos estudios han proporcionado evidencia de que el sonido tiene una función tanto como estimulante sexual como en el aislamiento sexual. Estos sonidos varían significativamente entre las diversas especies de los grupos affinis (Chang & Miller, 1978), melanogaster (Cowling & Burnet, 1981), virilis (Hoikkala et al., 1982; Hoikkala & Isoherranen, 1997), mercatorum (Ikeda & Maruo, 1982), repleta (Ewing & Miyan, 1986), auraria (Tomaru & Oguma, 1994), planitibia (Hoikkala et al., 1994), willistoni (Ritchie & Gleason, 1995), quinaria (Neems et al., 1997) y obscura (Noor & Aquadro, 1998).
Las diferencias interespecíficas en los sonidos de cortejo de Drosophila se caracterizan por uno o más parámetros sonoros, tales como: intervalo entre pulsos (IPI), que es el tiempo desde el comienzo de un pulso hasta el comienzo del siguiente; intervalo intrapulso (PI), que es la duración del pulso; frecuencia intrapulso (IF), que es acústicamente la frecuencia más fuerte dentro del pulso; número de pulsos por serie; y duración de cada intervalo dentro de una serie (Hoikkala & Lumme, 1987; Wheeler et al., 1988). Aunque no se ha establecido firmemente qué parámetros sonoros confieren especificidad, hay evidencia de que el IPI es importante. Según Ritchie & Kyriacou (1996), el IPI de los sonidos de cortejo de Drosophila varía muy poco dentro de poblaciones naturales y es importante para el éxito reproductivo masculino.
Sin embargo, está claro que muchas especies de Drosophila producen sonidos complejos con varias características, una o más de las cuales pueden ser valiosas para identificar especies. Esta especificidad en los sonidos de cortejo de Drosophila puede explicarse por la selección para la discriminación entre especies (Tomaru & Oguma, 1994) de los diferentes tipos de sonidos, que podrían haber evolucionado a través de la selección sexual intraespecífica (Ritchie & Gleason, 1995). Además, los diferentes tipos de sonidos encontrados en las diversas especies de Drosophila podrían simplemente reflejar divergencias filogenéticas.
El subgrupo fasciola
Las especies del subgrupo fasciola se encuentran en bosques húmedos, principalmente en los de América Central y del Sur y en las islas del Caribe. En Brasil, se han recolectado en la selva atlántica, así como en bosques de los estados de São Paulo, Paraná, Mato Grosso do Sul y Bahía (Vilela, 1983; Vilela et al., 1983; Tidon-Sklorz & Sene, 1992).
La mayor parte del trabajo sobre este subgrupo ha sido citológico y se realizó a principios de los años 60, mostrando que las especies de este grupo difieren de todas las demás del grupo repleta por tener las inversiones homocigóticas: 2o2, 2e3 y 2l3. Wasserman (1982) propuso un ancestro común para los subgrupos fasciola y mulleri, porque comparten la inversión 3c. Sin embargo, recientemente Diniz (1998) mostró que la inversión 3c del subgrupo fasciola es diferente de la encontrada en el subgrupo mulleri y propuso que el subgrupo fasciola se derivó directamente de I primitivo, y ya no puede considerarse vinculado al subgrupo mulleri. Kuhn et al. (1995) realizaron un estudio cariotípico de algunas especies del subgrupo fasciola y encontraron variación interespecífica en el tamaño del microcromosoma y en el número de cromosomas.
Según Wasserman (1992), el subgrupo fasciola consiste en nueve especies: D. pictilis y D. pictura, formando el complejo pictilis; D. paraguttata; D. mojuoides y D. moju, formando el complejo moju; y D. fulvalineata, D. fasciola, D. coroica y D. fascioloides que no se encuentran en ningún complejo. Vilela (1983), al estudiar la morfología de los genitales masculinos, determinó que la especie D. fascioloides estudiada por Wasserman (1962) en realidad no pertenecía a esta especie, y la renombró D. ellisoni. También añadió las especies D. linearepleta y D. onca al subgrupo fasciola y describió D. carolinae, D. hermionae, D. ivai, D. querubimae, D. rosinae y D. senei como nuevas especies, aumentando a 18 el número de especies en este subgrupo.
En este trabajo describimos los patrones de sonido de cortejo de seis especies del subgrupo fasciola: D. ellisoni, D. fascioloides, D. moju, D. onca, D. rosinae y D. coroica. Además de los análisis interespecíficos, también examinamos las diferencias en los patrones de sonido de tres poblaciones diferentes de D. coroica.
Materiales y métodos
Establecimiento y mantenimiento de isolinas
Las isolinas se produjeron a partir de hembras individuales ya apareadas en la naturaleza. Estas isolinas fueron identificadas a través del análisis morfológico de los genitales de machos F1 (Vilela, 1983). Las larvas de tercer instar del subgrupo fasciola normalmente intentan salir del frasco de cultivo. Para evitar este problema, los frascos de cultivo se abrieron y se colocaron sobre arena húmeda dentro de botellas de plástico para que las larvas pudieran pupatear en la arena. Las moscas eclosionadas se retiraron con un aspirador y se transfirieron a frascos llenos de medio de cultivo, donde maduraron, se aparearon y pusieron huevos, reiniciando el ciclo.
Grabaciones de sonido
Moscas vírgenes recién eclosionadas fueron aisladas en frascos de cultivo de 35 ml y se dejaron durante 7-10 días para permitir el tiempo de maduración sexual. Posteriormente, se introdujo un macho y una hembra de la misma línea en una cámara de grabación de sonido descrita por Sene & Manfrin (1998). Para grabar el sonido, la cámara que contenía la pareja de moscas se colocó sobre el diafragma de un micrófono ultrasensible, como se describe en Manfrin et al. (1997). Las moscas fueron observadas durante un máximo de 10 minutos, o hasta que se aparearon. Todas las grabaciones se realizaron a 25 ± 1ºC.
Análisis sonoro
Las señales electromagnéticas de las grabaciones analógicas se convirtieron en señales digitales a una frecuencia de 5 KHz, con un circuito convertidor analógico-digital CAD 12/36-60 k (Lynx) y el programa AqDADOS 4 (Lynx).
Los patrones sonoros de cortejo de seis especies diferentes del subgrupo fasciola se describen en la Tabla 1. También se analizaron los patrones sonoros de los machos de D. coroica de tres localidades diferentes para estudiar las diferencias interpopulacionales.
Los parámetros utilizados para estudios comparativos de los patrones sonoros fueron el intervalo intrapulso (PI), el intervalo interpulso (IPI) y la frecuencia intrapulso (IF). Los valores de PI e IPI se obtuvieron directamente de las figuras. Las IF se obtuvieron con la ayuda del software MATLAB (MathWorks, Inc.) utilizando Transformadas Rápidas de Fourier (FFT). Este análisis descompone la señal sonora en una serie de ondas (sinas y cosinas) de diferentes frecuencias y amplitudes. La IF de un sonido se define como la frecuencia de la onda de mayor amplitud en la señal sonora.
La FFT puede analizar sonidos que contienen miles de puntos por milisegundo, pero la máxima eficiencia de análisis se obtiene al restringir el número de puntos a potencias de dos. Por esta razón, todos los intervalos utilizados para el análisis de IF se seleccionaron de modo que tuvieran un número de puntos igual a potencias de dos. Por lo tanto, se utilizaron intervalos de 64 puntos para D. moju; 128 puntos para D. rosinae y D. coroica; 256 puntos para D. ellissoni; y 512 puntos para D. onca y D. fascioloides. Se realizaron diez medidas de los parámetros PI, IPI e IF para cada uno de los 10 machos de cada una de las isolinas.
Análisis estadístico
Las líneas descritas en la Tabla 1 fueron analizadas con el objetivo de investigar diferencias interespecíficas. La isolina D96N74 fue elegida como representativa de D. coroica. Las tres líneas (D96N74, D88M1 y J7C1) de D. coroica fueron probadas por separado para diferencias interpoblacionales. Los valores de los parámetros intervalo intrapulso (PI), intervalo interpulso (IPI) y frecuencia intrapulso (IF) fueron analizados por separado mediante análisis de varianza (ANOVA de una vía) a un nivel de significancia de 0.05.
Resultados
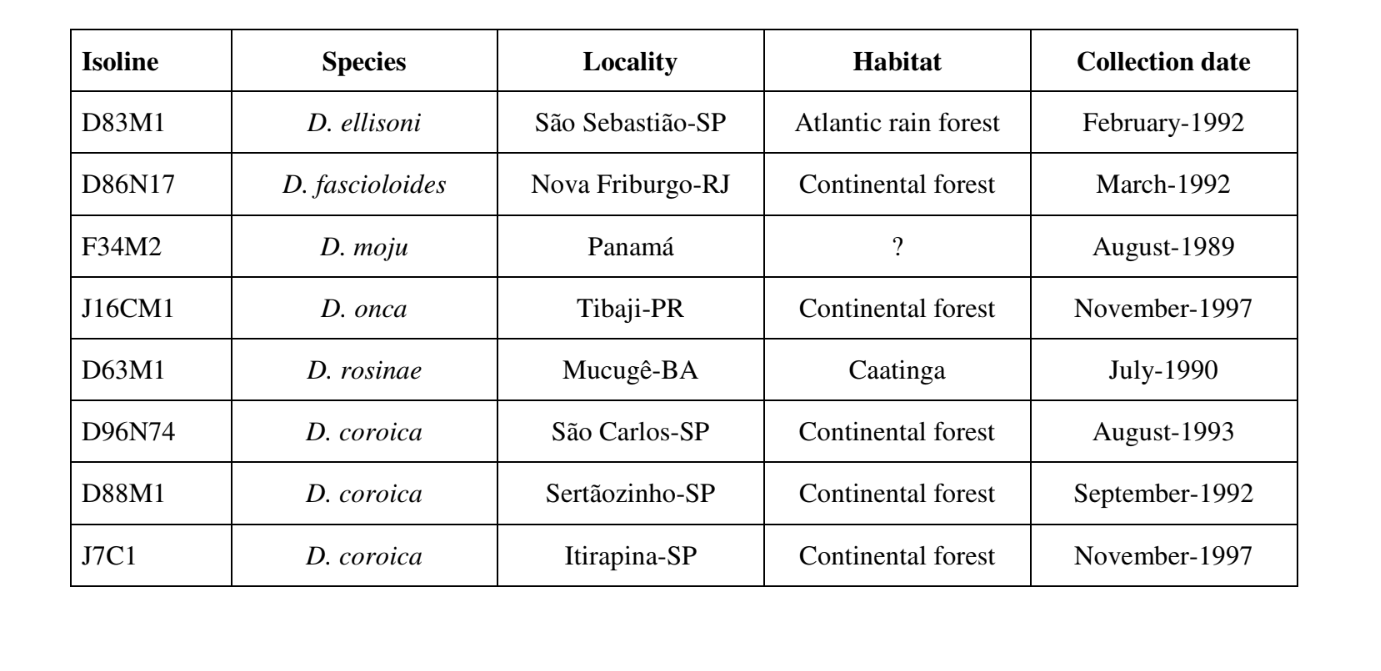
Las Fig. 1 a 6 muestran los sonogramas básicos de las diversas especies analizadas. La isolina D96N74 fue elegida para representar la especie D. coroica. Estos sonogramas y el análisis de los pulsos de sonido permiten una división de los sonidos de cortejo en tres grupos distintos: 1. sonidos de cortejo de las especies D. onca, D. fascioloides y D. ellisoni, en los que cada secuencia de sonido está compuesta por una secuencia de pulsos cortos, seguida de un trino, similar al que se encuentra en algunas especies del subgrupo planitibia, denominado por Hoikkala et al. (1994) como canción de frase. En las especies D. fascioloides y D. onca, la secuencia de pulsos está compuesta por cuatro pulsos, seguidos de un trino relativamente largo, mientras que en D. ellisoni, hay solo dos pulsos, seguidos de un trino más corto; 2. el tipo típico del sonograma de D. rosinae, con un sonido de cortejo formado por pulsos simples pero duplicados, un patrón también observado por Ewing & Miyan (1986) en algunas especies del grupo repleta; 3. un tipo basado en los sonidos de cortejo de las especies D. moju y D. coroica, con pulsos cortos en secuencia, similar a la canción de pulso de D. melanogaster (Schilcher, 1976) y sonido A de D. mercatorum (Ikeda & Maruo, 1982; Manfrin et al, 1997).
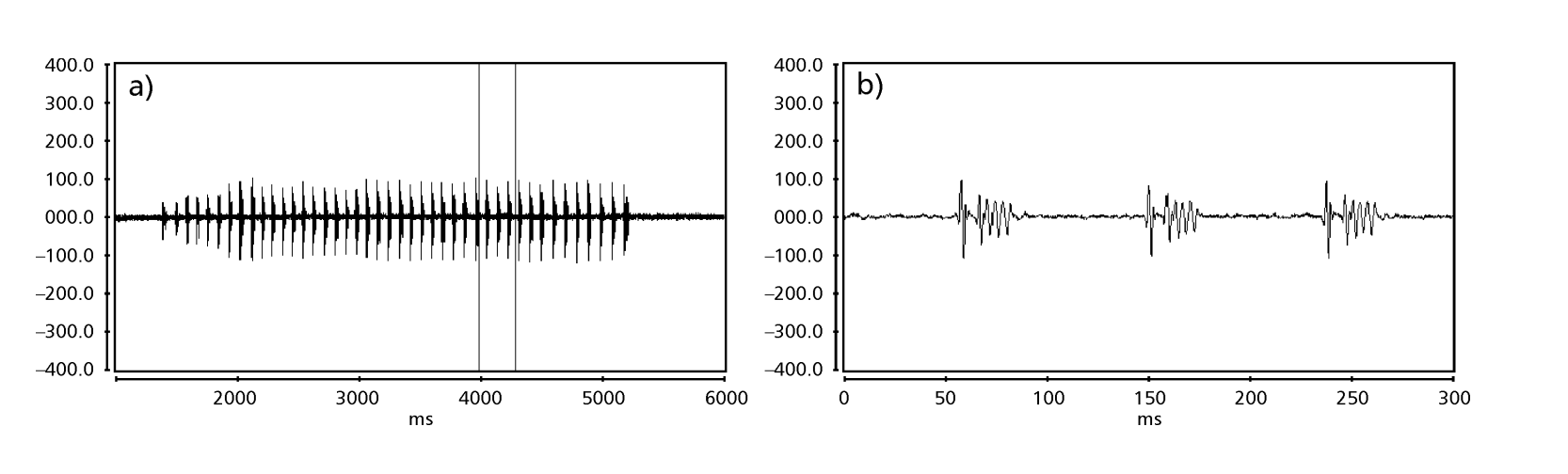
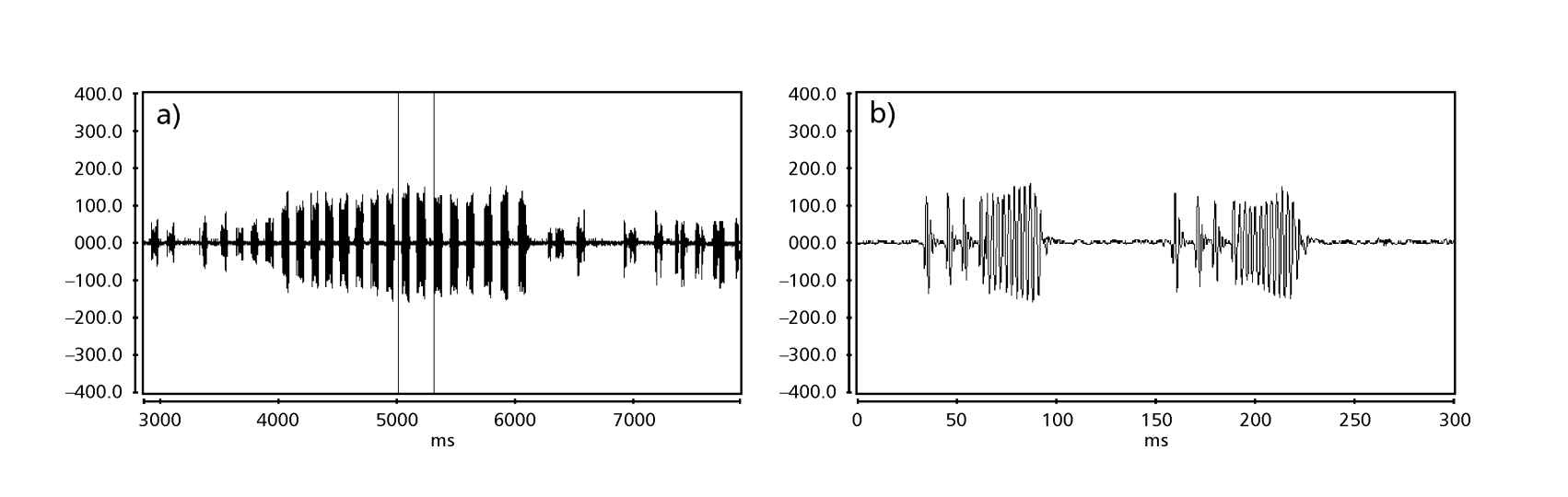
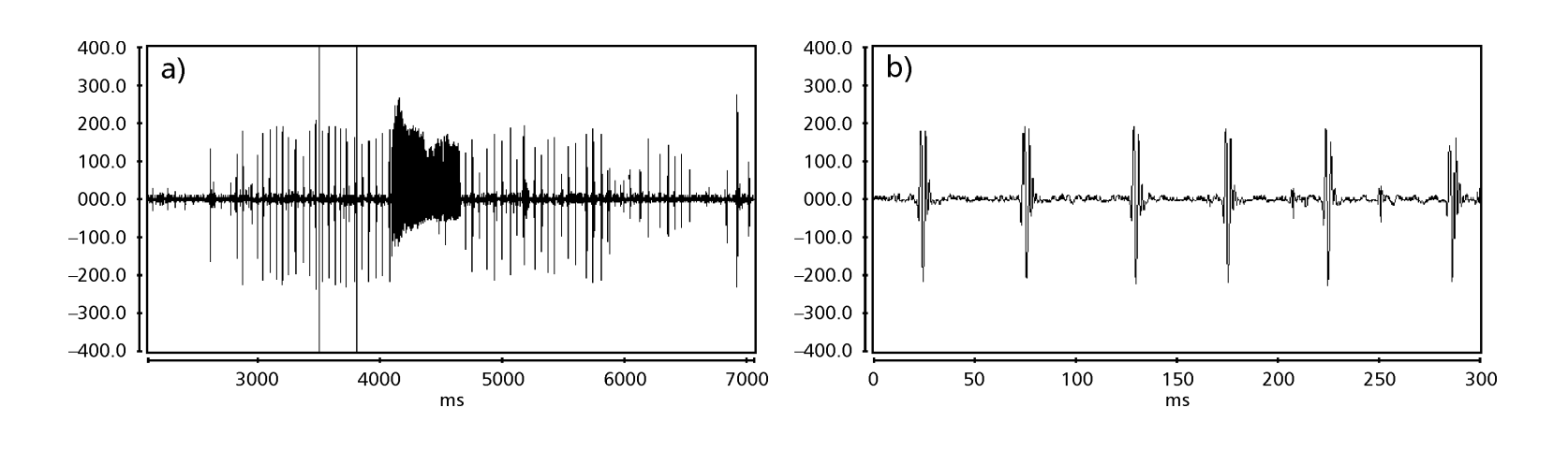
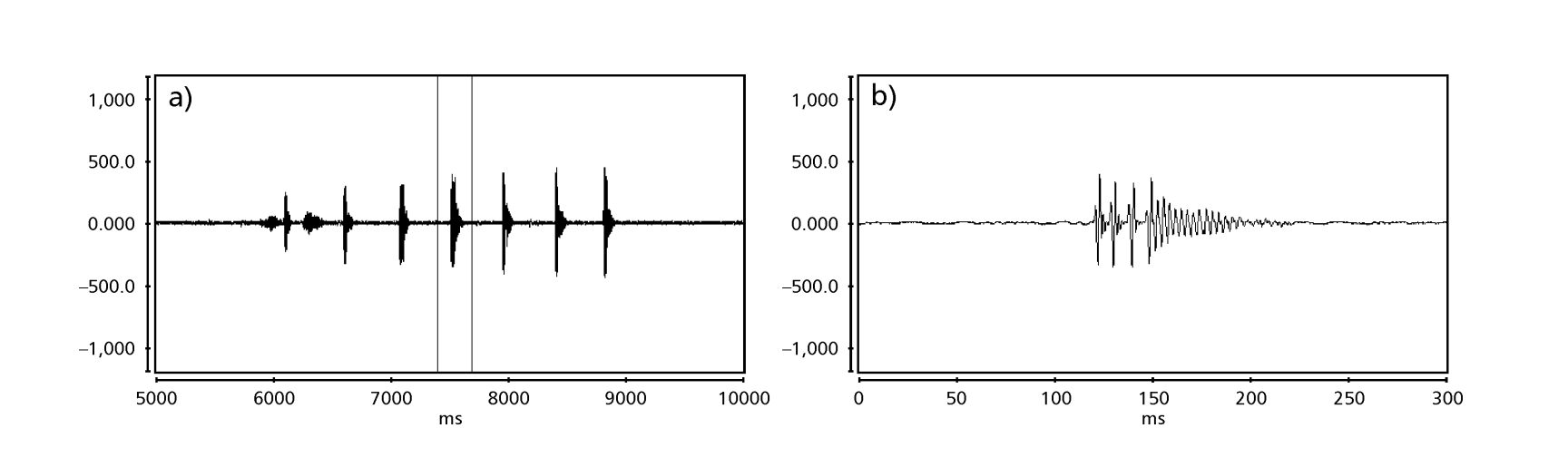
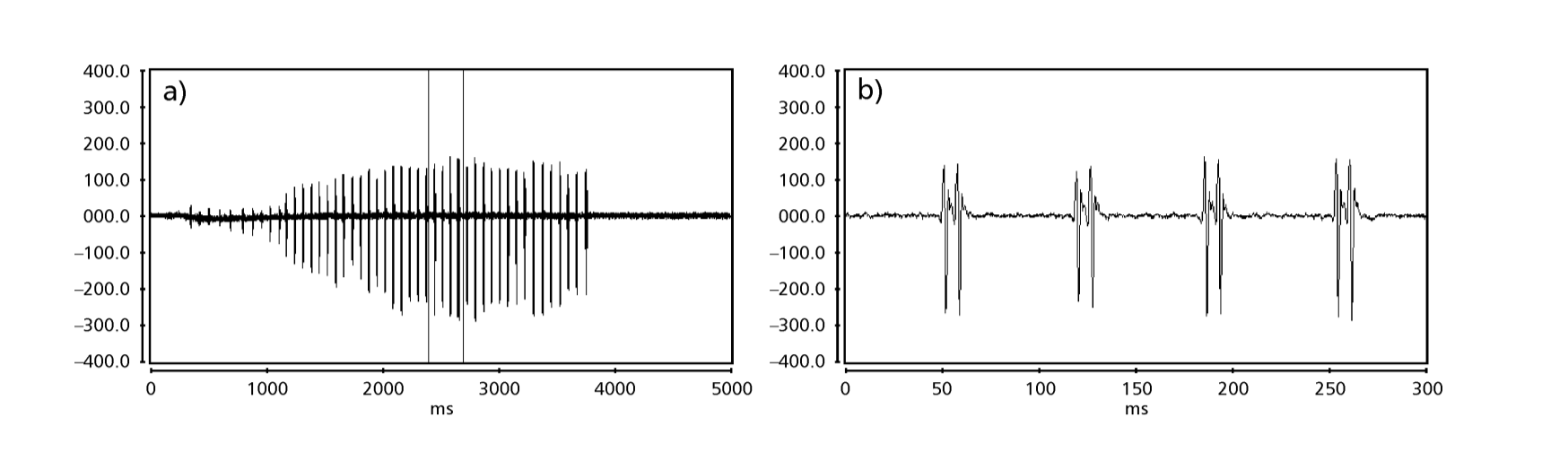
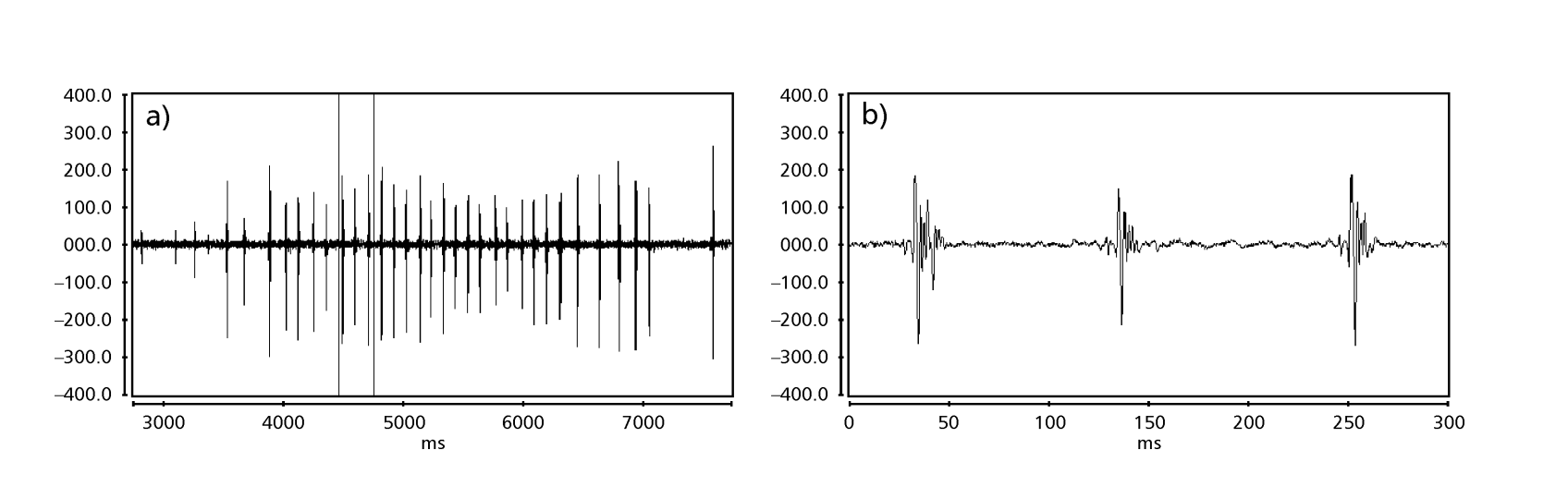
Los sonogramas de cada una de las especies analizadas eran una secuencia de un tipo de pulso sonoro. Este hallazgo es diferente de los estudios realizados en las especies D. melanogaster (Schilcher, 1976), D. mercatorum (Ikeda & Maruo, 1982; Manfrin et al., 1997), y algunas especies del subgrupo repleta (Ewing & Miyan, 1986), en las que se encontraron dos tipos diferentes de sonidos.
La Tabla 2 muestra los valores medios para PI (intervalo intrapulso), IPI (intervalo interpulso) e IF (frecuencia intrapulso) de las isolíneas descritas en la Tabla 1. Una comparación de las desviaciones estándar (± sd) entre las diversas especies muestra que D. ellisoni y D. fascioloides tienen la menor variación para los tres parámetros: PI (27.470 ± 2.73 y 69.859 ± 6.12), IPI (97.473 ± 5.76 y 125.757 ± 7.87), e IF (251.358 ± 19.36 y 362.901 ± 17.04), lo que indica que los sonidos de cortejo de estas especies son uniformes con poca variación intraespecífica. Por otro lado, D. onca tuvo una variación considerable en PI (93.662 ± 31.44) e IPI (508.091 ± 73.06) y una variación moderadamente alta en IF (289.260 ± 32.71) en comparación con las otras especies, lo que indica que las diferencias en PI e IPI, aunque grandes, no fueron suficientes para alterar significativamente la forma de onda del pulso. Las desviaciones estándar fueron relativamente bajas para PI (7.363 ± 7.36 y 14.673 ± 1.98) e IPI (50.859 ± 5.47 y 72.340 ± 5.68) en D. moju y D. rosinae, pero los valores de IF fueron relativamente altos (412.501 ± 55.63 y 306.624 ± 57.80). En este caso, aunque la duración del pulso y el tiempo de un pulso al siguiente eran relativamente uniformes dentro de cada una de estas especies, la forma de onda del pulso sonoro variaba considerablemente.
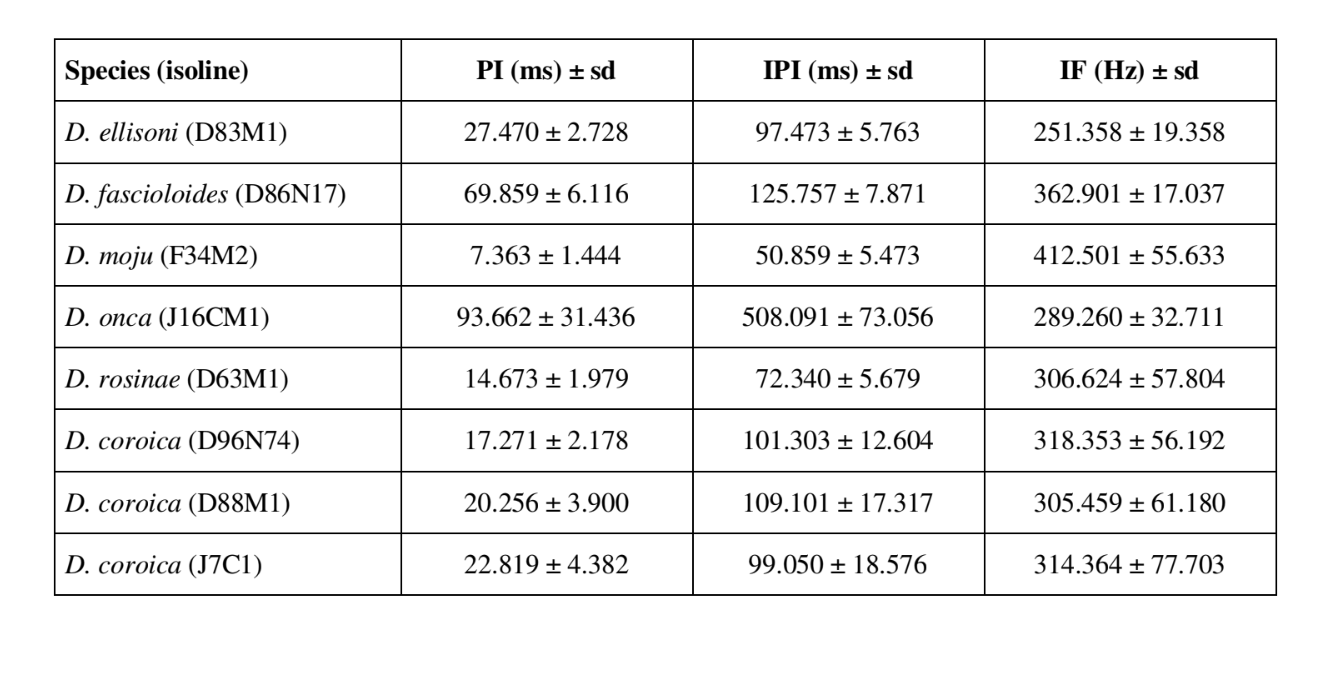
Hubo relativamente poca variación intrapoblacional en los PIs de las líneas D. coroica D96N74, D88M1 y J7C1 (17.271 ± 2.18, 20.256 ± 3.90 y 22.819 ± 4.38, respectivamente), variabilidad intermedia en IPI (101.303 ± 12.60, 109.101 ± 17.32 y 99.050 ± 18.58), y alta variabilidad en IF (318.353 ± 56.19, 305.459 ± 61.18 y 314.364 ± 77.70), lo que indica que incluso con baja variación intrapoblacional en la longitud del pulso sonoro, hubo una variación considerable en la forma de onda del pulso sonoro.
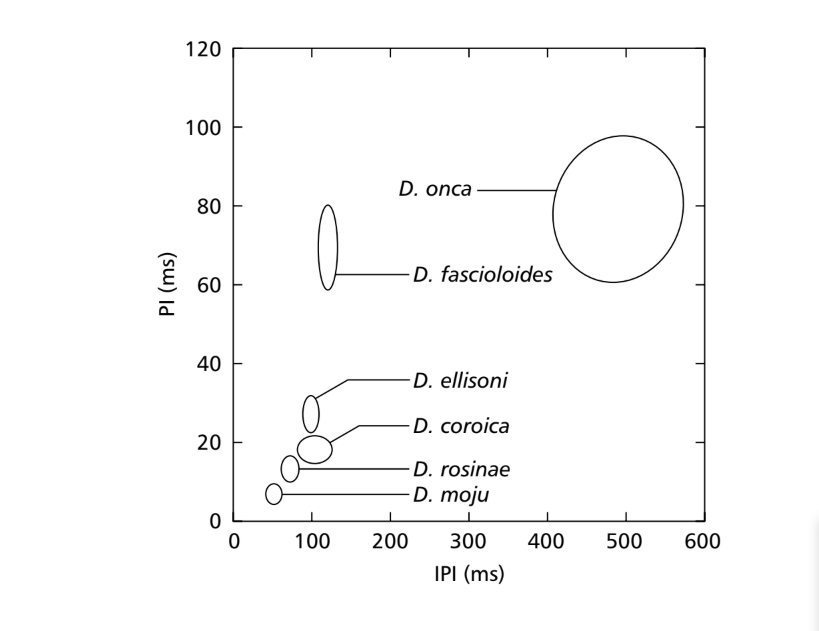
Cuando se compararon los valores medios de los parámetros PI e IPI, se encontraron diferencias entre las especies del subgrupo fasciola para al menos uno de estos parámetros. Estas diferencias en los sonidos de cortejo se pueden ver en la Fig. 7, en la que los valores de estos dos parámetros están representados en forma de elipses, que incluyen el 75% de los valores para los parámetros PI e IPI. Se encontraron diferencias significativas en los valores de PI (ANOVA, F5,48 = 124.98, p < 0.001) e IPI (ANOVA, F5,48 = 949.35, p < 0.001) entre especies. Las diferencias interspecíficas en IF se muestran en la Fig. 8. También se encontraron diferencias significativas en los valores de IF (ANOVA, F5,48 = 23.40, p < 0.001).
Las tres poblaciones de D. coroica difirieron significativamente en el PI (ANOVA, F2,24 = 8.75, p < 0.05) pero no en el IPI (ANOVA, F2,24 = 1.72, p > 0.10) y IF (ANOVA, F2,24 = 0.15, p > 0.25).
Discusión
Hoikkala et al. (1994) en su análisis del sonido de cortejo de varias especies del subgrupo planitibia, descubrieron que es común encontrar los mismos tipos de sonidos en especies filogenéticamente cercanas. Además, Hoikkala & Kaneshiro (1993) observaron que algunas especies estrechamente relacionadas en este subgrupo, que son simpátricas, utilizan diferentes tipos de sonidos en el cortejo.
Noor & Aquadro (1998) encontraron diferencias significativas en los sonidos de cortejo en dos especies estrechamente relacionadas del subgrupo obscura: D. pseudoobscura y D. persimilis. Algunos experimentos que involucraron cruces entre estas dos especies indicaron que las hembras de D. pseudoobscura probablemente aumentaron su discriminación contra los machos de D. persimilis en poblaciones simpátricas. Esto podría haber ocurrido a través de la selección en contra de la producción de híbridos mal adaptados, resultando en una alteración del sonido de cortejo en estas poblaciones simpátricas.
Ewing & Miyan (1986), trabajando con especies del grupo repleta , no encontraron relación entre una filogenia basada en datos citológicos y otra hecha a partir de datos sonoros. Sin embargo, algunas de las características que la mayoría de las especies estudiadas tienen en común y que también se encuentran en especies de otros grupos nos permiten proponer un sonido de cortejo ancestral para el grupo repleta . Este sonido habría estado compuesto por dos componentes distintos: el sonido inicial A, que consiste en un máximo de 10 pulsos monocíclicos cortos y regulares, con un intervalo entre pulsos de 8 a 15 ms; y el sonido B, compuesto por una serie de pulsos regulares y monocíclicos, pero con un mayor número de pulsos y un intervalo entre pulsos más largo al final del cortejo. Durante la evolución del grupo repleta , algunas especies habrían perdido el sonido A, y otras, el sonido B, y, en muchas, el sonido B habría llegado a ser menos regular y más complejo.
Basado en estas suposiciones y observando los sonogramas obtenidos para las seis especies del subgrupo fasciola en este estudio, podemos inferir que en todas estas especies hubo una pérdida del sonido A, ya que los intervalos entre pulsos son siempre mucho más largos que 15 ms. D. coroica tiene pulsos irregulares, con un intervalo medio entre pulsos de 101.3 ms, mientras que los sonidos de cortejo de D. moju están compuestos por pulsos más regulares, con un intervalo medio entre pulsos de
50.9 ms. D. rosinae tiene un sonograma compuesto de pulsos duplicados, un tipo de sonido también encontrado por Ewing & Miyan (1986), con un intervalo medio entre pulsos de 72.3 ms. D. ellisoni, D. fascioloides y D. onca tienen sonidos de cortejo compuestos de pulsos policíclicos, probablemente como resultado de una fusión de los sonidos A y B, con intervalos medios entre pulsos de 97.4, 125.7 y 508.0 ms, respectivamente. Estas similitudes en los tipos de sonidos en estas tres especies no están estrechamente correlacionadas con los datos citológicos, excepto para D. ellisoni y D. fascioloides que fueron colocadas cerca una de la otra en una filogenia basada en caracteres citológicos, tienen dos fusiones cromosómicas en común: 2-4F y 3-5F (Diniz, 1998). Como es el caso de los caracteres morfológicos, se espera una tendencia de las especies estrechamente relacionadas a compartir algunos parámetros de sonido. Sin embargo, incluso cuando se conocen las relaciones filogenéticas entre las especies, las tendencias evolutivas basadas en caracteres de sonido no se han establecido bien.
Aunque el sonido de cortejo no es un ejemplo de comportamiento circadiano, la investigación ha relacionado este comportamiento con la expresión del gen period (per) ubicado en el cromosoma X y bien caracterizado a nivel molecular. Las mutaciones en este gen pueden alterar el ritmo circadiano de Drosophila. Un análisis genético realizado por Konopka et al. (1996) mostró que el ritmo sonoro del intervalo entre pulsos también se ve afectado por mutaciones en el gen per. Kyriacou & Hall (1980) informaron una modulación rítmica del intervalo entre pulsos con períodos específicos en D. melanogaster y D. simulans de 55 y 35 segundos respectivamente. Estas diferencias se demostraron estar relacionadas con algunas variaciones en el gen per. Las mutaciones en este gen, que fueron estudiadas inicialmente por Konopka & Benzer (1971) en un análisis de ritmos circadianos anormales, provocaron efectos correspondientes en los ritmos de intervalo entre pulsos de los sonidos de cortejo. La mutación perShort (perS), con un ritmo circadiano de aproximadamente 19-20 horas, tuvo un período medio de 41.5 segundos; la mutación perLong (perL) cuyo ritmo circadiano de 28-30 horas tuvo un período medio de 82.1 segundos; y la mutación per0 no tuvo ritmo de intervalo entre pulsos.
En esta investigación encontramos diferencias significativas en los parámetros de intervalo intrapulso, intervalo interpulso e intrapulso frecuencia en las especies de fasciola analizadas. Entre estos parámetros, el intervalo interpulso fue el que más diferenció, con poca superposición y poca variación intraespecífica, sugiriendo que este parámetro podría ser parte de un sistema de reconocimiento de especies. Este alto nivel de diferenciación en los sonidos masculinos es consistente con el consenso general de que el comportamiento de cortejo puede diferir más que los caracteres morfológicos u otras características en especies relacionadas. Sin embargo, en este momento es imposible conocer la dirección de la evolución de estos diferentes tipos de sonidos en el subgrupo de fasciola. Estudios genéticos han demostrado que las diferencias interespecíficas en los intervalos interpulso son frecuentemente debidas a factores aditivos y poligénicos. Estas diferencias también pueden explicarse por la adaptación a diferentes entornos en ausencia de flujo génico. Se sabe que hubo ciclos alternos entre frío-seco y caliente-húmedo en el período Cuaternario. En un ciclo climático frío-seco, la vegetación adaptada a las condiciones secas se expandió, mientras que el bosque se retrajo. Durante el ciclo caliente-húmedo subsiguiente, la situación se invirtió (Ab’ Saber, 1977; Vanzolini, 1981). Se cree que las moscas siguieron estos procesos de reducción y expansión del bosque, lo que resultaría en largos períodos de aislamiento geográfico durante los ciclos frío-seco y algunas áreas de simpatría durante los ciclos caliente-húmedo.
Aunque el intervalo interpulso puede variar ampliamente entre diferentes especies del género Drosophila, generalmente esto no se observa cuando se analizan poblaciones de la misma especie (Costa et al., 2000; Ritchie et al., 1994). Las tres poblaciones analizadas de D. coroica mostraron diferencias significativas solo en el intervalo intrapulso, sin diferencias en el intervalo interpulso y la frecuencia intrapulso. Es posible que una fuerte presión de selección esté actuando sobre el intervalo interpulso y la frecuencia intrapulso. Esta baja variabilidad también podría ocurrir si las poblaciones geográficamente distintas fueran genéticamente homogéneas debido a un flujo genético constante, o si un ancestro común hubiera colonizado recientemente estas poblaciones. Sin embargo, los datos de PI muestran que este no es el caso.
Se sabe poco sobre los mecanismos genéticos involucrados en los procesos de especiación, sin embargo, primero es necesario entender la genética y la evolución de los mecanismos que impiden el flujo genético. Los híbridos estériles e inestables se consideran fuertes barreras al flujo genético, pero estos tipos de mecanismos postcigóticos pueden resultar en altos costos en forma de gametos y energía. Por lo tanto, las diferencias en los sonidos de cortejo pueden ser un mecanismo de aislamiento importante, ya que limitarían o prevenirían tales pérdidas (Welbergen et al., 1992). El análisis de estas señales, que son importantes para el éxito del apareamiento, es de considerable interés para la biología evolutiva y el conocimiento de la arquitectura de los sonidos podría ayudar a probar varios modelos de selección sexual y especiación.
Autores: Costa, C. T. A. y Sene, F. M.
Referencias:
- Ab’ Saber, A. N., 1977, Espacios ocupados por la expansión de los climas secos de América del Sur, con ocasión de los períodos glaciares cuaternarios. Paleoclimas, 3: 1-19.
- Chang, H. C. & Miller, D. D., 1978, Sonidos de cortejo y apareamiento en especies del subgrupo Drosophila affinis. Evolution, 32: 540-550.
- Costa, C. T. A., Kuhn, G. C. S. & Sene, F. M., 2000, Baja variación en la canción de cortejo en poblaciones del sur y sureste de Brasil de D. meridionalis (Diptera, Drosophilidae). Rev. Brasil. Biol., 60: 53-61.
- Cowling, D. E. & Burnet, B., 1981, Canciones de cortejo y control genético de las características acústicas en especies hermanas del subgrupo Drosophila melanogaster. Anim. Behav., 29: 924-935.
- Diniz, N. M., 1998, Filogenia cromosómica de especies del subgrupo fasciola del grupo repleta género Drosophila. Tesis de Doctorado, Facultad de Medicina de Ribeirão Preto de la Universidad de São Paulo.
- Ewing, A. W. & Miyan, J. A., 1986, Selección sexual, aislamiento sexual y la evolución de la canción en el grupo de especies Drosophila repleta. Anim. Behav., 34: 421-429.
- Hoikkala, A. & Lumme, H., 1987, La base genética de la evolución de los sonidos de cortejo masculinos del grupo Drosophila virilis. Evolution, 41: 827-845.
- Hoikkala, A. & Kaneshiro, K. Y., 1993, Cambio en la secuencia de señal-respuesta responsable del aislamiento asimétrico entre Drosophila planitibia y D. silvestris. Proc. Natn,. Acad. Sci., 90: 5813-5817.
- Hoikkala, A. & Isoherranen, E., 1997, Variación y repetibilidad de los caracteres de la canción de cortejo entre machos de Drosophila montana y D. littoralis capturados en la naturaleza y criados en laboratorio (Diptera-Drosophilidae). Jornal of Insect Behavior, 10: 193-202.
- Hoikkala, A., Lakovaara, S. & Romppainen, E., 1982, Comportamiento de apareamiento y sonidos de cortejo masculinos en el grupo Drosophila virilis. En: Lakovaara, S. (ed.), Avances en genética, desarrollo y evolución de Drosophila. Plenum, Nueva York.
- Hoikkala, A., Kenneth, Y. & Hoy, R. H., 1994, Canciones de cortejo de las especies del subgrupo de alas de imagen Drosophila planitibia. Anim. Behav., 47: 1363-1374.
- Ikeda, H. & Maruo, O., 1982, Selección direccional para la tasa de repetición de pulso del sonido de cortejo y respuestas correlacionadas que ocurren en varios caracteres en Drosophila mercatorum. Jnp. J. Genet., 57: 241-258.
- Konopka, R. J. & Benzer, S., 1971, Mutantes de reloj de Drosophila melanogaster. Proc. Natl. Acad. Sci., 68: 2112-2116.
- Konopka, R. J., Kyriacou, C. P. & Hall, J. C., 1996, Análisis mosaico en el CNS de Drosophila de ritmos de canción de cortejo circadianos afectados por una mutación de reloj de período. J. Neurogenet., 11: 117-140.
- Kuhn, G. C. S., Diniz, N. M., Alves, M. A. R. & Sene, F. M., 1995, Constitución cariotípica de especies del subgrupo fasciola del grupo repleta género Drosophila. Rev. Bras. Gen., 18 supplement: 282.
- Kyriacou, C. P. & Hall, J. C., 1980, Mutaciones de ritmo circadiano en Drosophila melanogaster afectan las fluctuaciones a corto plazo en la canción de cortejo del macho. Proc. Natl. Acad. Sci., 77: 6729-6733.
- Manfrin, M. H., Prado, P. R. R. & SENE, F. M., 1997, Análisis de los componentes sonoros del cortejo sexual de dos subespecies de Drosophila mercatorum (Diptera, Drosophilidae). Rev. Brasil. Biol., 57: 349-355.
- Neems, R. M., Dooher, K., Butlin, R. K. & Shorrocks, B., 1997, Diferencias en la canción de cortejo masculino entre las especies del grupo quinaria de Drosophila. Journal of Insect Behavior, 10: 237-246.
- Noor, M. A. & Aquadro, C. F., 1998, Canciones de cortejo de Drosophila pseudoobscura y D. persimilis: análisis de la variación. Anim. Behav., 56: 115-125.
- Ritchie, M. G. & Gleason, J. M., 1995, Evolución rápida del patrón de canción de cortejo en especies de Drosophila willistoni. J. Evol. Biol., 8: 463-479.
- Ritchie, M. G. & Kyriacou, C. P., 1996, Selección artificial para una señal de cortejo en Drosophila melanogaster. Anim. Behav., 52: 603-611.
- Ritchie, M. G., Yate, V. H. & Kyriacou, C. P., 1994, Variabilidad genética del intervalo entre pulsos de la canción de cortejo entre algunas poblaciones europeas de Drosophila melanogaster. Heredity, 72: 459-464.
- Schilcher, F. V., 1976, El papel de los estímulos auditivos en el cortejo de Drosophila melanogaster. Anim. Behav., 24: 18-26.
- Sene, F. M. & Manfrin, M. H., 1998, Una cámara para grabar la canción de cortejo en Drosophila. D. I. S., 81: 203-204.
- Shorey, H. H., 1962, La naturaleza del sonido producido por Drosophila melanogaster durante el cortejo. Science, 137: 677-678.
- Tidon-Sklorz, R. & Sene, F. M., 1992, Distribución vertical y temporal de especies de Drosophila (Diptera, Drosophilidae) en un área boscosa en el estado de São Paulo, Brasil. Rev. Brasil. Biol., 52: 311-317.
- Tomaru, M. & Oguma, Y., 1994, Diferencias en la canción de cortejo en las especies del complejo Drosophila auraria. Anim. Behav., 47: 133-140.
- Vanzolini, P. E., 1981, Un enfoque cuasi-histórico sobre la historia natural de la diferenciación de los reptiles en aislamientos geográficos tropicales. Papeis Avulsos Zool., 34: 189.
- Vilela, C. R., 1983, Una revisión del grupo de especies Drosophila repleta (Diptera, Drosophilidae). Revta. Bras. Ent., 27: 1-114.
- Vilela, C. R., Pereira, M. A. Q. R. & Sene, F. M., 1983, Datos preliminares sobre la distribución geográfica de especies de Drosophila dentro de dominios morfoclimáticos de Brasil. II. El grupo repleta. Cienc. Cult., 35: 66-70.
- Wasserman, M., 1962, Estudios citológicos del grupo repleta del género Drosophila. VI. El subgrupo fasciola. Univ. Texas Public., 6205: 119-134.
- Wasserman, M., 1982, Evolución del grupo repleta. En: M. Ashburner, H. L. Carson & J. N. Thompson (eds.), La genética y biología de Drosophila, vol. 3b. Academic Press, Londres, pp. 61-139.
- Wasserman, M., 1992, Evolución citológica del grupo de especies Drosophila repleta: VI. El subgrupo fasciola. En: Estudios en Genética II. Informes de Investigación sobre genética de Drosophila, taxonomía y evolución. CRC Press, Inc., M. R. la Universidad de Texas, Austin.
- Welbergen, P., Van Duken, F. R., Scharloo, W. & Köhler, W., 1992, La base genética del aislamiento sexual entre Drosophila melanogaster y D. simulans. Evolution, 46: 1385-1398.
- Wheeler, D. A., Fields, W. L. & Hall, J. C., 1988, Análisis espectral de las canciones de cortejo de Drosophila: D. melanogaster, D. simulans, y su híbrido interespecífico. Behav. Genet., 18: 675-703.
