Morfología del aedeago como marcador discriminante en dos especies cactofílicas estrechamente relacionadas de Drosophila (Diptera; Drosophilidae) en América del Sur
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
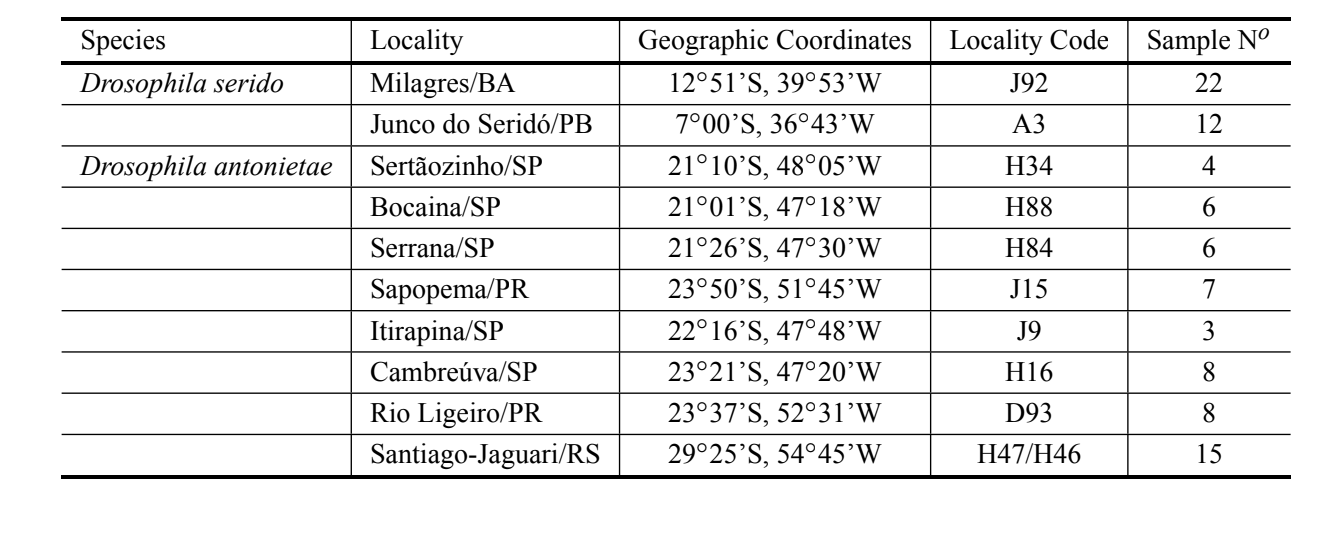
Drosophila serido y D. antonietae son especies hermanas que pertenecen al grupo Drosophila buzzatii. Morfológicamente, solo se pueden discriminar por rasgos cuantitativos. En este artículo analizamos la longitud y la curvatura promedio igualada de cuatro regiones del aedeago de D. antonietae y D. serido. Los especímenes de D. serido y D. antonietae fueron clasificados correctamente el 96.74% de las veces. Basándonos únicamente en la variable que más contribuyó a la discriminación de los grupos (curvatura promedio igualada del arco IV del aedeago), observamos una divergencia morfológica intraespecífica significativa en D. serido en relación con D. antonietae, en concordancia con otros marcadores. La alta divergencia morfológica en la curvatura promedio igualada del arco IV del aedeago muestra que esta región evolucionó más rápido que otras, desde la divergencia de las dos especies. Se discute la importancia del presente estudio para la comprensión de la base genética que controla la formación del aedeago, en las especies del grupo Drosophila buzzatii.
Introducción
Los caracteres morfológicos se han utilizado históricamente en estudios evolutivos y taxonómicos. Sin embargo, la falta de diferencias morfológicas cualitativas entre especies hermanas dificulta establecer las características morfológicas diagnósticas entre ellas. En muchos casos, las variaciones cuantitativas de los rasgos morfométricos son suficientes para la discriminación de especies hermanas (Moreteau et al. 2003, Moraes et al. 2004).
La morfología del aedeago (genitales masculinos externos) es de extrema importancia en la caracterización taxonómica de las especies de Drosophila (Vilela 1983, Silva y Sene 1991, Liu et al. 1996, Moreteau et al. 2003, Kullikov et al. 2004), así como en otros Dípteros. Las variaciones cuantitativas en las características morfológicas del aedeago también se han utilizado para la discriminación de las especies hermanas de Drosophila (Silva y Sene 1991, Kullikov et al. 2004). En el grupo de Drosophila repleta , que incluye más de 90 especies neotropicales, la mayoría se consideran especies hermanas. Sin embargo, existe una marcada diferencia en la forma de los aedeagos (forma + tamaño) entre ellas, que se considera el principal carácter diagnóstico en el grupo (Vilela 1983).
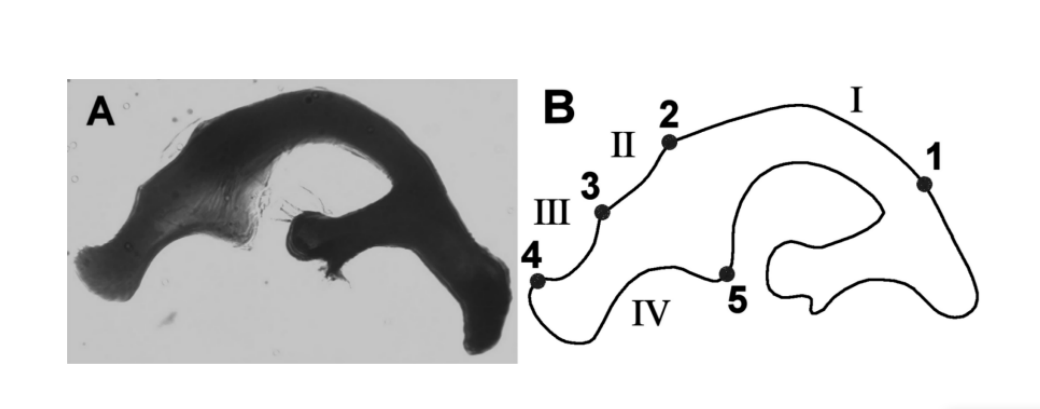
El grupo Drosophila buzzatii (grupo repleta, subgrupo mulleri, complejo buzzatii) es un grupo monofilético formado por siete especies hermanas cactofílicas: D. buzzatii, D. borborema, D. koepferae, D. antonietae, D. gouveai, D. serido y D. seriema. En este grupo, las diferencias cuantitativas de las características morfológicas del ala (Moraes et al. 2004) y de los genitales masculinos (Silva y Sene 1991, Tidon-Sklorz y Sene 1995, Prado et al. 2004) se han utilizado con éxito para la discriminación de especies y poblaciones. Entre las siete especies de este grupo, D. buzzatii y D. borborema presentan aedeagos que son diferentes en forma y tamaño de las otras especies (Tidon-Sklorz y Sene 1995). Sin embargo, la morfología del aedeagus de las otras especies del grupo es similar al llamado tipo de aedeagus D. serido (Figura 1a) y, basándose en esta observación, estas especies fueron clasificadas inicialmente como pertenecientes a la misma especie (Vilela y Sene 1977). Para estudiar el aedeagus de estas especies, Silva y Sene (1991) lo dividieron en cuatro regiones principales delimitadas por puntos de referencia (Figura 1b). Cada región delimitada por dos puntos de referencia adyacentes fue denominada arco. Basándose en la longitud de los arcos, los investigadores identificaron cinco tipos diferentes de aedeagus, nombrados de A a E, específicos para cada especie.
Drosophila serido y D. antonietae son dos especies hermanas que pertenecen al grupo Drosophila buzzatii analizado en este estudio. D. antonietae se encuentra en bosques mesofílicos en las regiones de la cuenca del Paraná-Paraguay, en América del Sur, asociada con el cactus Cereus hildemannianus (Tidon-Sklorz y Sene 2001). D. serido está presente en la Caatinga del noreste y la costa atlántica de Brasil, desde el noreste hasta la región sur de Brasil, asociada con una serie de géneros de cactáceas (Pereira et al. 1983). En el límite sur de la distribución de D. serido, hay un área de contacto con D. antonietae (A.C. Morales et al., datos no publicados). A pesar de que D. serido y D. antonietae presentan placas metafásicas distintas (Baimai et al. 1983), patrones aloenzimáticos (A.C. Morales et al., datos no publicados, Mateus y Sene 2003), haplotipos mitocondriales (Manfrin et al. 2001) y ADN satélite (Kuhn y Sene 2005), comparten la misma inversión cromosómica fija 2x7 (Ruiz et al. 2000), lo que puede indicar una relación filogenética cercana. En términos morfológicos, solo variaciones cuantitativas pueden discriminar estas dos especies (Silva y Sene 1991, Moraes et al. 2004).
En este artículo, se analizaron los caracteres morfométricos del aedeago de especímenes de D. antonietae de varias poblaciones diferentes, cubriendo toda la distribución conocida de la especie, y de especímenes de D. serido provenientes de dos poblaciones diferentes. Hemos elegido estas especies porque se pueden diferenciar a través de marcadores genéticos y, al presentar un área de contacto secundaria, con una población en simpatría, con posible formación de híbridos en la región sur de Brasil. Además de las medidas de longitud del arco del aedeago, ya utilizadas en Silva y Sene (1991), también se utilizaron medidas de curvatura de estos arcos (Prado et al. 2004). Nuestros principales objetivos fueron introducir y probar el uso de las medidas de curvatura en las especies del grupo Drosophila buzzatii y determinar las regiones del aedeago que más contribuyeron a la discriminación de las especies D. serido y D. antonietae. Los datos discutidos aquí destacan la importancia de estas regiones del aedeago para futuras investigaciones con el fin de comprender la base genética del aedeago de las especies pertenecientes al grupo Drosophila buzzatii, así como para estudios del área de contacto entre las dos especies.
Materiales y métodos
Muestras
Se analizaron cincuenta y ocho aedeagos de la especie D. antonietae de varias poblaciones diferentes, representando toda la distribución, y 34 aedeagos de D. serido, pertenecientes a poblaciones ubicadas en Junco do Seridó/PB y Milagres/BA (localización tipo) (Tabla I). Todos los individuos analizados fueron recolectados en ambientes naturales (moscas capturadas en la naturaleza). Los aedeagos fueron preparados en secciones para microscopía óptica según Kaneshiro (1969). Todos los aedeagos utilizados en este artículo fueron depositados en el Laboratorio de Genética Evolutiva de la USP – Ribeirão Preto. Las imágenes de los aedeagos fueron ampliadas 200X y digitalizadas desde un microscopio (Axioplan2 Zeiss) equipado con el sistema de captura de imágenes digitales Axiovision Zeiss y almacenadas en una computadora.
Medición y Análisis Estadístico
Se definieron manualmente cinco puntos como hitos, de acuerdo con Silva y Sene (1991). Los hitos se utilizaron para establecer los contornos internos de la región en estudio; las regiones entre dos hitos adyacentes son los arcos (Figura 1b).
Al igual que en Silva y Sene (1991), se midió la longitud de los arcos I, II, III y IV del aedeago (Tabla II). Esto mide la distancia acumulada entre los hitos consecutivos. Además de esto, también realizamos medidas igualadas de la curvatura de los arcos. En resumen, la curvatura continua es una medida geométrica que expresa la tasa de cambio del ángulo entre la tangente de la curva y el eje x (Costa et al. 2004). Los valores de la curvatura igualada se generan a través de la estandarización por una sigmoide de la curvatura continua para amplificar los puntos de baja curvatura de la región de interés (Costa y Cesar 2000). Esta etapa permite maximizar la información sobre la curvatura de la estructura analizada. Para realizar los análisis, utilizamos los promedios de las curvaturas igualadas de los arcos I, II, III y IV del aedeago (Tabla II). Las medidas se obtuvieron de acuerdo con la metodología descrita por Prado et al. (2004).
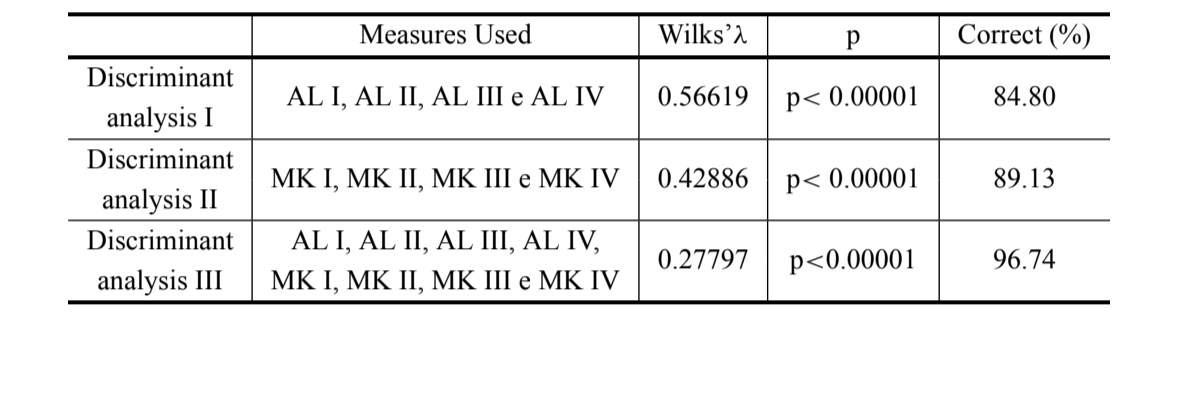
Realizamos tres análisis discriminantes distintos, utilizando únicamente las medidas de longitud del arco (discriminante I) y la curvatura media igualada (discriminante II) y un análisis discriminante utilizando todas las medidas juntas (discriminante III). Estos análisis se realizaron para obtener porcentajes correctos de clasificación de individuos, para verificar qué variables contribuyeron más a la discriminación de los grupos y para comparar el uso de las medidas de curvatura utilizadas con las medidas de la longitud del arco, realizadas previamente por Silva y Sene (1991). Los valores más bajos de lambda de Wilk (que varían de 0 a 1) indican un mejor análisis. Además de esto, con los datos del análisis discriminante III, se realizó un análisis de variables canónicas. El análisis de variables discriminantes y canónicas se realizó con el uso del software Splus (versión 1.8).
El valor absoluto de los coeficientes estandarizados canónicos, generados por el análisis de variables canónicas, representa el peso de cada variable en la formación de la raíz canónica, donde los valores más altos corresponden a la mayor diferenciación entre grupos. Estos coeficientes se presentarán para mostrar la contribución relativa de cada variable en la formación de la raíz canónica obtenida y para determinar qué variable es la más importante para la discriminación de los grupos.
Además del análisis multivariado, la medida más importante para la discriminación de las especies se utilizó de manera individual para obtener el porcentaje correcto de clasificación de los individuos a través del método de clasificación bayesiana (Duda et al. 2000). Para ello, se establecieron curvas normales a partir de la media y la desviación estándar de cada grupo en relación con la variable, definiendo la densidad de función y la probabilidad utilizadas en el análisis bayesiano.
Resultados
Los resultados de los tres análisis discriminantes realizados se muestran en la Tabla III. La discriminación entre D. antonietae y D. serido es mayor cuando se utilizan las longitudes del arco del aedeago junto con las medidas de curvatura (discriminante III) (λ de Wilks = 0.27797; p<0.00001), donde el 96.74% de los individuos se clasifican correctamente (Tabla III), la clasificación correcta de D. antonietae es del 98.30% y la de D. serido es del 94.10%.
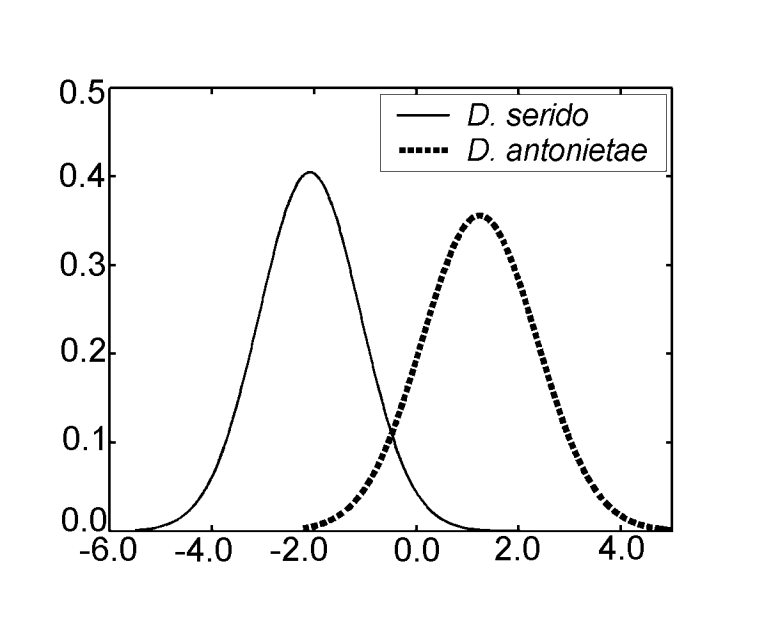
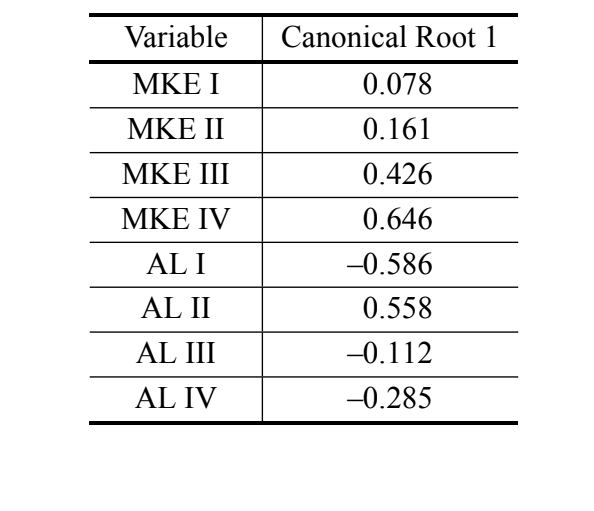
Solo se obtuvo un eje canónico en el análisis de las variables canónicas utilizando las medidas del análisis discriminante III. Los coeficientes canónicos estandarizados (el peso de cada variable) se muestran en la Tabla IV. Los valores absolutos de estos coeficientes indican que la variable más importante para la formación de la raíz canónica fue MKE IV, mientras que la menos importante fue la variable MKE I. Las curvas normales obtenidas por la media y la desviación estándar de los dos grupos en relación con las puntuaciones canónicas se muestran en la Figura 2, en la que podemos observar la discriminación entre D. antonietae (puntuaciones canónicas más altas) y D. serido (puntuaciones canónicas más bajas).
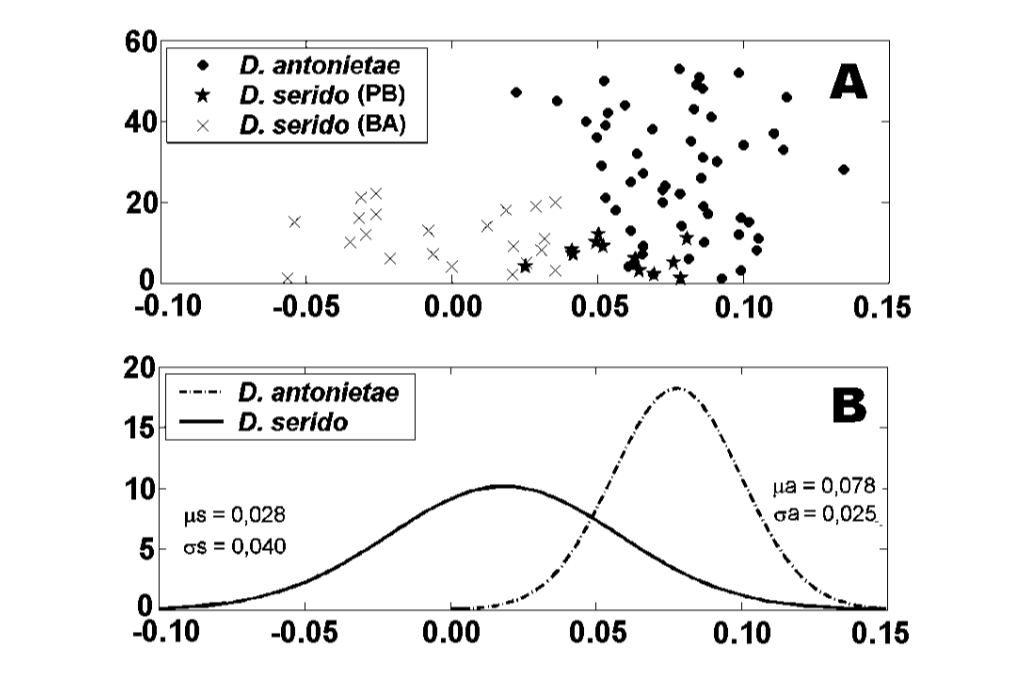
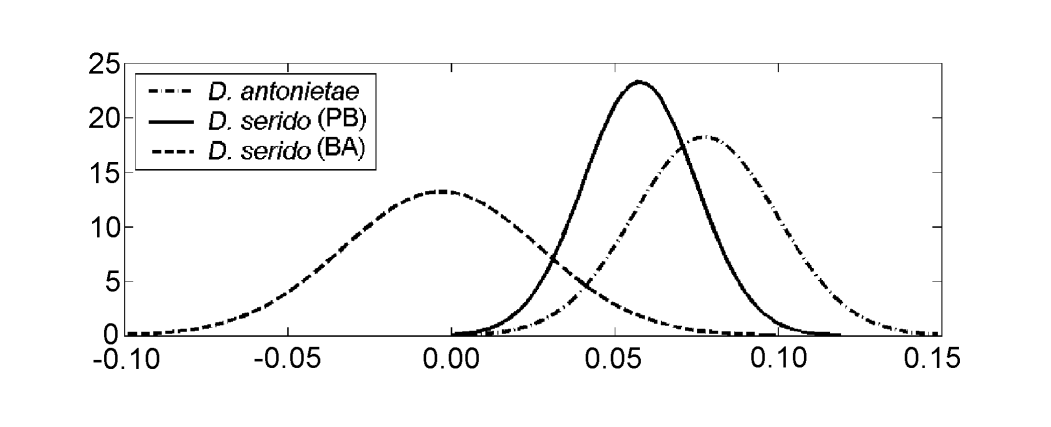
Los valores para cada individuo obtenidos del análisis de MKE IV se muestran en la Figura 3a. En relación con esta medida, D. serido tiene una mayor variación alrededor de la media (desviación estándar = 0.04) que D. antonietae (desviación estándar = 0.025) (Figura 3b), principalmente porque hay diferencias significativas en relación con esta medida entre ambas poblaciones que componen la muestra de D. serido (Figura 3a; Figura 4).
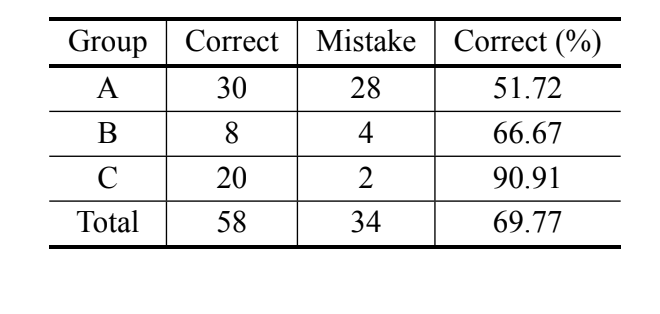
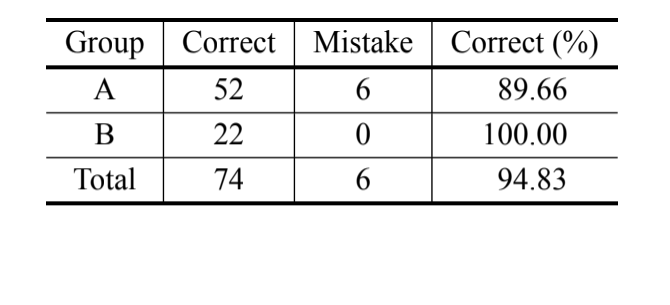
De acuerdo con el análisis bayesiano, basado únicamente en la medida de MKE IV, el 69.8% de los individuos fueron clasificados correctamente y más del 90% de los individuos de D. serido de Milagres/BA fueron clasificados correctamente. Sin embargo, se observó un alto porcentaje de errores en los individuos de D. serido de Junco do Seridó/PB y
D. antonietae (Tabla V). El mismo análisis se realizó sin los individuos de D. serido de Junco do Seridó/PB y el porcentaje de clasificaciones correctas fue del 94.83% (Tabla VI), mostrando una divergencia extrema entre los individuos de la población de D. serido de Milagres/BA y D. antonietae basado en MKE IV.
Discusión
Nuestros datos confirman la existencia de diferencias cuantitativas en las características morfológicas del aedeagus de los individuos analizados, lo que hace posible la discriminación de D. serido de D. antonietae. Además, la curvatura media igualada del arco IV (MKE IV) fue la variable que más contribuyó a la discriminación de los grupos (Tabla IV).
La longitud de los primeros cuatro arcos del aedeagus ya se había utilizado con éxito en la discriminación de especies del grupo Drosophila buzzatii , incluyendo entre ellas D. serido y D. antonietae (aedeagus Tipo A y D, respectivamente en Silva y Sene 1991). En este artículo encontramos un aumento considerable en la discriminación de los grupos al agregar medidas de curvatura media igualada en el análisis morfométrico, donde el 96.74% de los individuos están correctamente clasificados (Tabla III). Así, las mediciones de curvatura media igualada son importantes para la discriminación de D. antonietae y D. serido y pueden ser útiles en el estudio de una zona de simpatría entre estas especies en la región sur de Brasil. Dado que las medidas de curvatura no tienen en cuenta el tamaño de la estructura, es posible inferir que pequeñas alteraciones cuantitativas en la forma del aedeagus, especialmente en la región del arco IV, pueden haber ocurrido desde el evento de cladogénesis de las especies D. serido y D. antonietae .
Hay una divergencia morfológica significativa en relación con MKE IV entre D. antonietae y D. serido, ya que D. antonietae muestra relativamente menos variación alrededor del promedio que D. serido (Figura 3b). Se analizaron individuos de diferentes poblaciones, representando toda el área de distribución de las poblaciones de D. antonietae (Tabla I); en esta muestra, los datos sugieren que hay homogeneidad entre las poblaciones de D. antonietae . Monteiro y Sene (1995) analizaron la morfología del aedeagus de individuos de varias poblaciones de
D. antonietae a través del método morfométrico de red de truss y tampoco observaron las diferencias morfológicas entre ellos. Los patrones aloenzimáticos (Mateus y Sene 2003) y de microsatélites (L.P.B. Machado et al., datos no publicados) también mostraron homogeneidad entre las diferentes poblaciones de D. antonietae. Estos resultados sugieren flujo genético entre las poblaciones de D. antonietae, favorecido por la asociación de esta especie y su cactus huésped, Cereus hildmaniannus que se encuentra en bosques de galería mesófilos a lo largo de los ríos de la cuenca del Paraná-Paraguay, que forman corredores de migración para individuos de la especie D. antonietae (Monteiro y Sene 1995).
Drosophila serido tiene, comparativamente, una mayor variación interespecífica en relación con MKE IV que con D. antonietae (Figura 3b), como se puede observar en las diferencias encontradas entre los individuos de las poblaciones de Junco do Seridó/PB y Milagres/BA. Los individuos de D. serido de la población de Junco do Seridó/PB tienen valores intermedios para MKE IV de los encontrados para las poblaciones de D. serido en Milagres/BA y las poblaciones de D. antonietae analizadas (Figura 4). Estos datos sugieren una diferenciación morfológica entre ambas poblaciones de D. serido, probablemente debido a la restricción del flujo genético entre ellas. Hay un gran río entre los estados brasileños de Bahia y Pernambuco, el río São Francisco, que podría estar actuando como una barrera geográfica, impidiendo el flujo genético entre las poblaciones de D. serido analizadas en este artículo. Las divergencias morfológicas entre las poblaciones de D. serido están de acuerdo con otros trabajos, siendo que esta especie es politépica en relación con otros marcadores. Las poblaciones del noreste de D. serido tienen placas metafásicas de Tipo I, mientras que algunas poblaciones costeras tienen placas metafásicas de Tipo III (Arraial do Cabo/RJ) y Tipo IV (Peruíbe/SP) (Baimai et al. 1983). En cuanto a las inversiones cromosómicas, aunque todas las poblaciones de D. serido comparten la inversión fija 2x7, cuatro inversiones polimórficas están restringidas a poblaciones del noreste (2a8, 2b8, 2c8 y 2d8) y dos inversiones fijas (2x8 y 2w8) ocurren en poblaciones costeras (Tosi y Sene 1989, Ruiz et al. 2000). Además, las poblaciones de D. serido del noreste de Brasil están parcialmente aisladas reproductivamente de la población de Arraial do Cabo/RJ a lo largo de la costa brasileña (N.M.V. Bizzo, datos no publicados). Estudios recientes también sugieren discriminación entre las poblaciones de D. serido en el noreste y la costa de Brasil basados en la diferenciación de haplotipos mitocondriales (A.C. Morales et al., datos no publicados).
La diferenciación entre poblaciones de la misma especie es un requisito importante en el proceso de especiación, por lo tanto, los estudios que involucran una variedad de poblaciones de una especie politépica, como D. serido, son importantes para cuantificar la divergencia morfológica en relación con la divergencia genética en poblaciones naturales.
No todos los arcos del aedeago son igualmente informativos en la discriminación de las especies. Según Silva y Sene (1991), los arcos II y III (Figura 1) son los más informativos para la discriminación de las especies en el grupo de Drosophila buzzatii. En comparación par a par, utilizando el método de red de truss, las medidas relacionadas con el arco III fueron las más significativas en la discriminación entre
D. antonietae y D. gouveai (Monteiro y Sene 1995). A través del análisis de la morfometría geométrica utilizando las medidas de curvatura, Prado et al. (2004) observaron que la curvatura y la longitud normalizada del arco III son medidas importantes en la discriminación entre las especies D. gouveai y D. antonietae. Nuestros datos muestran que MKE IV es el más importante en la discriminación de las especies D. serido y D. antonietae; y basándose únicamente en esta medida, es posible discriminar más del 94% de los individuos de D. serido de la población de Milagres/BA (localización tipo) de aquellos de D. antonietae (Tabla VI). Estos resultados muestran que la porción distal del aedeago (arco III + arco IV) presenta las mayores diferencias interespecíficas, independientemente de otras partes de este órgano, sugiriendo que esta región puede considerarse un “punto evolutivo caliente” (Kullikov et al. 2004) para el aedeago durante eventos de cladogénesis en el grupo de Drosophila buzzatii, pero esta cuestión aún permanece abierta a discusión.
Las variaciones morfométricas entre y dentro de los grupos de organismos reflejan la expresión de un fenotipo resultante de un control poligénico integrado, que se altera durante la cladogénesis y la evolución de los grupos (Falconer 1989). Además, varios factores epigenéticos y ambientales pueden afectar la formación de una estructura (Atchley et al. 1992), lo que dificulta la identificación de las causas de la divergencia morfológica entre poblaciones y especies. No obstante, los estudios morfométricos comparativos de las regiones homólogas de ambas especies, como los arcos del aedeago, son requisitos importantes para la comprensión de la base genética que controla la formación de esa región. Aunque la base genética del aedeago se está descubriendo para otros grupos de Drosophila (Liu et al. 1996), los genes que controlan la formación del aedeago en las especies del grupo Drosophila buzzatii aún no están establecidos. El alto porcentaje de corrección de los individuos analizados en este artículo, basado únicamente en el MKE IV, indica que la región del arco cuatro puede ser útil para futuros estudios sobre la comprensión de la base genética del aedeago en estas especies, ya que establecer caracteres morfológicos informativos entre distintos grupos taxonómicos es un paso preliminar en el estudio de QTL (Loci de Características Cuantitativas), una metodología para la detección, mapeo y estimación de efectos de algunos loci en las características métricas.
Autores: Fernando F. Franco, Pedro R.R. Prado, Fábio M. Sene, Luciano F. Costa y Maura H. Manfrin
Referencias
- Atchley WR, Cowley DE, Vogi C y Mc-Lellan T. 1992. Divergencia evolutiva, cambio de forma y estructura de correlación genética en la mandíbula de roedores. Syst Biol 41: 196–221.
- Baimai V, Sene FM y Pereira MAQR. 1983. Heterocromatina y diferenciación cariotípica de algunas especies de cactáceas neotropicales del grupo Drosophila repleta . Genetica 67: 81–92.
- Costa LF y Cesar RMJ. 2000. Análisis de forma y clasificación: teoría y práctica. CRC Press Book Series on Image Processing. Cambridge Univ Press, Nueva York, 659 p.
- Costa LF, dos Reis SF, Arantes RAT, Alves ACR y Multinari G. 2004. Análisis biológico de la forma mediante curvatura digital. Pattern Recognit 37: 515–524.
- Duda RO, Hart PE y Stork DG. 2000. Clasificación de patrones. J Wiley & Sons, Nueva York, EE. UU., 680 p.
- Falconer DS. 1989. Introducción a la genética cuantitativa. 2ª ed., Londres: Longman.
- Kaneshiro KY. 1969. Un estudio de las relaciones de las especies de Drosophila de Hawái basado en los genitales externos masculinos. Univ Texas Publ 6918: 55–70.
- Kuhn GCS y Sene FM. 2005. Rotación evolutiva de dos subfamilias de ADN satélite pBuM en el grupo de especies Drosophila buzzatii (grupo repleta ): de alpha a alpha/beta arrays. Gene 349: 77–85.
- Kullikov AM, Melnikov AI, Gornostaev NG, Lazebny OE y Mitrofanov VG. 2004. Análisis morfológico del órgano de apareamiento masculino en el grupo de especies Drosophila virilis : un enfoque multivariado. J Zool. Syst Evol Res 42: 135–144.
- Liu J, Mercer JM, Stam LF, Gibson GC, Zeng Zhao-Bang y Laurie CC. 1996. Análisis genético de una diferencia morfológica en los genitales masculinos de Drosophila simulans y D. mauritiana. Genetics 142: 1129–1145.
- Manfrin MH, Brito ROA y Sene FM. 2001. Sistemática y evolución del grupo Drosophila buzzatii (Diptera; Drosophilidade) utilizando mtDNA. Ann Entomol Soc Am 94: 333–346.
- Mateus RP y Sene FM. 2003. Variación alozima temporal y espacial en el Drosophila antonietae cactófilo sudamericano (Diptera; Drosophilidae). Biochem Genet 41: 219–233.
- Monteiro SG y Sene FM. 1995. Estudio morfométrico de poblaciones de Drosophila serido de las regiones Central y Sur de Brasil. Rev Bras Genet 18 (Suppl.): 283.
- Moraes EM, Spressola VL, Prado PRR, Costa LF y Sene FM. 2004. Divergencia en la morfología de las alas entre especies hermanas del grupo buzzatii . J Zool Syst Evol Res 42: 154–158.
- Moreteau B, Gibert P, Pétavy G, Moereteau JC, Huey RB y David JR. 2003. Evolución morfométrica en un clado de Drosophila : el grupo Drosophila obscure . J Zool Syst Evol Res 41: 64–71.
- Pereira MAQR, Vilela CR y Sene FM. 1983. Notas sobre sitios de cría y alimentación de algunas especies del grupo repleta del género Drosophila (Diptera; Drosophilidae). Cienc Cult 35: 1313–1319.
- Prado PRP, Franco FF, Manfrin MH, Costa LF y Sene FM. 2004. Una forma fácil y rápida de analizar caracteres morfométricos. Proc Third Braz Symp Mathem Comp Biol 1: 329–340.
- Ruiz A, Cassian AM, Kuhn GCS, Alves Maqr y Sene FM. 2000. El rompecabezas de especiación de Drosophila serido : juntando nuevas piezas. Genetica 108: 217–227.
- Silva AFG y Sene FM. 1991. Variabilidad geográfica morfológica en Drosophila serido (Diptera; Drosophilidae). Rev Bras Entomol 35: 455–468.
- Tidon-Sklorz R y Sene FM. 1995. Evolución del grupo buzzatii (grupo de especies Drosophila repleta) en el centro de América del Sur. Evolución Biológica 9: 71–85.
- Tidon-Sklorz R y Sene FM. 2001. Dos nuevas especies del conjunto de hermanos de Drosophila serido (Diptera; Drosophilidae). Iheringia 90: 141–146.
- Tosi D y Sene FM. 1989. Estudios adicionales sobre variabilidad cromosómica en el taxón complejo Drosophila serido (Diptera; Drosophilidae). Rev Bras Genet 12: 729–745.
- Vilela CR. 1983. Una revisión del grupo de especies Drosophila repleta (Diptera; Drosophilidae). Rev Bras Entomol 27: 1–114.
- Vilela CR y Sene FM. 1977. Dos nuevas especies neotropicales del grupo repleta del género Drosophila (Diptera; Drosophilidae). Papéis Avulsos de Zoologia 30: 295–299.
