Efectividad del fibrinógeno rico en plaquetas de silicio y hueso autólogo en la regeneración ósea en defectos calvarios de conejo: un estudio radiológico e histológico.
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen: La reparación de defectos óseos en Cirugía Oral a menudo requiere el uso de técnicas de regeneración ósea. El silicio es un elemento que se ha empleado como material de regeneración en varios estudios. En nuestro estudio, el silicio se combinó con hueso autólogo y membranas de fibrina rica en plaquetas (PRF) para analizar el comportamiento de este elemento en la regeneración ósea. Se crearon cuatro defectos circunferenciales en la bóveda craneal de 5 conejos de Nueva Zelanda. Se aplicaron los siguientes elementos a la regeneración de los defectos: (P): PRF; (S): silicio y (B): hueso autólogo, con la siguiente distribución de grupos de estudio: Grupo 1 (PSB); Grupo 2 (PS); Grupo 3 (SB) y Grupo 4 (CONTROL): grupo no regenerado. Los animales fueron sacrificados después de 3 semanas. Se realizaron estudios de microtomografía computarizada (μ-CT), así como estudios histomorfométricos. Se utilizó la prueba estadística ANOVA con una prueba post-hoc de Bonferroni para comparar los resultados (p≤ 0.05). Radiológicamente, los grupos PSB y SB fueron mejores en cuanto a la cantidad y porcentaje de hueso sano observado, pero no significativamente en comparación con el grupo de control. El grupo PS fue significativamente peor. La prueba histológica reveló que el grupo PSB fue el que presentó la mayor área, porcentaje y perímetro de hueso mineralizado. Al evaluar el hueso en formación (osteoid), no se observó diferencia entre los grupos, con la excepción del perímetro óseo, donde el grupo SB fue significativamente mejor. La variable de altura ósea no mostró diferencias significativas. En conclusión, podemos afirmar que la combinación de PRF, hueso autólogo y silicio proporciona buenos resultados a las 3 semanas, mientras que el grupo PS muestra los peores resultados. Esto resalta la importancia de que el hueso autólogo forme parte del material de injerto para que el hueso se mineralice.
Introducción
Los defectos óseos en la cirugía oral son comunes y a veces difíciles de reparar, requiriendo técnicas de regeneración ósea para asegurar el éxito del tratamiento restaurador. La investigación científica continúa avanzando en la comprensión de los procesos biológicos y fisiológicos involucrados en la curación, regeneración y remodelación ósea. La ingeniería de tejidos in vivo abarca la regeneración y reconstrucción de tejidos y órganos en el propio cuerpo. La premisa básica es que la manipulación controlada del microambiente extracelular puede llevar a controlar la capacidad de las células para organizarse, crecer, diferenciarse y formar una matriz extracelular funcional y, finalmente, nuevo tejido funcional.
Las técnicas regenerativas se han convertido en procedimientos rutinarios y con resultados clínicos probados, pero su predictibilidad y tiempo de espera siguen siendo algunos de los factores que impulsan la investigación en el desarrollo de nuevos y mejorados materiales para la regeneración ósea. El hueso autólogo y el plasma rico en plaquetas son dos materiales ampliamente utilizados en el campo de la implantología para regenerar tejido blando y duro. Sin embargo, aún no se ha desarrollado un material que combine todas las ventajas de cada uno de ellos por separado.
El uso de hueso autólogo está ampliamente descrito en la literatura ya que se considera el estándar de oro para la regeneración ósea. No obstante, a pesar de que tiene excelentes propiedades biológicas de osteoinducción, osteoconducción y osteogénesis, el injerto autólogo presenta una morbilidad considerable y una tasa de resorción elevada e impredecible, pero ha demostrado que su comportamiento mejora en combinación con otros sustitutos óseos, obteniendo un volumen más abundante y consistente a lo largo del tiempo y una curación ósea más rápida.
Junto con el hueso autólogo, los derivados sanguíneos ricos en plaquetas también se utilizan frecuentemente en la regeneración de tejidos. Entre estos derivados se encuentra el fibrina rica en plaquetas [PRF]. Es un biomaterial regenerativo ampliamente utilizado en diversas aplicaciones médicas. Además, ha ganado mayor popularidad en comparación con el plasma rico en plaquetas [PRP] porque es una técnica de un solo paso a la que no es necesario añadir sustancias químicas. Otra ventaja es la liberación gradual de factores de crecimiento a lo largo del tiempo. Una sola membrana de fibrina contiene una gran cantidad de factores de crecimiento y citoquinas involucradas en la regeneración ósea y la maduración de tejidos blandos. Es un biomaterial fácilmente manipulable que en Cirugía Oral se aplica en terapia periodontal, preservación alveolar, procedimientos de aumento óseo quirúrgico y, en combinación con injertos óseos, en cirugía de elevación del seno maxilar. Su última aplicación, aún no probada clínicamente, es como desinfectante para superficies de titanio rugosas debido a sus propiedades antimicrobianas.
Finalmente, hay varias publicaciones que afirman que los iones bioinorgánicos como el zinc, el manganeso, el magnesio o el silicio son esenciales en el metabolismo óseo. El silicio es el segundo elemento más abundante en la corteza terrestre y en el cuerpo humano se encuentra principalmente en áreas de mineralización y crecimiento óseo. Desempeña un papel vital en la biología del hueso y del tejido conectivo, y aunque su mecanismo de acción no se comprende exactamente, gracias a la investigación de Carlisle y Schwarz se sabe que actúa produciendo una mayor mineralización en la matriz ósea a través de la síntesis y estabilización del entrecruzamiento de las fibras de colágeno. El silicio es un factor iniciador en la mineralización ósea ya que está presente en concentraciones elevadas en la matriz osteoide del hueso inmaduro y, a medida que el hueso madura, la concentración de silicio se ve disminuida por la concentración de calcio. Se ha utilizado a lo largo de los años como material regenerativo óseo en forma de recubrimiento de implantes dentales, así como también se ha incorporado en biomateriales cerámicos [hidroxiapatita, fosfato tricálcico o cerámicas vítreas] proporcionando buenos resultados en cuanto a la regeneración ósea en estudios in vitro e in vivo. Este buen comportamiento se debe a su fuerte unión. El silicio se ha empleado junto con otros biomateriales como cerámicas vítreas o apatita o con fosfato tricálcico [TCP] para mejorar las propiedades biológicas de los materiales con los que se une. Sin embargo, hasta donde sabemos, no hay estudios con hueso debido a la formación de una capa biológicamente activa, similar a la apatita, en su superficie.
El silicio se ha empleado junto con otros biomateriales como cerámicas de vidrio o apatito o con fosfato tricálcico [TCP] para mejorar las propiedades biológicas de los materiales con los que se une. Sin embargo, hasta donde sabemos, no se han encontrado estudios sobre el uso de silicio en combinación con hueso autólogo o con membranas de fibrina rica en plaquetas para su uso en regeneración ósea.
En nuestro estudio, el silicio se combinó con hueso autólogo y membranas de PRF con el fin de analizar el papel de este elemento en la regeneración ósea cuando se combina con otros biomateriales de uso común. El objetivo principal fue evaluar la regeneración ósea obtenida en los diferentes grupos analizados (siendo estos (P): PRF; (S): silicio y (B): hueso autólogo, con una distribución de grupos de estudio como sigue: Grupo 1 (PSB); Grupo 2 (PS); Grupo 3 (SB) y Grupo 4 (CONTROL): grupo no regenerado) durante un período de 3 semanas en un modelo de prueba animal.
Materiales y Métodos
Especímenes de animales de prueba
El estudio experimental se llevó a cabo en el hueso parietal de 5 conejos de laboratorio de Nueva Zelanda de 6 meses de edad y con un peso entre 3.5-4 kg. Los animales fueron alimentados diariamente (ad libitum) con una dieta para animales de laboratorio utilizando Harlan-Teklad (2030). Los animales fueron sometidos a cirugía bajo anestesia general en el Centro Quirúrgico Mínimamente Invasivo Jesús Usón, [Cáceres, Extremadura, España]. El experimento se realizó de acuerdo con las directrices del Instituto Nacional de Salud de España (NIH) y la Directiva Europea 86/609/EEC sobre el cuidado y uso de animales experimentales. El estudio también cumplió con la Directiva Europea 2010/63/EU sobre la protección de los animales utilizados para fines experimentales y todas las leyes y regulaciones locales. Los investigadores obtuvieron la aprobación del Comité Ético de la Institución (CCMI-Ref 028/16). La identificación de los animales que conforman los grupos a evaluar se realizó utilizando un chip. Durante el período experimental, los especímenes se mantuvieron en jaulas individuales.
Procedimiento quirúrgico
Antes de iniciar el procedimiento quirúrgico, se realizó la inmovilización de los conejos y se registraron sus signos vitales. Los anestésicos empleados fueron midazolam intravenoso (0.25 mg / kg) y propofol (5 mg / kg) y gas sevoflurano inhalado al 2.8%. Se utilizaron dos analgésicos: tramadol (3 mg / kg) y ketorolaco (1.5 mg / kg). Después de la sedación, se extrajo una muestra de sangre retro-orbital de cada conejo utilizando una aguja mariposa. Dichas muestras se colocaron en tubos de ensayo sin anticoagulante y se centrifugaron durante 12 minutos a una velocidad de 2700 rpm a temperatura ambiente para obtener membranas de PRF. Una vez obtenidas las membranas, se cortaron en pequeñas porciones de aproximadamente 2 mm de diámetro para ser divididas en tres partes que se utilizaron posteriormente para los tres grupos experimentales. Se utilizó 0.01 mg por cc de versenato de silicio. (Laboratorio de Energía Natural de Venezuela, Caracas, Venezuela).
Se lograron cuatro defectos óseos no autoinmunes (diámetro: 9 mm; profundidad: aproximadamente 3 mm, hasta alcanzar la duramadre) en el hueso parietal, a cada lado de la línea media del cráneo, utilizando un trefina (Helmut-Zepf Medical GmbH, Seitingen, Alemania) montada en un micromotor quirúrgico a 2000 rpm bajo irrigación con solución salina. Se utilizaron instrumentos piezoeléctricos para eliminar la tabla interna y el hueso medular de cada defecto. La profundidad se controló con una sonda periodontal. Una vez realizados los defectos, el hueso obtenido fue triturado y el material obtenido se dividió en dos partes iguales. La configuración de los grupos fue la siguiente: Grupo 1 (PSB): mezcla de membrana de fibrina rica en plaquetas (P) + silicio (S) + hueso autólogo (B); Grupo 2 (PS): membrana de fibrina rica en plaquetas (P) + silicio (S); Grupo 3 (SB): silicio (S) + hueso autólogo (B) y por último Grupo 4 (CONTROL) en el que no se colocó material regenerativo. La distribución de los grupos en el hueso parietal se puede ver en la Tabla 1.
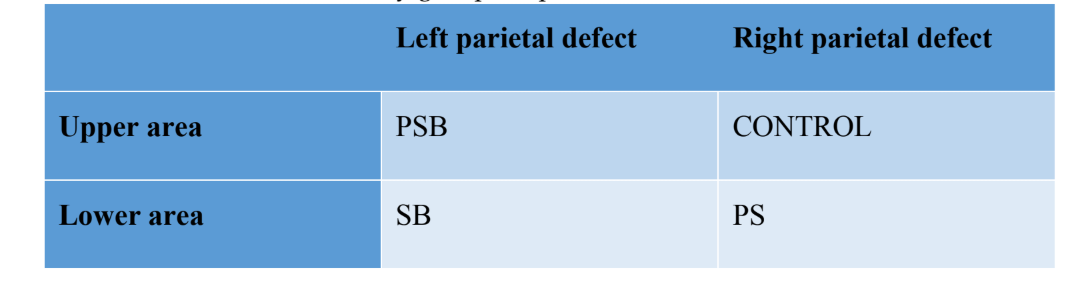
Después de la sutura, se administraron agentes antiinflamatorios y analgésicos (carprofeno 1 ml / 12.5 kg y buprenorfina 0.05 mg / kg). Finalmente, los animales fueron sacrificados utilizando una sobredosis intravenosa de cloruro de potasio después de 3 semanas. El procedimiento quirúrgico se puede ver en la Figura 1.
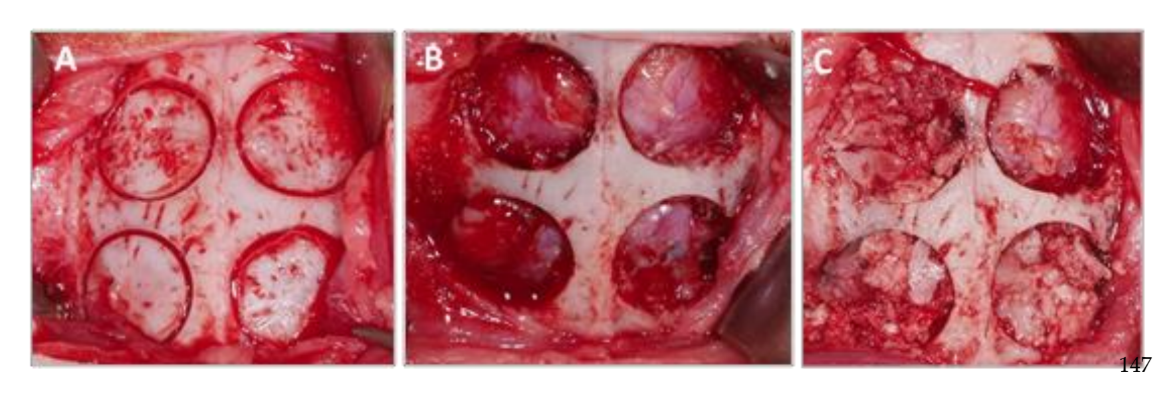
Las muestras obtenidas de la bóveda craneal de cada espécimen se cortaron en el plano sagital anatómico, y después de separarse de la masa cerebral y lavarse en solución salina fisiológica, las piezas se cortaron y marcaron individualmente. Cada una de las muestras se sumergió en una solución de formalina al 10% para análisis tomográfico e histomorfométrico.
Tomografía microcomputada (micro-CT)
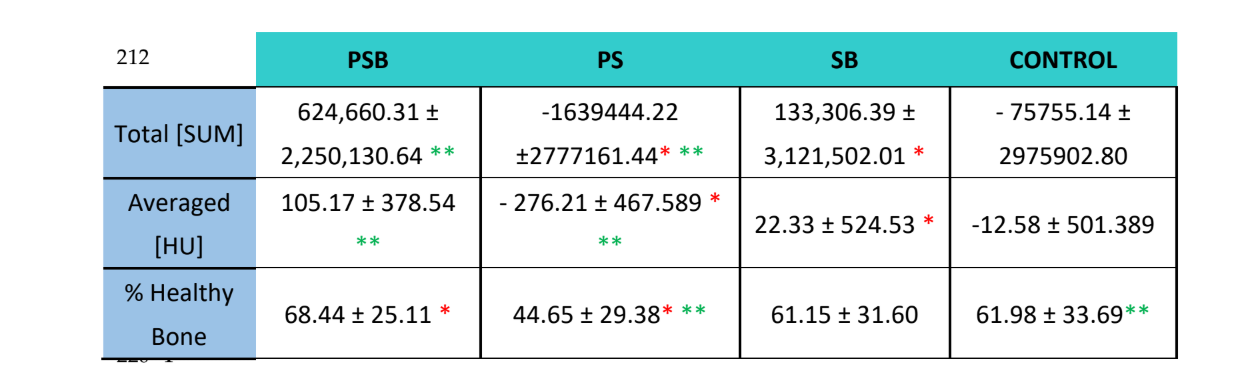
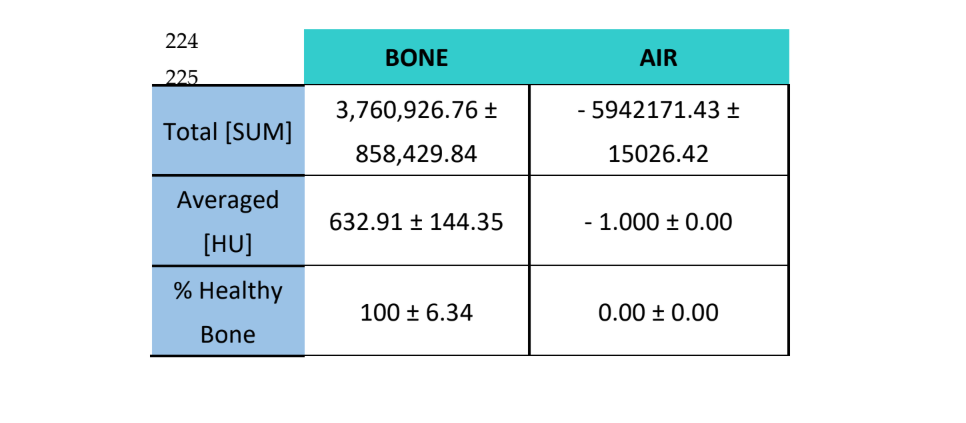
Las muestras fueron analizadas utilizando Tomografía Computarizada (CT) con un escáner CT Bruker Albira (Bruker Co., Billerica, MA, EE. UU.). Las adquisiciones se realizaron utilizando los siguientes parámetros: 1000 imágenes, en proyección radiográfica de 360°, a 45 kV y 30 minutos de tiempo de adquisición. La reconstrucción tomográfica se llevó a cabo utilizando el software Albira Suite (Bruker Co., Billerica, MA, EE. UU.) y parámetros de reconstrucción estándar para generar volúmenes 2D y 3D con una resolución de 8.3 voxeles/mm. La densidad ósea promedio medida en Unidades Hounsfield (HU) fue evaluada utilizando el software PMOD (Bruker Co., Billerica, MA, EE. UU.), posicionando volúmenes esféricos de interés [VOI] de 2 mm en una formación de roseta dentro de cada lesión. Se realizaron reconstrucciones de alta resolución de un volumen de 10 mm3 en cada lesión utilizando el software Albira Suite, dando lugar a volúmenes con una resolución de 20 voxeles / mm. Para cada uno de los volúmenes se evaluaron las siguientes variables: (1) La suma total de los valores Hounsfield de todos los voxeles (SUMA TOTAL), (2) el promedio de todos los valores Hounsfield de los voxeles (Promedio) en unidades Hounsfield y (3) el porcentaje de hueso sano (%).
Estas mismas variables se evaluaron para el aire ̶ como una medida para establecer el ruido de fondo de las imágenes ̶ y para el hueso circundante, en el cual el porcentaje de hueso sano esperado es del 100%.
Procesamiento histológico de la muestra
Se obtuvieron muestras del cráneo de cada muestra, cortando a lo largo del plano sagital anatómico. Las muestras deshidratadas se sumergieron inmediatamente en una solución de formaldehído al 4% y calcio al 1% incrustadas en resina acrílica y se procesaron para cortes siguiendo el método de Donath y Breuner para obtener cortes histológicos de 5µm de grosor. Las muestras se tiñeron con Von Kossa (VK) nitrato de plata al 5% (Sigma-Aldrich Chemical Co., Poole, Reino Unido) para visualizar el hueso mineralizado después de 3 semanas y se observaron utilizando un microscopio óptico Olympus BXB61 (Olympus, Tokio, Japón) con lentes de 1.5 y 20x. Las imágenes se tomaron utilizando un procesador de señal digital DSP DS-Fi1 (Nikon, Tokio, Japón) en conjunto con el software NIS-Elements 4.0 BR (Nikon, Tokio, Japón). Se tomó una imagen de cada defecto óseo. Una semana antes de sacrificar a los especímenes (a las 2 semanas) se administró un marcador fluorescente a los conejos para observar la deposición de calceína en la matriz ósea recientemente depositada. Las imágenes fluorescentes se tomaron utilizando una cámara DSP DS-Fi1 [Nikon, Tokio, Japón] en conjunto con el software NIS-Elements 4.0 BR [Nikon, Tokio, Japón].
Para ambos tipos de tinciones (VK e inmunofluorescencia) se analizaron cuatro variables: altura ósea (solo en VK) (mm) (BH), área ósea (µm2) (BA), porcentaje de área ósea (%) (BA) y perímetro óseo (µm) (BP).
Análisis estadístico
Para el análisis estadístico de los resultados obtenidos se aplicó la prueba t de ANOVA con un posterior test de Bonferroni para comparar los resultados obtenidos en ambos grupos de estudio, utilizando el software STATVIEW F-4.5. Los resultados se expresaron como mediana ± desviación estándar para todas las variables analizadas. El nivel de significancia se estableció en p ≤ 0.05.
Resultados
Resultados para variables radiológicas
Utilizando el software Albira Suite, se obtuvieron reconstrucciones en 2D y 3D de alta definición (Figura 2) y se midieron las variables de cuantificación ósea, en las cuales después de 3 semanas no hubo diferencias estadísticamente significativas entre los grupos PSB, SB y CONTROL en las variables Total SUM, Promedio y % Hueso Saludable. El grupo PS fue el que obtuvo los valores menos significativos para estas tres variables (Tablas 2 y 3).
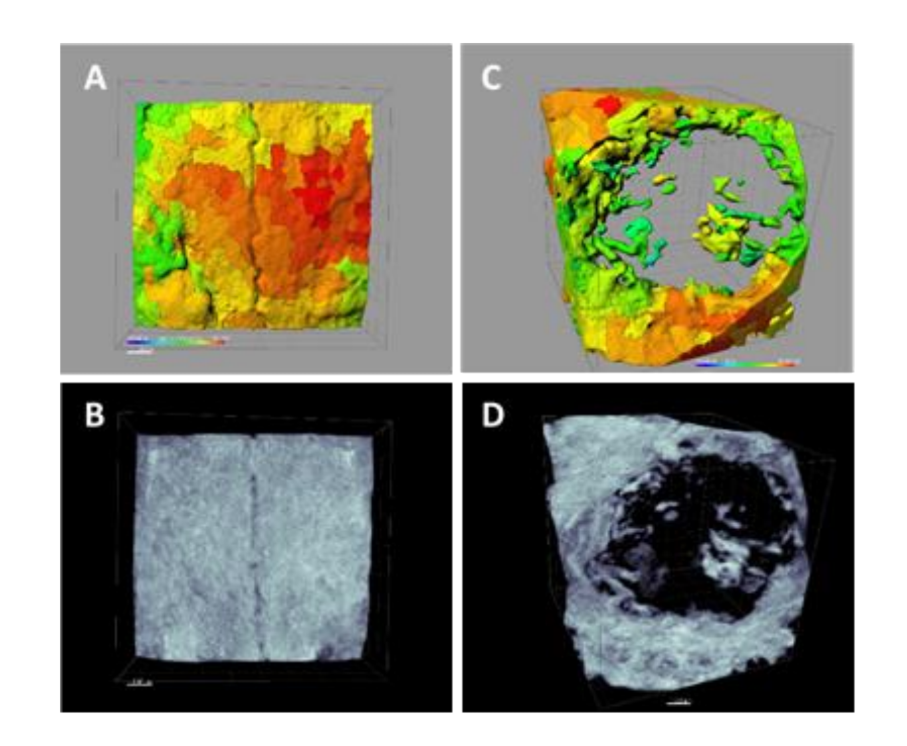
Tres semanas después se realizaron evaluaciones histológicas de los cuatro grupos (Tabla 4). La variable de altura ósea no mostró diferencias estadísticamente significativas entre los grupos después de 3 semanas de curación.
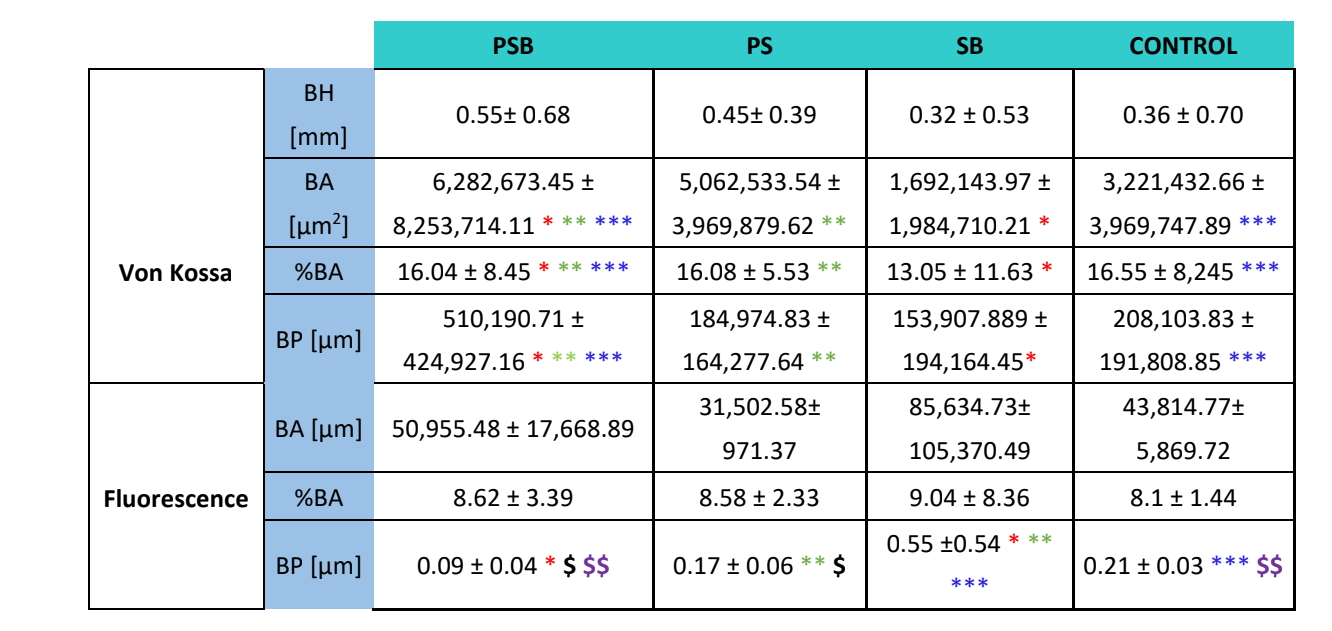
Se realizaron dos tinciones histológicas, Von Kossa y fluorescencia (Figura 4). La primera se utilizó para observar hueso mineralizado. Se observaron el área ósea [BA], el porcentaje de área [%BA] y el perímetro óseo [BP]. La tinción de Von Kossa reveló que el grupo PSB presentó un BA y BP estadísticamente más altos que los otros grupos. El %BA fue mayor en el grupo CONTROL, aunque no significativamente en comparación con todos los grupos, siendo el tamaño de la muestra muy pequeño.
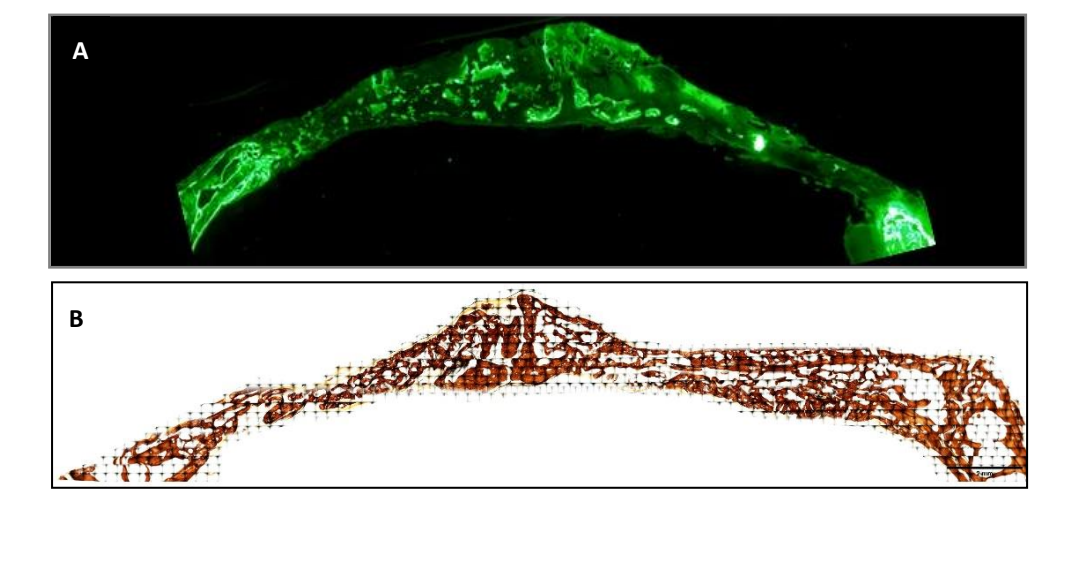
Se empleó la tinción por fluorescencia para medir las variables mencionadas anteriormente en el hueso recién depositado. No se observaron diferencias estadísticamente significativas entre los grupos para las variables BA y %BA después de 3 semanas. En el grupo SB, el perímetro óseo fue significativamente mayor, siendo el grupo PSB el que mostró un valor significativamente más bajo.
Discusión
En este estudio radiológico e histológico, observamos el hueso formado después de la colocación de diferentes materiales regenerativos óseos a los que se añadió silicio para evaluar su papel como estimulador de la formación ósea.
En el estudio radiológico (Tabla 2) se observó que los grupos PSB y SB mostraron valores más altos en términos de la cantidad y porcentaje de hueso sano observado. Sin embargo, estas diferencias no fueron estadísticamente significativas con respecto al grupo CONTROL. Por otro lado, el grupo PS presentó valores significativamente más bajos en comparación con el resto de los grupos.
El estudio histológico (Tabla 4) reveló que el grupo PSB fue el que presentó la mayor área, porcentaje y perímetro de hueso mineralizado en comparación con los otros grupos. Por el contrario, al evaluar la deposición de calceína en la matriz ósea, no se observó diferencia entre los grupos en cuanto al área ósea y el porcentaje de área. El grupo SB presentó un perímetro óseo significativamente mayor. La variable de altura ósea no mostró diferencias entre los grupos.
El silicio es un ion bioinorgánico que se ha empleado como material regenerativo en varios estudios, generalmente con otros biomateriales inorgánicos como el fosfato de calcio o la hidroxiapatita. Las ventajas que ofrecen son un bajo costo y una vida útil más larga. La bioactividad del silicio dependerá de la acumulación de iones de silicio cuando se expone a fluidos corporales, como la sangre en el caso de este estudio. Este fenómeno dio lugar a la formación de una capa similar a la apatita biológicamente activa.
Hasta donde sabemos, no hay evidencia en la literatura del uso de versenato de silicio como material regenerativo, por lo que la comparación con otros estudios debe realizarse con precaución.
El método que se emplea generalmente se lleva a cabo sustituyendo hidroxiapatita o fosfato de calcio por silicio mediante métodos de precipitación, lo que permite obtener biomateriales regenerativos con mejores propiedades. Varios estudios in vitro han demostrado que el silicio es un elemento biocompatible y bioinerte. Además, promueve la angiogénesis, la diferenciación osteoblástica y aumenta la densidad mineral ósea, acelerando su formación. En un estudio reciente, se regeneraron defectos en las bóvedas craneales de ratas y, después de 4 semanas, se observó que se produjo una formación ósea significativamente mayor en comparación con una mezcla similar a la que no se le había añadido silicio.
Asimismo, se han llevado a cabo estudios mixtos in vitro y in vivo en los que ha sido posible comparar el comportamiento del silicio en ambas situaciones. Mao et al realizaron un estudio en el que se añadió silicio a una mezcla de fosfato de calcio y cerámica vítrea para regenerar defectos en las bóvedas craneales de conejos. Se observó una viabilidad celular similar a la que se presenta en hueso esponjoso bovino, pero con una mayor tasa de proliferación celular. Todo esto se atribuyó a la inclusión de iones de silicio, que también potenciaron otras funciones celulares como la adhesión celular. En el estudio histológico realizado, se observó un aumento en la formación de nuevo hueso en el grupo experimental.
De acuerdo con la literatura revisada, se esperaría encontrar una mayor cantidad de hueso mineralizado en los grupos que contienen silicio. En nuestro estudio, los grupos PS y SB no mostraron diferencia en comparación con el grupo de control, siendo la combinación de silicio, fibrina rica en plaquetas y hueso autólogo [el grupo PSB] la que permitió un nivel significativamente más alto de hueso mineralizado que el resto.
El hueso autólogo sigue siendo considerado el material de referencia para la regeneración, ya que es el único que posee propiedades osteogénicas, osteoinductivas y osteoconductivas, lo que le otorga una ventaja en comparación con el resto de los materiales disponibles. No obstante, su disponibilidad limitada, morbilidad y su mayor tasa de reabsorción han impulsado la búsqueda de nuevos biomateriales.
En nuestro estudio, el hueso autólogo combinado con silicio [SB] no mostró diferencia significativa en comparación con los grupos PS y de control en lo que respecta al hueso calcificado. Sin embargo, fue, después del grupo PSB, el que presentó una mayor cantidad de hueso y el que presentó un mayor perímetro óseo de hueso osteoide. No hay publicaciones en las que alguno de los grupos de estudio haya empleado hueso autólogo con silicio; y nuestros resultados preliminares sugieren que necesitaríamos ver cómo se comporta el hueso autólogo durante períodos más largos.
El plasma rico en fibrina se ha utilizado anteriormente en la regeneración ósea como el único material de relleno, o en combinación con hueso autólogo, injertos xenogénicos o injertos aloplásticos, proporcionando mejores resultados en cuanto a la regeneración ósea y una curación más rápida en comparación con grupos de control negativos. Sin embargo, hay evidencia limitada sobre la combinación de silicio y concentrados ricos en plaquetas. Solo se han encontrado dos estudios en la literatura que combinan ambos materiales. Sus resultados difieren y también con los nuestros. En el primer estudio, una combinación de PRP/silicio fue posteriormente gelificada con cloruro de calcio. Se aplicó en un cultivo celular de osteoblastos, y se observó una mayor proliferación, mayor viabilidad celular y mayor deposición de calcio en el grupo experimental que en el grupo sin silicio. Por el contrario, en el segundo estudio, un factor generador de células (CGF) se combinó con ortosilicato de sodio en osteoblastos humanos. No se observaron diferencias estadísticamente significativas en cuanto a la proliferación celular o el crecimiento en comparación con los grupos en los que solo se administró ortosilicato o solo concentrado de plaquetas. Por el contrario, se observó una mayor producción de colágeno tipo I. En ambos estudios se concluyó que las propiedades osteoconductivas del silicio se verían potenciadas por los factores de crecimiento en el CGF. Ambos resultados diferían en nuestro estudio, en el cual el grupo PS fue el que obtuvo valores radiológicos significativamente más bajos, aunque histológicamente no mostró diferencia en comparación con el grupo de control. La comparación con ambas publicaciones debe hacerse con precaución porque fueron estudios in vitro con un material diferente. No obstante, nuestros resultados estarían de acuerdo con dos ensayos realizados en hueso de conejo en los que se observó que el PRF no mejoró significativamente la regeneración ósea en comparación con el grupo de control negativo.
En nuestro estudio, se observó una mayor formación de hueso mineralizado en el grupo PSB y esto podría deberse a dos factores: el primero de ellos es que el silicio y el PRF potenciarían su capacidad osteoconductiva al combinarse entre sí y al mismo tiempo acelerarían la mineralización ósea. Esto podría explicar el mejor rendimiento del grupo PSB en nuestro estudio. El segundo factor es la adición de hueso autólogo al biomaterial que, como se mencionó anteriormente, se considera el material de referencia en la regeneración ósea.
Como limitaciones del estudio, vale la pena señalar el bajo número de especímenes en la muestra, así como el período de tiempo evaluado. Los grupos de estudio PSB y SB ofrecieron buenos resultados de regeneración, sin embargo, radiológicamente no presentaron una diferencia significativa en comparación con el grupo de control. Una forma de mejorar el estudio sería evaluar períodos de tiempo más largos, que quizás ofrecerían resultados más reveladores sobre el comportamiento de estos materiales regenerativos. Además, se podría haber contemplado el uso de un grupo de control positivo (rellenando el defecto con hueso autólogo sin silicio o una mezcla de solo hueso autólogo y heterólogo). Otra limitación del estudio es la dificultad en la comparación debido al tipo de material empleado (silicio versenato). El silicio es un elemento que se emplea en formas muy diferentes en la literatura, como dióxido de silicio, acetato de silicio y silicato de sodio, y aún no existe un protocolo validado. Se utilizó silicio granulado en nuestro estudio. En condiciones fisiológicas, el silicio bio-disponible se encuentra en forma de ácido ortosilícico, mientras que en los estudios en los que se ha empleado hidroxiapatita sustituida con silicio, el silicio utilizado está en forma de SiO4, aunque, por otro lado, se ha demostrado recientemente que el silicio en su formato fisiológico podría no concentrarse en la etapa mineral inorgánica del hueso sin metabolizarlo previamente a ortosilicato.
En el estudio radiológico, no se observó una diferencia estadísticamente significativa entre los grupos de estudio en comparación con el grupo de control y esto podría deberse a la falta de uso de membranas o agentes fijadores para recubrir el defecto con el fin de estabilizar la coagulación y prevenir el retraso en la completa osificación del área, aunque el período estudiado (3 semanas) sería insuficiente para observarlo.
Conclusiones
El silicio es un elemento prometedor como material a incluir con otros materiales regenerativos óseos debido a su bajo costo y buenas propiedades observadas in vitro y in vivo, aunque la definición de sus propiedades y condiciones óptimas de uso aún se están investigando. La combinación de fibrina rica en plaquetas, hueso autólogo y silicio ofrece buenos resultados después de 3 semanas. Los grupos PSB y SB son los que ofrecen buenos resultados, el grupo PSB presenta una mayor velocidad de mineralización ósea en comparación con SB y esto podría deberse a la inclusión de plasma rico en plaquetas y silicio. Los resultados obtenidos en este estudio revelan la importancia del hueso autólogo como parte del material de injerto para que el hueso se mineralice.
Dentro de los límites de esta investigación, el análisis histológico de los tejidos regenerados podría proporcionar información útil sobre la naturaleza y la cantidad de hueso formado con el uso de silicio, fibrina rica en plaquetas y hueso autólogo. Se necesitan más estudios para obtener conocimiento sobre el verdadero potencial regenerativo de iones bioinorgánicos como el silicio.
Autores: Argimiro Hernández-Suarez, María Rizo-Gorrita, Dubraska Suárez-Vega, Gladys Velazco, Ivan Rodriguez Gelfenstein, María-Ángeles Serrera-Figallo y Daniel Torres-Lagares
Referencias:
- Ferres E. Estudio del efecto de la adición de silicio al beta-fosfato tricálcico e hidroxiapatita en la neoformación ósea en defectos críticos en calotas y conejo. Tesis Doctoral. Universidad de Murcia.2017.
- Morales D. Ingeniería tisular como puntal de la medicina regenerativa en estomatología. Revista Cubana de Estomatología 2014;51(3):288-304
- Oppenheimer AJ, Tong L, Buchman SR. Injerto óseo craneofacial: La ley de Wolff revisitada. Craniomaxillofac Trauma Reconstr. 2008;1(1):49-61.
- Henkel J, Woodruff MA, Epari DR, Steck R, Glatt V, Dickinson IC, Choong PF, Schuetz MA, Hutmacher DW. Regeneración ósea basada en concepciones de ingeniería de tejidos - Una perspectiva del siglo XXI. Bone Res. 2013 Sep 25;1(3):216-48.
- Mordenfeld A, Johansson CB, Albrektsson T, Hallman M. Un ensayo clínico aleatorizado y controlado de dos composiciones diferentes de hueso bovino desproteinizado y hueso autógeno utilizados para la augmentación del reborde lateral. Clin Oral Implants Res. 2014 Mar;25(3):310-320.
- Masoudi E, Ribas J, Kaushik G, Leijten J, Khademhosseini A. Derivados sanguíneos ricos en plaquetas para la ingeniería de tejidos y regeneración basadas en células madre. Curr Stem Cell Rep. 2016 Mar;2(1):33-42.
- Anitua E, Sánchez M, Nurden AT, Nurden P, Orive G, Andía I. Nuevas perspectivas y aplicaciones novedosas para las terapias con fibrina rica en plaquetas. Trends Biotechnol. 2006 May;24(5):227-34.
- Amaral Valladão CA Jr, Freitas Monteiro M, Joly JC. Regeneración ósea guiada en aumentación ósea vertical y horizontal escalonada utilizando fibrina rica en plaquetas asociada con injertos óseos: un estudio clínico retrospectivo. Int J Implant Dent. 2020 Oct 17;6(1):72.
- Cho YS, Hwang KG, Jun SH, Tallarico M, Kwon AM, Park CJ. Análisis comparativo radiológico entre el relleno de solución salina y fibrina rica en plaquetas después de un levantamiento de seno transcrestal hidráulico sin injerto óseo adicional: Un ensayo controlado aleatorizado. Clin Oral Implants Res. 2020 Nov;31(11):1087-1093.
- Areewong K, Chantaramungkorn M, Khongkhunthian P. Fibrina rica en plaquetas para preservar los alvéolos óseos tras la extracción dental: Un ensayo controlado aleatorizado. Clin Implant Dent Relat Res. 2019 Dec;21(6):1156-1163.
- de Almeida Barros Mourão CF, de Mello-Machado RC, Javid K, Moraschini V. El uso de fibrina rica en leucocitos y plaquetas en el manejo de la cicatrización de tejidos blandos y el dolor en los alvéolos post-extracción: Un ensayo clínico aleatorizado. J Craniomaxillofac Surg. 2020 Apr;48(4):452-457.
- Castro AB, Herrero ER, Slomka V, Pinto N, Teughels W, Quirynen M. Capacidad antimicrobiana de la fibrina rica en leucocitos y plaquetas contra patógenos periodontales. Sci Rep. 2019 Jun 3;9(1):8188.
- Schuldt L, Bi J, Owen G, Shen Y, Haapasalo M, Häkkinen L, Larjava H. Descontaminación de superficies de implantes rugosas colonizadas por biofilm oral multispecies mediante la aplicación de fibrina rica en leucocitos y plaquetas. J Periodontol. 2020 Aug 27.
- Zofková I, Nemcikova P, Matucha P. Elementos traza y salud ósea. Clin Chem Lab Med. 2013 Aug;51(8):1555-61.
- Zhang D, Wong CS, Wen C, Li Y. Respuestas celulares de células similares a osteoblastos a 17 metales elementales. J Biomed Mater Res A. 2017 Jan;105(1):148-158.
- Arora M., Arora E. La promesa del silicio: regeneración ósea y aumento de la densidad ósea. J Arthroscopy and Joint Surgery 2017;4(3):103-105.
- Carlisle EM. Silicio. Un posible factor en la calcificación ósea. Science 1970;167:279–280.
- Carlisle EM. Silicio como un elemento traza esencial en la nutrición animal. Ciba Found Symp. 1986;121:123-39.
- Schwarz K, Milne DB. Efectos promotores del crecimiento del silicio en ratas. Nature. 1972 Oct 6;239(5371):333-4.
- Dong M, Jiao G, Liu H, Wu W, Li S, Wang Q, Xu D, Li X, Liu H, Chen Y. El silicio biológico estimula la síntesis de colágeno tipo 1 y osteocalcina en células similares a osteoblastos humanos a través de la vía de señalización BMP-2/Smad/RUNX2. Biol Trace Elem Res. 2016 Oct;173(2):306-15.
- Price CT, Koval KJ, Langford JR. Silicio: una revisión de su posible papel en la prevención y tratamiento de la osteoporosis postmenopáusica. Int J Endocrinol. 2013;2013:316783.
- Zou S, Ireland D, Brooks RA, Rushton N, Best S. Los efectos de los iones de silicato en la adhesión, proliferación y diferenciación de osteoblastos humanos. J Biomed Mater Res B Appl Biomater. 2009 Jul;90(1):123-30. Uribe P, Johansson A, Jugdaohsingh R, Powell JJ, Magnusson C, Davila M, Westerlund A, Ransjö M. La sílice soluble estimula la diferenciación osteogénica y la comunicación de uniones gap en células del folículo dental humano. Sci Rep. 2020 Jun 18;10(1):9923.
- Kim, E. J., Bu, S. Y., Sung, M. K. & Choi, M. K. Efectos del silicio en la actividad de los osteoblastos y la mineralización ósea de las células MC3T3-E1. Biol. Trace Elem. Res. 2013; 152(1):105–12.
- Hench LL, Xynos ID, Polak JM. Vidrios bioactivos para la regeneración de tejidos in situ. J Biomater Sci Polym Ed. 2004;15(4):543-62.
- Chowdhury M. Las formulaciones a base de sílice para la entrega de medicamentos, tratamiento óseo y regeneración ósea. ChemBioEng Rev 2016; 3(5):229-246.
- Byun IS, Sarkar SK, Anirban Jyoti M, Min YK, Seo HS, Lee BT, Song HY. Biocompatibilidad inicial y respuesta osteoblástica mejorada de la dopaje de Si en un sustituto de injerto óseo poroso de BCP. J Mater Sci Mater Med. 2010 Jun;21(6):1937-47.
- Mao Z, Gu Y, ZhangJ, Shu W.W., Cui Y. Superior rendimiento biológico y actividad osteoinductiva de partículas bioactivas de regeneración ósea que contienen Si para la reconstrucción del hueso alveolar. Ceram. Int. 2020. 46(2020):353-364.
- Wang X, Ito A, Sogo Y, Li X, Oyane A. Capas compuestas de silicato-apatita en varillas de fijación externa y evaluación in vitro utilizando fibroblastos y osteoblastos. J Biomed Mater Res A. 2010 Mar 1;92(3):1181-9.
- Roh J, Kim JY, Choi YM, Ha SM, Kim KN, Kim KM. Regeneración ósea utilizando una mezcla de coral HA sustituido por silicio y β-TCP en un modelo de defecto óseo calvarial en ratas. Materials (Basel). 2016 Feb 6;9(2):97.
- Toledano M, Toledano-Osorio M, Osorio R, Carrasco-Carmona Á, Gutiérrez-Pérez JL, Gutiérrez-Corrales A, Serrera-Figallo MA, Lynch CD, Torres-Lagares D. Doxiciclina y polímeros de sílice nanofibrosos cargados de zinc como biomateriales para la regeneración ósea. Polymers (Basel). 2020 May 25;12(5):1201.
- Sánchez F, Orero A, Soriano A, Correcher C, Conde P, González A, Hernández L, Moliner L, Rodríguez-Alvarez MJ, Vidal LF, Benlloch JM, Chapman SE, Leevy WM. ALBIRA: un sistema de imagen PET∕SPECT∕CT para pequeños animales. Med Phys. 2013 May;40(5):051906.
- Donath K, Breuner G. Un método para el estudio de huesos y dientes no descalcificados con tejidos blandos adjuntos. La técnica Säge-Schliff (sierra y molienda). J Oral Pathol. 1982 Aug;11(4):318-26.
- Garbo C, Locs J, D'Este M, Demazeau G, Mocanu A, Roman C, Horovitz O, Tomoaia-Cotisel M. Hidroxiapatitas avanzadas de Mg, Zn, Sr, Si multi-sustituidas para la regeneración ósea. Int J Nanomedicine. 2020 Feb 13;15:1037-1058.
- Wang W, Yeung KWK. Injertos óseos y sustitutos biomateriales para la reparación de defectos óseos: Una revisión. Bioact Mater. 2017 Jun 466 7;2(4):224-247.
- Götz W, Tobiasch E, Witzleben S, Schulze M. Efectos de los compuestos de silicio en la biomineralización, osteogénesis y formación de tejidos duros. Pharmaceutics. 2019 Mar 12;11(3):117.
- Gibson IR, Best SM, Bonfield W. Efecto de la sustitución de silicio en la sinterización y microestructura de la hidroxiapatita. J Am Ceram Soc. 2002;85(11):2771–2777
- Porter AE, Botelho CM, Lopes MA, Santos JD, Best SM, Bonfield W. Comparación ultrastructural de la disolución y precipitación de apatita en hidroxiapatita y hidroxiapatita sustituida por silicio in vitro e in vivo. J Biomed Mater Res A. 2004 Jun 15;69(4):670-9.
- Li H, Chang J. Materiales silicatados bioactivos estimulan la angiogénesis en un sistema de co-cultivo de fibroblastos y células endoteliales a través del efecto paracrino. Acta Biomater. 2013 Jun;9(6):6981-91.
- Shie MY, Ding SJ, Chang HC. El papel del silicio en la proliferación y apoptosis de células similares a osteoblastos. Acta Biomater. 2011 477 Jun;7(6):2604-14.
- Thian E.S., Huang J., Best S.M., et al., La respuesta de los osteoblastos a la película delgada de hidroxiapatita sustituida por silicio nanocristalino. Biomaterials 2006; 27(13):2692–2698
- Lee, S. H., Kim, S. W., Lee, J. I., Yoon, H. J. El efecto de la fibrina rica en plaquetas en la regeneración ósea y angiogénesis en defectos craneales de conejos. Tissue Engineering and Regenerative Medicine 2015. 12(5):362-370.
- Jeon YR, Kim MJ, Kim YO, Roh TS, Lee WJ, Kang EH, Yun IS. Regeneración ósea sin andamiaje utilizando fibrina rica en plaquetas en un modelo de defecto calvarial. J Craniofac Surg. 2018 Jan;29(1):251-254.
- Sindel A, Dereci Ö, Toru HS, Tozoğlu S. Comparación histomorfométrica de la regeneración ósea en defectos óseos de tamaño crítico utilizando matriz ósea desmineralizada, fibrina rica en plaquetas y ácido hialurónico como sustitutos óseos. J Craniofac Surg. 2017 Oct;28(7):1865-1868.
- Kökdere NN, Baykul T, Findik Y. El uso de fibrina rica en plaquetas (PRF) y injerto óseo autógeno particulado mezclado con PRF en el tratamiento de defectos óseos: Un estudio experimental e histomorfométrico. Dent Res J (Isfahan). 2015 Sep-Oct;12(5):418-24.
- Karayürek F, Kadiroğlu ET, Nergiz Y, Coşkun Akçay N, Tunik S, Ersöz Kanay B, Uysal E. Combinando fibrina rica en plaquetas con diferentes materiales de injerto óseo: Un estudio experimental sobre los aspectos histopatológicos e inmunohistoquímicos de la cicatrización ósea. J Craniomaxillofac Surg. 2019 May;47(5):815-825.
- Knapen M, Gheldof D, Drion P, Layrolle P, Rompen E, Lambert F. Efecto de la fibrina rica en leucocitos y plaquetas (L-PRF) en la regeneración ósea: un estudio en conejos. Clin Implant Dent Relat Res. 2015 Jan;17 Suppl 1:e143-52.
- Sani F, Mehdipour F, Talaei-Khozani T, Sani M, y RazbanV. Fabricación de andamios de plasma rico en plaquetas/sílice para la ingeniería de tejidos óseos Bioinspirados, Biomiméticos y Nanobiomateriales 2018 7:2, 74-81.
- Bonazza V, Borsani E, Buffoli B, Parolini S, Inchingolo F, Rezzani R, Rodella LF. Tratamiento in vitro con factores de crecimiento concentrados (CGF) y ortosilicato de sodio afecta positivamente la renovación celular en tres líneas celulares humanas diferentes. Cell Biol Int. 2018 Mar;42(3):353-364.
- Faot F, Deprez S, Vandamme K, Camargos GV, Pinto N, Wouters J, van den Oord J, Quirynen M, Duyck J. El efecto de las membranas L-PRF en la cicatrización ósea en defectos óseos de tibias de conejos: resultados de micro-CT y biomarcadores. Sci Rep. 2017 Apr 12;7:46452.
- Fielding GA, Smoot W, Bose S. Efectos de los dopantes de SiO2, SrO, MgO y ZnO en los fosfatos tricálcicos osteoblásticos en la expresión de Runx2. J Biomed Mater Res A. 2014 Jul;102(7):2417-26.
- Kamitakahara M, Tatsukawa E, Shibata Y, Umemoto S, Yokoi T, Ioku K, Ikeda T. Efecto de la incorporación de silicato en las respuestas in vivo de cerámicas de α-fosfato tricálcico. J Mater Sci Mater Med. 2016 May;27(5):97.
- Chappell HF, Jugdaohsingh R, Powell JJ. La incorporación fisiológica de silicio en el mineral óseo requiere el metabolismo del ácido ortosilícico a SiO44. J R Soc Interface. 2020 Jun;17(167):20200145.
- Gutiérrez-Prieto SJ, Fonseca LF, Sequeda-Castañeda LG, Díaz KJ, Castañeda LY, Leyva-Rojas JA, Salcedo-Reyes JC, Acosta AP. 508 Elaboración y biocompatibilidad de un material de hidroxiapatita derivado de cáscara de huevo modificado con Si/PLGA para la regeneración ósea en odontología. Int J Dent. 2019 Dec 5;2019:5949232.
- Szurkowska K, Szeleszczuk Ł, Kolmas J. Efectos de las condiciones de síntesis en la formación de fosfatos tricálcicos alfa sustituidos por Si. Int J Mol Sci. 2020 Dec 1;21(23):9164.
