Entrega local repetida de gel de ácido hialurónico como tratamiento adjunto de bolsas residuales en pacientes con periodontitis en cuidado periodontal de soporte. Un ensayo clínico controlado aleatorizado.
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivos Evaluar el efecto de la aplicación de ácido hialurónico (HyA) como complemento a la re-instrumentación de bolsas residuales en pacientes que reciben atención periodontal de soporte (SPC) de manera regular.
Métodos Pacientes con periodontitis crónica (etapa III y IV, grado B y C) con 4 bolsas residuales interproximales fueron asignados aleatoriamente al grupo de prueba (gel de HyA) o al grupo de control (salina). Después de la instrumentación subgingival, se aplicó la sustancia de prueba o control subgingivalmente, luego diariamente supragingivalmente durante 3 meses, y si era necesario, una segunda vez después de la re-instrumentación subgingival tras 3 meses. Se registraron parámetros clínicos y de resultados reportados por los pacientes cada 3 meses durante 12 meses. El cierre de la bolsa [profundidad de sondaje de la bolsa (PPD) ≤ 4mm con ausencia de sangrado al sondear (BoP) a PPD = 4mm] fue el principal parámetro de resultado.
Resultados Se analizaron cincuenta y seis pacientes (221 sitios experimentales). Se logró el cierre de la bolsa en el 56.8 y 46.6% de los sitios experimentales en el grupo de prueba y control, respectivamente (p > 0.05), mientras que la mediana de PPD y la distribución de PPD (< 5mm/5mm/ > 5mm) difirieron significativamente entre los grupos a favor del grupo de prueba, a los 12 meses. Además, significativamente menos sitios en el grupo de HyA requirieron re-instrumentación a los 3 meses, y los sitios en el grupo de HyA mostraron una tendencia a tener menores probabilidades de permanecer enfermos en comparación con el grupo de control (OR 0.48, 95%CI 0.22–1.06). Las probabilidades de que un sitio permaneciera enfermo después de 12 meses aumentaron significativamente en presencia de placa (OR 7.94, 95%CI 4.12–15.28), pero en general, disminuyeron significativamente con el tiempo (OR 0.48, 95%CI 0.28–0.81).
Conclusión La re-instrumentación de los bolsillos residuales en pacientes con SPC, por sí sola, conduce a un aumento significativo en el cierre de los bolsillos a lo largo del tiempo; esto fue impedido por un mal control de placa. La aplicación local repetida de HyA resulta en menos sitios que requieren re-instrumentación y podría mejorar ligeramente la tasa de cierre de los bolsillos. (número de registro clinicaltrials.gov NCT04792541).
Relevancia clínica El gel de HyA es fácil de aplicar, bien aceptado por los pacientes y puede tener algún efecto positivo en términos de menos sitios que requieren re-instrumentación a los 3 meses y una mayor tasa de cierre de bolsillos a los 12 meses.
Introducción
La instrumentación subgingival no quirúrgica inicial (es decir, segundo paso de la terapia), ya sea manual o con instrumentos (ultra)sonicos (o una combinación de ambos), es un enfoque de tratamiento muy exitoso en pacientes con periodontitis; en promedio, se puede lograr una profundidad de sondaje de bolsillo (PPD) poco profunda en 3 de cada 4 bolsillos. Recientemente, el Taller Mundial sobre la Clasificación de Enfermedades y Condiciones Periodontales y Peri-Implantarias y la Guía de Práctica Clínica de nivel S3 de la EFP han definido el objetivo del tratamiento periodontal. A nivel del sitio, el cierre del bolsillo se define como PPD ≤ 4 mm y sin sangrado al sondear (BoP), mientras que a nivel del paciente, un paciente con periodontitis tratado con éxito y estable se caracteriza por tener 1) PPD de ≤ 4 mm, 2) sin PPD = 4 mm con BoP, y 3) BoP en toda la boca < 10%. Aunque este objetivo es difícil de alcanzar en cada paciente, se ha demostrado que los pacientes que alcanzan estos puntos finales clínicos presentan una tasa reducida de progresión/recurrencia de la enfermedad y pérdida de dientes debido a la periodontitis durante el cuidado periodontal de soporte a largo plazo (SPC). Por lo tanto, el uso de productos adjuntos (administrados local o sistémicamente) durante el segundo paso de la terapia se discute con frecuencia, con el objetivo de 1) mejorar aún más la tasa de cierre de los bolsillos, 2) reducir la necesidad de terapia quirúrgica adicional, y/o 3) mejorar la tasa de lograr un paciente con periodontitis tratado con éxito y estable. Esto, a su vez, no solo debería mejorar la estabilidad a largo plazo del tratamiento y reducir la pérdida de dientes, sino también minimizar la morbilidad del paciente y, eventualmente, los costos del tratamiento. Las diversas opciones y la eficacia de los adjuntos administrados localmente (es decir, moduladores del huésped o antimicrobianos) durante el segundo paso de la terapia han sido evaluadas extensamente dentro del marco de la Guía de Práctica Clínica de nivel S3 de la EFP. Finalmente, se sugirió que solo la clorhexidina de liberación sostenida y los antibióticos aplicados localmente pueden considerarse opciones válidas. En este contexto, hay información limitada sobre el “mejor” momento de entrega de los adjuntos aplicados localmente, en términos de (costo-)eficiencia, es decir, si deben aplicarse durante el segundo paso de la terapia o durante el tercer o cuarto paso de la terapia en la re-instrumentación de bolsillos residuales/recidivantes, respectivamente. Considerando los impactos del paciente, la sociedad y/o los posibles impactos biológicos del uso innecesario de cualquier medida adjunta, este último enfoque permitiría limitar su uso a aquellos pacientes/sitios que no sanan después de la instrumentación subgingival inicial. Dos revisiones sistemáticas recientes cubrieron la eficacia de los adjuntos para pacientes con periodontitis con bolsillos residuales/recidivantes durante el SPC. Específicamente, entre los antimicrobianos administrados localmente, la clorhexidina de liberación sostenida y las fibras de tetraciclina, ocuparon el primer lugar con una reducción adicional de PPD estadísticamente y clínicamente significativa de aproximadamente 0.6 a 0.7 mm, mientras que hay evidencia insuficiente disponible para cualquier otra opción de tratamiento adjunto (es decir, diferente de los antimicrobianos).
Sin embargo, otro adyuvante administrado localmente, que no ha sido incluido en ninguna de las revisiones sistemáticas mencionadas anteriormente ni en la Guía de Práctica Clínica de nivel S3 de la EFP, es el ácido hialurónico (HyA). Varios geles que contienen HyA en diferentes concentraciones han sido, desde hace varios años, probados como adyuvantes a la instrumentación mecánica subgingival no quirúrgica y su eficacia incluso ha sido resumida en algunas revisiones sistemáticas. Estas revisiones tuvieron conclusiones bien comparables, es decir, la mayoría de los ensayos clínicos incluidos informaron un efecto positivo, aunque moderado, a favor de HyA en términos de reducción de PPD y BoP. Sin embargo, hubo una gran variación en los modos de aplicación y la frecuencia en los estudios originales, y todas las revisiones enfatizaron la necesidad de más ensayos clínicos controlados aleatorizados (RCT) bien diseñados, que incluyan un informe suficiente de los detalles del producto. En este contexto, actualmente no está claro si la aplicación repetida de un adyuvante administrado localmente es, en general, ventajosa en comparación con la aplicación única, es decir, solo justo después de la instrumentación. Sin embargo, 2 RCT recientes han evaluado la aplicación de HyA en la oficina específicamente en la re-instrumentación de bolsas residuales/recidivantes. Cada estudio probó un producto de HyA diferente y una frecuencia de aplicación; en uno de los estudios, HyA se aplicó subgingivalmente, una vez, mientras que en el otro estudio, HyA se aplicó subgingivalmente en 2 citas consecutivas, pero ambos mostraron una tendencia a favor de la aplicación de HyA.
Por lo tanto, parece razonable evaluar si la aplicación local combinada de HyA, es decir, subgingival en la consulta, después de la instrumentación mecánica, y repetida supragingivalmente, por el paciente, una vez al día durante 3 meses, tiene el potencial de mejorar la tasa de cierre de bolsas en comparación con la re-instrumentación sola en el tratamiento de bolsas residuales en pacientes con periodontitis que se someten a SPC regular.
Materiales y métodos
Diseño del estudio y participantes
El presente estudio fue un ensayo clínico aleatorizado, doble ciego (paciente y observador), controlado con placebo, de grupos paralelos con un seguimiento de 12 meses y se informa de acuerdo con los estándares de informes de ensayos clínicos (Declaración CONSORT; Apéndice 1). El protocolo fue aprobado por el comité ético regional (Dnr. 2016/468) y registrado en clinicaltrials.gov (NCT04792541); cualquier cambio en el protocolo después de su publicación se enumera en el Apéndice 2. La reclutación de pacientes se realizó entre diciembre de 2016 y enero de 2020, es decir, la reclutación de pacientes comenzó antes del Taller Mundial sobre la Clasificación de Enfermedades y Condiciones Periodontales y Peri-Implantarias en 2017. Todos los pacientes con periodontitis que habían completado la fase de tratamiento activo desde hace ≥ 6 meses y estaban inscritos en un programa regular de SPC (es decir, paso 4 del tratamiento) en una Clínica Especializada en Periodoncia (Servicio Dental Público, Värmland, Suecia), que cumplían con los siguientes criterios de inclusión fueron incluidos de manera consecutiva: (i) 35 a 75 años, (ii) diagnóstico de periodontitis crónica, (iii) al menos 10 dientes restantes, y (iv) 4 a 8 sitios interproximales con PPD de ≥ 5 a < 8 mm y presencia de BoP en el momento de la inclusión. Además, se definieron los siguientes criterios de exclusión: (i) molares con involucramiento de furcación clase II o III, (ii) movilidad dental clase II o III, (iii) > 2 mm de PPD más profundo en otro sitio en el mismo espacio interproximal, (iv) terapia antibiótica en los 6 meses anteriores o durante la participación en el estudio, (v) necesidad de profilaxis antibiótica antes del examen periodontal y/o tratamiento, (vi) uso a largo plazo de medicamentos antiinflamatorios e inmunosupresores, (vii) diabetes descontrolada o recién diagnosticada antes o durante la participación en el estudio, (viii) embarazo o lactancia, (ix) disfunción oclusal severa, (x) tratamiento ortodóntico en curso, y (xi) lesiones endodónticas. Se registraron la edad, el género, el estado de tabaquismo (es decir, nunca / ex / fumador actual) y la presencia/ausencia de diabetes mellitus bien controlada para cada participante.
Producto de prueba y placebo
El producto utilizado en el “grupo de prueba/HyA” para la aplicación sub- y supragingival fue un gel que contenía ácido hialurónico (0.3%, no reticulado, de peso molecular medio; Afta Clear™ Gel; Sunstar Europe SA, Etoy, Suiza), mientras que el “grupo control/placebo” recibió una pequeña botella de solución salina fisiológica. Ambos productos fueron enmascarados con cinta blanca, de modo que el paciente no estaba al tanto de la asignación del grupo.
Intervención, aleatorización y cegamiento
Antes de comenzar el estudio, se generó por computadora una lista de secuencia aleatoria para la asignación de grupos (proporción 1:1 para el grupo de prueba/HyA y el grupo control/placebo) por un periodoncista que no estaba incluido en el proceso de reclutamiento (KB). Todos los participantes fueron reclutados por uno de los 3 higienistas dentales experimentados (LG, AS, MSS). Se definieron cuatro sitios interproximales de cada participante como sitios experimentales (es decir, mesio-bucal, mesio-palatino/-lingual, disto-bucal o disto-palatino/-lingual); si era posible, se elegía 1 sitio por cuadrante, de lo contrario, los sitios experimentales debían estar en diferentes espacios interproximales. Todos los participantes recibieron al inicio una sesión estándar de SPC que incluía reinstrumentación con un dispositivo ultrasónico (E.M.S. Electro Medical Systems S.A., Nyon, Suiza) y/o instrumentos manuales (HuFriedyGroup, Chicago, EE. UU.) de todos los bolsillos residuales por uno de los 3 higienistas dentales mencionados anteriormente; cada paciente fue tratado por el mismo higienista dental durante todo el período del estudio. La asignación de grupos se mantuvo oculta hasta después de la reinstrumentación de los bolsillos residuales. Después de la reinstrumentación, un periodoncista (AZ) se unió a la sesión de tratamiento, reveló la asignación del grupo solo para sí mismo abriendo una nota oculta en el sobre con el formulario de informe de caso del paciente, y aplicó ya sea el producto de prueba o el producto placebo subgingivalmente en todos los sitios experimentales. Para la aplicación subgingival, el producto de prueba y el producto placebo se transfirieron a una jeringa estéril con una aguja roma y los sitios experimentales se llenaron hasta que el producto desbordaba del bolsillo (Fig. 1). El mismo periodoncista realizó este procedimiento a todos los participantes, mientras que los higienistas dentales y los pacientes permanecieron cegados a la asignación del grupo. Cada paciente recibió un folleto con un resumen de las instrucciones relevantes y un dibujo que indicaba los 4 sitios experimentales, incluyendo el tamaño correcto de los cepillos interdentales (TePe Munhygienprodukter AB, Malmö, Suecia) para el espacio interproximal específico y ya sea el producto de prueba o el producto placebo. Los pacientes debían aplicar el producto una vez al día supragingivalmente con un cepillo interdental después del cepillado, solo en los sitios experimentales, y durante los próximos 3 meses hasta la segunda cita de SPC (es decir, seguimiento de 3 meses). Además, se instruyó a los pacientes a evitar cepillarse los dientes o comer durante 3 horas después de la aplicación y no usar ninguna solución de enjuague bucal ni ningún otro gel durante su participación en el presente estudio. Las sesiones de SPC se repitieron después de 3, 6, 9 y 12 meses; sin embargo, el paciente dejó de aplicar el producto de prueba o el producto placebo después de los primeros 3 meses. Finalmente, todos los sitios experimentales con PPD = 5 mm y BoP o PPD > 5 mm en el seguimiento de 3 meses recibieron nuevamente reinstrumentación y una segunda aplicación subgingival del producto asignado, como se describió anteriormente. En general, todos los sitios con PPD= 5 mm y BoP o PPD>5 mm en cualquiera de las sesiones de SPC recibieron como estándar de atención reinstrumentación subgingival.
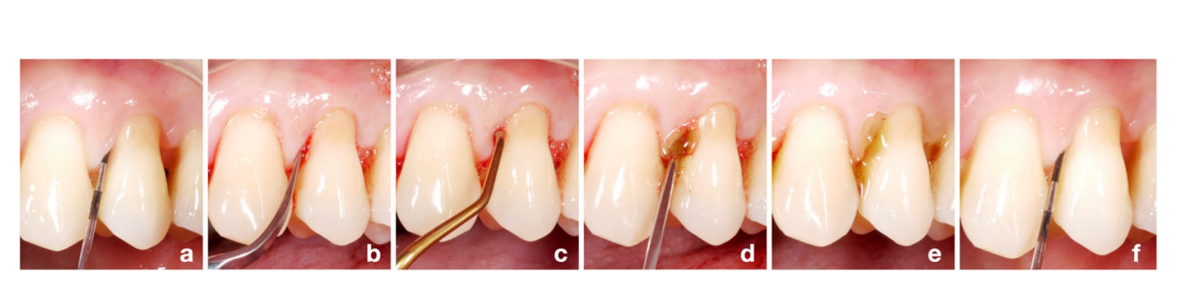
Evaluación de resultados y enmascaramiento
Se realizó un muestreo microbiológico subgingival de los 4 sitios experimentales en la línea de base y después de 3, 6 y 12 meses. Los resultados del muestreo microbiológico se informarán en otro lugar. Además, después del muestreo microbiológico y en cada SPC (es decir, en la línea de base, y después de 3, 6, 9 y 12 meses), el mismo higienista dental enmascarado y calibrado (LG, AS, MSS) registró PPD, nivel de inserción clínica (CAL), presencia/ausencia de BoP y presencia/ausencia de placa en cada sitio experimental. Como estándar de atención, el periodoncista (AZ) de esta Clínica Especializada específica controla las mediciones de PPD de cada higienista aproximadamente 2 a 3 veces al año, lo que se consideró como calibración. Además, en cada seguimiento se preguntó a los pacientes sobre cualquier cambio en su historial médico y sobre cualquier ingesta de antibióticos en los 3 meses anteriores. En el segundo SPC (es decir, seguimiento de 3 meses), los pacientes recibieron adicionalmente un breve cuestionario sobre su opinión del producto probado. El cuestionario preguntó sobre la presencia e intensidad del dolor durante la aplicación, y sobre la opinión de los pacientes sobre la consistencia y el sabor del producto durante el uso en casa, utilizando una escala del 1 al 10. Un resultado de tratamiento exitoso (es decir, cierre de bolsa) se definió como PPD≤ 4 mm con ausencia de BoP a PPD = 4 mm; si estos criterios no se cumplían, el sitio experimental permanecía clasificado como “enfermo”. Este resultado compuesto se definió como parámetro de resultado primario y se evaluó en cada SPC.
Criterios de elegibilidad para el seguimiento
Los pacientes fueron programados cada 3 meses para SPC, sin embargo, se permitió un rango de 2.5 a 5 meses entre 2 sesiones de SPC; si el tiempo entre 2 sesiones de SPC excedía los 5 meses, la cita de SPC se consideraba como perdida. Además, el período total desde la primera hasta la quinta cita de SPC no debía exceder los 18 meses, de lo contrario, el paciente era excluido. Debido a que se incluyeron varios pacientes antes del brote de la pandemia de Covid-19, se permitió que los pacientes faltaran a la cita de 6 o 9 meses sin ser excluidos del estudio. Sin embargo, los pacientes que faltaron a 2 sesiones de SPC o a la cita de 3 o 12 meses también fueron excluidos.
Cálculo del tamaño de la muestra
Para el cálculo del tamaño de la muestra, se asumió que el 75 y el 25% de los sitios en el grupo de prueba/HyA y en el grupo de control/placebo, respectivamente, lograrían el cierre de la bolsa, es decir, PPD ≤ 4 mm con ausencia de BoP en PPD = 4 mm. En presencia de estos parámetros clínicos, el riesgo de progresión de la enfermedad se considera bajo y el tratamiento se considera exitoso. Basado en el conjunto de datos de una publicación anterior, se asume un coeficiente de correlación intraindividual de 0.42 para la presencia de BoP. Basado en este coeficiente de correlación, una potencia de 0.80 y un valor alfa de 0.05, se calculó un tamaño de muestra de 30 participantes por grupo (es decir, una población total de estudio de 60). Para compensar las deserciones, se reclutaron de manera consecutiva un total de 80 pacientes (40 pacientes por grupo).
Análisis estadístico
La distribución de frecuencia para variables categóricas (como género, estado de fumador, distribución de PPD, etc.) y medias (desviaciones estándar) o medianas y rangos intercuartílicos para variables continuas (como edad, PPD, etc.) se informan por separado para el grupo de prueba/HyA y el grupo de control/placebo. Para probar cualquier diferencia entre el grupo de prueba/HyA y el grupo de control/placebo, se aplicó la prueba exacta de Fisher o la prueba de chi-cuadrado para parámetros categóricos (es decir, se aplicó la prueba de chi-cuadrado si cada celda presentaba una frecuencia > 5) y para variables continuas se utilizó una prueba t independiente (para datos distribuidos normalmente) o una prueba de Mann Whitney-U (para datos no distribuidos normalmente). La normalidad de los datos se controló mediante la prueba de Shapiro-Wilk. El “estado de salud del sitio experimental” se definió como el parámetro de resultado primario [dicotómico; “enfermo” (es decir, PPD > 4 mm o PPD = 4 mm con BoP) frente a “tratado con éxito/cierre de bolsa” (es decir, PPD ≤4 mm con ausencia de BoP en PPD = 4 mm). Se calcularon dos modelos de regresión logística de efectos mixtos multivariables con la asignación de grupo como el principal predictor y los siguientes factores de confusión a priori: 1) tipo de diente (anterior / premolar / molar), 2) sitio interproximal (bucal / palatino/lingual), 3) PPD en la línea base en el sitio experimental (5 mm / 6–7 mm), 4) placa en el sitio experimental en cada cita (ausente / presente), 5) estado de fumador (nunca / ex / actual), 6) género (femenino / masculino), 7) tiempo transcurrido entre citas (meses), y 8) edad (años). El primer modelo incluyó solo los datos de 3 meses, mientras que el segundo modelo incluyó todos los datos recopilados durante un período de 12 meses; en este último modelo se agregó un factor de confusión adicional, es decir, punto de tiempo (seguimiento de 3 / 6 / 9 / 12 meses). El análisis estadístico se realizó con STATA/IC 17.0 para Mac (Lakeway Drive, Texas, EE. UU.) y se consideró un valor p ≤ 0.05 como estadísticamente significativo.
Resultados
Características de la población al inicio (nivel del paciente)
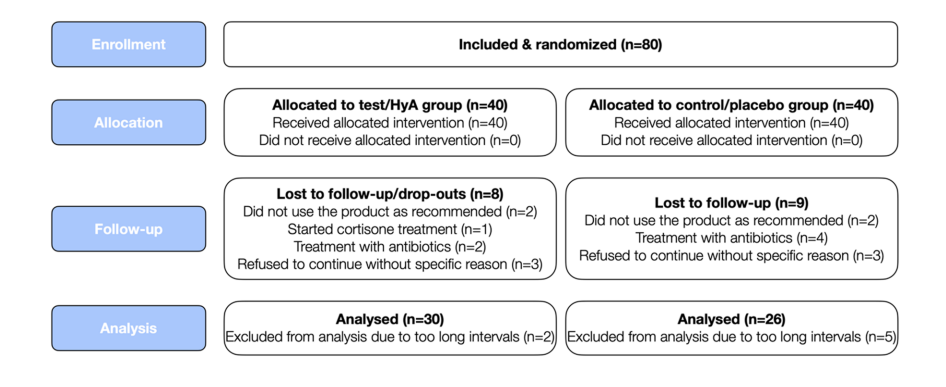
Se reclutaron y aleatorizaron ochenta pacientes con periodontitis crónica (correspondientes a pacientes con periodontitis de etapa III y IV y grado B y C) que se sometían a SPC regular. En total, 24 participantes abandonaron o no pudieron ser incluidos en el análisis por diversas razones (para más detalles, ver Fig. 2). Las características de los 56 pacientes (es decir, 30 y 26 pacientes en el grupo de prueba/HyA y el grupo de control/placebo, respectivamente), que contribuyeron al análisis, se muestran en la Tabla 1; ninguna de las características basales a nivel del paciente difirió significativamente entre los 2 grupos. En resumen, la muestra 1) consistió en aproximadamente 66% de mujeres, 2) tuvo una edad promedio de 58 años, 3) incluyó aproximadamente 46% de fumadores actuales, y 4) tuvo 3 diabéticos bien controlados.
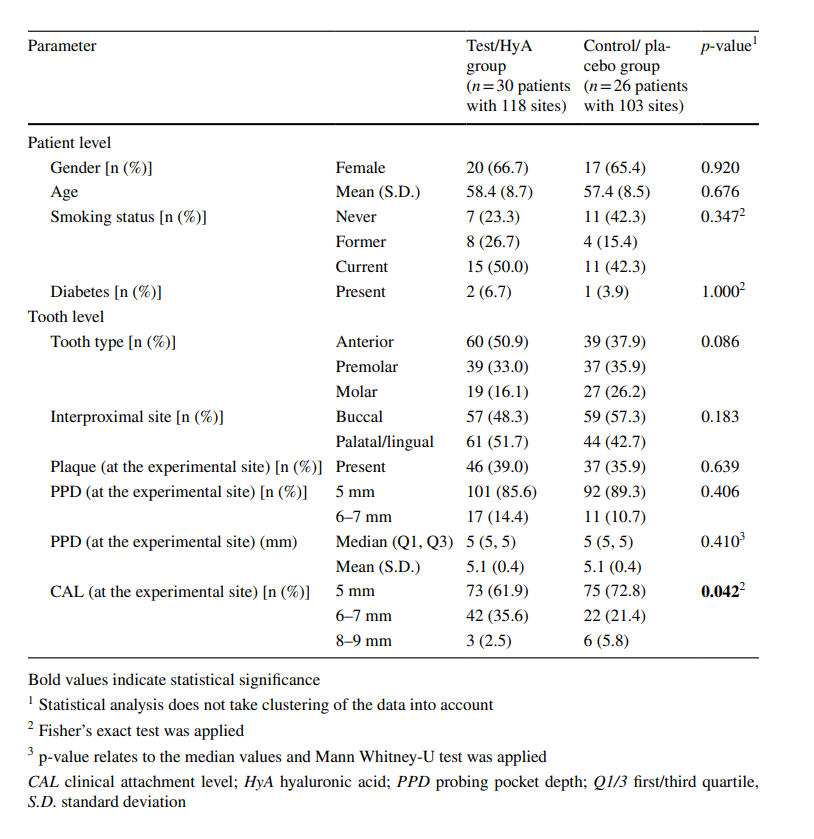
Características de los sitios experimentales en la línea base (a nivel de diente)
La muestra incluyó 221 sitios experimentales, que fueron todos juzgados como “enfermos” según los criterios de elegibilidad con presencia de BoP en la línea base. Excepto por 3 pacientes, cada paciente contribuyó con 4 sitios experimentales. Tres sitios experimentales (un sitio de 2 pacientes de prueba/HyA y 1 paciente de control/placebo) tuvieron que ser excluidos debido a la rehabilitación con una nueva restauración protésica en el diente experimental o vecino (n = 2) y debido a que un paciente aplicó por error el producto en el diente contralateral, es decir, en el incorrecto (n = 1). Las características basales de los sitios experimentales del grupo de prueba/HyA y del grupo de control/placebo se muestran en la Tabla 1. El tipo de diente, los sitios interproximales, la placa y el PPD estaban bien distribuidos entre los 2 grupos, mientras que el grupo de prueba/HyA contribuyó con significativamente más sitios que mostraban un CAL ≥ 6 mm en comparación con el grupo de control/placebo (p = 0.042). La mayoría de los sitios presentaron un PPD = 5 mm en la línea base, mientras que el 14.4 y el 10.7% del grupo de prueba/HyA y del grupo de control/placebo, respectivamente, tenían un PPD de 6 a 7 mm en la línea base.
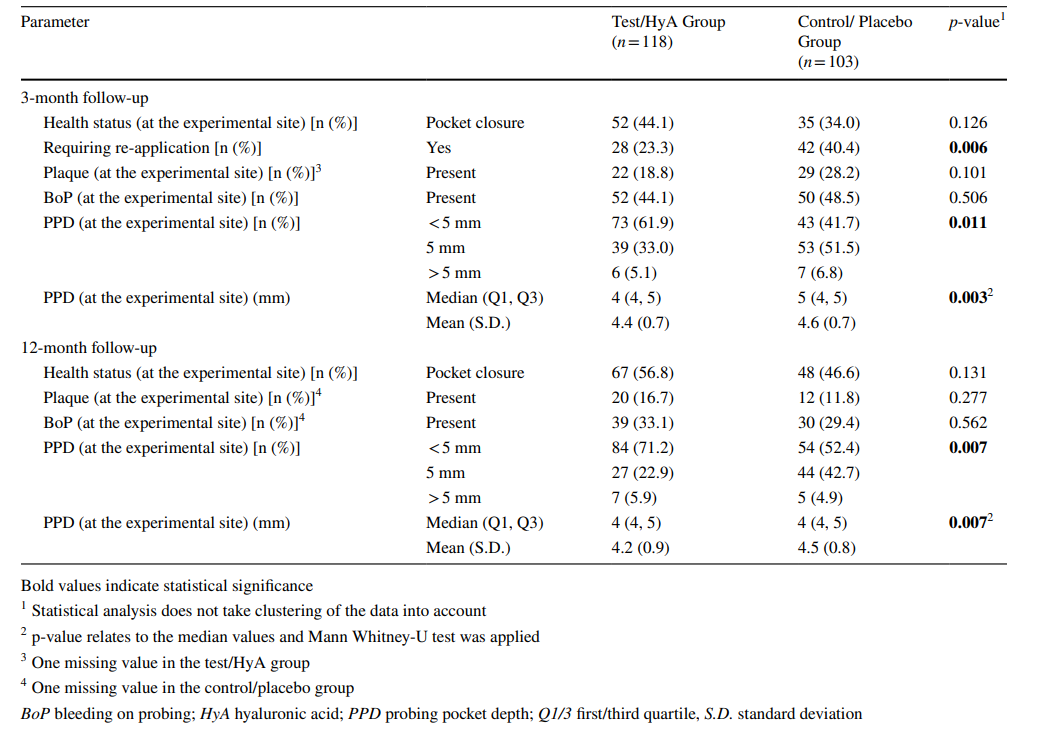
Características de los sitios experimentales después de 3 meses (nivel de diente)
Las características de los sitios experimentales después de 3 meses se informan en la Tabla 2. Después de 3 meses, el 44.1 y el 34.0% de los sitios experimentales del grupo de prueba/HyA y del grupo de control/placebo, respectivamente, lograron el cierre de bolsas sin una diferencia significativa entre los grupos. De manera similar, la presencia de placa y BoP fue comparable entre los 2 grupos. Sin embargo, la mediana de PPD (p = 0.003) y la distribución de PPD (< 5mm / 5 mm / > 5mm; p = 0.011) difirieron significativamente entre los grupos a favor del grupo de prueba/HyA. Específicamente, el 61.9 y el 41.7% de los sitios experimentales del grupo de prueba/HyA y del grupo de control/placebo, respectivamente, presentaron PPD < 5 mm. Además, significativamente menos sitios en el grupo de prueba/HyA (p = 0.006) en comparación con el grupo de control/placebo, 23.3 y 40.4%, respectivamente, requirieron re-aplicación subgingival en el seguimiento de 3 meses.
Evaluación del resultado del tratamiento después de 3 meses
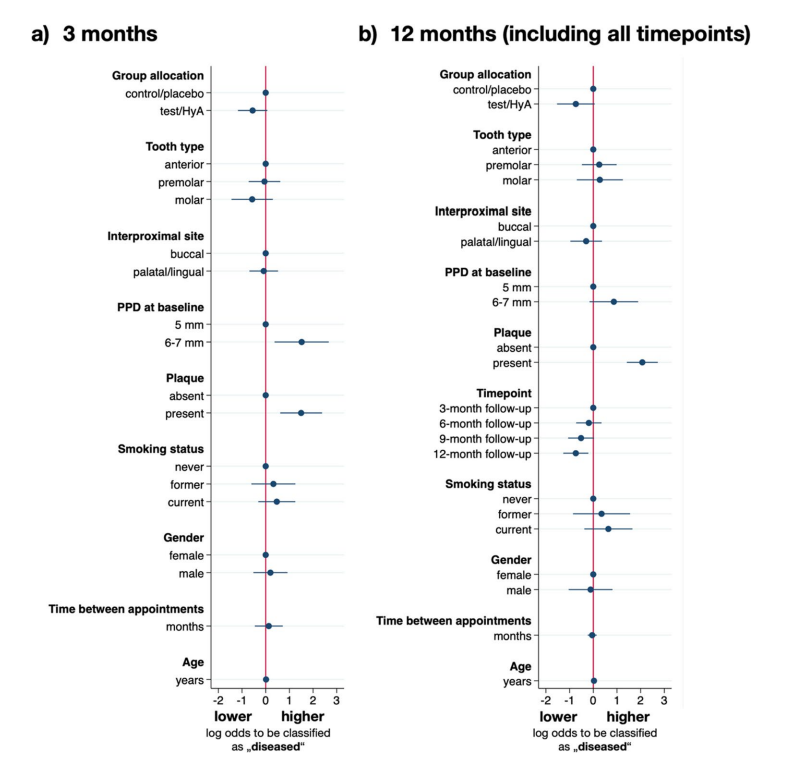
Los resultados del análisis de regresión logística de efectos mixtos multivariables después de 3 meses de SPC se muestran en la Fig. 3a y en la Tabla 3. Los sitios experimentales en el grupo de prueba/HyA tuvieron probabilidades ligeramente más bajas, pero estadísticamente no significativas, en comparación con el grupo de control/placebo para permanecer “enfermos” (es decir, PPD > 4 mm o PPD = 4 mm con BoP) (OR 0.58, 95% CI 0.31–1.07; p = 0.081). De los factores de confusión incluidos, solo la placa y el PPD en la línea de base tuvieron un efecto significativo en el resultado. Específicamente, la presencia de placa (OR 4.47, 95% CI 1.84–10.81; p = 0.001) y un PPD más alto en la línea de base (OR 4.57, 95% CI 1.45–14.34; p = 0.009) aumentaron significativamente las probabilidades de permanecer “enfermos” en el seguimiento de 3 meses.
Características de los sitios experimentales después de 12 meses (nivel dental)
Las características de los sitios experimentales en la evaluación final (seguimiento de 12 meses) se informan en la Tabla 2. En la evaluación final, el 56.8 y el 46.6% de los sitios experimentales del grupo de prueba/HyA y del grupo de control/placebo, respectivamente, lograron el cierre de bolsas sin una diferencia significativa entre los grupos. De manera similar, la presencia de placa y BoP fueron comparables entre los 2 grupos. Sin embargo, la mediana de PPD (p = 0.007) y la distribución de PPD (< 5mm / 5 mm / > 5mm; p = 0.007) difirieron significativamente entre los grupos a favor del grupo de prueba/HyA. Específicamente, el 71.2 y el 52.4% de los sitios de prueba/HyA y control/placebo, respectivamente, presentaron PPD < 5 mm y la mediana de PPD fue menor en el grupo de prueba/HyA. En el grupo de prueba/HyA, de 28 sitios experimentales que recibieron re-aplicación a los 3 meses, el 28.6% ya no estaban enfermos después de 12 meses, mientras que de 90 sitios experimentales que no recibieron re-aplicación a los 3 meses, el 34.4% fueron clasificados nuevamente como “enfermos”. En el grupo de control/placebo, de 42 sitios experimentales que recibieron re-aplicación a los 3 meses, el 33.3% ya no estaban enfermos después de 12 meses, mientras que de 61 sitios experimentales que no recibieron re-aplicación a los 3 meses, el 44.3% fueron clasificados nuevamente como “enfermos”.
Evaluación del resultado del tratamiento después de 12 meses
Los resultados del análisis de regresión logística de efectos mixtos multivariables se muestran en la Fig. 3b y en la Tabla 3. Los sitios experimentales del grupo test/HyA tenían probabilidades ligeramente, pero estadísticamente no significativas, más bajas en comparación con el grupo control/placebo de permanecer “enfermos” (es decir, PPD > 4 mm o PPD = 4 mm con BoP) (OR 0.48, 95% CI 0.22–1.06; p = 0.070). De los factores de confusión incluidos, solo la placa y el momento tuvieron un efecto significativo en el resultado. Específicamente, la presencia de placa aumentó significativamente las probabilidades de permanecer “enfermo” aproximadamente 8 veces (OR 7.94, 95% CI 4.12–15.28; p < 0.001), y, en general, las probabilidades de permanecer “enfermo” disminuyeron durante el período de estudio alcanzando significancia en la evaluación final (OR 0.48, 95% CI 0.28–0.81; p = 0.006).
Opinión de los pacientes
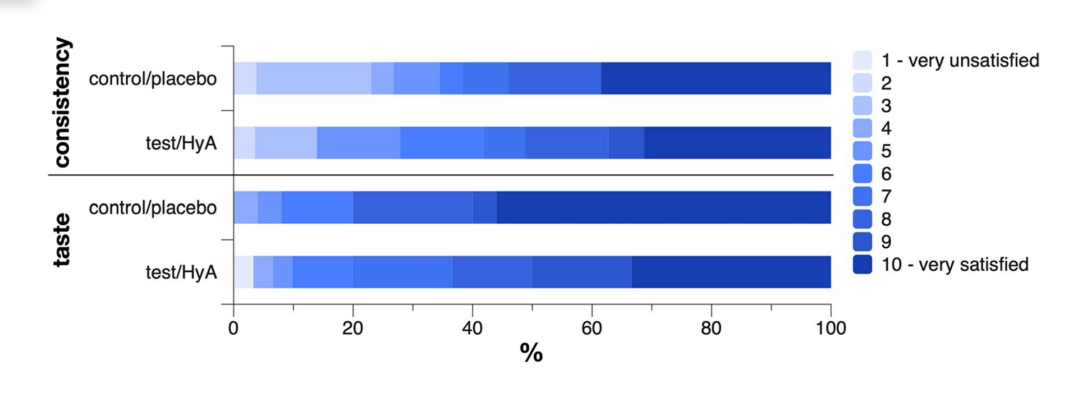
Un paciente de cada grupo informó haber experimentado dolor en la encía durante la aplicación del producto con una intensidad de 3 a 4 de 10, siendo 10 el máximo dolor. Un paciente del grupo de prueba/HyA no respondió sobre la consistencia y un paciente del grupo de control/placebo no respondió sobre el sabor. Los grupos no presentaron diferencias significativas en su opinión sobre la consistencia y el sabor del producto (Fig. 4). Específicamente, los valores medios (desviación estándar) de la escala para la consistencia fueron 7.2 (2.6) y 7.0 (3.0) en el grupo de prueba/HyA y el grupo de control/placebo, respectivamente (p = 0.822), y los valores medianos (primer, tercer cuartil) de la escala para el sabor fueron 8.5 (7, 10) y 10 (8, 10) en el grupo de prueba/HyA y el grupo de control/placebo, respectivamente (p = 0.184); para ambos parámetros un valor de 10 representó estar muy satisfecho.
Seguridad
Ninguno de los pacientes informó efectos secundarios/complicaciones relacionados con la aplicación del producto y no se pudieron observar eventos adversos clínicamente.
Discusión
Los quimioterapéuticos administrados localmente se utilizan frecuentemente como complemento al tratamiento no quirúrgico en pacientes con periodontitis, ya sea en la fase inicial del tratamiento o en bolsas residuales/recidivantes durante una etapa posterior del tratamiento. Sin embargo, dado que la instrumentación subgingival no quirúrgica inicial es un tratamiento bastante exitoso por sí mismo, un enfoque más específico para las bolsas que no sanaron durante el segundo paso de la terapia, y/o de las bolsas recidivantes durante el SPC podría ser el enfoque más relevante. En este sentido, un gel que contiene HyA, aplicado repetidamente (diariamente) durante un período de 3 meses, como complemento a la reinstrumentación de bolsas residuales/recidivantes en pacientes que se someten a SPC regular, mostró cierta tendencia a mejorar el resultado, es decir, se observó una tasa de cierre de bolsas un 10% más alta para los sitios que recibieron HyA en comparación con aquellos en el grupo de control que recibieron solución salina fisiológica (es decir, 57 frente a 47% de los sitios, respectivamente), después de 12 meses. Además, el porcentaje de sitios experimentales con PPD < 5 mm fue aproximadamente 1.4 veces mayor en el grupo de prueba/HyA en comparación con el grupo de control/placebo (es decir, 71 y 52% de los sitios, respectivamente).
Estos resultados están de acuerdo con los reportados en 2 RCT recientes que evaluaron un gel que contiene HyA como complemento a la re-instrumentación de bolsas residuales/recaídas y que mostraron que el uso de un gel que contiene HyA resultó en una tendencia a obtener resultados superiores en comparación con la re-instrumentación sola. Además, ambos estudios informaron en su grupo de prueba una frecuencia similar de sitios con PPD < 5 mm después de 12 meses, es decir, 76 a 77% en los 2 estudios anteriores y 71% en este. Además, en uno de los estudios RCT que informaron sobre el cierre de bolsas (es decir, PPD ≤ 4 mm sin BoP), se observó una tasa comparable en el grupo de HyA como en este, es decir, en 59 y 57%, respectivamente. Sin embargo, una diferencia significativa entre esos 2 RCT y el estudio actual se refiere a las características del producto del gel de HyA aplicado. Específicamente, se utilizó en este estudio un HyA no reticulado, de peso molecular medio, con una concentración relativamente baja (0.3%), mientras que los otros estudios utilizaron un producto con HyA reticulado, de alto peso molecular a una concentración más alta o un producto combinado con polinucleótidos y HyA de alto peso molecular a una concentración más alta. Estudios de laboratorio sobre células periodontales o patógenos asociados a la periodontitis han comparado los efectos de HyA no reticulado y reticulado o de HyA de diferentes pesos moleculares; ninguna de las formulaciones probadas mostró ningún efecto negativo en términos de cicatrización de heridas periodontales. En este contexto, debido a la falta de ensayos clínicos comparativos hasta ahora, sigue siendo incierto si las diferentes características de HyA realmente se traducen en diferencias clínicamente relevantes. Otra diferencia entre esos 2 RCT y este se refiere al modo/frecuencia de aplicación de HyA. En este estudio, el gel que contiene HyA se aplicó repetidamente (diariamente) de forma supragingival durante 3 meses por los pacientes, además de las aplicaciones subgingivales en la consulta. Uno de los estudios anteriores evaluó el efecto de una aplicación repetida en la consulta después de 3 meses, pero no logró mostrar ningún efecto beneficioso adicional de HyA después de la re-aplicación; sin embargo, antes de la re-aplicación no se realizó ninguna instrumentación subgingival adicional en este estudio específico. En este caso, solo los sitios con signos de patología restantes recibieron una re-aplicación en combinación con la re-instrumentación subgingival. En ambos grupos (es decir, prueba y control), aproximadamente el 30% de los sitios que requerían re-instrumentación y re-aplicación fueron considerados como tratados con éxito al final del ensayo. Sin embargo, aunque el re-tratamiento mejoró la situación en 1 de cada 3 casos y no se pudo notar un efecto beneficioso distinto de HyA, el número de sitios que requerían re-instrumentación (re-tratamiento) a los 3 meses fue significativamente menor en el grupo de HyA, en comparación con el que recibió NaCl. Finalmente, también los datos actuales no permiten ninguna conclusión sobre un posible efecto adicional de la aplicación supragingival repetida por parte de los pacientes durante 3 meses, ya que faltaba aquí un tercer grupo con solo entrega subgingival en la consulta.
En general, se ha demostrado que reducir el número de bolsas residuales después del tratamiento periodontal activo (es decir, pasos 1 a 3) es beneficioso en términos de recurrencia/progresión de la enfermedad y pérdida dental en varios estudios que se centran en el SPC a largo plazo después del tratamiento periodontal activo. Por lo tanto, es razonable suponer que cualquier medida de tratamiento, como el uso de adyuvantes aplicados localmente, que mejore la tasa de cierre de bolsas - independientemente de la etapa del tratamiento - puede contribuir positivamente también al resultado a largo plazo. En este contexto, los geles que contienen HyA como adyuvante a la instrumentación subgingival en el segundo paso de la terapia han mostrado cierto potencial en términos de reducción de PPD y BoP, lo cual ha sido reconfirmado por ensayos controlados aleatorios más recientes. En comparación con otros estudios con un diseño de estudio similar pero que evalúan diferentes productos como adyuvantes a la reinstrumentación de bolsas residuales en pacientes con SPC, la frecuencia de cierre de bolsas parecía un poco más baja aquí. Por ejemplo, 2 ensayos controlados aleatorios recientes que evaluaron el efecto adyuvante de la aplicación sin colgajo de derivados de matriz de esmalte, gel de hipoclorito de sodio y gel de clorhexidina informaron un cierre de bolsas (es decir, PPD ≤ 4 mm sin BoP) en el 80, 78 y 63% de los sitios en comparación con el 57% aquí. Por lo tanto, y considerando la falta de ensayos controlados aleatorios que comparen directamente estos productos, el HyA parecía igualmente efectivo que el gel de CHX, pero ligeramente inferior a los derivados de matriz de esmalte y al gel de hipoclorito de sodio. Este último podría ser de interés específico, ya que la combinación de gel de hipoclorito de sodio con gel de HyA reticulado ha recibido recientemente atención como tratamiento adyuvante combinado en pacientes con periodontitis. Sin embargo, una serie de casos retrospectiva reciente que incluyó a 29 pacientes con SPC con bolsas residuales/recidivantes informó para este enfoque combinado una tasa de cierre de bolsas algo más baja del 25%.
Entre los factores de confusión utilizados para ajustar el análisis presente, dos tuvieron un efecto significativo en el resultado en la evaluación final, es decir, el control de placa y la adherencia/tiempo, que están bien en acuerdo con la literatura. Específicamente, aquí la presencia de placa, que fue evaluada en cada sitio experimental en cada sesión de SPC, disminuyó significativamente las probabilidades de lograr el cierre de bolsas. Motivar con éxito a los pacientes para mantener niveles altos de control de placa durante el SPC es un desafío clínico bien conocido y estudios recientes de SPC a largo plazo re-confirmaron su relevancia clínica. Ambos estudios, que incluyeron a 100 y más de 200 individuos, respectivamente, sometidos a aproximadamente 10 años de SPC después de un tratamiento periodontal activo, mostraron un aumento en el riesgo de recurrencia de la enfermedad y pérdida de dientes debido a la periodontitis con un mal control de placa. Además, los pacientes del presente ECA mostraron en general e independientemente de la asignación del grupo una mejora significativa a lo largo del tiempo, que se volvió significativa después de 12 meses. Específicamente, también en el grupo de control/placebo casi el 50% de los sitios experimentales lograron el cierre de bolsas al final del ensayo. Este tamaño del efecto de lograr el cierre de bolsas solo mediante re-instrumentación mecánica es comparable con estudios anteriores que informaron tasas del 42 al 60%. Además, la participación en el estudio por sí misma probablemente tiene un efecto beneficioso en la adherencia desde la perspectiva del paciente, pero también desde la perspectiva del dentista/higienista dental tratante, quien podría insistir más en mantener el intervalo de 3 meses. En este contexto, se ha demostrado que un tiempo más corto entre sesiones consecutivas de SPC puede resultar con el tiempo en una reducción de PPD y estabilidad periodontal, mientras que un tiempo más largo puede llevar a inestabilidad periodontal y posteriormente a la pérdida de dientes.
El presente estudio – realizado en condiciones de “vida real” – presenta algunas limitaciones, como una tasa de abandono relativamente alta del 30%, lo que no nos permitió alcanzar el tamaño de muestra previsto en el grupo de control/placebo, es decir, se analizaron 26 en lugar de 30 participantes. La alta tasa de abandono se debe al menos en parte a que los participantes faltaron a sus citas programadas durante la pandemia de Covid-19, es decir, aunque se aceptó un rango de 2.5 a 5 meses entre 2 sesiones de SPC, casi el 10% de los participantes (es decir, 2 y 5 del grupo de prueba/HyA y del grupo de control/placebo, respectivamente) fueron excluidos del análisis debido a intervalos demasiado largos. Sin embargo, dado que el tiempo entre 2 sesiones de SPC parece ser un factor relevante, este parámetro se incluyó en los análisis de regresión aquí, para corregir en el modelo la ligera variación en los intervalos de SPC. Sin embargo, dado que el presente ensayo se realizó en un diseño de grupos paralelos, los pacientes no recibieron ambos productos, lo que a su vez debería limitar cualquier sesgo debido a un insuficiente enmascaramiento de los pacientes. En este contexto, fue interesante que los grupos no presentaron diferencias significativas respecto a la opinión de los pacientes sobre la consistencia y el sabor del producto; ambos productos fueron bien aceptados por los pacientes, lo que a su vez puede indicar una buena adherencia.
Conclusión
La re-instrumentación de los bolsillos residuales en pacientes con SPC, per se, conduce a un aumento significativo en el cierre de bolsillos con el tiempo. Esta mejora dependió de la higiene oral del paciente, es decir, la presencia de placa aumentó las probabilidades de permanecer enfermo en aproximadamente 8 veces. La aplicación adicional sub- y supragingival repetida de un gel que contiene HyA resultó en significativamente menos sitios que requerían re-instrumentación a los 3 meses, y en algunas diferencias clínicamente relevantes después de 12 meses de SPC en comparación con el grupo de control/placebo, como el 71 frente al 52% de los sitios experimentales alcanzando un PPD < 5 mm, respectivamente. Sin embargo, la significancia estadística de este efecto se perdió marginalmente en el análisis ajustado sobre el logro del cierre de bolsillos. Por lo tanto, se necesitan más ensayos clínicos para confirmar la superioridad de este complemento en comparación con la re-instrumentación subgingival sola.
Autores: Kristina Bertl, Stefania Vlachou, Nikolaos Pandis, Antonios Zampelis, Andreas Stavropoulos
Referencias:
- Sanz M, Herrera D, Kebschull M et al (2020) Tratamiento de la periodontitis en etapas I-III: la guía de práctica clínica de nivel S3 de la EFP. J Clin Periodontol 47(Suppl 22):4–60. https://doi.org/10.1111/jcpe.13290
- Suvan J, Leira Y, Moreno Sancho FM, Graziani F, Derks J, Tomasi C (2020) Instrumentación subgingival para el tratamiento de la periodontitis. Una revisión sistemática. J Clin Periodontol 47(Suppl 22):155–175. https://doi.org/10.1111/jcpe.13245
- Chapple ILC, Mealey BL, Van Dyke TE et al (2018) Salud periodontal y enfermedades y condiciones gingivales en un periodonto intacto y reducido: informe de consenso del grupo de trabajo 1 del Taller Mundial de Clasificación de Enfermedades y Condiciones Periodontales y Peri-Implantarias 2017. J Clin Periodontol 45(Suppl 20):S68–S77. https://doi.org/10.1111/jcpe.12940
- Bertl K, Pandis N, Stopfer N, Haririan H, Bruckmann C, Stavropoulos A (2022) El impacto del estado de “paciente con periodontitis tratada con éxito y estable” en los parámetros de resultado relacionados con el paciente durante el cuidado periodontal de soporte a largo plazo. J Clin Periodontol 49:101–110. https://doi.org/10.1111/jcpe.13582
- Rattu V, Raindi D, Antonoglou G, Nibali L (2023) Prevalencia de sujetos con periodontitis estable y tratada con éxito e incidencia de pérdida dental subsecuente dentro del cuidado periodontal de soporte: una revisión sistemática con metaanálisis. J Clin Periodontol. https://doi.org/10.1111/jcpe.13835
- Donos N, Calciolari E, Brusselaers N, Goldoni M, Bostanci N, Belibasakis GN (2020) El uso adyuvante de moduladores del huésped en la terapia periodontal no quirúrgica. Una revisión sistemática de estudios clínicos aleatorizados controlados con placebo. J Clin Periodontol 47(Suppl 22):199–238. https://doi.org/10.1111/jcpe.13232
- Herrera D, Matesanz P, Martín C, Oud V, Feres M, Teughels W (2020) Efecto adyuvante de antimicrobianos administrados localmente en la terapia de periodontitis: una revisión sistemática y metaanálisis. J Clin Periodontol 47(Suppl 22):239–256. https://doi.org/10.1111/jcpe.13230
- Calciolari E, Ercal P, Dourou M, Akcali A, Tagliaferri S, Donos N (2022) La eficacia de las terapias periodontales adyuvantes durante el cuidado periodontal de soporte en pacientes con bolsas residuales. Una revisión sistemática y metaanálisis. J Periodontal Res 57:671–689. https://doi.org/10.1111/jre.13001
- Wang CY, Yang YH, Li H et al (2020) Tratamientos locales adyuvantes para pacientes con bolsas residuales durante el cuidado periodontal de soporte: una revisión sistemática y metaanálisis en red. J Clin Peri- odontol 47:1496–1510. https://doi.org/10.1111/jcpe.13379
- Bertl K, Bruckmann C, Isberg PE, Klinge B, Gotfredsen K, Stavropoulos A (2015) Hialuronano en terapia periodontal no quirúrgica y quirúrgica: una revisión sistemática. J Clin Periodontol 42:236–246. https://doi.org/10.1111/jcpe.12371
- Eliezer M, Imber JC, Sculean A, Pandis N, Teich S (2019) Ácido hialurónico como adyuvante en la terapia periodontal no quirúrgica y quirúrgica: una revisión sistemática y metaanálisis. Clin Oral Investig 23:3423–3435. https://doi.org/10.1007/s00784-019-03012-w
- Karakostas P, Davidopoulou S, Kalfas S (2022) Uso de ácido hialurónico en el tratamiento de enfermedades periodontales: una revisión sistemática. J Contemp Dent Pract 23:355–370
- Tan OL, Safii SH, Razali M (2021) Eficacia clínica de aplicaciones repetidas de entrega local de medicamentos y agentes adyuvantes en terapia periodontal no quirúrgica: una revisión sistemática. Antibiotics (Basel) 10:1178. https://doi.org/10.3390/antibiotics10101178
- Pilloni A, Rojas MA, Trezza C et al (2023) Efectos clínicos del uso adyuvante de gel de polinucleótidos y ácido hialurónico en la re-instrumentación subgingival de bolsas periodontales residuales: un ensayo clínico aleatorizado y a doble ciego. J Periodontol 94:354–363. https://doi.org/10.1002/JPER.22-0225
- Pilloni A, Zeza B, Kuis D et al (2021) Tratamiento de bolsas periodontales residuales utilizando un gel a base de ácido hialurónico: un ensayo clínico multicéntrico aleatorizado a doble ciego de 12 meses. Antibiotics (Basel) 10:924. https://doi.org/10.3390/antibiotics10080924
- Schulz KF, Altman DG, Moher D, CONSORT G (2010) Declaración CON-SORT 2010: pautas actualizadas para la presentación de ensayos aleatorizados de grupos paralelos. PLoS Med 7:e1000251. https://doi.org/ 10.1371/journal.pmed.1000251
- Papapanou PN, Sanz M, Buduneli N et al (2018) Periodontitis: Informe de consenso del grupo de trabajo 2 del Taller Mundial de Clasificación de Enfermedades y Condiciones Periodontales y Peri-Implantarias 2017. J Clin Periodontol 45(Suppl 20):S162–S170. https:// doi.org/10.1111/jcpe.12946
- Tonetti MS, Greenwell H, Kornman KS (2018) Etapas y grados de periodontitis: marco y propuesta de una nueva clasificación y definición de caso. J Clin Periodontol 45(Suppl 20):S149– S161. https://doi.org/10.1111/jcpe.12945
- Armitage GC (2000) Desarrollo de un sistema de clasificación para enfermedades y condiciones periodontales. Northwest Dent 79:31–35
- Hamp SE, Nyman S, Lindhe J (1975) Tratamiento periodontal de dientes multirradiculares. Resultados después de 5 años. J Clin Periodontol 2:126–135. https://doi.org/10.1111/j.1600-051x.1975.tb01734.x
- Asparuhova MB, Kiryak D, Eliezer M, Mihov D, Sculean A (2019) Actividad de dos preparaciones de hialuronano en fibroblastos orales humanos primarios. J Periodontal Res 54:33–45. https://doi.org/10. 1111/jre.12602
- Fujioka-Kobayashi M, Müller HD, Mueller A et al (2017) Efectos in vitro del ácido hialurónico en células del ligamento periodontal humano. BMC Oral Health 17:44. https://doi.org/10.1186/ s12903-017-0341-1
- Mueller A, Fujioka-Kobayashi M, Mueller HD et al (2017) Efecto del ácido hialurónico en los cambios morfológicos de las superficies de dentina y el efecto subsiguiente en la supervivencia, adhesión y expansión de las células del ligamento periodontal. Clin Oral Investig 21:1013–1019. https://doi.org/10.1007/s00784-016-1856-6
- Chen M, Li L, Wang Z, Li P, Feng F, Zheng X (2019) El ácido hialurónico de alto peso molecular regula la inflamación y migración inducidas por P. gingivalis en fibroblastos gingivales humanos a través de la vía de señalización MAPK y NF-κB. Arch Oral Biol 98:75–80. https:// doi.org/10.1016/j.archoralbio.2018.10.027
- Dannewitz B, Zeidler A, Hüsing J et al (2016) Pérdida de molares en pacientes tratados periodontalmente: resultados 10 años o más después de la terapia periodontal activa. J Clin Periodontol 43:53–62. https:// doi.org/10.1111/jcpe.12488
- Graetz C, Schützhold S, Plaumann A et al (2015) Factores pronósticos para la pérdida de molares: un estudio de cohorte retrospectivo de 18 años. J Clin Periodontol 42:943–950. https://doi.org/10.1111/jcpe.12460
- Graetz C, Plaumann A, Schlattmann P et al (2017) Retención dental a largo plazo en periodontitis crónica: resultados después de 18 años de un régimen de tratamiento periodontal conservador en un entorno universitario. J Clin Periodontol 44:169–177. https://doi.org/10.1111/jcpe.12680
- Matuliene G, Pjetursson BE, Salvi GE et al (2008) Influencia de las bolsas residuales en la progresión de la periodontitis y la pérdida dental: resultados después de 11 años de mantenimiento. J Clin Periodontol 35:685– 695. https://doi.org/10.1111/j.1600-051X.2008.01245.x
- Salvi GE, Mischler DC, Schmidlin K et al (2014) Factores de riesgo asociados con la longevidad de dientes multirradiculares. Resultados a largo plazo después de la terapia periodontal activa y de soporte. J Clin Periodontol 41:701–707. https://doi.org/10.1111/jcpe.12266
- Ariel H, Kahn A, Hila ZO, Anton S, Natan G, Kolerman R (2022) Un gel termorreactivo con un ingrediente activo de ácido hialurónico que contiene un sistema de preservación de octenidina como adyuvante a la escala y al alisado radicular: un estudio clínico prospectivo aleatorizado. Clin Oral Investig 26:3721–3733. https://doi.org/10.1007/s00784-021-04344-2
- Mohammad CA, Mirza BA, Mahmood ZS, Zardawi FM (2023) El efecto del gel de ácido hialurónico en los parámetros periodontales, citoquinas proinflamatorias y marcadores bioquímicos en pacientes con periodontitis. Gels 9:325. https://doi.org/10.3390/gels9040325
- Olszewska-Czyz I, Kralik K, Prpic J (2021) Biomoléculas en aplicaciones dentales: ensayo clínico aleatorizado y controlado que evalúa la influencia de la terapia adyuvante con ácido hialurónico en los parámetros clínicos de la periodontitis moderada. Biomolecules 11:1491. https://doi.org/10.3390/biom11101491
- Ramanauskaite E, Machiulskiene V, Shirakata Y, Dvyliene UM, Nedzelskiene I, Sculean A (2023) Evaluación clínica de hipoclorito de sodio/aminoácidos y ácido hialurónico reticulado adyuvante al tratamiento periodontal no quirúrgico: un ensayo clínico controlado aleatorizado. Clin Oral Investig. https://doi.org/10.1007/ s00784-023-05271-0
- Jentsch HFR, Roccuzzo M, Pilloni A, Kasaj A, Fimmers R, Jepsen S (2021) Aplicación sin colgajo de derivado de matriz de esmalte en retratamiento periodontal: un ensayo de viabilidad multicéntrico aleatorizado. J Clin Periodontol 48:659–667. https://doi.org/10.1111/jcpe.13438
- Radulescu V, Boariu MI, Rusu D et al (2022) Efectos clínicos y microbiológicos de una sola aplicación de gel de hipoclorito de sodio durante la re-instrumentación subgingival: un ensayo clínico aleatorizado controlado a triple ciego. Clin Oral Investig 26:6639–6652. https://doi.org/10.1007/s00784-022-04618-3
- Diehl D, Friedmann A, Liedloff P, Jung RM, Sculean A, Bilhan H (2022) Aplicación adyuvante de ácido hialurónico en combinación con un gel de hipoclorito de sodio para el tratamiento no quirúrgico de bolsas residuales reduce la necesidad de cirugía periodontal: análisis retrospectivo de una serie de casos clínicos. Materials (Basel) 15:6508. https://doi.org/10.3390/ma15196508
- Costa FO, Costa AM, Cortelli JR et al (2023) Efecto del control de placa supragingival en la periodontitis recurrente y la estabilidad clínica entre individuos bajo terapia de mantenimiento periodontal: seguimiento de 10 años. J Periodontol 94:55–65. https://doi.org/10. 1002/JPER.22-0301
- Tomasi C, Koutouzis T, Wennström JL (2008) Doxiciclina administrada localmente como adyuvante a la desbridación mecánica en el retratamiento de bolsas periodontales. J Periodontol 79:431–439. https:// doi.org/10.1902/jop.2008.070383
- Ramseier CA, Nydegger M, Walter C et al (2019) El tiempo entre las visitas de control y las profundidades de sondeo residuales predicen la estabilidad a largo plazo en pacientes inscritos en terapia periodontal de soporte. J Clin Periodontol 46:218–230. https://doi.org/10.1111/jcpe.13041
