Eficacia de la terapia a largo plazo con macrólidos en dosis bajas para prevenir la recurrencia temprana de pólipos nasales tras la cirugía endoscópica de senos paranasales.
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Antecedentes: Este estudio evaluó la eficacia de la terapia de macrólidos “a largo plazo” con claritromicina como un complemento a la terapia de mantenimiento con corticosteroides nasales para prevenir la recurrencia de pólipos nasales (PN) después de la cirugía endoscópica funcional de senos paranasales (FESS).
Métodos: Un total de 66 pacientes con rinosinusitis crónica y PN bilaterales fueron aleatorizados en 3 grupos de estudio, 22 pacientes en cada grupo. Después de la FESS, los pacientes en los primeros y segundos grupos fueron tratados con claritromicina 250 mg/día durante 12 y 24 semanas, respectivamente, mientras que los pacientes en el tercer grupo no recibieron ninguna claritromicina. Los pacientes en los 3 grupos recibieron terapia de mantenimiento con furoato de mometasona 400 μg/día. La evaluación de los pacientes se realizó antes de la cirugía y a las 6, 12 y 24 semanas después de la cirugía, utilizando una escala analógica visual (EAV), una prueba de resultado SinoNasal de 20 ítems (SNOT-20), rinometría acústica, rinomanometría, tiempo de tránsito de sacarina, endoscopia nasal, tomografía computarizada (TC) de senos paranasales y medición del nivel de proteína catiónica eosinofílica (ECP) en sus secreciones nasales.
Resultados: El estudio confirmó la eficacia de la terapia con macrólidos “a largo plazo”, resultando en una mejora significativa de todos los parámetros excepto la rinometría acústica y el VAS en ambos grupos de claritromicina en comparación con el control. La concentración de ECP en las secreciones nasales aumentó dramáticamente después de la cirugía, y luego regresó a niveles basales después de 12 y 24 semanas de tratamiento con claritromicina. En el grupo de control, el nivel de ECP continuó aumentando y fue significativamente más alto en el punto final. Ambos grupos con claritromicina mostraron puntuaciones endoscópicas y de TC significativamente mejores que el grupo de control en el punto final.
Conclusión: La claritromicina “a largo plazo” a baja dosis de 250 mg/día es capaz de controlar la inflamación eosinofílica y prevenir la recaída temprana de NP después de FESS 2014 ARS-AAOA, LLC.
La rinosinusitis crónica (CRS) a menudo ocurre en asociación con pólipos nasales (NP). En un estudio, se diagnosticó CRS con NP (CRSwNP) en el 4% de una población total y está asociada con asma bronquial (BA) en el 7% al 13% de los casos. Además, la enfermedad respiratoria exacerbada por aspirina (AERD) y NP están presentes en un gran número de pacientes (rango, 36-96%). En CRSwNP, la célula inflamatoria predominante es el eosinófilo, que se encuentra tanto en el tejido como en el moco de las vías respiratorias en casi todos los pacientes con CRSwNP. Aunque se ha investigado el papel de la infección (inflamación neutrofílica), no parece ser un factor primario en el desarrollo de CR-SwNP, aunque CRSwNP está asociado con BA. La alergia parece ser una condición comórbida y no un factor primario en el desarrollo de CRSwNP. En la actualidad, ni el tratamiento médico ni el quirúrgico pueden garantizar un control permanente o una cura duradera. Actualmente, el único tratamiento probado para el control efectivo de CRSwNP son los aerosoles nasales esteroides tópicos con o sin glucocorticoides sistémicos (GCS). La CRSwNP recurrente no siempre se previene incluso con GCS sistémicos y los efectos secundarios pueden ser graves, incluyendo cataratas y colapso vertebral. Debido a que el control de la enfermedad puede ser difícil incluso con GCS sistémicos, decidimos estudiar el tratamiento con terapia “a largo plazo” (3-6 meses o más) utilizando antibióticos macrólidos a baja dosis. Aparentemente, son las propiedades no antimicrobianas de los macrólidos (eritromicina, roxithromicina, claritromicina) las que contribuyen a sus efectos antiinflamatorios, que incluyen la inhibición tanto de la inflamación neutrofílica como eosinofílica. Los macrólidos son capaces de modular la respuesta inmune, inhibir el crecimiento de pólipos, destruir biopelículas y mejorar las propiedades protectoras de la mucosa del tracto respiratorio.
La efectividad de los macrólidos en pacientes con CRS sin NP ha sido confirmada; sin embargo, su eficacia en pacientes con CRSwNP no ha sido investigada a fondo. Por lo tanto, nuestro estudio controlado aleatorizado prospectivo fue diseñado para evaluar la eficacia y seguridad de un tratamiento a largo plazo (3 y 6 meses) con claritromicina en dosis baja en pacientes con CRSwNP después de una cirugía endoscópica funcional de senos paranasales (FESS).
Pacientes y métodos
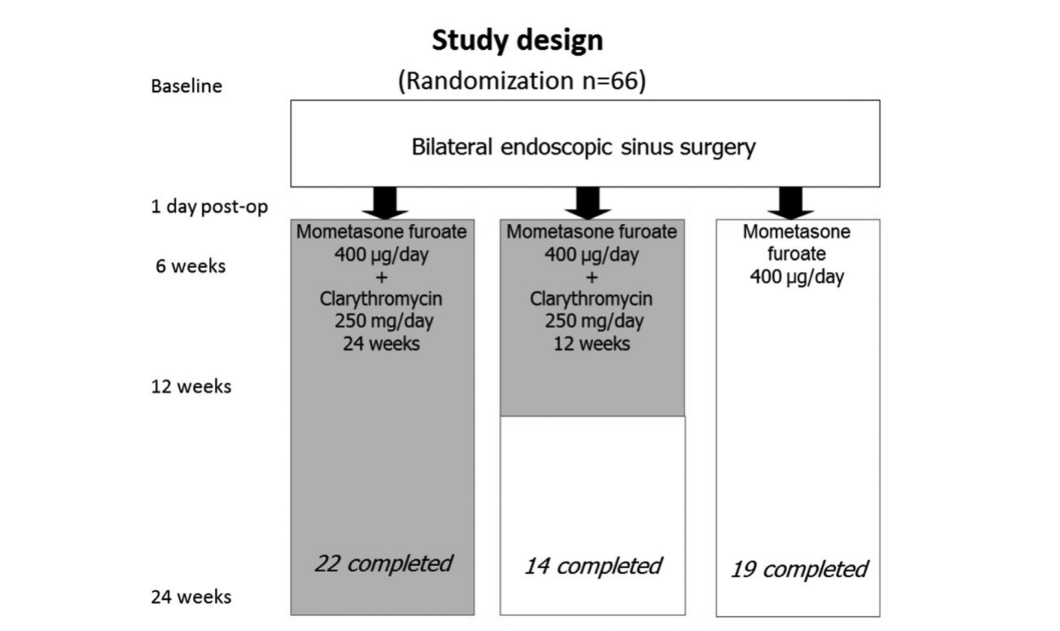
Se reclutaron un total de 66 pacientes (36 hombres y 30 mujeres) de entre 18 y 77 (promedio, 48.7) años con CRSwNP bilateral confirmado por endoscopia. El período del estudio fue de enero de 2008 a marzo de 2011. Los 66 pacientes fueron asignados aleatoriamente (sistema de sobre sellado) a 1 de 3 grupos de estudio (22 pacientes por grupo) de la siguiente manera: grupo 1 (antibióticos durante 24 semanas); grupo 2 (antibióticos durante 12 semanas); y grupo 3 (control, sin antibióticos).
Los 3 grupos recibieron spray nasal esteroide tópico (furoato de mometasona), 400 μg/día durante 24 semanas después de FESS. El antibiótico macrólido utilizado en los grupos 1 y 2 fue claritromicina 250 mg/día (Klacid; Abbott Laboratories, Abbott Park, Illinois, EE. UU.). La mayoría de los pacientes (79%) había tenido al menos 1 cirugía de senos paranasales previa sin éxito a largo plazo; el número medio de cirugías previas en los 66 pacientes fue de 3.2 (Tabla 1).
Los criterios de exclusión incluyeron lo siguiente: CR-SwNP unilateral, intolerancia a macrólidos, uso de esteroides sistémicos, embarazo, lactancia y enfermedades somáticas severas. Excluimos a todos los pacientes que estaban en tratamiento con esteroides sistémicos porque en Rusia, la terapia con esteroides sistémicos se reserva solo para pacientes con BA severa. Sería poco ético interrumpir los esteroides sistémicos en estos pacientes con BA; además, los esteroides sistémicos podrían tener un impacto negativo en la fiabilidad de los resultados de nuestro estudio. El Comité de Ética de la Primera Universidad Estatal de Medicina de Moscú Sechenov, requirió que todos los pacientes en los 3 grupos mantuvieran el uso de esteroides nasales tópicos después de la FESS, de lo contrario, el NP puede reaparecer rápidamente.
Después de la reclutación, los 66 pacientes se sometieron a FESS bilateral realizado por el mismo cirujano (autor principal Lopatin A.). Los pacientes en el grupo 1 (antibióticos durante 24 semanas) y el grupo 2 (antibióticos durante 12 semanas) comenzaron la terapia a largo plazo con claritromicina 250 mg/día el primer día postoperatorio y durante 24 semanas (6 meses) o 12 semanas (3 meses), respectivamente. En el séptimo día después de la cirugía, todos los pacientes comenzaron la terapia de mantenimiento con spray nasal de furoato de mometasona (Nasonex, MSD, Merck & Co., Inc., NJ, EE. UU.) 400 μg/día durante un total de 6 meses, incluidos los pacientes del grupo 3 (control sin antibióticos). El Comité de Ética aprobó el protocolo final del estudio con todos los 66 pacientes inscritos firmando formularios de consentimiento.
Los pacientes fueron cuidadosamente seguidos y vistos a las 6 semanas, 12 semanas y 24 semanas después de FESS (Fig. 1). Los resultados del tratamiento se basaron en la evaluación de las siguientes pruebas.
Prueba de Resultado SinoNasal de 20 ítems (SNOT-20) La Prueba de Resultado SinoNasal de 20 ítems (SNOT-20) es un cuestionario para evaluar la calidad de vida (CvD) en pacientes con rinosinusitis.
Escala analógica visual
La gravedad de la enfermedad fue evaluada por la evaluación subjetiva de los pacientes en la escala analógica visual (EAV) de 10 cm; 1 cm en la escala reflejaba 1 punto de la evaluación del paciente; 0 a 3 puntos correspondían a enfermedad leve, 3 a 7 puntos correspondían a enfermedad moderada, y 7 a 10 puntos correspondían a enfermedad severa.
Prueba olfativa
Se utilizó la “prueba Sniffin Sticks,” versión extendida (Burghart Messtechnik GmbH, Wedel, Alemania) para cada paciente. La identificación de olores se evaluó mediante 16 tubos de ensayo con diferentes olores. El número de respuestas correctas se relacionó con el grado de alteración olfativa, siendo 16 la puntuación máxima posible. Una puntuación de 0 a 6 refleja anosmia, una puntuación de 7 a 12 se denomina hiposmia, mientras que una puntuación que varía de 13 a 16 es normal.
Prueba de tiempo de tránsito de sacarina
Esta prueba mide el tiempo de tránsito de una partícula de sacarina para pasar desde la cabeza anterior del cornete nasal inferior hasta la faringe cuando el paciente experimenta por primera vez la sensación de un sabor dulce.
Endoscopia nasal
Se realizó una endoscopia con un endoscopio rígido de 2.7 mm (Karl Storz, Tutlingen, Alemania) sin descongestión. Se registraron puntuaciones semicuantitativas para pólipos, edema, secreción, costras y cicatrices en la línea de base, a las 6 semanas, a las 12 semanas y en la evaluación final a las 24 semanas después de la FESS. Estos resultados se evaluaron utilizando una puntuación de apariencia endoscópica (EAS). Los pólipos se clasificaron por tamaño de 0 a 3 puntos; la ausencia de pólipos se puntuó como 0, los pólipos que aparecían solo en el meato medio se puntuaron como 1; los pólipos que se extendían más allá del meato medio pero no obstruían la nariz se puntuaron como 2; y los pólipos que obstruían completamente la nariz se puntuaron como 3. La secreción se puntuó de la siguiente manera: 0 = sin secreción; 1 = secreción clara y delgada; y 2 = secreción espesa y purulenta. El edema mucoso se puntuó de la siguiente manera: 0 = ausente; 1 = leve; 2 = severo. Las costras y cicatrices en la cavidad postoperatoria se puntuaron de la siguiente manera: 0 = ausente; 1 = leve; y 2 = severo; estos hallazgos se evaluaron para la cavidad nasal derecha e izquierda por separado.
Rinomanometría anterior activa y rinometría acústica
La rinomanometría anterior activa (AAR) y la rinometría acústica (AR) se llevaron a cabo con el dispositivo SRE 2000 (Rhinometrics, Lynge, Dinamarca), que permitió realizar ambas pruebas: la AAR evaluó objetivamente tanto la resistencia nasal como el flujo de aire nasal, mientras que la AR reflejó la geometría y el volumen de toda la cavidad nasal.
Tomografía computarizada multicorte La tomografía computarizada multicorte (TC) de la nariz y los senos paranasales se realizó antes y 6 meses después de la FESS en todos los pacientes. Se obtuvieron cortes de medio centímetro (5 mm) en los planos axial y coronal. Se calculó el grado de opacificación de un seno particular (0-2) y del complejo ostiomeatal (0 = intacto, 2 = ocluido) utilizando el sistema de puntuación de Lund-Mackay.
Proteína catiónica eosinofílica
Los contenidos de proteína catiónica eosinofílica (ECP) en la secreción nasal se midieron utilizando un kit de recolección con datos generados por el analizador automático quimioluminiscente IMMULITE 1000 (Siemens Healthcare Diagnostics Inc, NY, EE. UU.). Para recolectar el moco, se introdujo un trozo de esponja de goma espuma estéril de 20 × 20 × 5 mm en el meato medio durante 20 minutos. Después de la extracción, la esponja se colocó en un tubo de ensayo de 10 mL y se centrifugó durante 3 minutos a una velocidad de 4000 rpm, permitiendo la recolección de 0.2 a 1.0 mL de moco para un análisis posterior. La sensibilidad de la prueba fue de 0.2 ng/mL.
Pruebas microbiológicas
Se recogió un hisopo nasal para pruebas microbiológicas del meato nasal medio antes de la FESS y en todas las visitas postoperatorias. Se realizaron pruebas de cultivo y sensibilidad (resistencia) utilizando el analizador bacteriológico Walk Away-40 (Dade Behring, Marburg, Alemania) y el método de difusión en disco (discos de Becton Dickinson con claritromicina, EE. UU.). Los resultados se estimaron de acuerdo con las recomendaciones del CLSI (instituto de estándares clínicos y de laboratorio).
Pruebas cutáneas
Se realizaron pruebas cutáneas para alérgenos de interiores y exteriores en todos los pacientes utilizando métodos estándar.
Evaluación final de los resultados del tratamiento
La evaluación final de los resultados del tratamiento se llevó a cabo utilizando los cambios en las puntuaciones de EAS y Lund-Mackay CT a las 24 semanas después de la FESS.
Análisis estadístico
Después de consultar a un estadístico médico, los resultados obtenidos se ingresaron en una base de datos computarizada y se procesaron utilizando el paquete de software estadístico SPSS versión 17.0 para Windows. Se realizaron pruebas de rango con signo de Wilcoxon para evaluar los efectos del tratamiento en varios puntos en el tiempo. Los valores se presentaron como medias ± desviaciones estándar. Los cambios dentro y entre grupos se consideraron estadísticamente significativos cuando los valores p eran <0.05.
Resultados
Once pacientes fueron excluidos del estudio por diversas razones: 8 pacientes en el grupo 2 (antibióticos durante 12 semanas) fueron retirados. Un paciente desarrolló dolor abdominal después de comenzar la terapia con claritromicina; un segundo paciente fue retirado debido a pesadillas que comenzaron 3 días después de iniciar el tratamiento con claritromicina. Una mujer en el mismo grupo desarrolló una exacerbación de duodenitis erosiva 2 meses después de la inscripción y fue retirada, mientras que 5 otros fueron retirados por incumplimiento. Una paciente femenina en el grupo 3 (control sin antibióticos) fue excluida debido a embarazo y 2 otras en este grupo fueron retiradas por incumplimiento. Por lo tanto, 55 pacientes completaron el estudio y en la última visita todos los 22 pacientes en el grupo 1 (antibióticos durante 24 semanas) completaron el estudio, 14 pacientes permanecieron en el grupo 2 (antibióticos durante 12 semanas) y 19 pacientes permanecieron en el grupo 3 (control sin antibióticos).
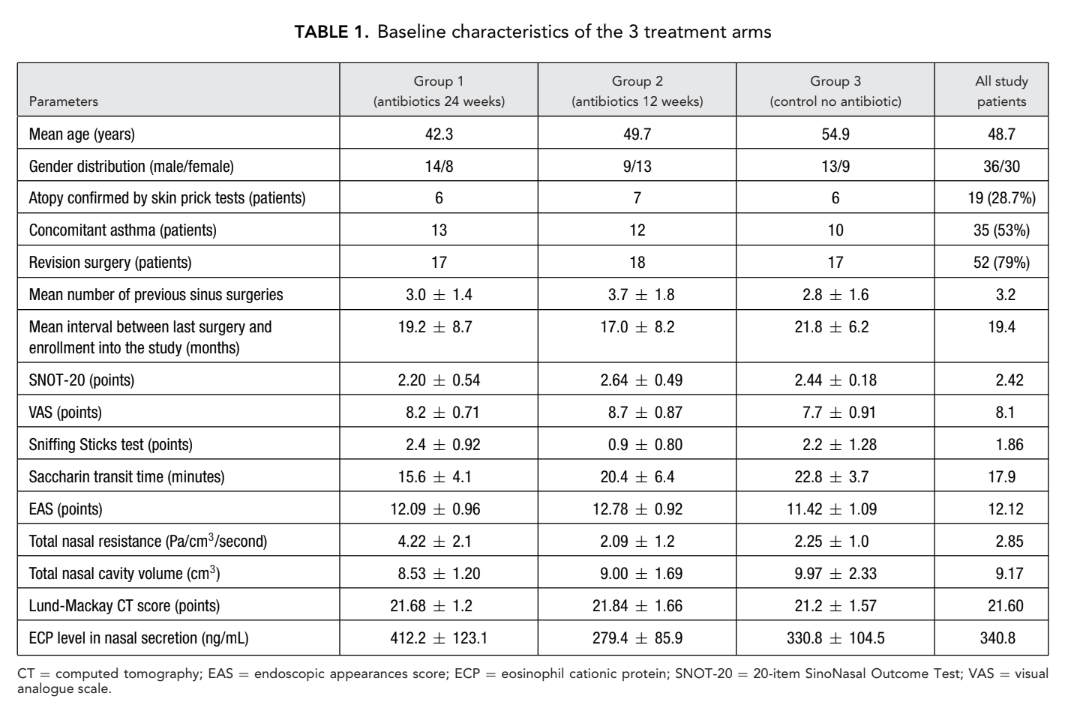
Treinta y cinco pacientes tenían BA, y 27 de estos 35 pacientes presentaron AERD. La atopia fue confirmada por pruebas cutáneas de punción en 19 de los 66 pacientes iniciales. No hubo diferencias significativas entre los 3 grupos en cuanto a edad, sexo, presencia de atopia, gravedad de la enfermedad y número de cirugías previas, así como todos los otros parámetros iniciales que examinamos. Las características basales de cada uno de los 3 brazos de tratamiento: grupo 1 (antibióticos durante 24 semanas), grupo 2 (antibióticos durante 12 semanas) y grupo 3 (control sin antibióticos) se presentan en la Tabla 1.
Los resultados del tratamiento fueron mejores para los pacientes que completaron el curso de tratamiento a largo plazo con claritromicina en el grupo 1 (antibióticos durante 24 semanas) y el grupo 2 (antibióticos durante 12 semanas) en comparación con los pacientes del grupo 3 (control sin antibióticos).
Diferencias estadísticamente significativas (p < 0.05) se obtuvieron para todos los parámetros (pero no en cada visita) entre los grupos de medicamentos del estudio 1 y 2 y el grupo 3 (control sin antibióticos), siendo la única excepción para VAS y AR donde no se logró evidencia estadísticamente significativa.
SNOT-20
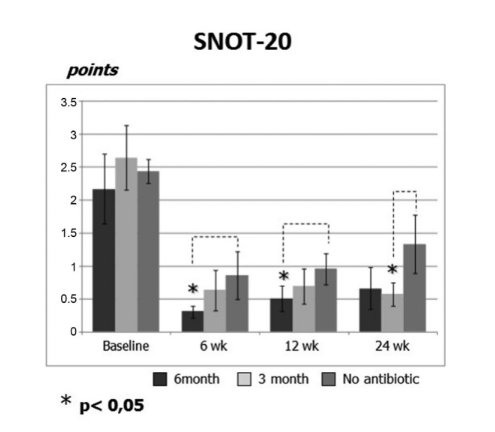
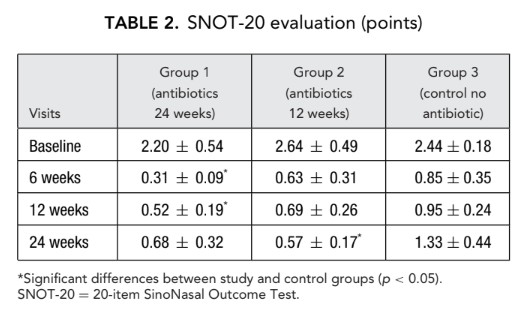
Las puntuaciones iniciales de SNOT-20 fueron 2.20 ± 0.54 en el grupo 1 (antibióticos durante 24 semanas), 2.64 ± 0.49 en el grupo 2 (antibióticos durante 12 semanas) y 2.44 ± 0.18 en el grupo 3 (control sin antibióticos). Después de la FESS, la calidad de vida mejoró y la gravedad de los síntomas de la rinosinusitis se alivió en todos los sujetos del estudio. Sin embargo, las puntuaciones de SNOT-20 de los pacientes en el grupo 1 (antibióticos durante 24 semanas) en las visitas a las 6 semanas y 12 semanas después de la FESS (0.31 ± 0.09 y 0.52 ± 0.19, respectivamente), así como las puntuaciones de SNOT-20 de los pacientes en el grupo 2 (antibióticos durante 12 semanas) en la visita final (0.57 ± 0.17) fueron significativamente mejores que las de los pacientes en el grupo 3 (control sin antibióticos) en las mismas visitas; 0.85 ± 0.35, 0.95 ± 0.24 y 1.33 ± 0.44, respectivamente (p < 0.05), (Fig. 2, Tabla 2).
Puntuaciones VAS
Las diferencias en los cambios de las puntuaciones VAS entre el estudio (grupos 1 y 2) y el grupo de control (grupo 3 sin antibióticos) no alcanzaron significancia estadística (Tabla 3).
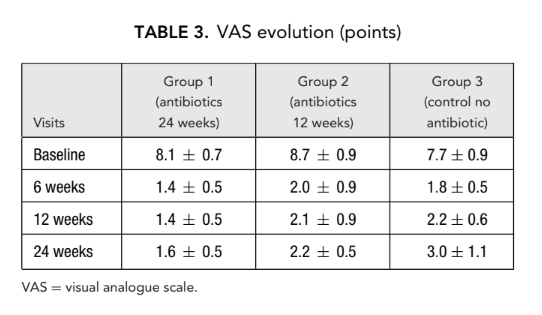
Prueba olfativa
Se detectó disfunción olfativa severa en todos los sujetos del estudio antes de la FESS. Se observó pérdida completa o casi completa de la capacidad para identificar olores (anosmia) cuando la nariz estaba totalmente obstruida (bloqueada) por pólipos nasales difusos. Ninguno de estos 66 pacientes recibió esteroides sistémicos antes de la FESS. En la segunda y tercera visitas, la olfacción mejoró significativamente en los 3 grupos de pacientes, aunque ningún paciente alcanzó valores normales. Se reveló una diferencia estadísticamente significativa en el número medio de respuestas correctas (p < 0.05) solo entre el grupo 1 (antibióticos durante 24 semanas) (9.5 ± 1.3) y el grupo 3 (control sin antibióticos) (4.4 ± 0.5) en la segunda visita 6 semanas después de la cirugía (Tabla 4).
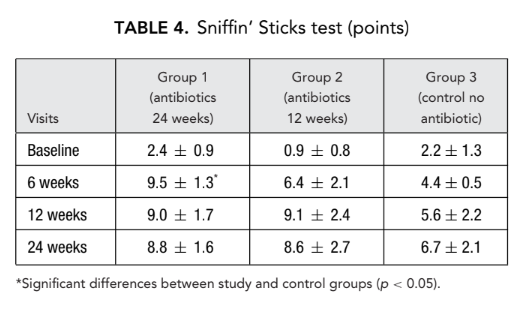
Tiempo de tránsito de sacarina
De manera similar, 12 semanas después de la cirugía se observó una reducción significativa (mejora) del tiempo de tránsito de sacarina en el grupo 1 (antibióticos durante 24 semanas) (13.6 ± 3.0 minutos) en comparación con el grupo 3 (control sin antibióticos) (21.0 ± 4.1 minutos) (Tabla 5).
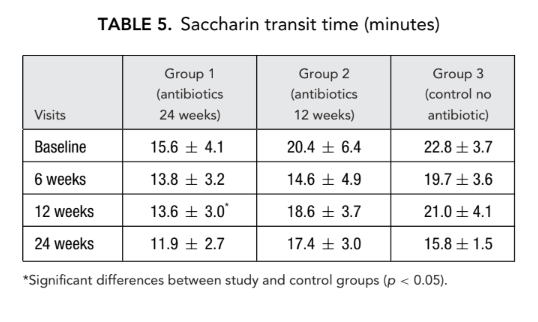
AR y AAR
No hubo diferencia significativa en los parámetros de rinometría acústica (volumen de la cavidad nasal, área mínima de sección transversal) entre todos los grupos. Sin embargo, la resistencia nasal medida por rinomanometría anterior en el grupo 1 (antibióticos durante 24 semanas) y el grupo 2 (antibióticos durante 12 semanas) fue significativamente menor (mejor respiración) (0.23 ± 0.02 y 0.19 ± 0.02 Pa/cm3/segundo, respectivamente) que en el grupo 3 (control sin antibióticos) (1.94 ± 1.50 Pa/cm3/segundo) en el punto final (Tablas 6 y 7).
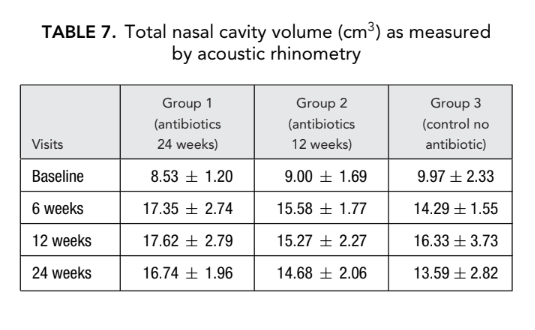
Tomografías computarizadas
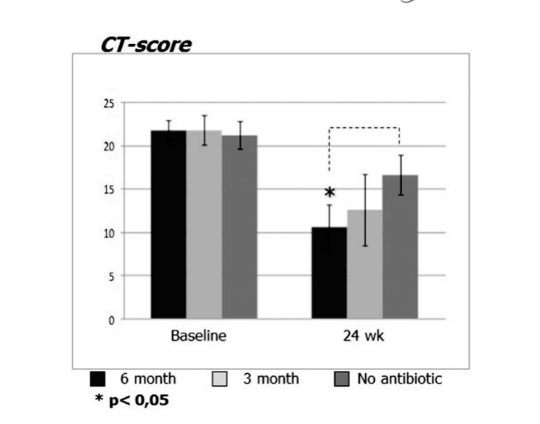
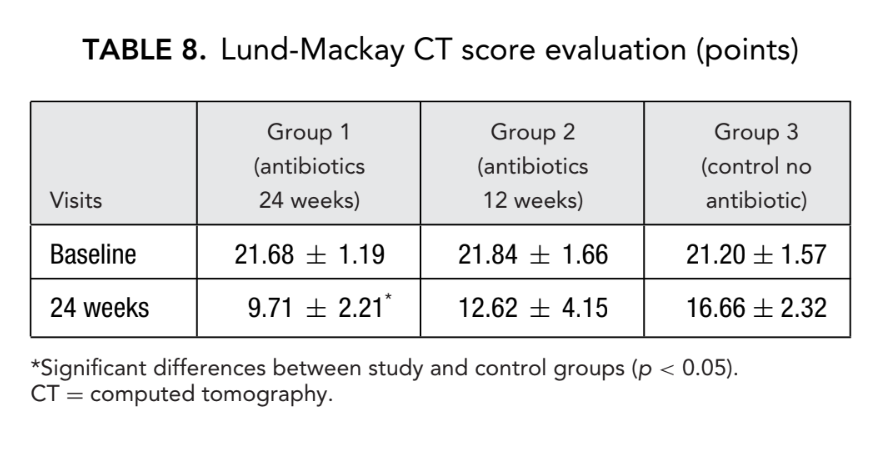
Antes del inicio del tratamiento, los valores medios para el puntaje de Lund-Mackay en los primeros, segundos y terceros grupos de pacientes no diferían significativamente, siendo 21.68 ± 1.20, 21.84 ± 1.66 y 21.2 ± 1.57, respectivamente. El puntaje medio de opacificación de los senos paranasales en las tomografías computarizadas disminuyó drásticamente (mejoró) en los 3 grupos 6 meses después de la FESS. Sin embargo, se observó una diferencia significativa solo entre el grupo 1 (antibióticos durante 24 semanas) con un puntaje medio de 9.71 ± 2.21, y el grupo 3 (control sin antibióticos) con un puntaje medio de 16.66 ± 2.32 (p < 0.05). En el grupo 2 (antibióticos durante 12 semanas) el puntaje medio fue de 12.62 ± 4.15, pero esta diferencia no alcanzó significancia estadística (Fig. 3, Tabla 8).
Endoscopia nasal
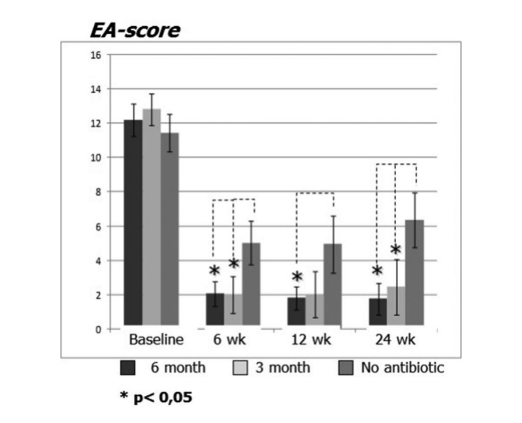
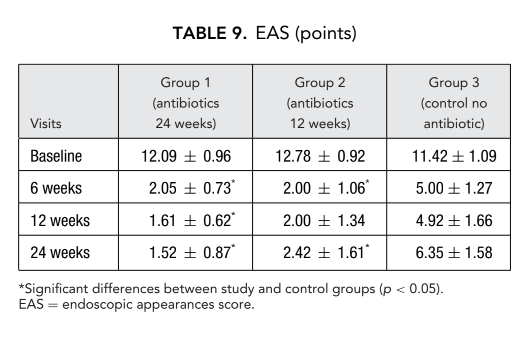
Los pacientes en terapia con claritromicina en el grupo 1 (antibióticos durante 24 semanas) y el grupo 2 (antibióticos durante 12 semanas) mostraron mejor EAS en cada visita en comparación con los pacientes del grupo 3 que no tomaron antibióticos (Fig. 4, Tabla 9). Veinticuatro semanas después de la cirugía, las EAS medias fueron: 1.52 ± 0.87 en el grupo 1 (antibióticos durante 24 semanas) y 2.42 ± 1.61 en el grupo 2 (antibióticos durante 12 semanas), y estos resultados fueron significativamente mejores que el grupo 3 (control sin antibióticos) 6.35 ± 1.58 (p < 0.05) (Fig. 4, Tabla 9). Uno de los casos más impresionantes que demuestra la eficacia de la terapia macrólida a largo plazo postoperatoria se presenta en la Figura 5.
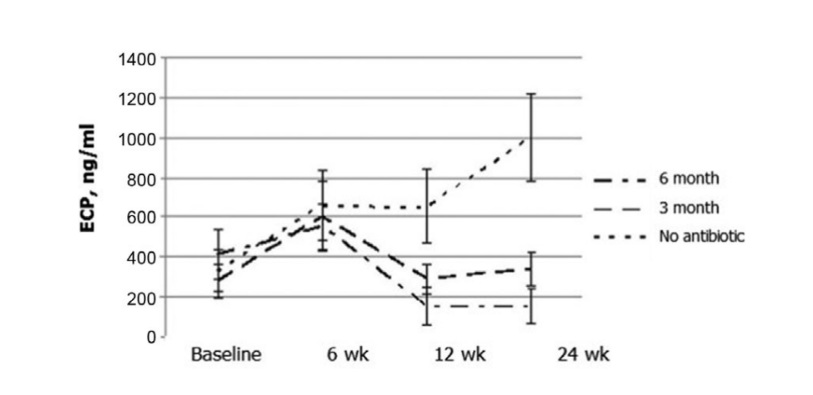
Los resultados más notables ocurrieron en la evaluación de la concentración de ECP postoperatoriamente. Antes de la cirugía, los valores medianos de las concentraciones de ECP en los 3 grupos de pacientes no diferían significativamente, siendo 412.2 ± 123.1, 279.4 ± 85.9 y 330.8 ± 104.5, respectivamente. Seis semanas después de la cirugía, el nivel de ECP en la secreción nasal aumentó en todos los pacientes del estudio, siendo 553.2 ± 115.5, 604.0 ± 173.2 y 660.0 ± 171.6 ng/mL en los grupos 1, 2 y 3, respectivamente. Doce semanas después de la FESS, se observó claramente una disminución significativa del nivel de ECP en la secreción nasal en el grupo 1 (antibióticos durante 24 semanas): 153.6 ± 98.8 ng/mL (p = 0.028), y en el grupo 2 (antibióticos durante 12 semanas): 290.4 ± 77.2 ng/mL (p = 0.036). El nivel de ECP en la secreción nasal en los pacientes del grupo 3 (control sin antibióticos) no cambió significativamente y se registró como 654.0 ± 184.9 ng/mL (p = 0.25). Solo en el grupo 1 (antibióticos durante 24 semanas) la concentración de ECP se mantuvo en el mismo nivel bajo (154.8 ± 89.8 ng/mL) a las 24 semanas. En el grupo 2 (antibióticos durante 12 semanas) hubo un ligero aumento de los niveles de ECP hasta 338.1 ± 83.1 ng/mL (p = 0.084) cuando se estudiaron a estos pacientes a las 24 semanas (3 meses después de detener los antibióticos); sin embargo, con un valor de p de 0.084, la diferencia no fue estadísticamente significativa. El nivel medio de ECP en la secreción nasal en el grupo 3 (control sin antibióticos) aumentó significativamente a 1000.0 ± 222.7 ng/mL (p = 0.041) (Fig. 6, Tabla 10).
Es importante señalar que el nivel de ECP en pacientes tratados con macrólidos durante un período completo de 6 meses (grupo 1) fue significativamente más bajo que en aquellos pacientes del grupo 2, que interrumpieron la terapia antibiótica después de 3 meses de tratamiento.
Los efectos secundarios fueron poco comunes, requiriendo la interrupción de la terapia antibiótica solo en 3 pacientes. Los niveles de enzimas hepáticas (alanina transaminasa [ALT], aspartato aminotransferasa [AST] y fosfatasa alcalina [ALP]) se mantuvieron normales en todos los pacientes.
El estudio microbiológico de los hisopos del meato medio reveló un amplio espectro de bacterias. El organismo más común fue Staphylococcus aureus (30% de los pacientes), seguido por Staphylococcus epidermidis (25%), Streptococcus haemolyticus (11%), Escherichia coli (9%), Pseudomonas aeruginosa (6%) y Enterobacter aerogenes (6%). El espectro bacteriano cambió significativamente después de la cirugía, pero la proporción entre cepas resistentes a la claritromicina (13%) y cepas sensibles a la claritromicina (87%) se mantuvo igual. Al concluir el estudio, algunas cepas bacterianas sensibles a macrólidos adquirieron resistencia a la claritromicina. Curiosamente, también ocurrió un fenómeno opuesto; inicialmente, algunas cepas bacterianas resistentes a macrólidos fueron reemplazadas por algunas cepas bacterianas sensibles a macrólidos. En general, el número de cepas resistentes a la claritromicina (13%) se mantuvo constante a lo largo del tratamiento prolongado con claritromicina.
Discusión
La evidencia actual apoya la idea de que el tratamiento a largo plazo con macrólidos en dosis bajas es efectivo cuando se reserva para pacientes con CRS no atópico recalcitrante en quienes los esteroides nasales tópicos y las irrigaciones salinas no han logrado controlar los síntomas. En pacientes con CRSwNP atópico, la terapia con macrólidos para BA y AERD no ha sido útil.
En la literatura más reciente, se ha informado que la terapia con macrólidos a largo plazo en dosis bajas es efectiva en CRS, incluidos aquellos pacientes con niveles elevados de inmunoglobulina E (IgE) y BA. Un estudio prospectivo reciente demostró que un tratamiento de 8 semanas con claritromicina fue igualmente efectivo en pacientes atópicos y no atópicos con poliposis nasal. En un estudio retrospectivo, los pacientes con CRS y atopia respondieron bien al tratamiento a largo plazo con macrólidos, mientras que los pacientes que fumaban tuvieron el peor resultado del tratamiento.
Los resultados de nuestro estudio demostraron que la terapia a largo plazo con macrólidos en dosis bajas previene la recurrencia temprana de pólipos nasales después de la FESS, incluidos los pacientes con atopia y BA. Hubo una clara correlación entre la atopia y la gravedad de la enfermedad, ya que nuestros pacientes atópicos tuvieron puntajes VAS más altos (coeficiente de correlación de rango de Spearman 0.332; p = 0.01). La presencia de atopia se correlacionó con niveles más altos de ECP en la secreción nasal (0.834; p = 0.01). Estos hallazgos sugieren que la gravedad de los síntomas está directamente relacionada con la intensidad de la inflamación eosinofílica. Desafortunadamente, no investigamos los niveles totales de IgE en la mayoría de los pacientes; por lo tanto, no fue posible realizar un análisis de subgrupos de aquellos pacientes con niveles bajos de IgE.
Un hallazgo de estudio más notable fue el cambio en los niveles de ECP en las secreciones nasales después de la FESS y durante el período postoperatorio con terapia de macrólidos. En el grupo 3 (control sin antibióticos) notamos un aumento casi 3 veces mayor del nivel medio de ECP 6 semanas después de la cirugía. Este hallazgo de un nivel elevado de ECP después de la FESS en estos pacientes del grupo 3 refleja una exacerbación de la inflamación eosinofílica causada por la cirugía que no pudo ser controlada adecuadamente solo con esteroides tópicos intranasales. Por otro lado, en los grupos de tratamiento 1 (antibióticos durante 24 semanas) y 2 (antibióticos durante 12 semanas) hubo una disminución gradual de los niveles de ECP con el tratamiento a largo plazo con claritromicina en dosis bajas, reflejando el control y la reducción de la inflamación eosinofílica.
Un objetivo de este trabajo fue estudiar la eficacia de un curso de tratamiento más largo (6 meses) en comparación con el curso relativamente corto (3 meses) de terapia con macrólidos en dosis bajas. Los datos sugirieron algún beneficio de un curso de antibióticos más largo, pero la diferencia entre el grupo 1 (antibiótico 24 semanas) y el grupo 2 (antibiótico durante 12 semanas) no alcanzó la significancia estadística en la mayoría de los pacientes. No obstante, hay alguna evidencia de que una duración más larga del tratamiento en el grupo 1 (antibióticos 24 semanas) parece ser más efectiva que un curso más corto visto en el grupo 2 (antibióticos durante 12 semanas).
Los puntajes de TC para el grupo 1 (antibióticos 24 semanas) fueron de 9.71 ± 2.21, que fue significativamente más bajo que en el grupo 3 (control sin antibióticos), con lecturas de 16.66 ± 2.32 al final del estudio. La diferencia entre el grupo 2 (antibióticos por 12 semanas) y el grupo 3 (control sin antibióticos) no alcanzó significancia estadística (Tabla 8). Hubo diferencias significativas en los niveles medios de ECP en los grupos
1 y 2 al final del estudio, confirmando indirectamente que un curso de antibióticos de 6 meses reduce la inflamación eosinofílica, previniendo así la recurrencia temprana de pólipos nasales. Obviamente, el uso de esteroides orales sería considerado el estándar de atención en los Estados Unidos y algunos otros países occidentales, especialmente en el contexto de un brote de inflamación eosinofílica postoperatoria. Sin embargo, en países como Rusia, donde la terapia con corticosteroides sistémicos en CRSwNP es extremadamente poco común, la terapia a largo plazo con macrólidos podría ser una opción alternativa porque conlleva menos riesgo de efectos secundarios sistémicos.
No encontramos un aumento en los cultivos bacterianos resistentes a macrólidos del meato medio después de un tratamiento a largo plazo y a baja dosis de 250 mg/día de terapia con claritromicina, lo que concuerda con estudios previos que también no encontraron microorganismos resistentes después de un tratamiento prolongado con azitromicina y eritromicina. Por supuesto, el riesgo de desarrollar cepas bacterianas resistentes a los antibióticos inducidas por la terapia macrólida a largo plazo siempre es posible.
Aunque no se diseñó un brazo de placebo en nuestro protocolo y los pacientes no fueron cegados al recibir terapia adicional, evaluamos 6 métodos objetivos diferentes en los 3 grupos de estudio. Todos los investigadores estaban cegados al evaluar y calificar los resultados de la endoscopia nasal, las tomografías computarizadas y todas las demás pruebas. Se requeriría un futuro estudio aleatorizado, doble ciego y controlado con placebo, con un tamaño de muestra grande, para determinar la eficacia de la terapia macrólida a largo plazo, particularmente en la prevención de la recurrencia de pólipos nasales después de la cirugía endoscópica sinusal funcional (FESS). Además, dicho estudio podría predecir con esperanza qué pacientes con CRSwNP se beneficiarían del tratamiento antibiótico a largo plazo y si este tratamiento aumenta el riesgo de inducir una resistencia bacteriana significativa.
Conclusión
Los resultados de este estudio demostraron la eficacia y la seguridad relativa de la terapia a largo plazo (6 meses) con macrólidos a baja dosis (250 mg/día) (claritromicina) para prevenir la recurrencia temprana de pólipos nasales en pacientes con CRSwNP después de la FESS. A pesar de los datos clínicos limitados, nuestra evidencia sugiere que los pacientes con CRSwNP recurrente (fracasos quirúrgicos) merecen un ensayo de tratamiento con claritromicina a baja dosis (250 mg diarios durante 3-6 meses), que puede iniciarse inmediatamente después de la FESS junto con la terapia de mantenimiento utilizando esteroides nasales tópicos.
Referencias
- Hedman J, Kaprio J, Poussa T, Nieminen MM. Prevalencia de asma, intolerancia a la aspirina, pólipos nasales y enfermedad pulmonar obstructiva crónica en un estudio poblacional. Int J Epidemiol. 1999;28:717–722.
- Settipane G. Epidemiología de los pólipos nasales. En: Settipane G, Lund VJ, Bernstein JM, Tos M, eds. Pólipos Nasales: Epidemiología, Patogénesis y Tratamiento. Providence, RI: Oceanside Publications; 1997:17– 24.
- Ogino S, Harada T, Okawachi I, Irifune M, Matsunaga T, Nagano T. Asma inducida por aspirina y pólipos nasales. Acta Otolaryngol Suppl. 1986;430:21– 27.
- Fokkens W, Lund V, Mullol J. Grupo del Documento de Posición Europeo sobre Rinosinusitis y Pólipos Nasales. Documento de Posición Europeo sobre Rinosinusitis y Pólipos Nasales 2007. Rhinol Suppl. 2007;(20):1–136.
- Desrosiers MY, Kilty SJ. Alternativas de tratamiento para la rinosinusitis crónica que persiste después de la ESS: qué hacer cuando los antibióticos, esteroides y cirugía fallan. Rhinology. 2008;46:3–14.
- Kudoh S, Uetake T, Hagiwara K, et al. Efecto clínico de la quimioterapia a largo plazo con eritromicina a baja dosis en la bronquiolitis pan difusa (Resumen en inglés). Jpn J Thorac Dis. 1984;25:632–642.
- Kudoh S, Asuma A, Yamamoto M, Izumi T, Ando M. Mejora de la supervivencia en pacientes con bronquiolitis pan difusa tratados con eritromicina a baja dosis. Am J Respir Crit Care Med. 1998;157:1829– 1832.
- Cervin A, Wallwork B. Terapia con macrólidos para la rinosinusitis crónica. Rhinology. 2007;45:259– 267.
- Cervin A, Wallwork B, Mackay-Sim A, Coman WB, Greiff L. Efectos del tratamiento a largo plazo con claritromicina sobre los marcadores de inflamación en el líquido de lavado en la rinosinusitis crónica. Clin Physiol Funct Imaging. 2009;29:136–142.
- Stjarne P, Ollson P, Alenius M. Uso de furoato de mometasona para prevenir la recaída de pólipos después de la cirugía endoscópica de senos. Arch Otolaryngol Head Neck Surg. 2009;135:296–302.
- Piccirillo J, Merritt M, Richards M. Validez psicométrica y clinimétrica del Test de Resultado Sino-Nasal de 20 ítems (SNOT-20). Otolaryngol Head Neck Surg. 2001;126:41–47.
- Hummel T, Kobal G, Gudziol H, Mackay-Sim A. Datos normativos para los “Sniffin’ Sticks” incluyendo pruebas de identificación de olores, discriminación de olores y umbrales olfativos: una actualización basada en un grupo de más de 3,000 sujetos. Eur Arch Otorhinolaryngol. 2007;264:237–243.
- Lund VJ, Mackay IS. Estadio en rinosinusitis. Rhinology. 1993;31:183–184.
- Fokkens WJ, Lund VJ, Mullol J, et al. Documento de Posición Europeo sobre Rinosinusitis y Pólipos Nasales 2012.
- Rhinol Suppl. 2012;(23):3 p antes de la tabla de contenido, 1–298.
- Wallwork B, Coman W, Mackay-Sim A, Greiff L, Cervin A. Un ensayo doble ciego, aleatorizado y controlado con placebo de macrólidos en el tratamiento de la rinosinusitis crónica. Laryngoscope. 2006;116:189– 193.
- Haruna S, Shimada C, Ozawa M, Fukami S, Moriyama H. Un estudio de los malos respondedores a la administración a largo plazo de macrólidos a baja dosis para la sinusitis crónica. Rhinology. 2009;47:66–71.
- Videler WJ, Badia L, Harvey RJ, et al. Falta de eficacia de la azitromicina a largo plazo y baja dosis en la rinosinusitis crónica: ensayo controlado aleatorizado. Allergy. 2011;66:1457–1468.
- Peric A, Vojvodic D, Baletic N, Peric A, Miljanovic O. Influencia de la alergia en los efectos inmunomoduladores y clínicos del tratamiento a largo plazo con macrólidos a baja dosis de pólipos nasales. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2010;154:327–334.
- Videler WJ, van Hee SM, Reinartz C, Georgalas FW, Meulen K, Fokkens WJ. Antibióticos a largo plazo y baja dosis en rinosinusitis crónica recalcitrante: un análisis retrospectivo. Rhinology. 2012;50:45–55.
- Cervin A, Kalm O, Sandkull P, Lindberg S. Tratamiento con eritromicina a baja dosis durante un año de sinusitis crónica persistente después de la cirugía de senos: resultado clínico y efectos sobre los parámetros mucociliares y óxido nítrico nasal. Otolaryngol Head Neck Surg. 2002;126:481–489.
