Un estudio comparativo de las propiedades fisicoquímicas de los selladores de conductos radiculares AH PlusTM y EpiphanyTM
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivo: Evaluar el tiempo de fraguado, solubilidad y desintegración, flujo, grosor de película y cambio dimensional tras el fraguado en un sellador de conductos radiculares de resina de curado dual EpiphanyTM en comparación con un sellador a base de resina epóxica AH PlusTM.
Metodología: Los experimentos se realizaron de acuerdo con la Especificación ANSI/ADA 57 que evalúa las propiedades fisicoquímicas de los materiales de sellado endodóntico. Se probaron cinco muestras de cada material para cada una de las propiedades. Además, el agua destilada desionizada del test de solubilidad de EpiphanyTM fue sometida a análisis de los cationes Fe, Ni, Ca, Mg, Zn, Na y K en un espectrómetro de absorción atómica. Se analizaron tres muestras.
Resultados: No hubo diferencias estadísticas (P > 0.05) en el flujo (AH PlusTM: 38.57 mm; EpiphanyTM: 35.74 mm) y grosor de película (AH PlusTM: 10.6 μm; EpiphanyTM: 20.1 μm). La solubilidad (AH PlusTM: 0.21%; Epiphany : 3.41%) y las alteraciones dimensionales tras el fraguado (AH PlusTM: expansión del 1.3%; EpiphanyTM: expansión del 8.1%) fueron estadísticamente diferentes (P < 0.05). Los tiempos de fraguado de ambos selladores estaban de acuerdo con los requisitos de ANSI/ADA.
Conclusiones: Las pruebas de tiempo de fraguado, flujo y espesor de película para ambos cementos cumplieron con los estándares de ANSI/ADA. La prueba de alteración dimensional para ambos cementos fue mayor que los valores considerados aceptables por ANSI/ADA. Los valores de EpiphanyTM respecto a la solubilidad también fueron mayores que los valores considerados aceptables por ANSI/ADA.
Introducción
Actualmente se están utilizando muchos cementos de conducto radicular diferentes en combinación con gutapercha para llenar el conducto radicular después de la preparación biomecánica. Los materiales de relleno de resina han ganado popularidad de manera constante y ahora son aceptados como un relleno de conducto radicular (Consejo de Asuntos Científicos de la ADA 1998).
Los selladores de resina epóxica se han utilizado debido a su menor solubilidad (Carvalho-Junior et al. 2003), sellado apical (Sousa-Neto et al. 2002) y micro-retención a la dentina radicular (Tagger et al. 2002). Recientemente, se han desarrollado selladores endodónticos de resina metacrilato (Kardon et al. 2003, Shipper & Trope 2004). Sin embargo, la combinación de conos de gutapercha y sellador de resina metacrilato ha mostrado una capacidad de sellado apical reducida en comparación con los conos de gutapercha y el sellador de resina epóxica convencional (Kardon et al. 2003, Sevimay & Kalayci 2005). Así, se han utilizado imprimaciones autograbantes para la unión a la dentina del conducto radicular (Economides et al. 2004). Dado que los selladores de resina epóxica no copolimerizan con adhesivos a base de resina metacrilato (Tay et al. 2005), se desarrolló un sellador de resina metacrilato de curado dual (EpiphanyTM; Pentron Clinical Technologies, Wallingford, CT, EE. UU.), con una imprimación autograbante y un nuevo polímero relleno termoplástico (ResilonTM; Resilon Research LLC, Madison, CT, EE. UU.), en lugar de la gutapercha (Jia & Alpert 2003). Esto resultó en mejoras en el sellado apical (Shipper & Trope 2004) y en la adhesión a la dentina radicular (Gogos et al. 2004).
El propósito de este in vitro estudio fue evaluar el tiempo de fraguado, solubilidad y desintegración, flujo, grosor de la película y cambio dimensional tras el fraguado del sellador de resina dual-curada EpiphanyTM en comparación con un sellador de resina epoxi-amina convencional y bien establecido, AH PlusTM, de acuerdo con las recomendaciones de la Especificación ANSI/ADA 57 (ANSI/ADA 2000).
Materiales y métodos
El tiempo de fraguado, solubilidad, prueba de flujo, grosor de la película y cambio dimensional después del fraguado para AH PlusTM (Dentsply DeTrey, Konstanz, Alemania) y EpiphanyTM (Pentron Clinical Technologies) selladores de conductos radiculares se midieron de acuerdo con los estándares de la ANSI/ADA para materiales de sellado de conductos radiculares dentales (ANSI/ADA 2000). Dado que EpiphanyTM es una resina de curado dual, se mezcló y manipuló en una sala de procesamiento radiográfico, donde no había luz natural.
Tiempo de fraguado
Se prepararon cinco moldes de anillo de yeso, con un diámetro interno de 10 mm y un grosor de 2 mm. Los bordes externos de los moldes se fijaron con cera en una placa de vidrio de 1 mm de grosor, 25 mm de ancho y 75 mm de largo. Luego, los moldes se llenaron con el material, mezclado de acuerdo con las instrucciones del fabricante, y se transfirieron a una cámara con 95% de humedad relativa y una temperatura de 37 °C. Cuando el tiempo de fraguado indicado por el fabricante se acercó, se bajó cuidadosamente una aguja tipo Gilmore con una masa de (100 ± 0.5) g que tenía un extremo plano de (2.0 ± 0.1) mm de diámetro verticalmente sobre la superficie horizontal del sellador. La punta de la aguja se limpió y el movimiento se repitió hasta que las impresiones dejaron de ser visibles. Se registró el tiempo desde el inicio de la mezcla hasta este punto. Si los resultados diferían en más de ±5%, se repitió la prueba. Se registró la media aritmética de cinco réplicas para cada sellador y se consideró como el tiempo de fraguado.
Solubilidad
Un molde cilíndrico de Teflón® (Politetrafluoroetileno, DuPont, HABIA, Knivsta, Suecia) de 1.5 mm de grosor y 20 mm de diámetro interno se llenó con el material, mezclado de acuerdo con las instrucciones del fabricante. El molde se apoyó sobre una placa de vidrio de dimensiones mayores que el molde y se cubrió con una hoja de celofán. El molde se llenó con un ligero exceso, se colocó un hilo de nylon impermeable dentro del material y se posicionó otra placa de vidrio, también cubierta con film de celofán, sobre el molde y se presionó manualmente de tal manera que las placas tocaran todo el molde de manera uniforme. El conjunto se colocó en una cámara con 95% de humedad relativa a 37 °C. El conjunto se dejó reposar durante un período correspondiente a tres veces el tiempo de fraguado, y las muestras se retiraron del molde. Se eliminaron los residuos y partículas sueltas, las muestras se pesaron tres veces en una balanza de precisión HM-200 (A & D Engineering, Inc., Bradford, MA, EE. UU.). Luego se registró la lectura media.
Las muestras fueron suspendidas por un hilo de nailon y colocadas dentro de un recipiente de plástico con una abertura ancha, que contenía 50 mL de agua destilada y desionizada. Se tuvo cuidado de evitar cualquier contacto entre la muestra y la superficie interna del contenedor y el líquido. Cada muestra se colocó en un contenedor que fue sellado y dejado durante 1 semana en un incubador a 37°C y 95% de humedad relativa. Luego, las muestras fueron retiradas de los contenedores, enjuagadas con agua destilada y desionizada, y secadas con papel absorbente. Las muestras se colocaron en un deshumidificador durante 24 h y se pesaron nuevamente. El experimento se repitió cinco veces para cada sellador. La pérdida de peso de cada muestra, expresada como un porcentaje de la masa original, se tomó como la solubilidad del sellador.
No hay información en la literatura sobre los metales que se liberan por el sellador de conductos radiculares EpiphanyTM. Por lo tanto, el agua destilada desionizada del test de solubilidad de este material fue sometida a análisis. Se utilizó un volumen de 50 mL de agua destilada desionizada del test de solubilidad del sellador de conductos radiculares EpiphanyTM para medir la solubilidad de los metales mediante espectrometría de absorción atómica, como se describe en los Métodos Estándar para el Examen de Agua y Aguas Residuales de la Asociación Americana de Salud Pública (APHA), la Asociación Americana de Obras de Agua (AWWA) y la Federación del Medio Ambiente del Agua (WEF, anteriormente Federación de Control de Contaminación del Agua, WPCF) (APHA, AWWA, WPCF 1989) con Perkin-Elmer (Analyst 700; Shelton, CT, EE. UU.). El aparato se utilizó para medir los niveles de Fe, Ni, Ca, Mg, Zn, Na y K.
Este espectrofotómetro (Perkin-Elmer) se suministra con lámparas de cátodo hueco con diferentes espectros de luz exclusivamente para medir iones metálicos. Ocho mililitros de agua destilada de cada muestra, utilizada durante la prueba de solubilidad y desintegración, se vertieron en un crisol de porcelana limpio y seco. Cada crisol se colocó en un mufla y se quemó a 550 °C. Las cenizas se disolvieron en un ácido nítrico concentrado utilizando un palo de vidrio. A continuación, las muestras se colocaron en matraces volumétricos de 50 mL y se completó el volumen con agua ultrapura desionizada (MilliQ, Millipore, Billerica, MA, EE. UU.). Las soluciones obtenidas se pulverizaron en el espectrofotómetro de absorción atómica para su medición.
Se registró la media aritmética de tres réplicas para cada espécimen y se consideró como el resultado de los niveles de Fe, Ni, Ca, Mg, Zn, Na y K, expresados como μg mL–1.
Prueba de flujo
Un volumen de 0.5 mL del cemento mezclado según las recomendaciones del fabricante se colocó sobre una placa de vidrio (40 · 40 · 5 mm) utilizando una jeringa desechable graduada de 3 mL. A los (180 ± 5) s después del inicio de la mezcla, se colocó cuidadosamente y de manera central una carga de 100 N más la placa superior con una masa de (20 ± 2) g sobre el material. Diez minutos después del inicio de la mezcla, se retiró la carga y se midió el promedio de los diámetros mayor y menor de los discos comprimidos con un calibrador digital con una resolución de 0.01 mm (Mitutoyo MTI Corporation, Tokio, Japón). Si ambos diámetros coincidían dentro de 1 mm, se registraron los resultados. Si los discos de diámetro mayor y menor no eran uniformemente circulares o no coincidían dentro de 1 mm, se repitió la prueba. La media de cinco tales determinaciones para cada sellador, expresada al milímetro más cercano, se tomó como el flujo del material.
Grosor de película
Se colocaron juntas dos placas de vidrio planas (200 ± 25 mm2) de 5 mm de grosor cada una y se midió el grosor combinado. Se depositó un volumen de 0.5 mL del material, mezclado de acuerdo con las recomendaciones del fabricante, en el centro de una placa de vidrio y se colocó la segunda placa de vidrio de manera central sobre el sellador. A los 180s (±10) después del inicio de la mezcla, se aplicó cuidadosamente una carga de 150 N verticalmente sobre la placa de vidrio superior con un dispositivo de carga (IMI Norgren Inc., Littleton, CO, EE. UU.), asegurando que el material llenara toda el área entre las placas de vidrio superior e inferior. Diez minutos después del inicio de la mezcla, se midió el grosor de las dos placas de vidrio y de la película de sellador interpuesta con un micrómetro exterior con una resolución de 0.002 mm (Mitutoyo MTI Corporation). La diferencia en el grosor de las dos placas de vidrio, con y sin sellador, se tomó como el grosor de la película del material. El valor medio de cinco tales determinaciones para cada sellador se tomó como el grosor de la película del material.
Alteraciones dimensionales
Se prepararon cinco moldes de Teflón® para la producción de cuerpos de prueba cilíndricos de 12 mm de altura y 6 mm de diámetro. El molde se colocó sobre una placa de vidrio de 1 mm de grosor, 25 mm de ancho y 75 mm de largo envuelta con una fina hoja de celofán. El molde se llenó hasta que se observó un ligero exceso de material, mezclado de acuerdo con las instrucciones del fabricante, en su extremo superior. Luego, se presionó un portaobjetos de microscopio, también envuelto en celofán, sobre la superficie superior del molde. El grupo ensamblado se mantuvo firmemente unido con la ayuda de una abrazadera en forma de C. Cinco minutos después de que se preparó la mezcla por primera vez, el ensamblaje se transfirió a un incubador ajustado a 95% de humedad relativa y 37 °C, se dejó reposar durante un período correspondiente a tres veces el tiempo de fraguado y luego se retiró.
El siguiente paso consistió en lijar planos los extremos del molde que contenía la muestra con papel de lija húmedo de grano 600 para obtener una superficie regular. La muestra se retiró del molde, se midió la longitud con un calibrador digital con una resolución de 0.01 mm (Mitutoyo MTI Corporation) y se almacenó en un recipiente de 50 mL que contenía 30 mL de agua destilada desionizada a 37 °C y 95% de humedad relativa durante 30 días. Luego, la muestra se retiró del recipiente, se secó con papel absorbente y se midió nuevamente la longitud.
El porcentaje de las alteraciones dimensionales se calculó utilizando la fórmula:
((L30 — L)/L) × 100
donde L30 es la longitud de la muestra después de 30 días de almacenamiento bajo las condiciones experimentales y L es la longitud inicial de la muestra. La media aritmética de cinco réplicas para cada sellador se registró como la alteración dimensional del cemento probado.
Análisis estadístico
Se probaron cinco especímenes de cada grupo y se calculó la media. Los datos se registraron directamente en hojas de codificación y luego se almacenaron en una computadora. Los valores medios se compararon estadísticamente utilizando la prueba U de Mann–Whitney entre los grupos experimentales para cada procedimiento. El nivel de significancia se estableció en 5%.
Resultados
Tiempo de fraguado
Los requisitos de la ANSI/ADA (2000) exigen que un sellador esté dentro del 10% de lo indicado por el fabricante. De acuerdo con las pautas para AH PlusTM y EpiphanyTM, los cementos tienen 8 h (480 min) y 25 min de tiempo de fraguado respectivamente. Los valores medios de 500 min para AH PlusTM, y 24.75 min para EpiphanyTM (Tabla 1) mostraron concordancia con la estandarización ANSI/ADA.

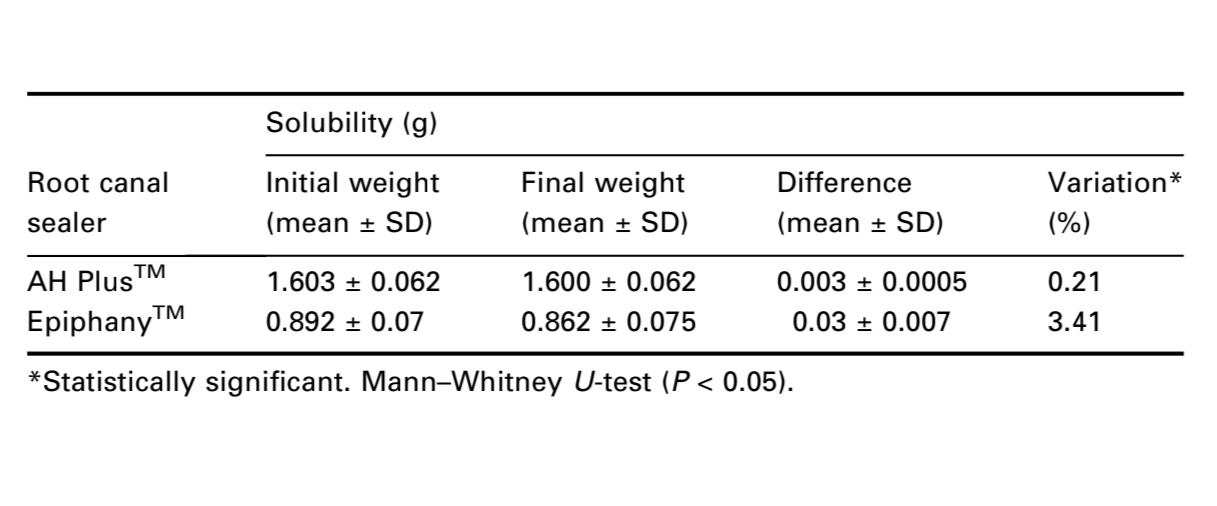
Solubilidad
La Especificación ANSI/ADA 57 establece que un cemento de conducto radicular no debe exceder el 3% en masa cuando se prueba la solubilidad del material fraguado. En contraste con el resultado medio de AH PlusTM (0.21%), la solubilidad del sellador EpiphanyTM no cumplió con la estandarización ANSI/ADA (3.41%) (Tabla 2). La prueba de Mann–Whitney U mostró una diferencia estadística entre los cementos (P < 0.05).
El agua destilada desionizada utilizada para la prueba de solubilidad del sellador de conductos radiculares EpiphanyTM fue sometida a espectrometría de absorción atómica. Los niveles resultantes de siete metales que se analizaron fueron: Fe (0.56 mg L–1), Ni (0.06 mg L–1), Ca (41.46 mg L–1), Mg (0.80 mg L–1), Zn (0.05 mg L–1), Na (4.11 mg L–1) y K (0.50 mg L–1).
Prueba de flujo
La ANSI/ADA (2000) requiere que un sellador tenga un diámetro de no menos de 20 mm. Ambos cementos cumplieron con los estándares de ANSI/ADA ya que los resultados fueron 38.57 (±3.85) y 35.74 (±0.47) mm para AH PlusTM y EpiphanyTM respectivamente (Tabla 3). Comparando las medias por pares, la prueba de Mann–Whitney U no mostró diferencia estadística (P > 0.05).
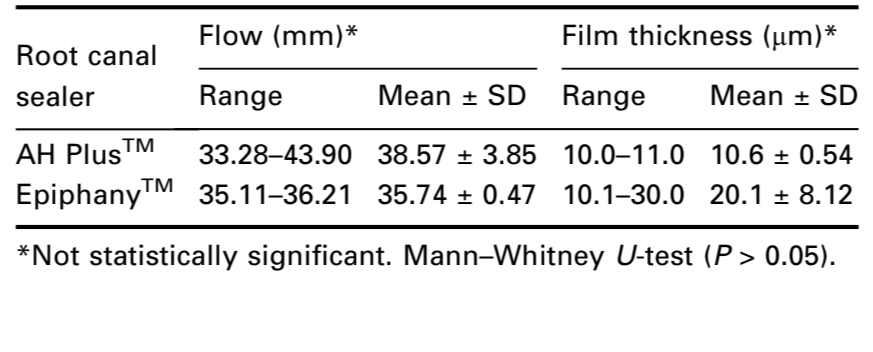
Grosor de película
La ANSI/ADA (2000) requiere que un sellador tenga un grosor de película de no más de 50 μm. Ambos cementos cumplieron con la estandarización de la ANSI/ADA, ya que los resultados fueron 10.6 (±0.54) y 20.1 (±8.12)μm para AH PlusTM y EpiphanyTM respectivamente (Tabla 3). La prueba de Mann–Whitney U no mostró diferencia estadística (P > 0.05).
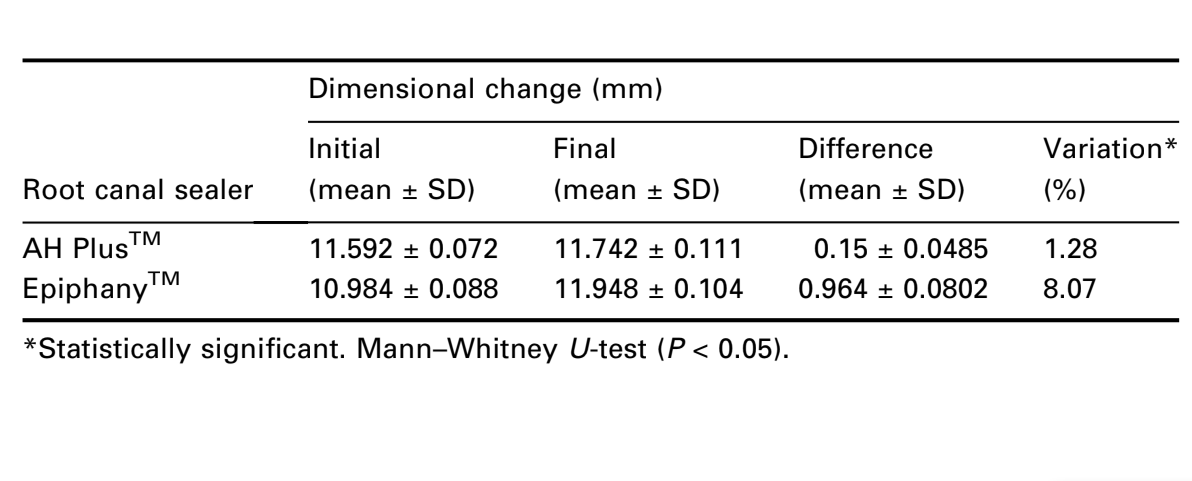
Alteraciones dimensionales
Los requisitos de la ANSI/ADA (2000) para esta prueba establecen que la contracción lineal media del sellador no debe exceder el 1% o el 0.1% en expansión. Ningún cemento cumplió con la estandarización de la ANSI/ADA. Los resultados mostraron expansiones del 1.3% y 8.1% para AH PlusTM y EpiphanyTM respectivamente (Tabla 4). La prueba de Mann–Whitney U mostró diferencia estadística (P < 0.05).
Discusión
El tiempo de fraguado es el tiempo necesario para que el sellador logre sus propiedades definitivas (Batchelor & Wilson 1969). No hay un tiempo de fraguado estándar estipulado para los selladores, pero la utilidad clínica exige que debe ser lo suficientemente largo para permitir la colocación y ajuste del relleno radicular si es necesario (McMichen et al. 2003). Sin embargo, debe ser lo más corto posible debido a la dificultad de mantener la sequedad del canal preparado vacío (Batchelor & Wilson 1969). Una vez que el ambiente se vuelve húmedo, los fluidos periapicales juegan un papel importante en la degradación química del sellador (Ruyter 1995). Un mejor término para el período de tiempo, medido desde el inicio de la mezcla hasta que el sellador endodóntico de resina ha polimerizado, puede ser ‘tiempo de polimerización’. El tiempo de fraguado de los selladores depende de los componentes constitutivos, su tamaño de partícula, la temperatura ambiente y la humedad relativa (Ulrich et al. 1978). Ambos selladores, EpiphanyTM y AH PlusTM, demostraron un tiempo de fraguado comparable y aceptable según lo establecido por la Especificación ANSI/ADA 57 (ANSI/ADA 2000).
El sellador EpiphanyTM es un compuesto de resina de curado dual que contiene un nuevo catalizador redox (Jin & Jia 2003). El fabricante indica que se requieren 40 s de luz para curar los 2 mm coronales del canal, mientras que el llenado completo se curará por sí mismo en aproximadamente 15–30 min (Leonard et al. 1996). En este estudio, EpiphanyTM se mezcló y manipuló en una sala de procesamiento radiográfico para asegurar que durante los diferentes experimentos el material no estuviera parcialmente curado por la luz. Durante el procedimiento experimental, siempre se observó una delgada capa superficial no curada en las muestras de EpiphanyTM después del tiempo de fraguado requerido. Incluso cuando las muestras fueron expuestas a una fuente de luz de curado, un nuevo lote preparado y dejado reposar por un período correspondiente a cinco veces el tiempo de fraguado, la capa no curada aún permanecía.
Se sabe que el oxígeno inhibe la polimerización de vinilo en las resinas utilizadas para la odontología restauradora (Franco et al. 2002). Los materiales compuestos no sufren una polimerización completa, y aproximadamente el 40–60% de los enlaces de carbono permanecen insaturados (Finger et al. 1996). Por lo tanto, la polimerización se ve comprometida por la inhibición del oxígeno. Esto probablemente causa la pronunciada inhibición de polimerización mostrada por EpiphanyTM. El oxígeno puede resultar en una delgada película de polímero con un bajo grado de polimerización, particularmente en la dentina donde el oxígeno tiene acceso al sellador desde la superficie libre y, en cierta medida, a través de la estructura de dentina permeable (Rueggeberg & Margeson 1990). Esta reducción en la polimerización podría comprometer las propiedades clínicas.
AH PlusTM, un sellador de conductos radiculares de pasta de dos componentes, basado en la reacción de polimerización de aminas de resina epóxica (Cohen et al. 2000), fue probado para comparación. Según la descripción del fabricante, AH PlusTM posee propiedades ventajosas similares a las de AH26TM, ya que preserva la química de las aminas epóxicas. El material no libera formaldehído, lo que interfiere negativamente con la biocompatibilidad de AH26TM (Mickel et al. 2003). Por lo tanto, AH PlusTM ha sido utilizado continuamente en estudios comparativos de propiedades fisicoquímicas, biológicas y antimicrobianas (Duarte et al. 2004, Gomes et al. 2004, Karadag et al. 2004, Kokkas et al. 2004, Saleh et al. 2004).
La solubilidad es la capacidad de una sustancia para disolverse en otra, expresada como la concentración de la solución saturada de la primera en la segunda (Sousa-Neto et al. 1999). La solubilidad del material establecido, cuando se determina de acuerdo con la Especificación ANSI/ADA 57 (ANSI/ADA 2000), no debe exceder el 3% en masa. Los hallazgos de este estudio demostraron que AH PlusTM (0.21%) estaba dentro del rango recomendado, mientras que EpiphanyTM (3.41%) mostró un valor más alto que las recomendaciones de ANSI/ADA (2000). Se llevó a cabo una investigación adicional para determinar los componentes de EpiphanyTM que se liberaron durante el período de prueba. El agua destilada desionizada utilizada para la prueba de solubilidad del sellador de conductos radiculares EpiphanyTM fue sometida a espectrometría de absorción atómica y mostró una liberación extensa de calcio (41.46 mg L–1). Se ha demostrado que la liberación de iones de calcio favorece un pH más alcalino del ambiente, lo que lleva a efectos bioquímicos que culminan en la aceleración del proceso de reparación (Seux et al. 1991). Esta alta liberación de calcio por el sellador EpiphanyTM podría explicar la reducción de la periodontitis apical observada clínicamente (Shipper et al. 2005) y su biocompatibilidad intraósea (Souza et al. 2006).
EpiphanyTM está compuesto por rellenos de hidróxido de calcio, sulfato de bario, vidrio de bario y sílice. El contenido total de relleno en el sellador es aproximadamente del 70% en peso (Leonard et al. 1996). Una posible explicación para el valor más alto verificado en la prueba de solubilidad de EpiphanyTM es la erosión de las partículas de relleno que ocurre debido a la degradación (Soderholm et al. 1984, Gopferich 1996). La difusión de agua también conduce a la erosión del material de resina compuesta causada por la liberación de monómeros no reaccionados (monómeros residuales y monómeros activados por luz) (Gopferich 1996). Como un sellador de resina compuesta de curado dual, la matriz de resina de EpiphanyTM es una mezcla de metacrilato de glicidilo de bisfenol A (Bis-GMA), BisGMA etoxilado, dimetacrilato de ureano (UDMA) y metacrilatos difuncionales hidrofílicos (Leonard et al. 1996). Se ha demostrado que los monómeros residuales son los principales componentes liberados de los materiales compuestos dentales curados, ocurriendo dentro de los primeros 7 días desde la colocación (Øysaed et al. 1988, Ruyter 1995). En este estudio, las muestras para la prueba de solubilidad se almacenaron durante un período de 7 días y no durante 24 h como se recomienda por ANSI/ADA. Estos procesos de erosión resultarán en una pérdida de masa del material compuesto dental (Örtengren et al. 2001).
La capacidad del sellador para fluir y entrar en la anatomía del conducto radicular accesorio no instrumentado y entre los conos de gutapercha es importante (McMichen et al. 2003), sin aumentar el riesgo de extrusión periapical, lo que puede comprometer la curación periapical (Sjögren et al. 1990). Los resultados de la prueba de flujo mostraron que ambos cementos eran consistentes con los estándares ANSI/ADA (2000). No hubo diferencia estadística (P > 0.05) en el flujo de los dos cementos. La instrucción del fabricante para curar inmediatamente con luz el relleno radicular coronal para crear un sellado coronal también puede limitar el flujo del sellador de resina para el alivio de tensiones (Davidson & de Gee 1984).
Otra propiedad física importante de un sellador es el grosor de la película. Se esperaría que un sellador con un grosor de película delgada humedezca mejor la superficie que un sellador con un grosor de película gruesa y, por lo tanto, proporcione un mejor sellado (De Deus et al. 2003). Los resultados de la prueba de grosor de película de ambos cementos se ajustaron a la estandarización ANSI/ADA (2000).
Como el sellador contribuye a la unión de la gutapercha a las paredes dentinales, debe ser lo más estable posible (Camps et al. 2004). La Especificación ANSI/ADA 57 (ANSI/ADA 2000) establece que la contracción lineal media del sellador no debe exceder el 1% o el 0.1% en expansión. EpiphanyTM y AH PlusTM presentaron expansión, aunque estos tipos de selladores de resina promueven la contracción por polimerización. El cemento AH PlusTM presentó poca expansión (1.3%), en comparación con Epiphany (8.1%), lo que puede deberse a la metodología de la ADA que recomienda que una muestra se sumerja en agua después del establecimiento del material, en otras palabras, después de la polimerización. Esta alteración dimensional podría explicarse por la absorción de agua sufrida por estos tipos de resinas después de la polimerización (Phillips 1991). La absorción de agua en materiales compuestos es un proceso controlado por difusión y ocurre principalmente en la matriz de resina (Braden et al. 1976, Braden & Clarke 1984). Epiphany mostró altos valores de expansión. Esto podría explicarse por la presencia de metacrilatos difuncionales hidrofílicos. Los materiales polimerizados de mezclas de monómeros hidrofílicos mostrarán alta absorción de agua (Øysaed & Ruyter 1986). La naturaleza polar de tal matriz polimérica y la presencia de sus enlaces son importantes para la absorción de agua y la expansión higroscópica de los materiales de resina compuesta (Peutzfeldt 1997). Otro aspecto es el contenido de relleno del material compuesto que también puede afectar las características de absorción de agua. EpiphanyTM contiene rellenos de hidróxido de calcio que absorben agua (Soderholm et al. 1984, Øysaed & Ruyter 1986).
Conclusión
En conclusión, las pruebas de tiempo, flujo y grosor de película de ambos cementos se ajustaron a las especificaciones de las Normas Nacionales Americanas para materiales de relleno endodóntico (ANSI/ADA 2000). Sin embargo, los valores de solubilidad y alteración dimensional del sellador EpiphanyTM, y los valores de alteración dimensional de AH PlusTM fueron más altos que los considerados aceptables para las especificaciones ANSI/ADA (ANSI/ADA 2000).
Autores: M. A. Versiani, J. R. Carvalho-Junior, M. I. A. F. Padilha, S. Lacey, E. A. Pascon, M. D. Sousa-Neto
Referencias
- ADA Council on Scientific Affairs (1998) Declaración sobre compuestos de resina para posterior. ADA Council on Dental Benefit Programs. Journal of the American Dental Association 129, 1627–8.
- ANSI/ADA (2000) Especificación No. 57 Material de Sellado Endodóntico. Chicago, EE. UU.: ANSI/ADA.
- APHA, AWWA, WPCF (1989) Métodos Estándar para el Examen de Agua y Aguas Residuales, 17ª ed. Washington: American Public Health Association, American Water Works Association, Water Pollution Control Federation.
- Batchelor RF, Wilson AD (1969) Cementos de óxido de zinc-eugenol. I: Los efectos de las condiciones atmosféricas sobre las propiedades reológicas. Journal of Dental Research 48, 883–7.
- Braden M, Causton EE, Clarke RL (1976) Difusión de agua en materiales de relleno compuestos. Journal of Dental Research 55, 730–2.
- Braden M, Clarke RL (1984) Características de absorción de agua de materiales de relleno compuestos microfinos dentales. I. Materiales de propiedad. Biomaterials 5, 369–72.
- Camps J, Pommel L, Bukiet F, About I (2004) Influencia de la relación polvo/líquido en las propiedades de un sellador de conductos radiculares a base de óxido de zinc-eugenol. Dental Materials 20, 915–23.
- Carvalho-Junior JR, Guimarães LF, Correr-Sobrinho L, Pecora JD, Sousa-Neto MD (2003) Evaluación de la solubilidad, desintegración y alteraciones dimensionales de un sellador de conductos radiculares de ionómero de vidrio. Brazilian Dental Journal 14, 114–8.
- Cohen BI, Pagnillo MK, Musikant BL, Deutsch AS (2000) Un estudio in vitro de la citotoxicidad de dos selladores de conductos radiculares. Journal of Endodontics 26, 228–9.
- Davidson CL, de Gee AJ (1984) Relajación de las tensiones de contracción por polimerización mediante flujo en compuestos dentales. Journal of Dental Research 63, 146–8.
- de Deus GA, Martins F, Lima AC, Gurgel-Filho ED, Maniglia CF, Coutinho-Filho T (2003) Análisis del grosor de película de un sellador de conductos radiculares tras tres técnicas de obturación. Brazilian Oral Research 7, 119–25.
- Duarte MAO, Demarchi AC, De Moraes IG (2004) Determinación del pH y liberación de iones de calcio proporcionados por AHPlus puro y que contiene hidróxido de calcio. International Endodontic Journal 37, 42–5.
- Economides N, Kokorikos I, Kolokouris I, Panagiotis B, Gogos C (2004) Estudio comparativo de la capacidad de sellado apical de un nuevo sellador de conductos radiculares a base de resina. Journal of Endodontics 30, 403–6.
- Finger WJ, Lee KS, Podszun W (1996) Monómeros con baja inhibición de oxígeno como adhesivos para esmalte/dentina. Dental Materials 12, 256–61.
- Franco EB, Lopes LG, D’alpino PH, Pereira JC, Mondelli RF, Navarro MF (2002) Evaluación de la compatibilidad entre diferentes tipos de adhesivos y cemento de resina de curado dual. Journal of Adhesive Dentistry 4, 271–5.
- Gogos C, Economides N, Stavrianos C, Kolokouris I, Kokorikos I (2004) Adhesión de un nuevo sellador a base de resina metacrilato a la dentina humana. Journal of Endodontics 30, 238–40.
- Gomes BP, Pedroso JA, Jacinto RC et al. (2004) Evaluación in vitro de la actividad antimicrobiana de cinco selladores de conductos radiculares. Brazilian Dental Journal 15, 30–5.
- Gopferich A (1996) Mecanismos de degradación y erosión de polímeros. Biomaterials 17, 103–14.
- Jia WT, Alpert B (2003) Material de relleno de conductos radiculares. Solicitud de patente de EE. UU. 20030113686, Oficina de Patentes y Marcas de EE. UU., 19 de junio.
- Jin SH, Jia WT (2003) Sistema de autocurado para aplicaciones de sellador endodóntico. Solicitud de patente de EE. UU. 20030134933, Oficina de Patentes y Marcas de EE. UU., 17 de julio.
- Karadag LS, Bala O, Turkoz E, Mihcioglu T (2004) Los efectos de los adhesivos dentales a base de agua y acetona en la microfiltración apical. Journal of Contemporary Dental Practice 5, 93– 101.
- Kardon BP, Kuttler S, Hardigan P, Dorn SO (2003) Una evaluación in vitro de la capacidad de sellado de un nuevo sistema de obturación de conductos radiculares. Journal of Endodontics 29, 658–61.
- Kokkas AB, Boutsioukis ACH, Vassiliadis LP, Stavrianos CK (2004) La influencia de la capa de deslizamiento en la profundidad de penetración de tres selladores de conductos radiculares diferentes: un estudio in vitro. Journal of Endodontics 30, 100–2.
- Leonard JE, Gutmann JL, Guo IY (1996) Sellado apical y coronal de raíces obturadas con un agente de unión de dentina y resina. International Endodontic Journal 29, 76–83.
- McMichen FRS, Pearson G, Rahbaran S, Gulabivala K (2003) Un estudio comparativo de propiedades físicas seleccionadas de cinco selladores de conductos radiculares. International Endodontic Journal 36, 629–35.
- Mickel AK, Nguyen TH, Chogle S (2003) Actividad antimicrobiana de selladores endodónticos sobre Enterococcus faecalis. Journal of Endodontics 29, 257–8.
- Örtengren U, Wellendorf H, Karlsson S, Ruyter IE (2001) Sorción de agua y solubilidad de compuestos dentales e identificación de monómeros liberados en un entorno acuoso. Journal of Oral Rehabilitation 28, 1106–15.
- Øysaed H, Ruyter IE (1986) Sorción de agua y características de relleno de compuestos para uso en dientes posteriores. Journal of Dental Research 65, 1315–8.
- Øysaed H, Ruyter IE, Sjøvik-Kleven IJ (1988) Liberación de formaldehído de compuestos dentales. Journal of Dental Research 67, 1289–94.
- Peutzfeldt A (1997) Compuestos de resina en odontología: los sistemas de monómeros. European Journal of Oral Science 105, 97–116.
- Phillips RW (1991) Ciencia de los Materiales Dentales de Skinner, 9ª ed. Filadelfia: WB Saunders, pp. 221–32.
- Rueggeberg FA, Margeson DH (1990) El efecto de la inhibición de oxígeno en un sistema de compuesto sin llenar/llenado. Journal of Dental Research 69, 1652–8.
- Ruyter IE (1995) Aspectos físicos y químicos relacionados con sustancias liberadas de materiales poliméricos en un entorno acuoso. Advanced Dental Research 9, 344–7.
- Saleh IM, Ruyter IE, Haapasalo M, Ørstavik D (2004) Supervivencia de Enterococcus faecalis en túbulos dentinarios infectados después del relleno de conductos radiculares con diferentes selladores de conductos radiculares in vitro. International Endodontic Journal 37, 193–8.
- Seux D, Couble ML, Hartmann DJ, Gauthier JP, Magloire H (1991) Citodiferenciación similar a odontoblastos de la pulpa dental humana ‘in vitro’ en presencia de un cemento que contiene hidróxido de calcio. Archives of Oral Biology 36, 117–28.
- Sevimay S, Kalayci A (2005) Evaluación de la capacidad de sellado apical y adaptación a la dentina de dos selladores a base de resina. Journal of Oral Rehabilitation 32, 105–10.
- Shipper G, Trope M (2004) Filtración microbiana in vitro de dientes tratados endodónticamente utilizando nuevas y técnicas de obturación estándar. Journal of Endodontics 30, 154–8.
- Shipper G, Teixeira FB, Arnold RR, Trope M (2005) Inflamación periapical después de la inoculación microbiana coronal de raíces de perro rellenas con gutapercha o Resilon. Journal of Endodontics 31, 91–6.
- Sjögren U, Hagglund B, Sunfdgvist G, Wing K, (1990) Factores que afectan los resultados a largo plazo del tratamiento endodóntico. Journal of Endodontics 16, 498–504.
- Soderholm KJ, Zigan M, Ragan M, Fischlschweiger W, Bregman M (1984) Degradación hidrolítica de compuestos dentales. Journal of Dental Research 63, 1248–54.
- Sousa CJA, Montes CRM, Pascon EA, Loyola AM, Versiani MA (2006) Comparación de la biocompatibilidad intraósea de AH PlusTM, Endo REZTM, y EpiphanyTM selladores de conductos radiculares. Journal of Endodontics (en prensa).
- Sousa-Neto MD, Guimarães LF, Saquy PC, Pécora JD (1999) Efecto de diferentes grados de resinas de goma y resinas hidrogenadas sobre la solubilidad, desintegración y alteraciones dimensionales del cemento de Grossman. Journal of Endodontics 25, 477–80.
- Sousa-Neto MD, Passarinho-Neto JG, Carvalho-Junior JR, Cruz-Filho AM, Pecora JD, Saquy PC (2002) Evaluación del efecto de EDTA, EGTA y CDTA sobre la adhesividad de la dentina y la microfiltración con diferentes selladores de conductos radiculares. Brazilian Dental Journal 13, 123–8.
- Tagger M, Tagger E, Tjan AH, Bakland LK (2002) Medición de la adhesión de selladores endodónticos a la dentina. Journal of Endodontics 28, 351–4.
- Tay FR, Loushine RJ, Weller RN et al. (2005) Evaluación ultrastructural del sellado apical en raíces rellenas con un material de relleno de conductos radiculares a base de policaprolactona. Journal of Endodontics 31, 514–9.
- Ulrich JM, Moser JB, Heuer MA (1978) La reología de los cementos de sellador de conductos radiculares seleccionados. Journal of Endodontics 4, 373–9.
