Una evaluación histológica comparativa de la biocompatibilidad de materiales utilizados en cirugía apical
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivo: Evaluar las propiedades biológicas de una variedad de materiales que podrían ser utilizados en cirugía apical.
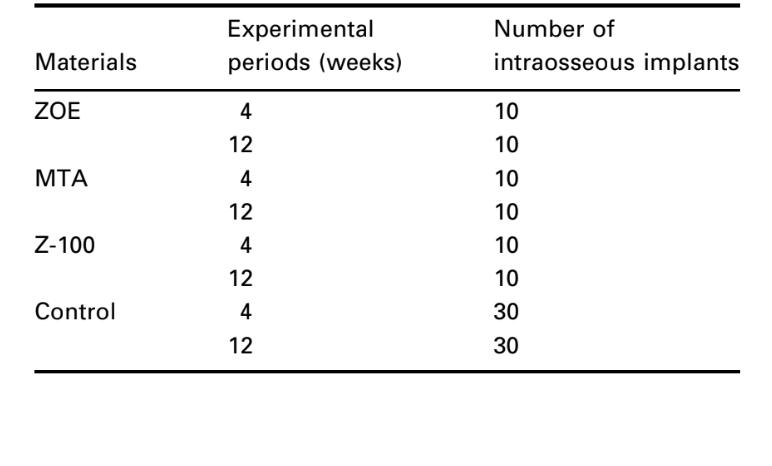
Metodología: Se utilizó la técnica de implante intraóseo recomendada por la FDI (1980) y la ADA (1982) para probar los siguientes materiales: óxido de zinc-eugenol (ZOE), agregado de trióxido mineral (MTA) y resina compuesta Z-100 curada con luz. Treinta cobayas, 10 para cada material, divididas en períodos experimentales de 4 y 12 semanas, recibieron un implante a cada lado de la sínfisis de la mandíbula inferior. La respuesta del tejido conectivo junto a la pared lateral fuera de la copa sirvió como control negativo para la técnica. Al final de los períodos de observación, los animales fueron sacrificados y los especímenes preparados para un examen histológico de rutina para evaluar su biocompatibilidad.
Resultados: La reacción del tejido a los materiales disminuyó con el tiempo. El cemento ZOE fue altamente tóxico durante el período experimental de 4 semanas, pero este perfil cambió significativamente después de 12 semanas, cuando mostró características biocompatibles. El MTA y el Z-100 mostraron biocompatibilidad en este modelo de prueba en ambos períodos de tiempo.
Conclusiones: MTA y el composite Z-100 fueron biocompatibles a las 4 y 12 semanas en este modelo experimental.
Introducción
El éxito en el tratamiento de conductos radiculares depende de la eliminación del contenido infectado del conducto, seguido del llenado del conducto utilizando un material de adecuada compatibilidad para evitar irritación a los tejidos periapicales. A pesar de la constante evolución de conceptos, nuevas técnicas endodónticas y el desarrollo de materiales e instrumentos más efectivos, la resolución de la patología periapical a veces solo se logra a través de procedimientos quirúrgicos (Tassery et al. 1999).
Sin embargo, la cirugía apical solo debe llevarse a cabo cuando el tratamiento convencional de conductos radiculares ha fallado. El material ideal para el sellado apical del extremo radicular debe tener características biocompatibles, estabilidad dimensional, adhesividad, baja solubilidad y la capacidad de crear un sellado del tercio apical del conducto para aislar el sistema de conductos radiculares de la región periapical (Gartner & Dorn 1992). Se ha demostrado que la biocompatibilidad es uno de los factores más importantes (Pascon et al. 2001).
Al considerar las propiedades biológicas de los materiales endodónticos, hay una amplia gama de características que deben tenerse en cuenta. Las metodologías para evaluar estos parámetros comprenden pruebas iniciales, pruebas secundarias y estudios de uso. La evaluación inicial debe incluir métodos básicos in vitro para evaluar las propiedades biológicas. Las evaluaciones secundarias deben realizarse in vivo en animales de laboratorio y pueden incluir experimentos de implantación. Los estudios de uso se llevan a cabo en primates o seres humanos (Spångberg 1969, Stanley 1985).
Se ha recomendado una gran cantidad de materiales para el sellado apical del extremo radicular. El objetivo de este estudio fue evaluar la reacción del tejido de una variedad de materiales potencialmente útiles utilizados como sellador del extremo radicular utilizando el modelo experimental recomendado por la FDI (1980) y la ADA (1982).
Materiales y métodos
Los materiales evaluados fueron óxido de zinc-eugenol (ZOE) (S.S.White, Río de Janeiro, Brasil), agregado de trióxido mineral (MTA) (ProRootTM MTA; Dentsply Endodontics, Tulsa, OK, EE. UU.), y resina compuesta fotocurable Z-100 (3M, St Paul, MN, EE. UU.). Todos los materiales se prepararon de la manera aconsejada por el fabricante para su uso clínico, y se cargaron en portadores de Teflón® (Politetrafluoroetileno; DuPont, HABIA, Knivsta, Suecia), asegurando que no se atrapara aire.
El implante intraóseo en la mandíbula del cobayo (Spångberg 1969) y los métodos estandarizados para evaluar las reacciones biológicas recomendados por la FDI (1980) y la ADA (1982) fueron utilizados. Se seleccionaron treinta cobayos (con un peso de ~800 g) y cada animal recibió dos implantes del mismo material. Se utilizaron diez especímenes para cada material y período de observación (Tabla 1). Además, la respuesta del tejido conectivo junto a la pared lateral fuera de la taza de Teflon® sirvió como control negativo para la técnica.
Los animales fueron anestesiados intraperitonealmente con 0.6 mL de ketamina (100 mg mL–1), que contenía acepromazina (0.5 mg mL–1). En el pliegue mucobucal de la región de los incisivos mandibulares, se inyectaron 0.6 mL de xilocaína al 2% con epinefrina (1 : 100 000), para prevenir molestias locales. Los conejillos de indias fueron afeitados en el área submandibular, y la piel desinfectada con una tintura de yodo al 5%. La región simfisiaria ventral distal de la mandíbula fue expuesta quirúrgicamente bajo condiciones antisépticas a través de una incisión en la piel y el tejido muscular. El hueso mandibular a ambos lados de la sínfisis fue expuesto, y se prepararon agujeros cilíndricos ampliados a un diámetro de 2 mm y una profundidad de 2 mm con fresas bajo irrigación de solución salina fisiológica estéril. Se llenaron bajo condiciones estériles copas cilíndricas de Teflón®, abiertas en un extremo, y con sus superficies exteriores roscadas para proporcionar surcos de retención, con los materiales e insertadas en las cavidades óseas de tal manera que los materiales de relleno estuvieran en contacto con el tejido óseo. Los cilindros fueron
2.0 mm de largo y tenía un diámetro interno de 1.3 mm y un diámetro externo de 2.0 mm. Cuando las copas estaban en su lugar, los tejidos blandos fueron reemplazados y suturados de manera independiente con un material reabsorbible 3-0. Los períodos de observación fueron de 4 y 12 semanas, cuando los conejillos de indias fueron sacrificados, la mandíbula fue disecada y el hueso adyacente a las copas in situ se seccionó en bloques de 10 mm. Las muestras fueron sumergidas en una solución de formalina tamponada al 10% y preparadas para un examen histológico de rutina. Se cortaron secciones en serie (5 lm de grosor) y se tiñeron con hematoxilina-eosina (H & E) para el reconocimiento celular.
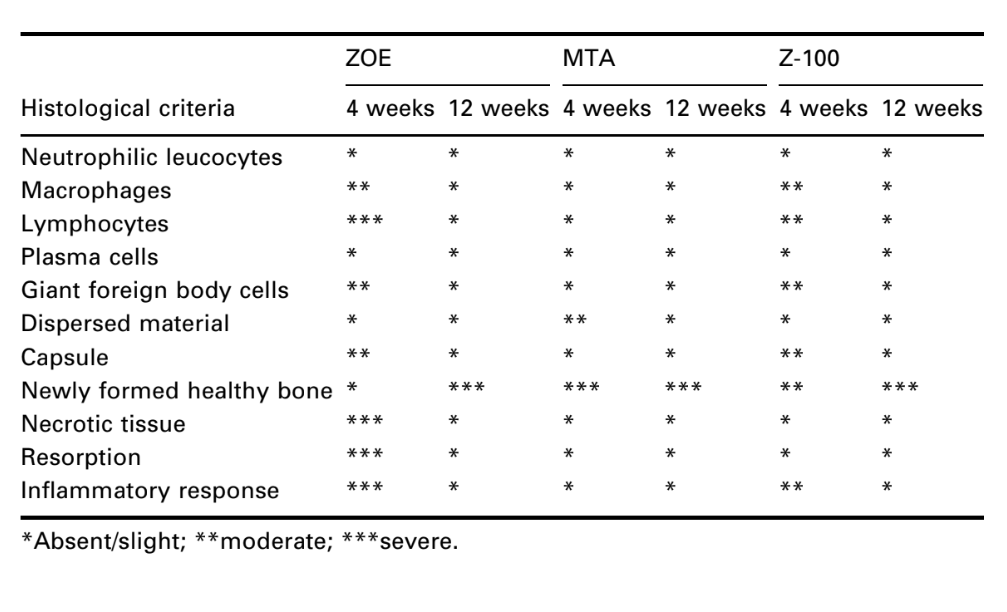
La interfaz en la apertura de la copa, entre el material y el hueso, fue examinada y evaluada por la intensidad de la inflamación. Se utilizaron diez criterios histológicos para determinar los niveles inflamatorios: presencia o ausencia de leucocitos neutrofílicos, macrófagos, linfocitos, células plasmáticas, células gigantes de cuerpo extraño, material disperso, cápsula, hueso sano recién formado, tejido necrótico y reabsorción.
Se utilizaron dos observadores independientes para evaluar las reacciones tisulares. El nivel general de la reacción tisular se calificó como ninguna a leve, moderada y severa de acuerdo con los criterios histológicos definidos previamente. Se consideró biológicamente aceptable que el material mostrara ninguna a leve reacción en ambos períodos experimentales de 4 y 12 semanas, o una reacción moderada a las 4 semanas que disminuyó a las 12 semanas.
Resultados
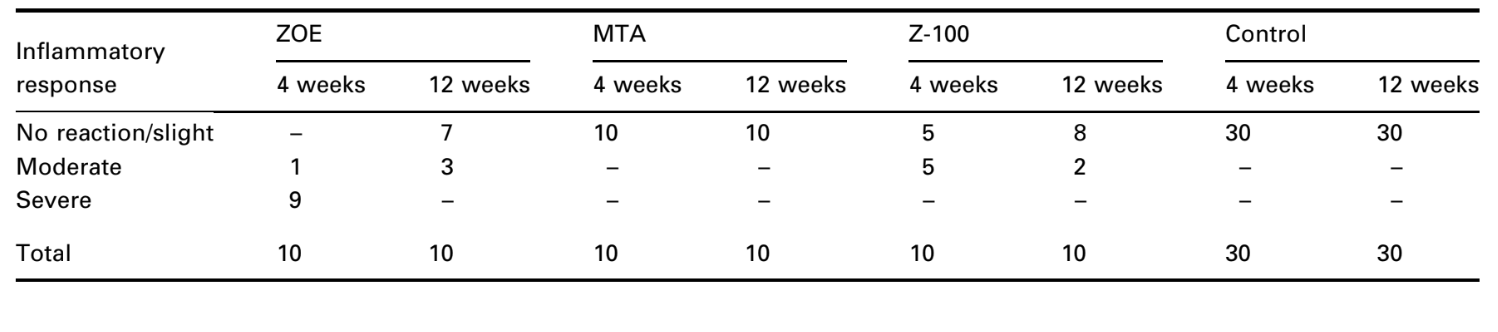
El número de implantes intraóseos y la intensidad de la respuesta inflamatoria se presentan en la Tabla 2. Las evaluaciones histológicas de los materiales a las 4 y 12 semanas se resumen en la Tabla 3.
Observaciones a las cuatro semanas
Control negativo
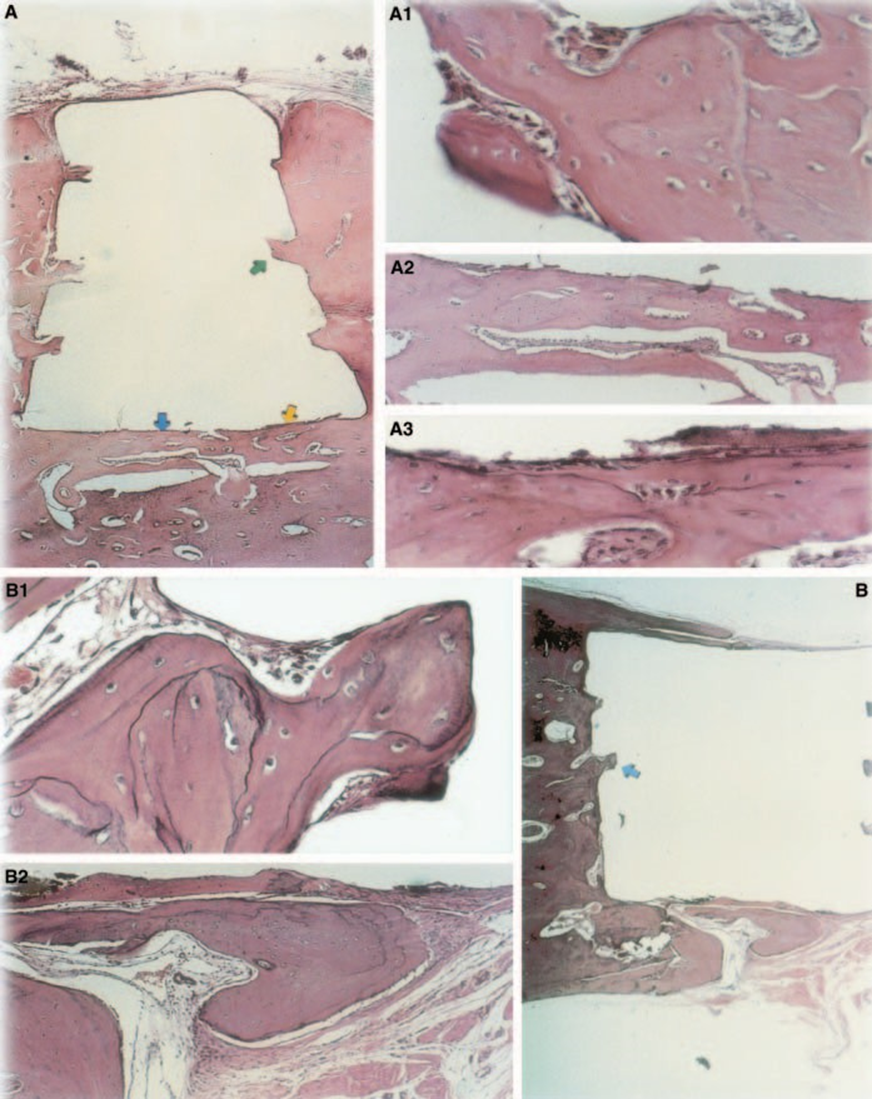
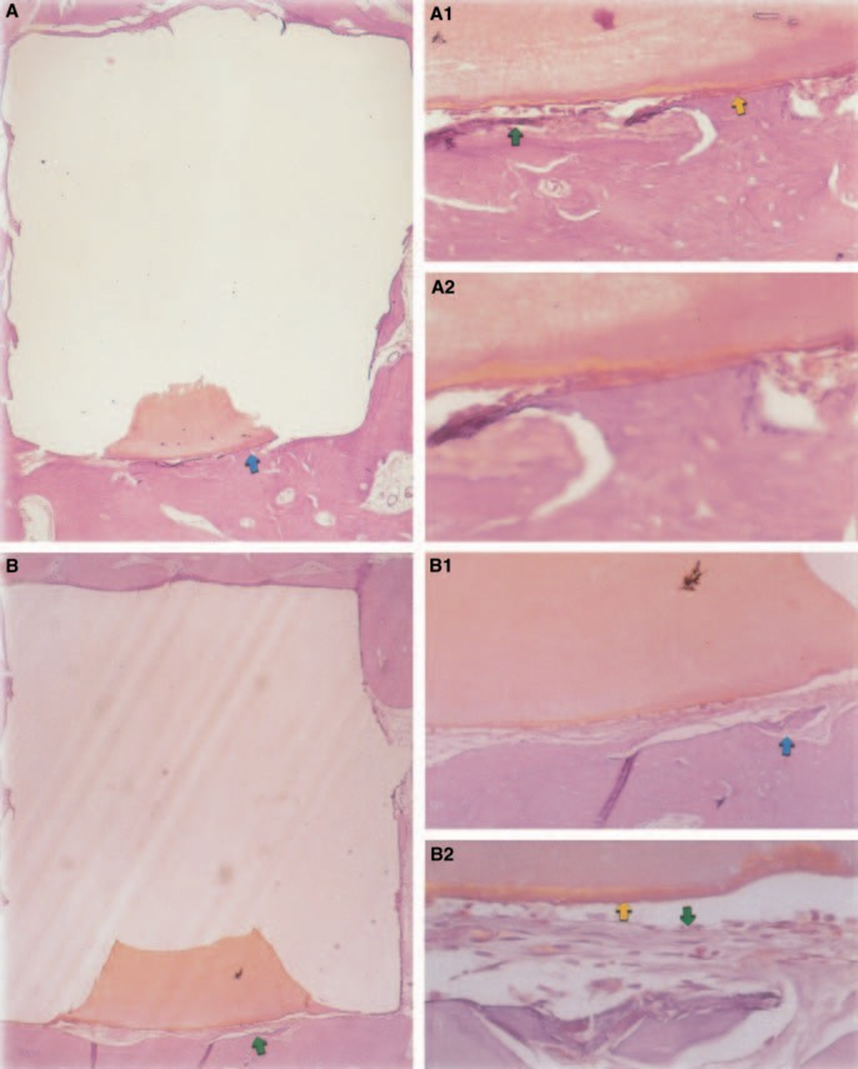
La respuesta del tejido conectivo junto a la pared lateral fuera de las copas de Teflón® de todos los especímenes sirvió como control negativo para la técnica. Las ranuras en la superficie exterior de las copas estaban llenas de nuevo tejido óseo, y se podían ver delgadas capas de tejido conectivo sin reacción inflamatoria entre la copa y el hueso en todos los períodos de observación en todos los especímenes (Fig. 6A1,A2).
Óxido de zinc-eugenol
La reacción fue severa con necrosis ósea, resorción, infiltrado inflamatorio mononuclear demostrado por la presencia de linfocitos, macrófagos y células gigantes de cuerpo extraño (Fig. 1C). La presencia de aglomerados de células gigantes de cuerpo extraño que contenían material en el citoplasma y tejido necrótico eran comunes (Fig. 1D). Hubo una mayor deposición de fibras de colágeno más cerca del tejido óseo que del material y baja presencia de células inflamatorias (Fig. 1B).
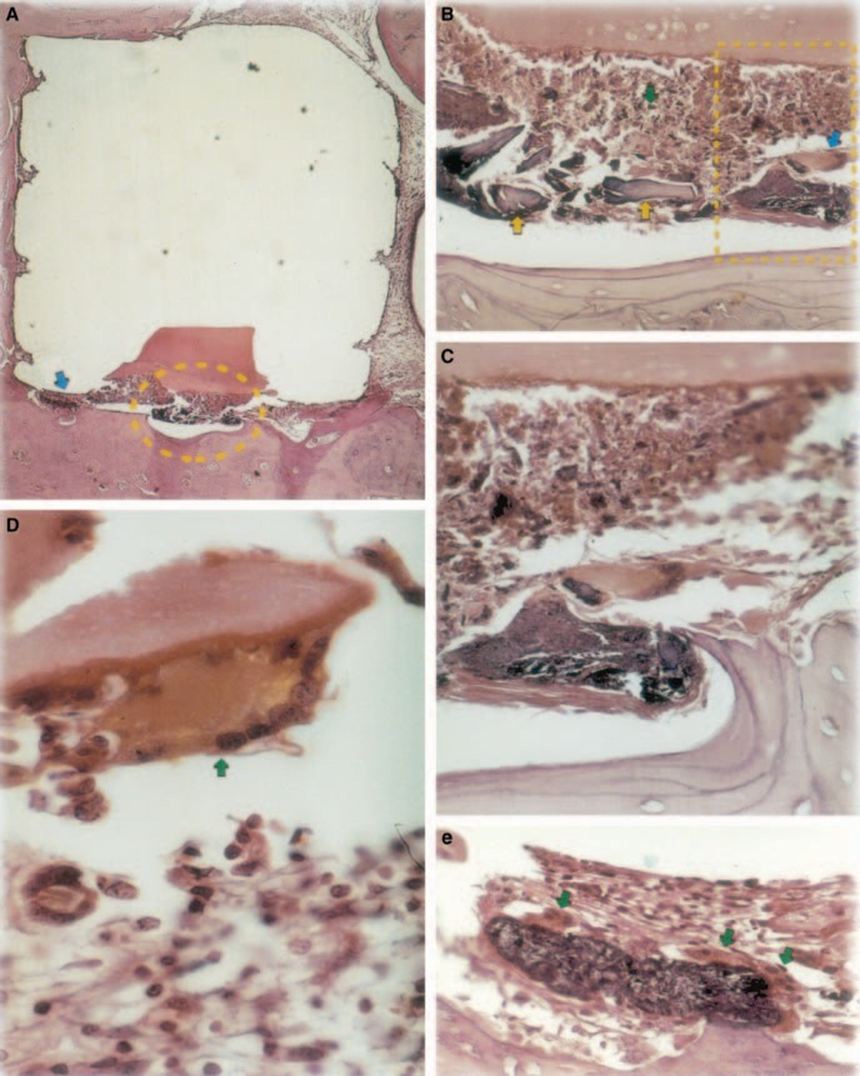
Agregado de trióxido mineral
La respuesta inflamatoria se clasificó como ninguna a leve. Hubo formación de hueso sano en estrecho contacto con el material (Fig. 3).
Z-100
Se observó una respuesta inflamatoria leve a moderada con formación de tejido conectivo denso en la interfaz material/tejido óseo (Fig. 5A2,B1). Este tejido conectivo fibroso era rico en fibroblastos; se podían observar vasos, sin infiltrado inflamatorio, y deposición de tejido mineral, demostrando formación ósea (Fig. 5A3). La presencia de macrófagos y células gigantes de cuerpo extraño cerca del material fue un hallazgo constante (Fig. 5A1,B1). Se observó un infiltrado inflamatorio crónico moderado cerca del material (Fig. 5B2).
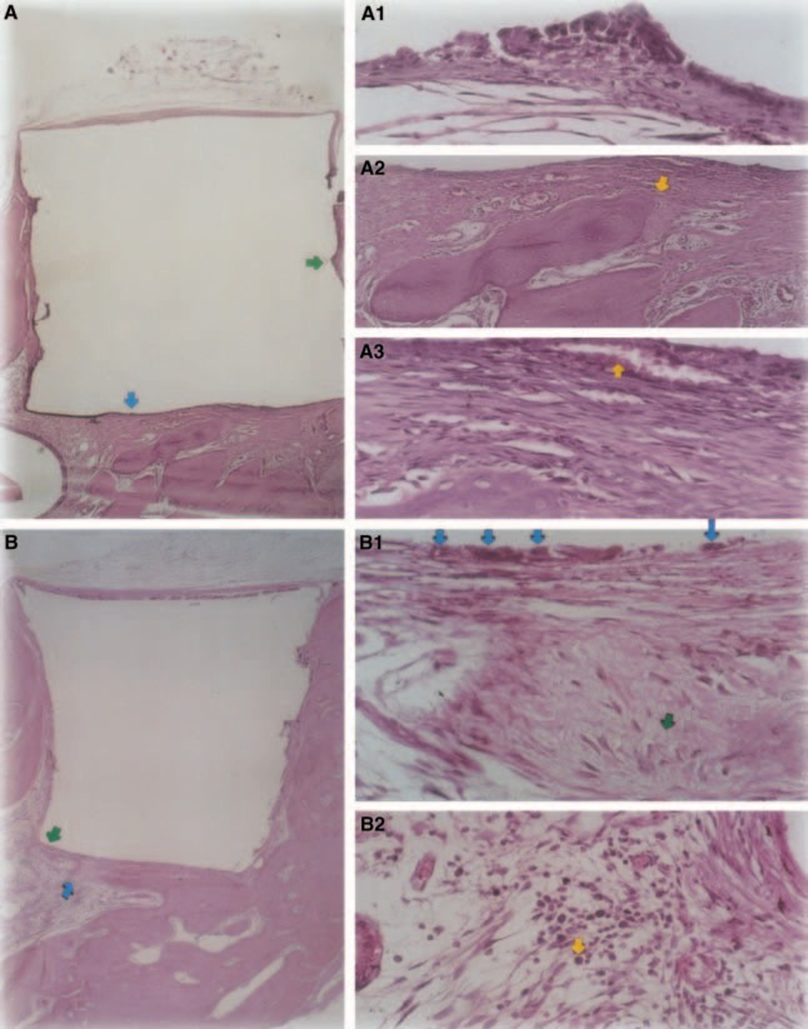
Observaciones de doce semanas
Control negativo
La respuesta del tejido conectivo junto a la pared lateral fuera de las copas de Teflon® de todos los especímenes sirvió como control negativo para la técnica. Se pudo observar que las ranuras en la superficie exterior de las copas estaban llenas de nuevo tejido óseo, y una delgada capa de tejido conectivo sin reacción inflamatoria se podía ver entre la copa y el hueso en todos los períodos de observación en todos los especímenes (Fig. 6A1,A2).
Óxido de zinc-eugenol
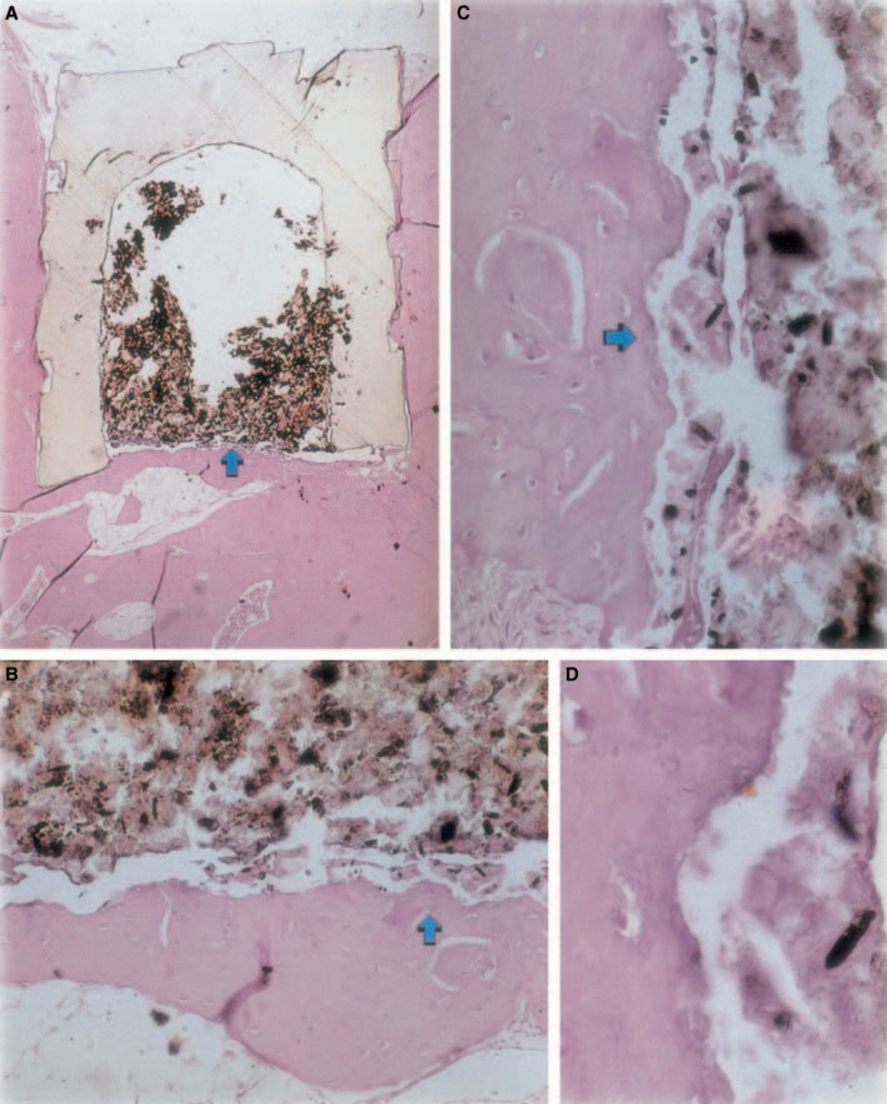
La reacción inflamatoria varió de ninguna a leve durante el período experimental. Hubo formación ósea en la interfaz (Fig. 2A,B). El hueso alrededor de la copa estaba sano y la cubría completamente. En algunos casos, había una delgada capa de tejido conectivo entre el material implantado y el nuevo tejido óseo (Fig. 2A1,A2,B1). Sin embargo, todavía había algo de resorción presente (Fig. 2B2).
Agregado de trióxido mineral
Se había formado nuevo tejido óseo en la interfaz material/tejido. No hubo una reacción inflamatoria significativa y, cuando estuvo presente, los macrófagos y las células gigantes de cuerpo extraño se encontraban en la región periférica, en estrecho contacto con la copa de Teflón®. También se observó hueso sano que contenía osteoblastos en estrecho contacto con el material (Fig. 4C).
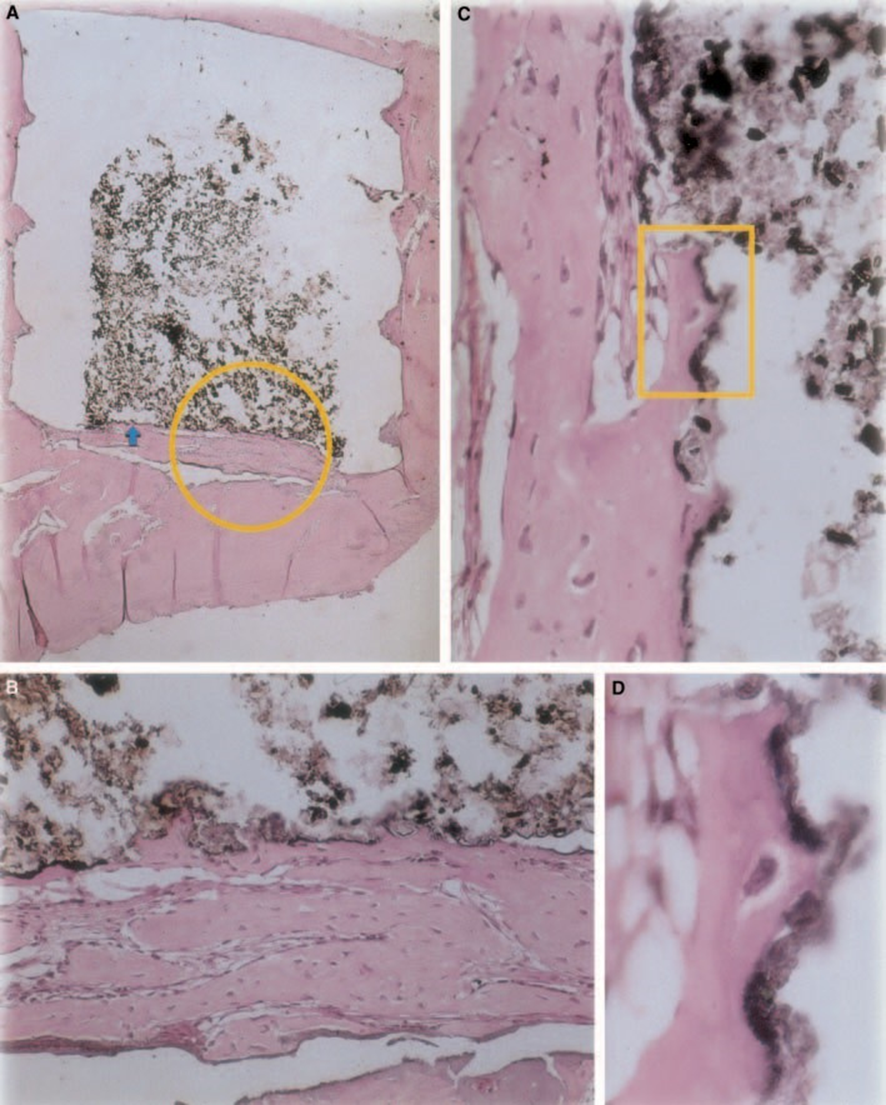
Z-100
El grosor del tejido conectivo se redujo significativamente en la interfaz (Fig. 6A,B). La presencia de células inflamatorias fue baja, excepto por las células gigantes de cuerpo extraño (Fig. 6A3).
Discusión
La biocompatibilidad es una de las propiedades más importantes de un material utilizado en el sellado apical de la raíz porque estará en contacto permanente con tejidos vivos en la región periapical. Uno de los objetivos de la cirugía perirradicular es crear una barrera entre la región periapical y cualquier agente físico y/o bacteriano dentro del sistema de conductos radiculares. El uso de un material de sellado de raíz no compatible interferirá con la curación en esa área. Los materiales utilizados en el sellado apical de la raíz, además de las pruebas preliminares necesarias, deben tener sus características de biocompatibilidad investigadas (Torabinejad & Pitt Ford 1996).
La prueba de implante en tejido óseo de cobayo recomendada por la FDI (1980) permite probar el material tal como se utiliza en el entorno clínico, preparado siguiendo las recomendaciones del fabricante. Aunque los resultados no pueden ser extrapolados directamente a los seres humanos, la prueba está estandarizada y permite una comparación directa entre materiales. La literatura en este campo proporciona resultados en varios laboratorios utilizando los mismos materiales para permitir que los datos sean comparados (Pascon et al. 1987, Andreana et al. 1989, Pascon & Langeland 1989, Barbosa et al. 1993). Los resultados obtenidos en este estudio confirmaron los hallazgos de otros que cualquier material colocado en contacto con tejidos provoca una reacción de cuerpo extraño (Figs 1D, 5B1 y 6A3).
Las reacciones a lo largo de la periferia externa de la taza de Teflon® reflejan el trauma causado por los procedimientos quirúrgicos necesarios para la introducción del Teflon® y su contenido. El Teflon® en sí causa una irritación insignificante en los tejidos (Stanley 1985) y se utilizó como portador debido a su biocompatibilidad (Spångberg 1969, ADA 1982). Esto fue confirmado por la ausencia de reacciones inflamatorias en la pared lateral de los portadores en ambos períodos de observación.
La respuesta inflamatoria al ZOE fue significativamente mayor que la de los otros materiales en ambos períodos de observación (Figs 1 y 2). Esta severa respuesta al ZOE ha sido descrita en la literatura (Pascon & Langeland 1989, Gulati et al. 1991, Guigand et al. 1999). También se ha demostrado que cualquier material que contenga eugenol provoca una reacción tisular severa debido a la depresión de la respiración celular (Hume 1984). Serene et al. (1988) encontraron que los selladores de ZOE activaron el sistema de complemento y, por lo tanto, una reacción inflamatoria. La respuesta inflamatoria prolongada al ZOE ocurre porque la reacción entre el material y los fluidos tisulares finalmente libera eugenol del material.
Los resultados presentados confirmaron los hallazgos reportados por Torabinejad et al. (1997, 1998) en relación con la respuesta inflamatoria del MTA (Figs 3 y 4). Estos autores probaron este material en las tibias y mandíbulas de cobayas, y como un material de obturación apical en monos, y reportaron su biocompatibilidad. No se observó una respuesta inflamatoria significativa.
Stabholz et al. (1985) introdujeron resinas compuestas como materiales de obturación apical y compararon sus propiedades físicas con las de la amalgama de plata, Cavit y fosfato de zinc. Sin embargo, no hubo preocupaciones sobre la respuesta del tejido en su trabajo. Cuando se utilizaron resinas como materiales apicales, los resultados variaron desde una inflamación severa (Bruce et al. 1993) hasta un alto grado de curación (Rud et al. 1991).
Los resultados del presente estudio son similares a los de Rud et al. (1991), quienes sugirieron que los compuestos tenían una biocompatibilidad prometedora. Aunque fue un hallazgo rutinario, el crecimiento óseo en estrecho contacto con el Z-100 ocurrió, probablemente como resultado de su bajo grado de toxicidad (Fig. 6A2,B2).
Conclusiones
- El nivel de toxicidad de los materiales probados disminuyó con el tiempo.
- El cemento basado en ZOE fue altamente tóxico durante el período experimental de 4 semanas, pero este perfil cambió significativamente después de 12 semanas, cuando mostró características biocompatibles.
- Todos los materiales estudiados, con excepción de ZOE, presentaron niveles de biocompatibilidad aceptables, dentro de los dos períodos analizados.
- El MTA presentó excelentes cualidades biológicas con crecimiento óseo en estrecho contacto con el material y sin tejido conectivo interpuesto.
- El MTA y Z-100 indicaron biocompatibilidad en esta prueba secundaria.
Autores: C. J. A. Sousa, A. M. Loyola, M. A. Versiani, J. C. G. Biffi, R. P. Oliveira, E. A. Pascon
Referencias
- ADA (1982) Evaluación Biológica de Materiales Dentales. Asociación Dental Americana, Nueva York, Documento No. 41.
- Andreana S, Pascon EA, Langeland K (1989) Respuesta del tejido óseo a la hemofibrina [Resumen]. Revista de Investigación Dental 68, 381.
- Barbosa SV, Araki K, Spångberg LS (1993) Citotoxicidad de algunos selladores de conductos radiculares modificados y sus componentes solubles. Cirugía Oral, Medicina Oral y Patología Oral 75, 357–61.
- Bruce GR, McDonald NJ, Sydiskis RJ (1993) Citotoxicidad de materiales de retrorelleno. Revista de Endodoncia 19, 288–92.
- FDI (1980) Prácticas Estándar Recomendadas para la Evaluación Biológica de Materiales Dentales. Federación Dental Internacional, Londres, Informe Técnico no. 9.
- Gartner AH, Dorn, SO (1992) Avances en cirugía endodóntica. Clínicas Dentales de América del Norte 36, 357–78.
- Guigand M, Pellen-Mussi P, LeGolff A, Vulcain J-M, Bonnaure-Mallet M (1999) Evaluación de la cito compatibilidad de tres materiales endodónticos. Revista de Endodoncia 25, 419–23.
- Gulati N, Chandra S, Aggarwal PK, Jaiswal JN, Singh M (1991) Citotoxicidad del eugenol en sellador que contiene óxido de zinc. Endodoncia y Traumatología Dental 7, 181–5.
- Hume WR (1984) Efecto del eugenol sobre la respiración y división en pulpa humana, fibroblastos de ratón y células hepáticas in vitro. Revista de Investigación Dental 63, 1262–5.
- Pascon EA, Langeland K (1989) Citotoxicidad de un nuevo sellador endodóntico [Resumen]. Revista de Investigación Dental 68, 244.
- Pascon EA, Spångberg L, Langeland K (1987) Citotoxicidad de selladores endodónticos [Resumen]. Revista de Investigación Dental 66, 200.
- Pascon EA, Sousa CJA, Langeland K (2001) Biocompatibilidad de materiales endodónticos: citotoxicidad de una resina de poliuretano derivada del aceite de ricino. Revista Brasileña de Endodoncia 5, 5–12.
- Rud J, Munksgaard EC, Andreasen JO, Rud V, Asmussen E (1991) Relleno retrogrado con composite y un agente de unión a la dentina. Parte 1. Endodoncia y Traumatología Dental 7, 118–25.
- Serene TP, Vesely J, Boackle RJ (1988) Activación del complemento como posible indicación in vitro del potencial inflamatorio de materiales endodónticos. Cirugía Oral, Medicina Oral y Patología Oral 65, 354–7.
- Spångberg L (1969) Efectos biológicos de materiales de relleno de conductos radiculares. Parte 7. Reacción del tejido óseo al material de relleno de conducto radicular implantado en cobayas. Revista Odontológica 77, 133–59.
- Stabholz A, Friedman S, Abed J (1985) Adaptación marginal de rellenos retrogrados y su correlación con la sellabilidad. Revista de Endodoncia 11, 218–23.
- Stanley HR (1985) Pruebas de Toxicidad de Materiales Dentales, 1ª ed. Miami, FL, EE. UU.: CRC Press.
- Tassery H, Pertot WJ, Camps J, Proust JP, Déjou J (1999) Comparación de dos sitios de implantación para probar la biocompatibilidad intraósea. Revista de Endodoncia 25, 615–8.
- Torabinejad M, Pitt Ford TR (1996) Materiales de relleno de extremo radicular: una revisión. Endodoncia y Traumatología Dental 12, 161–78.
- Torabinejad M, Pitt Ford TR, McKendry DJ, Abedi HR, Miller DA, Kariyawasam SP (1997) Evaluación histológica del agregado de trióxido mineral como un relleno de extremo radicular en monos. Revista de Endodoncia 23, 225–8.
- Torabinejad M, Pitt Ford TR, Abedi, HR, Kariyawasam SP, Tang HM (1998) Reacción del tejido a materiales de relleno de extremo radicular implantados en la tibia y mandíbula de cobayas. Revista de Endodoncia 24, 468–71.
