Comparación de la Biocompatibilidad Intraósea de los Selladores de Conductos Radiculares AH Plus, EndoREZ y Epiphany
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Evaluar la biocompatibilidad intraósea de los selladores de conductos radiculares AH Plus, EndoREZ y Epiphany según lo recomendado por el Informe Técnico #9 de la Fédération Dentaire Internationale (FDI). Treinta conejillos de indias, 10 para cada material, divididos en períodos experimentales de 4 y 12 semanas, recibieron un implante a cada lado de la sínfisis de la mandíbula inferior. Al final de los períodos de observación, los animales fueron sacrificados y las muestras preparadas para un examen histológico de rutina. Después de analizar ambos períodos, la reacción del tejido inflamatorio al EndoREZ se consideró severa. En el grupo AH Plus, la reacción cambió de severa a moderada, mientras que se observó compatibilidad biológica con Epiphany con formación ósea y ninguna a ligera reacción inflamatoria. Se concluyó que el sellador de conductos radiculares Epiphany fue el único material que presentó biocompatibilidad intraósea dentro de los dos períodos analizados. (J Endod 2006;32:656 – 662)
El éxito en el tratamiento de conductos radiculares depende de la eliminación completa del contenido infectado del conducto, seguido de la obturación utilizando un material de adecuada compatibilidad para evitar posibles irritaciones a los tejidos periradiculares. Debido a que la lesión tisular inducida por procedimientos intracanal puede resultar en respuestas desfavorables al tratamiento, la elección del profesional sobre los procedimientos a utilizar durante el tratamiento de conductos radiculares debe basarse en aquellos que se sabe que causan el menor daño posible. Se ha demostrado que los materiales extraños, como los selladores de conductos radiculares, atrapados en los tejidos periradiculares después del tratamiento endodóntico pueden perpetuar la periodontitis apical.
También se ha demostrado que la biocompatibilidad con los tejidos perirradiculares es el requisito más importante, ya que cualquier material que no sea biológicamente aceptable puede ser responsable de fallos. En cuanto a las propiedades biológicas de los materiales endodónticos, hay una amplia gama de características que deben ser consideradas. Las metodologías para evaluar los parámetros comprenden pruebas iniciales, pruebas secundarias y estudios de uso. La evaluación inicial debe incluir métodos in vitro para evaluar el perfil de toxicidad del material. Las pruebas secundarias deben realizarse in vivo, en animales de laboratorio, y pueden incluir experimentos de implantación. Los estudios de uso se llevan a cabo en primates o seres humanos.
Los materiales que se utilizan actualmente en la práctica clínica comprenden selladores endodónticos a base de resina, óxido de zinc-eugenol, ionómero de vidrio, hidróxido de calcio y silicona. Los materiales de relleno de resina han ganado popularidad de manera constante y ahora son aceptados como selladores de conductos radiculares, y las mejoras en la tecnología adhesiva han fomentado intentos de reducir la filtración apical y coronal al unirse a las paredes del conducto radicular. Así, los nuevos selladores de resina a base de metacrilato EndoREZ y Epiphany han sido desarrollados recientemente. Las propiedades biológicas de EndoREZ han sido investigadas previamente en cuanto a su citotoxicidad y biocompatibilidad tisular. Por otro lado, las propiedades biológicas de Epiphany, un sellador de composite de resina dental de curado dual, están poco investigadas.
Se ha afirmado que la base biológica para la terapia de conducto radicular está rezagada en comparación con los impresionantes avances tecnológicos en Endodoncia. Sin embargo, aunque se requiere antes de ser promovido para uso clínico, la mayoría de los materiales carecen incluso de pruebas básicas de seguridad.
Hasta la fecha, no se han realizado estudios para analizar histológicamente el efecto de la implantación de Epiphany en el hueso. Así, el propósito de este estudio fue evaluar las propiedades biológicas de los selladores de conducto radicular a base de metacrilato recientemente desarrollados, EndoREZ y Epiphany, comparándolos con un sellador de conducto radicular de resina epoxi-amina convencional y bien establecido, AH Plus, utilizando el protocolo recomendado por la Fédération Dentaire Internationale (FDI).
Materiales y Métodos
Los materiales evaluados fueron AH Plus (Dentsply, DeTrey, Konstanz, Alemania), EndoREZ (Ultradent Products, Inc., South Jordan, UT) y Epiphany (Pentron Clinical Technologies, Wallingford, CT) selladores de conducto radicular. Todos los materiales se prepararon de acuerdo con la recomendación del fabricante para su uso clínico y se cargaron en portadores de teflón (Politetrafluoroetileno, DuPont, HABIA, Knivsta, Suecia), asegurando que no se atrapara aire. El protocolo para este experimento fue revisado y aprobado por el Comité de Ética de la Investigación de la Universidad de Uberlândia y el experimento se llevó a cabo de acuerdo con los ‘Principios de Cuidado de Animales de Laboratorio’ (NIH, No. 86-23, 1985).
El implante intraóseo en la mandíbula del cobayo y los métodos estandarizados para evaluar las propiedades biológicas recomendados por el Informe Técnico #9 FDI fueron utilizados. Se seleccionaron treinta cobayos (con un peso de ~800 g) y cada animal recibió dos implantes del mismo material. Se utilizaron diez especímenes para cada material y período de observación. Además, la respuesta del tejido conectivo junto a la pared lateral fuera de la copa de Teflón sirvió como control negativo para la técnica.
Los animales fueron anestesiados intraperitonealmente con 0.6 ml de ketamina que contenía acepromazina en una proporción de 1:1. Para prevenir molestias locales, se inyectaron 0.6 ml de xilocaína al 2% con epinefrina (1:100,000) en el pliegue mucobucal de la región de los incisivos mandibulares. Se rasuró el área submandibular y se desinfectó la piel con una tintura de yodo al 5%. La región simfisaria ventral distal de la mandíbula fue expuesta quirúrgicamente bajo condiciones antisépticas a través de una incisión en la piel y el tejido muscular. Se expuso el hueso mandibular a ambos lados de la sínfisis, y se prepararon agujeros cilíndricos con un diámetro de 2 mm y una profundidad de 2 mm con fresas, bajo irrigación de solución salina fisiológica estéril. Se llenaron bajo condiciones estériles copas cilíndricas de Teflón, abiertas en un extremo y con sus superficies exteriores roscadas para proporcionar surcos de retención, con los materiales e insertaron en las cavidades óseas de tal manera que los materiales de relleno estuvieran en contacto con el hueso, preservando la condición estéril. Los cilindros tenían 2.0 mm de largo y un diámetro interno de 1.3 mm y un diámetro externo de 2.0 mm. Muestras aleatorias de los cilindros se colocaron en tubos de medio tioglicolato de Brewer y se incubaron aerobicamente durante 4 días para determinar su esterilidad.
Cuando las copas estaban en su lugar, los tejidos blandos fueron reemplazados y suturados de manera independiente con un material reabsorbible de 3-0. Los períodos de observación fueron de 4 y 12 semanas, cuando los conejillos de indias fueron sacrificados, la mandíbula fue disecada y el hueso adyacente a las copas en situ fue seccionado en bloques de 10 mm. Las muestras fueron sumergidas en una solución de formalina tamponada al 10% y preparadas para un examen histológico de rutina. Se cortaron secciones en serie, con el microtomo ajustado a un grosor de 5 µm, y se tiñeron con hematoxilina y eosina (H&E) para el reconocimiento celular. Se seleccionaron portaobjetos que fueron teñidos utilizando las técnicas de Tricrómico de Masson y de Brown y Brenn para el reconocimiento de colágeno y contaminación bacteriana.
La interfaz en la apertura de la copa, entre el material y el hueso, fue examinada y evaluada por la intensidad de la inflamación. La evaluación de los criterios de la FDI es exclusivamente cualitativa y no se utilizó ningún índice de puntuación. Por lo tanto, el nivel general de la reacción del tejido fue calificado como ninguno a leve, moderado y severo dependiendo de la presencia o ausencia de leucocitos neutrofílicos, macrófagos, linfocitos, células plasmáticas, células gigantes de cuerpo extraño, material disperso, cápsula, hueso sano recién formado, tejido necrótico y reabsorción.
Dos observadores independientes evaluaron ciegamente las reacciones. Sin embargo, previamente, cada investigador fue calibrado al puntuar dos veces un conjunto estándar de 50 diapositivas respecto a la intensidad y tipo de la reacción inflamatoria. El acuerdo entre examinadores, calculado como kappa de Cohen, varió de 0.8 a 0.95. La reproducibilidad intraexaminador se evaluó mediante una puntuación doble de 25 diapositivas seleccionadas al azar en un intervalo de 1 mes. En este caso, el kappa de Cohen varió de 0.85 a 0.91. Se consideró biológicamente aceptable cuando el material mostró ninguna a ligera reacción en ambos períodos experimentales, o una reacción moderada a las 4 semanas que disminuyó a las 12 semanas.
Resultados
El número de implantes intraóseos y la intensidad de la respuesta inflamatoria se presentan en Tabla 1. La evaluación histológica de los materiales a las 4 y 12 semanas se resume en Tabla 2.

Ning una de las diapositivas teñidas por la técnica de Brown y Brenn mostró la presencia de colonización bacteriana en ninguno de los implantes experimentales. Los cilindros almacenados con aquellos que producían crecimiento en los medios de cultivo fueron negativos. La respuesta del tejido conectivo junto a la pared lateral fuera de los vasos de Teflón de todos los especímenes sirvió como un control negativo para la técnica. Se pudo observar que las ranuras en la superficie exterior de los vasos estaban llenas de nuevo tejido óseo, y una delgada capa de tejido conectivo, sin reacción inflamatoria, se podía ver entre el vaso y el hueso en todos los períodos de observación en todos los especímenes probados.
Observaciones de Cuatro Semanas
AH Plus
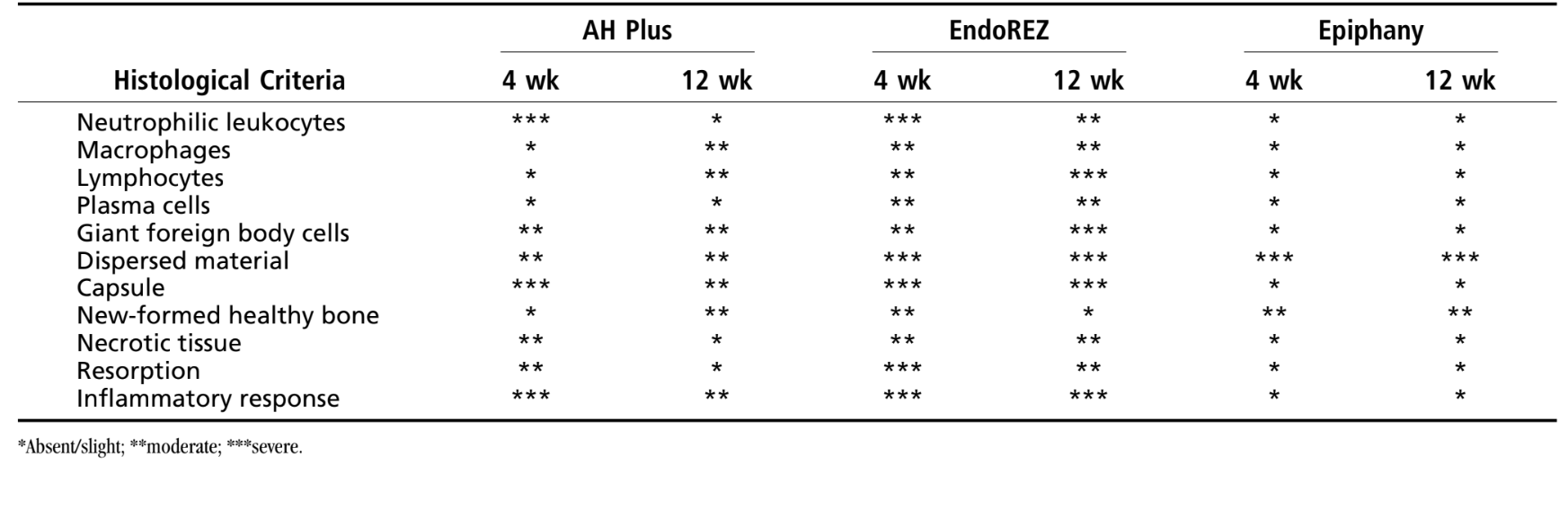
La reacción se consideró severa. Había una delgada capa de tejido conectivo interpuesta entre el material y el hueso (Fig. 1b) y la intensa infiltración inflamatoria mostró la presencia de linfocitos, macrófagos y células gigantes de cuerpo extraño, fragmentos óseos necróticos (Fig. 1c).

EndoREZ
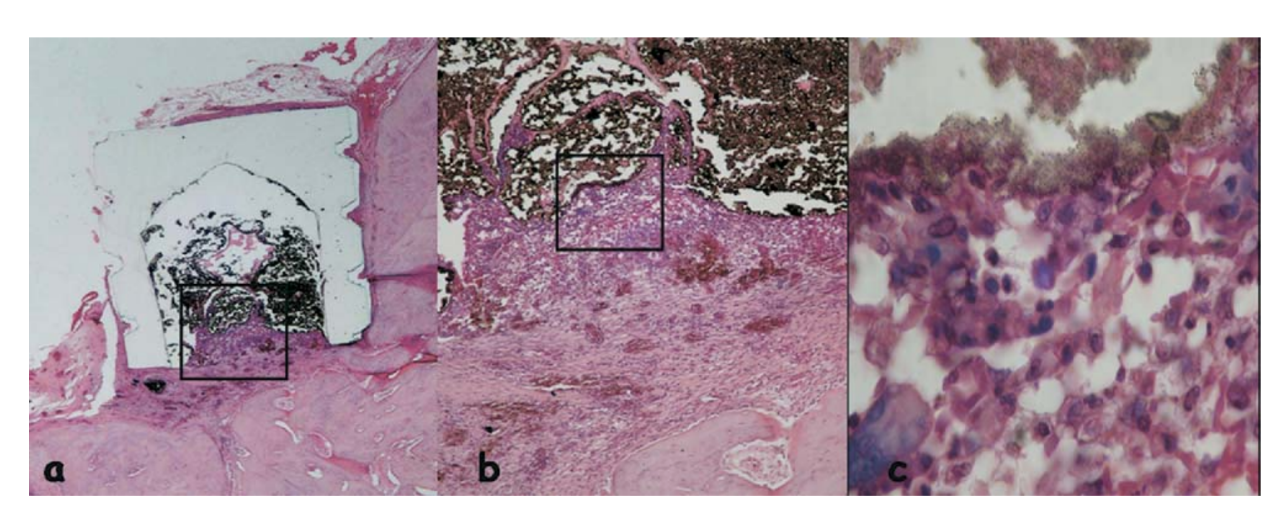
La reacción se consideró severa con un intenso infiltrado inflamatorio crónico, con predominancia de linfocitos, macrófagos y células gigantes de cuerpo extraño (Fig. 3c). Había material disperso y la formación de una capa gruesa de tejido conectivo interpuesta entre el material y el hueso (Fig. 3d).
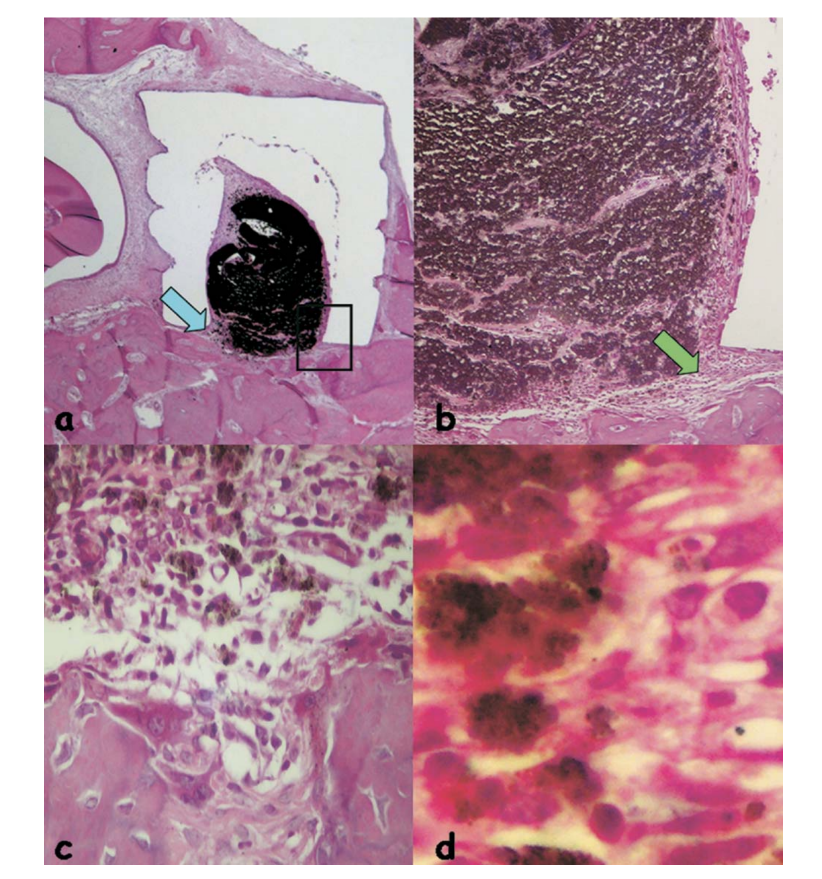
y el hueso (área delineada en a) (H&E, aumento original 40x); (c) tejido conectivo con algo de material disperso (flecha verde en b) (H&E, aumento original 100x); (d) infiltrado inflamatorio crónico y células con fragmentos del material probado (flecha azul en a) (H&E, aumento original 400x).
Epifanía
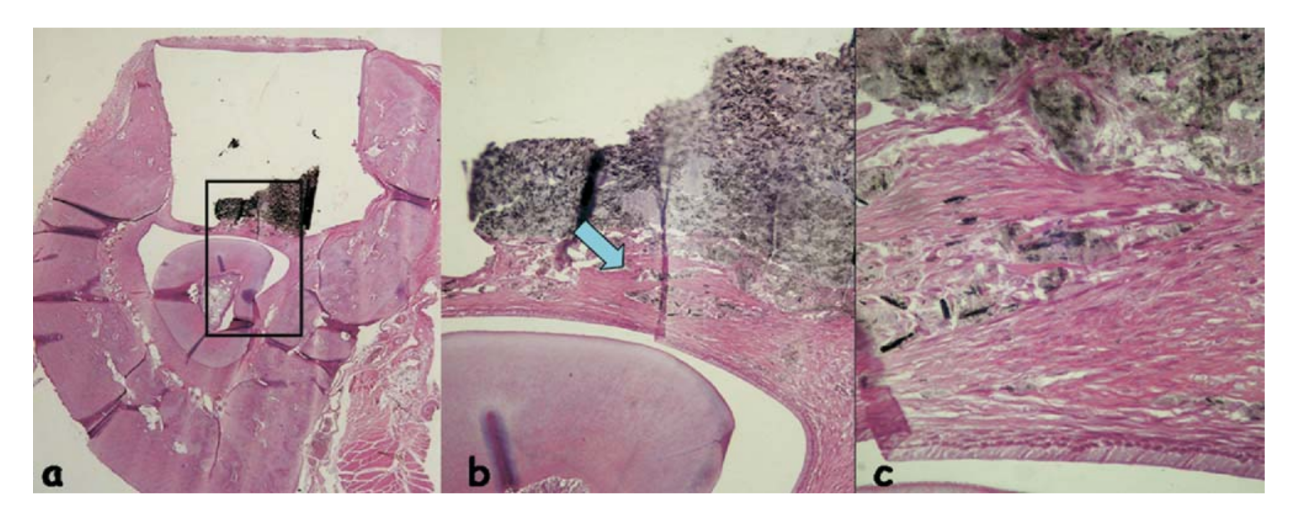
La respuesta inflamatoria se clasificó como ninguna a leve. Se observó un tejido conectivo organizado en estrecho contacto con el material probado (Fig. 5b), algunas células inflamatorias y algo de material disperso (Fig. 5c).
Observaciones a Doce Semanas
AH Plus
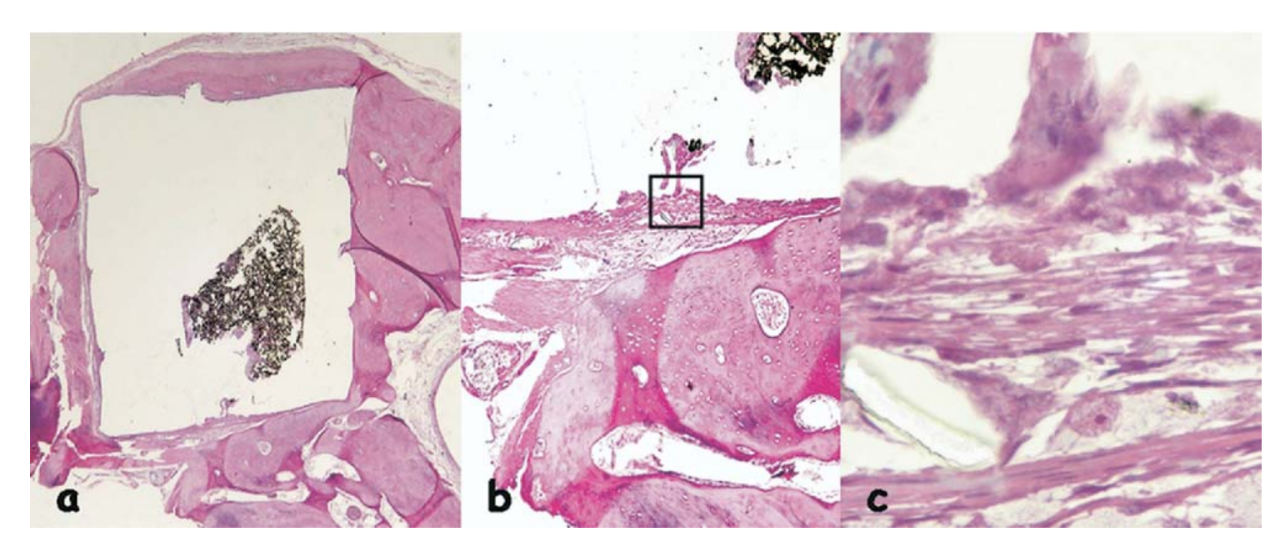
Se observó una reacción inflamatoria crónica clasificada como moderada. Se observó la presencia de algunas células gigantes de cuerpo extraño y una delgada capa de tejido conectivo interpuesta entre el hueso recién formado y el material implantado (Fig. 2c).
EndoREZ
La reacción inflamatoria seguía siendo severa con un intenso infiltrado inflamatorio crónico, con la prevalencia de linfocitos, macrófagos y células gigantes de cuerpo extraño (Fig. 4b). Se observó la presencia de material disperso, áreas hemorrágicas y vasos hiperémicos (Fig. 4c).
Epifanía
La reacción inflamatoria fue clasificada como ninguna a leve. Se observó la aposición de un hueso sano neoformado cerca del material (Fig. 6b) y una delgada capa de tejido conectivo adyacente al material probado sin células inflamatorias (Fig. 6c, d).
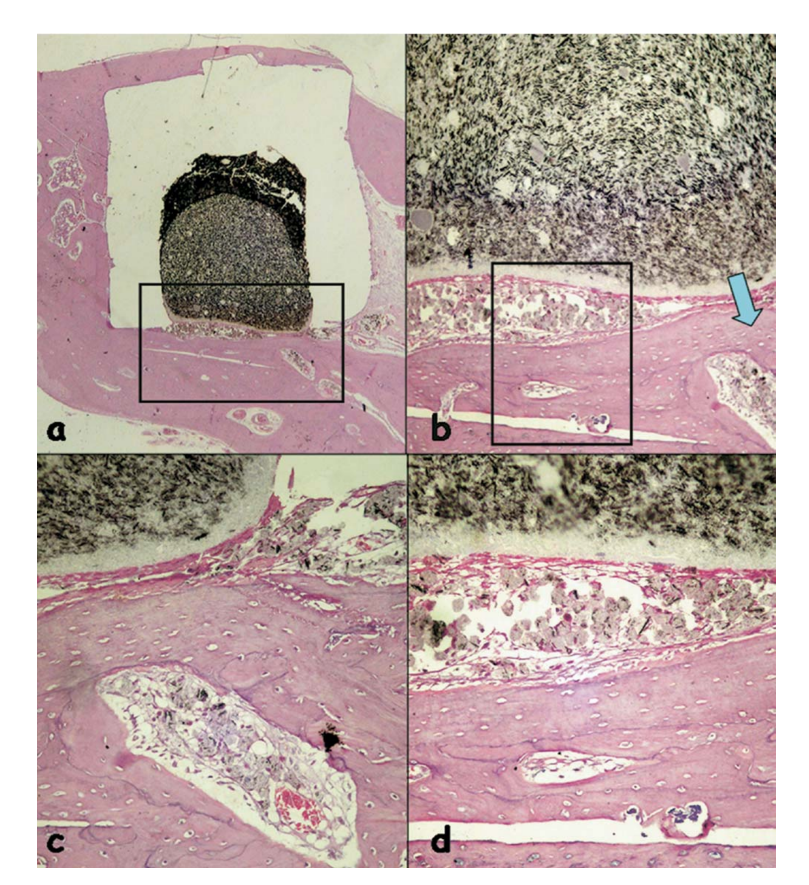
(b) aposición de un hueso sano neoformado cerca del material (área delineada en a) (H&E, aumento original 40x); (c) detalle del hueso sano neoformado
(flecha azul en b) (H&E, aumento original 100x); (d) delgada capa de tejido conectivo yuxtapuesta al material probado (área delineada en b) (H&E, aumento
original 200x).
Discusión
Cuando se introduce un nuevo material en el mercado, o se propone un material existente para una aplicación diferente, sus propiedades deben ser investigadas y los resultados encontrados comparados con los resultados obtenidos por otros investigadores. En los Estados Unidos, la Administración de Alimentos y Medicamentos (FDA) tenía la responsabilidad de evaluar y valorar los efectos biológicos de todos los medicamentos, materiales y dispositivos utilizados en seres humanos, incluidos la mayoría de los productos y dispositivos dentales. La FDA también proporcionó el reconocimiento de estándares establecidos por organizaciones privadas, como la ANSI/ADA. La revisión de las primeras Prácticas Estándar Recomendadas para la Evaluación Biológica de Materiales Dentales publicadas se retrasó para incorporar los elementos esenciales de las recomendaciones de la FDA. Este nuevo documento no tenía la intención de desalentar el desarrollo industrial de nuevos y mejorados productos dentales al exigir pruebas biológicas excesivas. Sin embargo, en esta era de preocupación por los peligros químicos, se debe desarrollar un perfil de toxicidad para todos los materiales nuevos y mejorados para obtener datos relevantes sobre seguridad y eficacia. Aunque ninguna cantidad de estudio experimental puede garantizar una seguridad absoluta para cualquier sustancia, las investigaciones toxicológicas proporcionan datos a partir de los cuales se pueden hacer proyecciones y predicciones razonables sobre las condiciones bajo las cuales el agente puede ser utilizado de manera segura.
Aunque se enumeran muchas pruebas como citotoxicidad, hemólisis, prueba de Ame, transformación celular de Styles, implantaciones subcutáneas y óseas, sensibilización y prueba de uso endodóntico para varios niveles de prueba, no todas son necesarias para cada producto. Se debe hacer un juicio sobre cuáles pruebas son relevantes. Las pruebas iniciales son para proporcionar un perfil de toxicidad en un sistema biológico, de modo que, en base a la comparación, el fabricante tendrá una apreciación y realización aproximada de dónde se encuentra su producto. Los dispositivos regulados por la FDA se dividen en tres clases; sin embargo, una de esas clases que incluye la mayoría de los dispositivos y aparatos dentales no estaría sujeta a la fijación de estándares de autorización previa a la comercialización. En otras palabras, a veces, incluso las pruebas de seguridad básicas no son necesarias antes de que los productos puedan ser promovidos para uso clínico.
La biocompatibilidad de los materiales dentales es un requisito importante porque los componentes tóxicos presentes en estos materiales podrían producir irritación o incluso degeneración de los tejidos circundantes, especialmente cuando se extruyen accidentalmente en los tejidos periradiculares.
Se han reportado reacciones severas después de la extrusión de algunas sustancias comúnmente utilizadas en los tejidos perirradiculares. Los selladores de conductos radiculares sobreextendidos también representan irritación química, ya que prácticamente todos los selladores endodónticos son altamente tóxicos cuando se preparan frescos. Además, su efecto irritante aumenta concebidamente a medida que aumenta el área de contacto material/tisular. Así, cuanto mayor sea el volumen de material sobreextendido, mayor será la superficie de contacto entre el sellador y el tejido, y mayor será la intensidad del daño químico.
La prueba de implante en tejido óseo de cobaya, como lo recomienda la FDI, permite probar el material tal como se utiliza en el entorno clínico. Aunque los resultados no pueden extrapolarse directamente a los seres humanos, la prueba está estandarizada y se puede establecer una comparación directa entre materiales. Las reacciones a lo largo de las paredes externas de la copa reflejarán el trauma causado por los procedimientos quirúrgicos, necesarios para la implantación. El teflón en sí ha demostrado causar solo una irritación insignificante de los tejidos y se utilizó como portador debido a su biocompatibilidad. Nuestros resultados confirmaron la ausencia de reacciones inflamatorias en la pared lateral de los portadores en ambos períodos de observación.
AH Plus, un sellador de conductos radiculares de pasta de dos componentes, basado en la reacción de polimerización de resina epoxi-aminas, fue probado para comparación. El sellador AH Plus mostró una reacción severa en el período de observación de 4 semanas que disminuyó a moderada a las 12 semanas (Fig. 1 y 2). El mecanismo que puede explicar la respuesta inflamatoria respecto al sellador AH Plus es la liberación de formaldehído que ha demostrado inducir respuestas no neoplásicas, como la degeneración epitelial y una infiltración de células inflamatorias mixtas, además de reacciones alérgicas y necrosis del tejido conectivo. Otro estudio ha demostrado que algunos selladores presentan riesgos biológicos significativos, particularmente en condiciones recién mezcladas. Sin embargo, incluso después del período de fraguado, la toxicidad puede seguir existiendo. Por lo tanto, las aminas, presentes en la composición de AH Plus, que aceleran la polimerización, podrían ser también la razón de la fuerte toxicidad inicial. Además, la actividad inflamatoria junto con un suministro sanguíneo intacto en el proceso de reparación del tejido podría eliminar la toxicidad inicial del material.
Recientemente, se introdujo un nuevo sellador endodóntico a base de metacrilato, EndoREZ, como sellador de conductos radiculares. EndoREZ es un material hidrofílico, de dos componentes, de curado químico que contiene óxido de zinc, sulfato de bario, resinas y pigmentos en una matriz de resina de dimetacrilato de urethane. En el presente estudio, EndoREZ causó una reacción inflamatoria severa en todos los períodos experimentales (Fig. 3 y 4). Usando células cultivadas, se demostró que EndoREZ se volvió más citotóxico con el tiempo de exposición y presentó riesgos citotóxicos significativos cuando se mezcló recién. La reacción del tejido conectivo a tubos de silicona llenos de EndoRez implantados en el tejido subcutáneo de ratas mostró una reacción severa que cambió significativamente su perfil después de 30 días, con una reacción moderada después de 3 meses, y ausencia de inflamación en el cuarto mes del período de observación. Sin embargo, también se informó que, en algunos animales, la respuesta inflamatoria persistió en todos los períodos experimentales. Se consideró que después de la implantación subcutánea de EndoREZ fresco, componentes como el zinc y el bario estaban en contacto directo con el tejido, y causaron esa severa reacción inicial. En contraste con los resultados de la presente investigación, Zmener et al. demostraron una respuesta satisfactoria del tejido óseo en el período de observación de 60 días de EndoREZ implantado en las tibias de ratas. La lenta descomposición del sellador EndoREZ, ilustrada por el material disperso, y la posterior endocitosis por macrófagos podrían haber sido la causa de tal inflamación crónica persistente. Además, la terapia de conducto radicular realizada con conos de gutapercha condensados lateralmente en conjunto con EndoRez parece presentar una buena tasa de éxito general después de una evaluación de seguimiento de 14 a 24 meses.
En nuestro estudio, AH Plus y EndoREZ no mostraron características biocompatibles porque la reacción fue severa en todos los períodos y, según los criterios de la FDI, el material se considera inaceptable. Epiphany es un sellador compuesto a base de resina dental de curado dual cuya matriz de resina es una mezcla de metacrilato de bisfenol-A-glicidilo, Bis-GMA etoxilado, resina de dimetacrilato de ureano y metacrilatos difuncionales hidrofílicos. Los resultados obtenidos en este trabajo demostraron respuestas biológicas óptimas en ambos períodos experimentales para este material (Fig. 5 y 6). Recientemente, en un estudio in vivo, Epiphany se asoció con menos periodontitis apical. Los autores correlacionaron este hallazgo con la superior resistencia a la filtración coronal de Epiphany, demostrada en un trabajo anterior. Sin embargo, Versiani et al., al probar la solubilidad de Epiphany, demostraron que era mayor que la establecida por la Especificación ANSI/ADA 57. El agua destilada desionizada utilizada para la prueba de solubilidad fue sometida a espectrometría de absorción atómica y mostró una liberación extensa de calcio (41.46 mg/L). Esta alta liberación de calcio por Epiphany podría explicar la reducida periodontitis apical observada clínicamente y los resultados del presente trabajo. La liberación de iones de calcio ha demostrado favorecer un pH más alcalino del ambiente, lo que lleva a efectos bioquímicos que culminan en la aceleración del proceso de reparación.
Conclusión
De acuerdo con los criterios de la FDI, los resultados obtenidos en este estudio permitieron concluir que el sellador de conductos radiculares Epiphany fue el único material que presentó biocompatibilidad intraósea dentro de los dos períodos analizados.
Autores: Cássio J. A. Sousa, Cristiana R. M. Montes, Elizeu A. Pascon, Adriano M. Loyola, Marco A. Versiani
Referencias:
- Sousa CJA, Loyola AM, Versiani MA, Biffi JCG, Oliveira RP, Pascon EA. Una evaluación histológica comparativa de la biocompatibilidad de materiales utilizados en cirugía apical. Int Endod J 2004;37:738 – 48.
- Siqueira JF Jr. Reacción de los tejidos perirradiculares al tratamiento de conductos radiculares: beneficios y desventajas. Endod Topics 2005;10:123– 47.
- Nair PNR. Patogénesis de la periodontitis apical y las causas de fracasos endodónticos. Crit Rev Oral Biol Med 2004;15:348 – 81.
- Spångberg L. Efectos biológicos de los materiales de obturación de conductos radiculares. Parte 7. Reacción del tejido óseo al material de obturación de conducto radicular implantado en conejillos de indias. Odontol Tidsk 1969;77:133–59.
- Stanley HR. Pruebas de toxicidad de materiales dentales. Estados Unidos: CRC Press, 1985.
- Zmener O, Banegas G, Pameijer CH. Respuesta del tejido óseo a un sellador endodóntico a base de metacrilato: un estudio histológico e histométrico. J Endod 2005;31:457–9.
- Declaración sobre compuestos de resina a base de posterior. Consejo de Asuntos Científicos de la ADA: Consejo de Programas de Beneficios Dentales de la ADA 1998;129:1627– 8.
- Tay FR, Loushine RJ, Weller RN, et al. Evaluación ultrastructural del sellado apical en raíces llenas con un material de obturación de conducto radicular a base de policaprolactona. J Endod 2005;31:514 –9.
- Boiullaguet S, Wataha JC, Lockwood PE, Galgano C, Golay A, Krejci I. Citotoxicidad y propiedades de sellado de cuatro clases de selladores endodónticos evaluadas por la actividad de deshidrogenasa succínica y microscopía confocal de barrido láser. Eur J Oral Sci 2004;112:182–7.
- Louw NP, Pameijer CH, Norval G. Evaluación histopatológica de un sellador de conducto radicular en primates subhumanos [Resumen]. J Dent Res 2001;80:654
- Zmener O. Respuesta del tejido a un nuevo sellador de conducto radicular a base de metacrilato: observaciones preliminares en el tejido conectivo subcutáneo de ratas. J Endod 2004;30:348 –51.
- Zmener O, Pameijer CH. Evaluación clínica y radiográfica de un sellador de conducto radicular a base de resina. Am J Dent 2004;17:19 –22.
- Shipper G, Teixeira FB, Arnold RR, Trope M. Inflamación periapical después de la inoculación microbiana coronal de raíces de perro llenas con gutapercha o Resilon. J Endod 2005;31:91– 6.
- Bergenholtz G, Spångberg L. Controversias en endodoncia. Crit Rev Oral Biol Med 2004;15:99 –114.
- Fédération Dentaire Internationale. Prácticas estándar recomendadas para la evaluación biológica de materiales dentales. Int Dent J 1980;30:174 – 6.
- Huang FM, Tsai CH, Yang SF, Chang YC. Inducción de la expresión génica de interleucina-6 e interleucina-8 por selladores de conductos radiculares en células osteoblásticas humanas. J Endod 2005;31:679 – 83.
- Lindgren P, Eriksson K-F, Ringberg A. Isquemia facial severa después del tratamiento endodóntico. J Oral Maxillofac Surg 2002;60:576 –9.
- Spångberg L, Pascon EA. La importancia de la preparación del material para la expresión de citotoxicidad durante la evaluación in vitro de biomateriales. J Endod 1988;14:247–50.
- Cohen BI, Pagnillo MK, Musikant BL, Dentsch AS. Evaluación de la liberación de formaldehído para tres materiales de obturación endodóntica. Oral Health 1998;88:37–9.
- Leonardo MR, de Silva LAB, Filho MT, de Silva RS. Liberación de formaldehído por 4 selladores endodónticos. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999;88:221–5.
- Morgan KT, Gross EA, Patterson DL. Distribución, progresión y recuperación de la inhibición aguda de la función mucociliar nasal inducida por formaldehído en ratas F-344. Toxicol Appl Pharmacol 1983;86:161–76.
- Kaplan AE, Ormaechea MF, Picca M, Canzobre MC, Ubios AM. Propiedades reológicas y biocompatibilidad de selladores endodónticos. Int Endod J 2003;36:527–32.
- Di Felice R, Lombardi T. Necrosis gingival y del hueso mandibular causada por una pasta que contiene paraformaldehído. Endod Dent Traumatol 1998;14:196 – 8.
- Matsumoto K, Inoue K, Matsumoto A. El efecto de los selladores de conducto radicular recién desarrollados en células de pulpa dental de rata en cultivo primario. J Endod 1989;15:60 –7.
- Zmener O, Spielberg C, Lamberghini F, Rucci M. Propiedades de sellado de un nuevo sellador de conducto radicular a base de resina epoxi. Int Endod J 1997;30:332– 4.
- Miletić I, Devčić N, Anić I, Borčić J, Karlović Z, Osmak M. La citotoxicidad de Roeko-Seal y AH Plus comparada durante diferentes períodos de fraguado. J Endod 2005;31:307–9.
- Zmener O, Pameijer CH. Evaluación clínica y radiográfica de un sellador de conducto radicular a base de resina. Am J Dent 2004;17:19 –22.
- Teixeira FB, Teixeira ECN, Thompson JY, Trope M. Resistencia a la fractura de raíces tratadas endodónticamente con un nuevo material de obturación de resina. J Am Dent Assoc 2004;135:646 –52.
- Shipper G, Trope M. Filtración microbiana in vitro de dientes tratados endodónticamente utilizando nuevas y técnicas estándar de obturación. J Endod 2004;30:154 – 8.
- Versiani MA, Carvalho-Júnior JR, Sasaki E, et al. Un estudio comparativo de las propiedades fisicoquímicas de los selladores de conducto radicular AH Plus™ y Epiphany™. Int Endod J (en prensa).
- ANSI/ADA Specification No. 57. Material de Sellado Endodóntico. Washington: EE. UU. 2000.
- Seux D, Couble ML, Hartmann DJ, Gauthier JP, Magloire H. Citodiferenciación similar a odontoblastos de pulpa dental humana 'in vitro' en presencia de un cemento que contiene hidróxido de calcio. Arch Oral Biol 1991;36:117–28.
