Análisis Bacteriológico Correlativo y Micro-Tomográfico de Canales Mesiales de Molares Mandibulares Preparados con Sistemas de Archivos Autoajustables, Recíprocos y de Archivo Torcido
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Introducción: Este estudio ex vivo evaluó la capacidad de desinfección y conformación de 3 protocolos utilizados en la preparación de los conductos radiculares mesiales de molares mandibulares mediante análisis bacteriológico correlativo y tomografía computarizada micro (mCT).
Métodos: Los conductos mesiales de molares mandibulares extraídos fueron contaminados con Enterococcus faecalis durante 30 días y asignados a 3 grupos según su configuración anatómica determinada por análisis mCT de acuerdo con la técnica de preparación (Archivo Autoajustable [ReDent-Nova, Ra’anana, Israel], Reciproc [VDW, Múnich, Alemania] y Archivo Torcido [SybronEndo, Orange, CA]). En todos los grupos, el irrigante fue NaOCl al 2.5%. Se tomaron muestras de los conductos antes (S1) y después de la instrumentación (S2), y se realizó la cuantificación bacteriana utilizando cultivo. A continuación, las raíces mesiales fueron sometidas a un análisis mCT adicional para evaluar la conformación de los conductos.
Resultados: Todos los protocolos de instrumentación promovieron una reducción bacteriana intracanal altamente significativa (P< .001). Las comparaciones cuantitativas y cualitativas entre grupos no revelaron diferencias significativas (P> .05). En cuanto a la conformación, no se observó diferencia estadística entre las técnicas respecto al porcentaje medio de aumento de volumen, el aumento del área superficial, el área superficial no preparada y el área superficial relativa no preparada (P> .05). El análisis correlativo no mostró una relación estadísticamente significativa entre la reducción bacteriana y el porcentaje medio de aumento de los parámetros analizados (P> .05).
Conclusiones: Los 3 sistemas de instrumentación tienen un rendimiento de desinfección y conformación similar en la preparación de los canales mesiales de los molares mandibulares. (J Endod 2013;39:1044–1050)
Los objetivos principales de la preparación quimio-mecánica son la limpieza y conformación del conducto radicular. Aunque son distintos, estos objetivos se logran simultáneamente durante la preparación mediante el uso de instrumentos e irrigantes. En conductos radiculares infectados, también se requiere desinfección, y el mejor resultado del tratamiento se logra generalmente cuando la infección del conducto radicular se erradica o se reduce a niveles compatibles con la curación perirradicular. Considerando que la infección residual es un factor de riesgo importante para la periodontitis apical post-tratamiento, la preparación quimio-mecánica asume un papel fundamental en el tratamiento porque actúa mecánica y químicamente sobre las comunidades bacterianas que colonizan el canal principal.
Con el fin de eludir tales limitaciones y hacer que la limpieza, desinfección y conformación sean más predecibles, se han ideado modificaciones en los instrumentos y técnicas. El Archivo Autoajustable (SAF) (ReDent-Nova, Ra’anana, Israel) es un ejemplo de un instrumento modificado que ha sido diseñado para adaptarse a la anatomía principal del conducto radicular. Los estudios han demostrado que el SAF promueve una mayor limpieza, desinfección y conformación en comparación con los instrumentos endodónticos convencionales. Se recomienda utilizar el SAF como una técnica de instrumento único y, en esta misma línea, también se han introducido otros sistemas, como Reciproc (VDW, Múnich, Alemania). A diferencia del SAF, estos instrumentos tienen un eje helicoidal y no son sustancialmente diferentes de los instrumentos rotatorios convencionales, pero se proponen para ser operados en movimiento recíproco. Los estudios han demostrado que las técnicas de instrumentación de un solo archivo utilizando estos instrumentos helicoidales pueden promover efectos de limpieza y conformación comparables con la instrumentación con una serie completa de instrumentos rotatorios. No hay muchos estudios que evalúen la capacidad desinfectante de los sistemas de un solo archivo, pero uno reciente mostró que no había diferencias significativas en la reducción bacteriana intracanal inducida por Reciproc y una serie completa de instrumentos, siempre que el volumen de irrigantes y el tiempo de irrigación se mantuvieran similares.
La imagenología por microtomografía computarizada (mCT) se ha utilizado ampliamente para evaluar ex vivo la capacidad de conformación de instrumentos y técnicas. La imagenología mCT ofrece una técnica no invasiva y reproducible para la evaluación tridimensional (3D) del sistema de conductos radiculares antes y después de la preparación, y puede aplicarse tanto de manera cuantitativa como cualitativa. Utilizando esta metodología, se ha demostrado que una gran área de las paredes del conducto radicular principal permanece intacta después de la preparación, independientemente de la técnica de instrumentación o del instrumento utilizado. En consecuencia, los biofilms bacterianos adheridos a las paredes pueden permanecer sin afectar en estas regiones. Para la evaluación de la capacidad desinfectante de instrumentos, técnicas y irrigantes, se ha utilizado ampliamente un modelo de desinfección de conductos ex vivo que empleó dientes extraídos con conductos contaminados con Enterococcus faecalis. Aunque es muy útil para comparaciones entre diferentes protocolos, este modelo experimental proporciona información sobre la persistencia bacteriana, pero no se puede determinar la ubicación de la infección persistente. Se podría añadir microscopía para este análisis, pero su naturaleza destructiva impide el análisis del conducto radicular antes de la instrumentación. Además, dado que no proporciona una imagen 3D, no se puede evaluar la calidad de la preparación. El propósito de este estudio ex vivo fue evaluar la capacidad desinfectante y de conformación de 3 protocolos de instrumentación utilizados en la preparación de conductos radiculares mesiales de molares mandibulares extraídos mediante un análisis bacteriológico y mCT correlativo.
Materiales y Métodos
Selección y Preparación de Especímenes
Este estudio utilizó raíces mesiales rectas o ligeramente curvadas de molares mandibulares extraídos por razones no relacionadas con este estudio. Se obtuvo la aprobación para el protocolo del estudio del Comité de Ética de la Universidad Estácio de Sá, Río de Janeiro, RJ, Brasil. Los dientes fueron seleccionados inicialmente en base a radiografías tomadas en ambas direcciones, bucolingual y mesiodistal. Solo se incluyeron dientes con 2 canales mesiales y sin calcificaciones significativas. Se prepararon cavidades de acceso y se realizó hemirresección de los molares utilizando discos de diamante. La sección mesial (raíz y corona) se utilizó en el estudio. Las cúspides se redujeron hasta que todos los especímenes tuvieron aproximadamente 13 mm de longitud. Los canales radiculares mesiales se exploraron utilizando limas K de tamaño 08 y 10, y solo se mantuvieron en el estudio aquellas raíces con 2 forámenes apicales independientes.
Todos los canales radiculares fueron instrumentados 1 mm más allá del foramen apical hasta una lima K de mano de tamaño 20 en movimientos rotatorios alternos bajo irrigación continua con agua. Esto se realizó para estandarizar el diámetro inicial del canal radicular y crear espacio para una mayor contaminación de los canales. La capa de lodo se eliminó utilizando irrigación con EDTA al 17% y hipoclorito de sodio (NaOCl) al 2.5%. El NaOCl fue inactivado con tiosulfato de sodio al 10%.
Análisis mCT de los Canales Radiculares
Se realizó una evaluación morfométrica del canal radicular utilizando imágenes de mCT. Del muestreo inicial, se seleccionaron aleatoriamente 18 especímenes, se secaron, se montaron en un accesorio personalizado y se escanearon utilizando un escáner de mCT (SkyScan 1174v2; Bruker-microCT, Kontich, Bélgica) a una resolución isotrópica de 16.7 mm. El escaneo se realizó mediante una rotación de 180° alrededor del eje vertical con un paso de rotación de 1.0 utilizando un filtro de aluminio de 0.5 mm de grosor. Las imágenes de cada espécimen se reconstruyeron con un software dedicado (NRecon v.1.6.3, Bruker-microCT) que proporciona secciones transversales axiales de la estructura interna de las muestras. Se utilizó el software CTAn v.1.12 (Bruker-microCT) para la evaluación 3D del canal radicular en cuanto a volumen y área superficial. El volumen se calculó como el volumen de objetos binarizados dentro del volumen de interés. Para la medición del área superficial, se utilizaron 2 componentes de la superficie: (1) los perímetros de los objetos binarizados en cada nivel de sección transversal y (2) las superficies verticales expuestas por diferencias de píxeles entre secciones transversales adyacentes. Se utilizó el software CTVol v.2.2.1 (Bruker-microCT) para la visualización y evaluación cualitativa de la configuración del sistema de canales radiculares.
Las muestras se emparejaron en tríos sobre la base de la configuración anatómica del conducto radicular evaluada mediante imágenes de mCT. Una muestra de cada trío fue asignada aleatoriamente a 1 de los 3 grupos experimentales. Después de verificar la suposición de normalidad (la prueba de Shapiro-Wilk), se evaluó el grado de homogeneidad (línea base) de los 3 grupos, con respecto a los parámetros 3D mencionados, utilizando un análisis de varianza de una vía con un nivel de confianza establecido en el 5%. Luego, se utilizó el lanzamiento de una moneda para definir qué grupo de dientes sería tratado con cada una de las siguientes técnicas de preparación del conducto radicular: sistemas SAF, Reciproc o Twisted File (TF; SybronEndo, Orange, CA).
Contaminación Bacteriana
Las 18 raíces mesiales seleccionadas mediante la evaluación de mCT se utilizaron en el análisis bacteriológico/mCT correlativo. Para fortalecer el poder estadístico del análisis bacteriológico, se incluyeron otras 18 muestras, seleccionadas sobre la base de radiografías. Ambos conductos mesiales se utilizaron en el experimento, totalizando 36 raíces (72 conductos) para el análisis bacteriológico (24 conductos por grupo experimental). Se utilizaron cinco raíces mesiales como controles: 3 para el experimento bacteriológico y 2 para la microscopía electrónica de barrido.
Los conductos radiculares se llenaron con caldo de tripticasa de soja recién preparado (Difco, Detroit, MI), se sumergieron en el mismo caldo y se sometieron a ultrasonido durante 1 minuto para liberar el aire atrapado y permitir la penetración del medio de cultivo en las irregularidades del conducto radicular. Luego, los especímenes dentales se esterilizaron en un autoclave. La cepa E. faecalis de la Colección Americana de Cultivos Tipo 29212 se utilizó para la contaminación del conducto radicular durante 30 días a 37°C bajo agitación suave, con el medio de cultivo siendo reabastecido cada semana. Después del período de contaminación, todos los dientes tuvieron el exceso de medio de cultivo goteando y su superficie radicular externa limpiada con gasa estéril. Dos dientes se fijaron en formalina tamponada al 10% y se procesaron para análisis por microscopía electrónica de barrido para confirmar la colonización bacteriana del conducto radicular como se describió anteriormente. Seis conductos mesiales contaminados pero no instrumentados, que fueron irrigados con las mismas sustancias y volúmenes que los grupos experimentales, sirvieron como el grupo de control positivo.
Los forámenes apicales de cada raíz mesial fueron sellados con resina epóxica de secado rápido para prevenir la filtración bacteriana apical y crear un canal de extremo cerrado que produce el efecto de bloqueo de vapor. Los dientes fueron montados verticalmente hasta la región cervical en bloques hechos de un material de impresión de silicona (President Jet; Coltène AG, Cuyahoga Falls, OH). La corona del diente, incluyendo las paredes de la cámara pulpar, y la superficie de silicona fueron desinfectadas con 2.5% de NaOCl seguido de la inactivación de esta sustancia con 10% de tiosulfato de sodio. A continuación, se determinó la longitud de trabajo (WL) introduciendo un archivo tipo K de tamaño 10 en el canal hasta que alcanzó el foramen apical, y se tomaron muestras bacteriológicas iniciales (S1) de todos los canales antes de la preparación de la siguiente manera. El conducto radicular fue enjuagado con 1 mL de solución salina estéril al 0.85% para eliminar células no adheridas, y se tomó una muestra inicial mediante el uso secuencial de 3 a 5 puntos de papel colocados hasta la WL.
Cada punto de papel permaneció en el canal durante 1 minuto. Los puntos de papel fueron transferidos a tubos que contenían 1 mL de solución salina estéril y procesados inmediatamente para análisis de cultivo.
Antes de la instrumentación, todos los conductos radiculares recibieron una irrigación inicial con 2 mL de NaOCl al 2.5% seguida de un ensanchamiento coronal utilizando un archivo RaCe tamaño 25, con un conicidad de 0.08 mm/mm (BR0; FKG Dentaire, La Chaux-de-Fonds, Suiza). A continuación, los conductos radiculares fueron irrigados nuevamente con 2 mL de NaOCl al 2.5%, y se utilizó un archivo tipo K de tamaño 15 hasta la longitud de trabajo (WL) para confirmar la permeabilidad. Los siguientes pasos variaron según cada grupo experimental.
Grupo SAF
Los conductos fueron instrumentados hasta la WL utilizando un archivo RaCe tamaño 25, con un conicidad de 0.04 mm/mm (FKG Dentaire). Después de la irrigación con 2 mL de NaOCl al 2.5%, se insertó el instrumento SAF en el conducto y se operó con un movimiento de entrada y salida hasta la WL durante un total de 3 minutos. Se utilizó un SAF de 1.5 mm de diámetro en un micromotor vibratorio (GENTLEpower; KaVo, Bieberach an der Riß, Alemania) combinado con una cabeza RDT3 (ReDent-Nova) a una frecuencia de 5000 movimientos por minuto y una amplitud de 0.4 mm. Se aplicó irrigación continua con NaOCl al 2.5% durante todo el procedimiento a un flujo de 2 mL/min (total = 6 mL por conducto) utilizando un aparato de irrigación especial (VATEA, ReDent-Nova).
Grupo Reciproc
El instrumento Reciproc R25 se operó en un movimiento recíproco impulsado por un motor eléctrico con limitación de torque (VDW Silver) utilizando los ajustes preestablecidos. El instrumento se introdujo en el canal hasta que se sintió resistencia y luego se activó. Se movió en dirección apical utilizando un movimiento de picoteo hacia adentro y hacia afuera de aproximadamente 3 mm de amplitud con ligera presión apical. Después de 3 movimientos de picoteo, se retiró el instrumento y se limpió, y el canal se irrigó con 2 mL de NaOCl. Se verificó la permeabilidad del canal tomando un archivo tipo K de tamaño 15 hasta la longitud de trabajo (WL). Este protocolo se repitió hasta que se alcanzó la WL con el instrumento R25. La irrigación se realizó con jeringas desechables y agujas NaviTip de 30-G (Ultradent, South Jordan, UT) llevadas hasta 4 mm por debajo de la WL.
Grupo TF
En este grupo, los conductos radiculares se prepararon utilizando la siguiente secuencia de instrumentos TF: 25/0.08, 25/0.06 y 25/0.04 de manera coronaria hacia abajo, operados a 500 rpm, en rotación continua en sentido horario, con el motor VDW Silver. Cada instrumento se introdujo en el canal mientras giraba hasta que se enganchó en la dentina. Luego, se retiró y el canal se irrigó con 2 mL de NaOCl y se verificó la permeabilidad apical con un archivo tipo K de tamaño 15. La irrigación se realizó como en el grupo Reciproc. La preparación se finalizó trabajando con el TF 25/0.06 en la WL y el canal irrigado con 2 mL de NaOCl.
Después de completar la preparación, la capa de smear fue eliminada enjuagando el canal con 2 mL de EDTA al 17% durante 1 minuto, seguido de 2 mL de NaOCl al 2.5%. El NaOCl fue inactivado enjuagando el canal con 1 mL de tiosulfato de sodio al 10%, que se dejó en el canal durante 5 minutos. Después de otro enjuague con 1 mL de tiosulfato de sodio, se tomó una muestra bacteriológica post-preparación (S2) como se describió para S1. En todos los grupos, se utilizó un volumen total de 14 mL de NaOCl al 2.5% por canal.
Cuantificación Bacteriana
Las muestras fueron diluidas en serie 10 veces en solución salina (hasta 10—5 en S1 y 10—3 en S2). Posteriormente, se sembraron alícuotas de 100 mL en placas de agar Mitis-Salivarius (Difco) e incubaron a 37°C durante 48 horas. Se contaron las unidades formadoras de colonias que crecieron, y se realizó una reacción en cadena de la polimerasa específica de especies para confirmar la identificación de E. faecalis en todas las muestras positivas.
Análisis mCT de la Preparación del Conducto Radicular
Después de la preparación quimio-mecánica y la toma de S2, los 18 especímenes escaneados en la primera parte de este estudio fueron esterilizados en autoclave, secados y sometidos a un nuevo escaneo mCT aplicando los mismos parámetros. La superposición de las imágenes pre y post-preparación de los conductos radiculares se realizó mediante un software de registro previamente validado (Mosaic 0.05; Instituto de Sistemas de Comunicación y Computación, Atenas, Grecia). Los modelos de conducto radicular codificados por colores (verde indica superficies del canal preoperatorio y rojo postoperatorio) permitieron una comparación cualitativa de los conductos radiculares emparejados antes y después de la conformación con el software CTVol v.2.2.1 (Bruker-microCT). Se utilizó CTAn v.1.12 (Bruker-microCT) para análisis de volumen y área de superficie.
El porcentaje medio de aumento (%D) de cada parámetro analizado se calculó de la siguiente manera: ([Pa — Pb]/Pb)*100, donde Pb y Pa son el volumen total o el área superficial del conducto radicular antes y después de la preparación, respectivamente. Se compararon modelos de superficie registrados espacialmente de las raíces, antes y después de la preparación, para evaluar el porcentaje de área superficial no preparada restante. Esta variable se calculó utilizando las distancias entre la superficie de los conductos radiculares antes y después de la preparación que se habían determinado en cada punto de la superficie.
Cuando había un istmo presente, se evaluaron su volumen y área relativos. En este estudio, el istmo se definió como la estructura en forma de cinta o delgada entre los 2 conductos radiculares mesiales después de la preparación. Su contribución al volumen total y al área superficial del conducto radicular se determinó como el volumen porcentual relativo (%RV) y el área superficial porcentual relativa (%RA) del istmo. El %RV se calculó de la siguiente manera: ([Va — RV]/Vb)*100, donde Vb y Va son el volumen total del conducto radicular antes y después de la preparación, respectivamente, y el RV (volumen relativo) es el volumen después de la preparación sin istmo. El %RA se calculó mediante la fórmula (A — RA/A)*100, donde A es el área superficial total del conducto radicular después de la preparación y RA es el área superficial de los conductos radiculares preparados sin istmo.
Análisis Estadístico
Se utilizó la prueba de rangos con signo de Wilcoxon para comparar la reducción intragrupo en los recuentos bacterianos de S1 a S2. Además, la comparación intergrupo se llevó a cabo utilizando la prueba de Kruskall-Wallis. Para esto, se calculó la proporción S2/S1 para cada canal y se utilizó para la comparación entre grupos. El cálculo del tamaño de la muestra reveló que 21 especímenes por grupo serían suficientes para mostrar una diferencia del 5% en las proporciones S2/S1, con una potencia del 90%. Cada grupo experimental se comparó con el grupo de control utilizando la prueba de Mann-Whitney U . Para los análisis pareados de datos cualitativos (presencia/ausencia) intragrupo e intergrupo, se utilizó la prueba exacta de Fisher.
En el análisis de mCT, dado que no se pudo verificar la normalidad (prueba de Shapiro-Wilk, P < .05), se comparó el porcentaje medio de aumento de volumen, el aumento del área superficial, el área superficial no preparada, RV y RA entre grupos utilizando la prueba de Kruskal-Wallis y dentro de los grupos utilizando la prueba t de muestras pareadas. Se utilizó el análisis de correlación de Pearson para verificar las relaciones entre la reducción bacteriana y el aumento porcentual medio de los parámetros analizados utilizando imágenes de mCT. Los análisis estadísticos se realizaron con STATISTICA versión 8 (StatSoft, Tulsa, OK) y SPSS versión 17.0 (SPSS Inc, Chicago, IL) con un nivel de confianza establecido en el 5%.
Resultados
El análisis por microscopía electrónica de barrido reveló que E. faecalis colonizó las paredes del conducto radicular, formando generalmente estructuras similares a biofilm (datos no mostrados). La colonización del conducto radicular fue confirmada adicionalmente por resultados positivos en cultivos para muestras S1 de todos los dientes utilizados en el experimento de desinfección del conducto.
Tabla 1 muestra la media, mediana y rango de los recuentos de unidades formadoras de colonias (datos cuantitativos) observados para los 3 grupos de prueba y el grupo de control. Los datos experimentales se muestran para los 18 dientes (36 conductos) sometidos a análisis bacteriológicos y de mCT y los 36 dientes en total (72 conductos) que fueron investigados bacteriológicamente. De los 18 dientes sometidos a análisis correlativo, solo 7 (39%) mostraron un cultivo negativo para ambos conductos mesiales, independientemente de la técnica (2 dientes del grupo Reciproc, 2 del grupo SAF y 3 del grupo TF). En general, la incidencia de cultivos positivos en S2 fue de 6 de 24 (25%) para el archivo Reciproc, 7 de 24 (29%) para el SAF y 9 de 24 (37.5%) para el TF. El análisis cuantitativo intragrupal que evaluó la reducción bacteriana de S1 a S2 en todos los grupos mostró que la preparación quimio-mecánica utilizando los 3 sistemas de instrumentación promovió una reducción bacteriana altamente significativa (P< .001). No se observaron diferencias significativas entre los grupos ni para el análisis cuantitativo ni cualitativo (P> .05). Todas las técnicas fueron significativamente mejores que el grupo de control (irrigación sin instrumentación) en la reducción de los niveles bacterianos (P< .001).
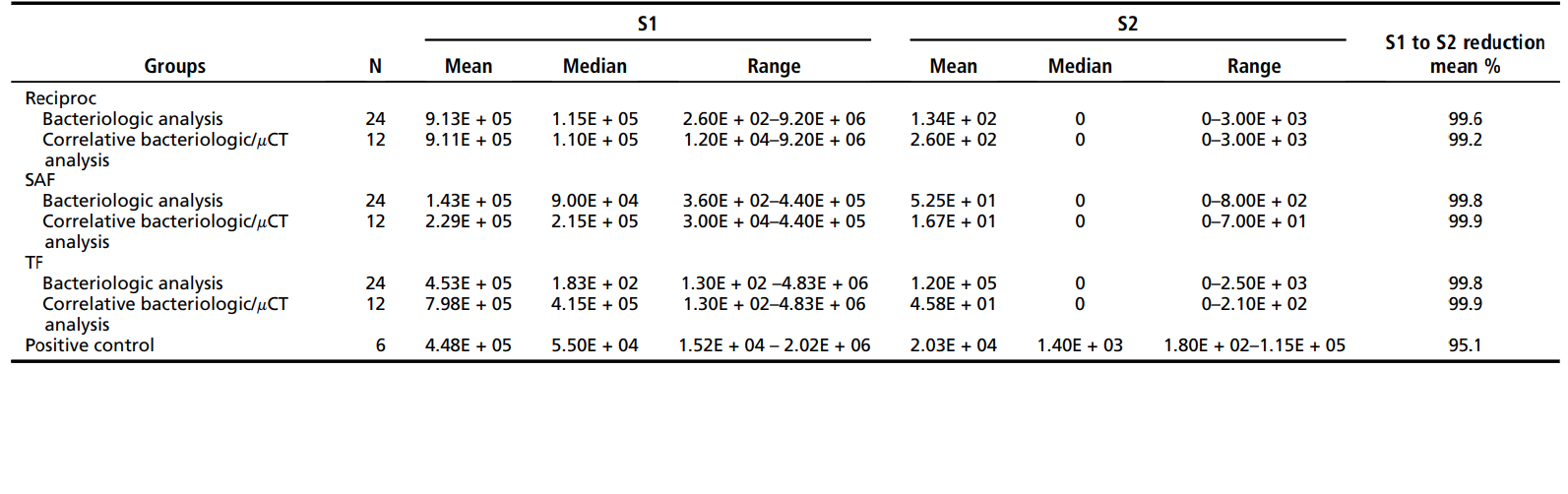
Tabla 2 muestra datos del análisis de mCT. No se observó diferencia estadística entre los instrumentos Reciproc, SAF y TF en cuanto al porcentaje medio de aumento de volumen, el aumento de área superficial y el área superficial no preparada (P > .05). El análisis intragrupo reveló una diferencia estadísticamente significativa en cuanto al volumen y área superficial antes y después de la preparación del conducto radicular (P < .05). El %RV y %RA del istmo en los grupos Reciproc, SAF y TF fueron 22.9 ± 15.2 y 23.9 ± 16.2, 16.9 ± 16.51 y 17.5 ± 13.3, y 23.7 ± 16.3 y 23.7 ± 12.8, respectivamente, sin diferencia estadística significativa entre los grupos (P > .05).
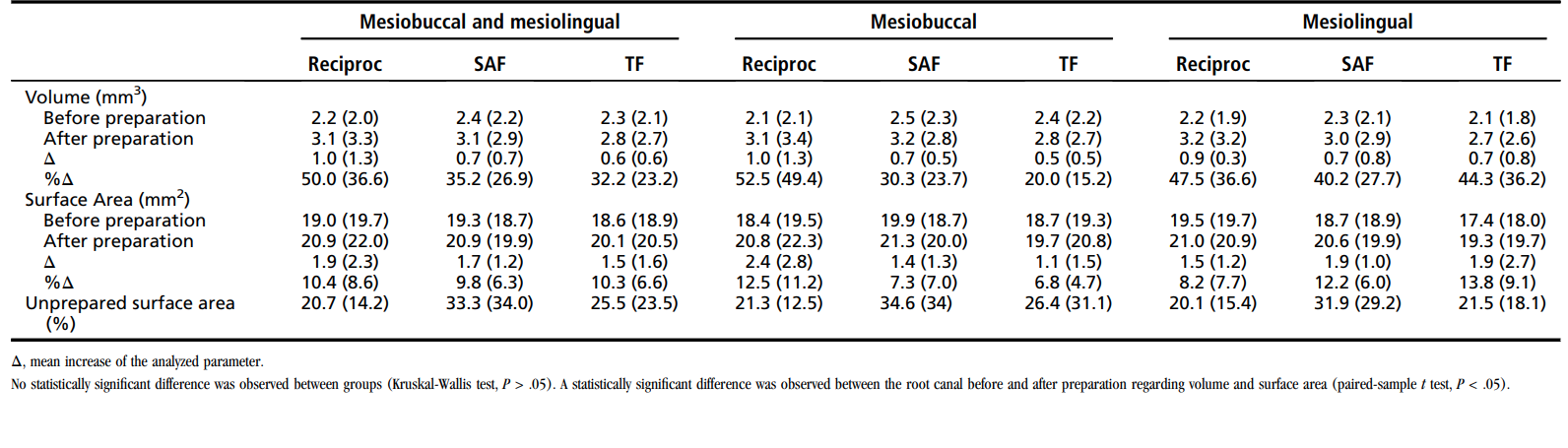
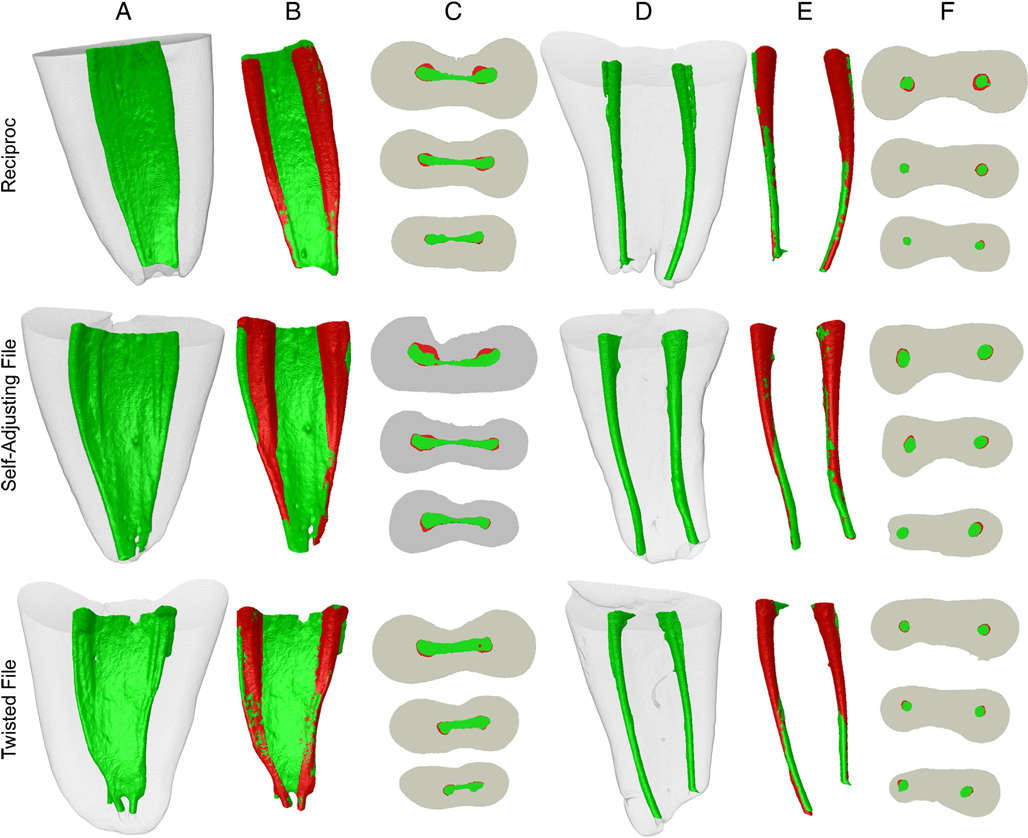
Figura 1A a través de F muestra ejemplos representativos de canales radiculares superpuestos antes y después de la instrumentación del canal en cada grupo. Los cambios en la forma del canal se muestran como superposiciones de áreas no preparadas (verde) y preparadas (rojo). El rojo muestra las áreas superpuestas. Todos los grupos mostraron más áreas no tocadas, principalmente en el istmo y el tercio apical del canal. Ninguno de los sistemas de instrumentación fue capaz de preparar todas las áreas de superficie del canal radicular. El análisis correlativo no mostró una relación estadísticamente significativa entre la reducción bacteriana y el aumento porcentual medio de los parámetros analizados (P > .05).
Discusión
El protocolo del presente estudio fue diseñado para permitir un análisis emparejado de la capacidad de 3 técnicas de instrumentación en la conformación y desinfección de los conductos radiculares mesiales de los molares mandibulares. Para esto, se evaluó la capacidad de conformación utilizando análisis de mCT de los mismos dientes sometidos a análisis bacteriológicos.
Una innovación del presente estudio fue el uso de la evaluación de mCT para la selección adecuada de dientes para el ensayo de desinfección de conductos ex vivo. Estudios previos seleccionaron dientes basándose en la anatomía externa y radiografías tomadas en ambas direcciones, mesiodistal y bucolingual. Al seleccionar dientes basándose en la anatomía interna revelada por la evaluación de mCT, se espera una mejor distribución de los especímenes entre los grupos, eliminando sesgos potencialmente significativos que podrían interferir con los resultados. Las mediciones del volumen y área superficial del conducto radicular no se utilizaron en este estudio para la selección de dientes y distribución entre grupos y serían información adicional interesante para futuros estudios. Sin embargo, no se encontró que estos factores interfirieran con los resultados, como se mostró estadísticamente.
El análisis bacteriológico mostró que la preparación quimio-mecánica con los 3 sistemas diferentes fue estadísticamente igual de efectiva en promover una reducción altamente significativa en los recuentos bacterianos intracanal. Sin embargo, muchos casos aún tenían bacterias detectables después de la instrumentación. La incidencia de cultivos positivos en muestras S2 (análisis cualitativo) osciló entre el 25% (grupo Reciproc) y el 37.5% (grupo TF), lo cual está en consonancia con estudios previos ex vivo y in vivo. Vale la pena señalar que la mayoría de los estudios previos se basaron en canales de dientes de raíz simple, mientras que en el presente estudio se utilizaron raíces mesiales de molares mandibulares, que se espera que presenten una mayor complejidad anatómica. Los hallazgos actuales confirman que, aunque la preparación quimio-mecánica puede considerarse el paso principal en términos de control de infecciones, puede no ser suficiente para desinfectar de manera predecible los conductos radiculares, independientemente de los instrumentos utilizados. Las bacterias restantes están concebidamente alojadas en áreas no preparadas y recovecos del canal principal, así como en istmos y otras irregularidades del sistema de conductos. El principal desafío terapéutico es alcanzarlas y eliminarlas en esas ubicaciones.
Las técnicas de un solo archivo han sido recomendadas recientemente para la preparación del conducto radicular, y se lanzaron nuevos instrumentos principalmente basados en opiniones y conveniencia en lugar de efectividad probada. Sin embargo, se ha demostrado que las capacidades de conformación y desinfección de estos sistemas son comparables con las convencionales que utilizan una gama completa de instrumentos. Estos hallazgos fueron confirmados en el presente estudio tanto para la desinfección como para la conformación.
El sistema SAF también es un enfoque de instrumento único, pero el diseño del instrumento y el principio de acción son completamente diferentes. El instrumento está diseñado para adaptarse a la morfología del conducto radicular en la sección transversal. En consecuencia, los resultados del SAF en términos de limpieza, conformación y desinfección de conductos que son curvados y/o irregulares en la sección transversal han demostrado ser superiores a los instrumentos convencionales. No obstante, los resultados del presente estudio en conductos mesiales de molares no mostraron resultados superiores para el SAF ni en la capacidad de conformación ni en la efectividad antibacteriana. Cabe señalar que el SAF se operó durante 3 minutos en el conducto. Aunque un estudio previo informó que el sistema SAF promovió una reducción significativa en las poblaciones bacterianas en conductos de forma ovalada de incisivos y premolares incluso después de solo 2 minutos de operación, los resultados más impresionantes se obtuvieron después de 6 minutos. Si los efectos del SAF en conductos mesiales mejorarían después de un tiempo de operación más largo sigue siendo objeto de investigación.
La raíz mesial de los molares mandibulares presenta un alto grado de complejidad, lo que dificulta lograr resultados óptimos en términos de capacidad antibacteriana y de conformación. Muchas áreas del conducto radicular principal permanecieron sin preparar independientemente de la técnica de instrumentación utilizada, variando en promedio del 20% al 35% (área del istmo excluida). Se puede suponer razonablemente que preparaciones apicales más grandes podrían haber resultado en un aumento del área de superficie preparada y una mejor desinfección, y esto merece una investigación adicional utilizando este enfoque correlativo. Siempre que estaban presentes, los istmos no fueron afectados mecánicamente por la instrumentación y posiblemente ni siquiera por los irrigantes. Estos últimos no pudieron ser evaluados mediante análisis de mCT, y las limitaciones de los procedimientos de muestreo utilizando puntos de papel impiden que el análisis bacteriológico evalúe la permanencia de bacterias en los istmos.
A pesar de los diferentes diseños y conicidades de los instrumentos, se hicieron esfuerzos para estandarizar el tamaño de las preparaciones tanto como fuera posible. Las dimensiones de los archivos utilizados para la preparación apical final fueron las siguientes: TF tamaño 25 con conicidad de 0.06 mm/mm a lo largo del eje helicoidal del instrumento, Reciproc R25 con una conicidad de 0.08 a lo largo de los últimos 3 mm desde la punta, y el SAF utilizado durante 3 minutos después de que el camino de deslizamiento fue preparado con un archivo rotatorio convencional tamaño 25/0.04. Estos enfoques resultaron en preparaciones sin diferencias significativas en el volumen final y el área de superficie preparada, como se muestra en el análisis de mCT. Debido a que el volumen total de irrigantes fue el mismo, esta falta de diferencia significativa también se reflejó en la efectividad antibacteriana de los 3 enfoques de instrumentación, que no diferían incluso con un aumento adicional en el tamaño de la muestra.
Se esperaba que los canales que mostraran resultados positivos para las bacterias después de la instrumentación presentaran una mayor área de superficie no preparada. No obstante, aunque todos los especímenes que mostraron presencia bacteriana en S2 tenían áreas no preparadas, también hubo especímenes con grandes áreas no preparadas que mostraron cultivos negativos. El análisis correlativo no logró mostrar relaciones estadísticamente significativas entre la eliminación bacteriana y el aumento porcentual medio de los parámetros analizados en la imagenología mCT. Es razonable suponer que en algunos especímenes las áreas del canal principal no tocadas por los instrumentos pueden no haber sido colonizadas por bacterias porque la colonización no suele ser uniforme a lo largo de las paredes del canal. Otra posibilidad es que las áreas no preparadas fueron desinfectadas con éxito por NaOCl, que tiene fuertes actividades antibacterianas y antibiofilm.
Aunque este estudio es innovador en el sentido de que combina datos de 2 enfoques que permiten un análisis correlativo, no está exento de limitaciones. La falta de correlación entre los 2 análisis puede estar relacionada con los factores discutidos anteriormente o puede haber sido el resultado de limitaciones de los procedimientos de muestreo utilizando puntos de papel, que pueden no lograr una buena muestra representativa del sistema de conductos radiculares, especialmente de irregularidades, recesos y áreas distantes del canal principal. Los estudios futuros que utilicen análisis histobacteriológicos o criopulverización de especímenes radiculares deberían sortear estas limitaciones. Sin embargo, estos enfoques también tienen sus propias limitaciones porque ambos son destructivos y no permiten evaluar los especímenes antes y después de la instrumentación. Además, el análisis histobacteriológico proporciona información bidimensional (2D) de las áreas seleccionadas y no da información sobre viabilidad, mientras que la criopulverización no indica la ubicación de las bacterias persistentes. Los estudios futuros deberían considerar agregar uno de estos enfoques a los utilizados en el presente estudio para un análisis más completo. Investigaciones adicionales utilizando este enfoque correlativo pueden investigar el impacto potencial de las variables de irrigación (por ejemplo, patrones de flujo, concentración, tiempo de exposición y temperatura) así como diferentes configuraciones anatómicas y sistemas de preparación en el resultado.
En conclusión, este estudio mostró que las 3 técnicas de instrumentación tienen un rendimiento desinfectante y de conformación similar en la preparación de los canales mesiales de los molares mandibulares. Refinamientos adicionales en el análisis correlativo utilizado en este estudio tienen el potencial de contribuir a un método que pueda evaluar de manera integral el rendimiento de los instrumentos y técnicas de instrumentación.
Autores: José F. Siqueira, Jr, Flávio R.F. Alves, Marco A. Versiani, Isabela N. Rôças, Bernardo M. Almeida, Mônica A.S. Neves, Manoel D. Sousa-Neto
Referencias:
- Siqueira JF Jr, Lopes HP. Preparación quimomecánica. En: Siqueira JF Jr, ed. Tratamiento de Infecciones Endodónticas. Londres: Quintessence Publishing; 2011:236–84.
- Sjögren U, Figdor D, Persson S, et al. Influencia de la infección en el momento del sellado radicular sobre el resultado del tratamiento endodóntico de dientes con periodontitis apical. Int Endod J 1997;30:297–306.
- Siqueira JF Jr, Rôças IN. Implicaciones clínicas y microbiología de la persistencia bacteriana después de los procedimientos de tratamiento. J Endod 2008;34:1291–13013.
- Barbizam JV, Fariniuk LF, Marchesan MA, et al. Eficacia de las técnicas de instrumentación manual y rotativa para limpiar canales radiculares aplanados. J Endod 2002;28: 365–6.
- Usman N, Baumgartner JC, Marshall JG. Influencia del tamaño del instrumento en la limpieza del canal radicular. J Endod 2004;30:110–2.
- Siqueira JF Jr, Araujo MC, Garcia PF, et al. Evaluación histológica de la efectividad de cinco técnicas de instrumentación para limpiar el tercio apical de los canales radiculares. J Endod 1997;23:499–502.
- Peters OA, Schönenberger K, Laib A. Efectos de cuatro técnicas de preparación de Ni-Ti sobre la geometría del canal radicular evaluados por microtomografía computarizada. Int Endod J 2001;34: 221–30.
- Vera J, Siqueira JF Jr, Ricucci D, et al. Tratamiento endodóntico de un diente con periodontitis apical en una o dos visitas: un estudio histobacteriológico. J Endod 2012;38: 1040–52.
- Nair PN, Henry S, Cano V, et al. Estado microbiano del sistema de canal radicular apical de molares mandibulares humanos con periodontitis apical primaria después del tratamiento endodóntico de "una visita". Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 99:231–52.
- Metzger Z, Teperovich E, Zary R, et al. El archivo autoajustable (SAF). Parte 1: respetando la anatomía del canal radicular: un nuevo concepto de archivos endodónticos y su implementación. J Endod 2010;36:679–90.
- Metzger Z, Teperovich E, Cohen R, et al. El archivo autoajustable (SAF). Parte 3: eliminación de desechos y capa de lodo: un estudio con microscopio electrónico de barrido. J Endod 2010;36:697–702.
- De-Deus G, Souza EM, Barino B, et al. El archivo autoajustable optimiza la calidad de la limpieza en canales radiculares de forma ovalada. J Endod 2011;37:701–5.
- Ribeiro MVM, Silva-Sousa YT, Versiani MA, et al. Comparación de la eficacia de limpieza del archivo autoajustable y sistemas rotativos en el tercio apical de canales de forma ovalada. J Endod 2013;39:398–401.
- Siqueira JF Jr, Alves FR, Almeida BM, et al. Capacidad de la preparación quimomecánica con instrumentos rotativos o archivo autoajustable para desinfectar canales radiculares de forma ovalada. J Endod 2010;36:1860–5.
- Versiani MA, Pecora JD, de Sousa-Neto MD. Preparación de canal radicular plano-oval con instrumento de archivo autoajustable: un estudio de microtomografía computarizada. J Endod 2011;37:1002–7.
- Paque F, Peters OA. Evaluación de microtomografía computarizada de la preparación de canales radiculares ovalados largos en molares mandibulares con el archivo autoajustable. J Endod 2011;37:517–21.
- De-Deus G, Barino B, Zamolyi RQ, et al. Calidad de limpieza subóptima producida por la técnica de archivo único F2 ProTaper en canales de forma ovalada. J Endod 2010;36: 1897–900.
- Burklein S, Hinschitza K, Dammaschke T, et al. Capacidad de conformación y efectividad de limpieza de dos sistemas de archivo único en canales radiculares severamente curvados de dientes extraídos: reciproc y WaveOne versus Mtwo y ProTaper. Int Endod J 2012;45: 449–61.
- Berutti E, Chiandussi G, Paolino DS, et al. Conformación de canal con archivos reciprocantes primarios WaveOne y sistema ProTaper: un estudio comparativo. J Endod 2012;38: 505–9.
- Dietrich MA, Kirkpatrick TC, Yaccino JM. Eliminación de desechos en el canal y el istmo in vitro del archivo autoajustable, K3 y archivos WaveOne en la raíz mesial de molares mandibulares humanos. J Endod 2012;38:1140–4.
- Alves FR, Rôças IN, Almeida BM, et al. Análisis cuantitativo molecular y de cultivo de la eliminación bacteriana en canales radiculares de forma ovalada mediante una técnica de instrumentación de archivo único. Int Endod J 2012;45:871–7.
- Peters OA, Paque F. Preparación del canal radicular de molares maxilares con el archivo autoajustable: un estudio de microtomografía computarizada. J Endod 2011;37:53–7.
- Markvart M, Darvann TA, Larsen P, et al. Análisis de micro-CT de la ampliación apical y la complejidad del canal radicular de molares. Int Endod J 2012;45:273–81.
- Solomonov M, Paque F, Fan B, et al. El desafío de los sistemas de canal en forma de C: un estudio comparativo del archivo autoajustable y ProTaper. J Endod 2012;38: 209–14.
- Paque F, Balmer M, Attin T, et al. Preparación de canales radiculares de forma ovalada en molares mandibulares utilizando instrumentos rotativos de níquel-titanio: un estudio de microtomografía computarizada. J Endod 2010;36:703–7.
- Paque F, Ganahl D, Peters OA. Efectos de la preparación del canal radicular en la geometría apical evaluados por microtomografía computarizada. J Endod 2009;35:1056–9.
- Alves FR, Almeida BM, Neves MA, et al. Efectos antibacterianos dependientes del tiempo del archivo autoajustable utilizado con dos concentraciones de hipoclorito de sodio. J Endod 2011; 37:1451–5.
- Siqueira JF Jr, Rôças IN. Análisis basado en la reacción en cadena de la polimerasa de microorganismos asociados con el fracaso del tratamiento endodóntico. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004;97:85–94.
- Tassani S, Matsopoulos GK, Baruffaldi F. Identificación 3D de la zona de fractura del hueso trabecular utilizando un esquema automático de registro de imágenes: un estudio de validación. J Biomech 2012;45:2035–40.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Suplementando los efectos antimicrobianos de la limpieza quimomecánica con irrigación ultrasónica pasiva o un enjuague final con clorhexidina: un estudio clínico. J Endod 2012;38:1202–6.
- Ricucci D, Loghin S, Siqueira JF Jr. Infección exuberante por biofilm en un canal lateral como causa del fracaso del tratamiento endodóntico a corto plazo: informe de un caso. J Endod 2013;39:712–8.
- Ruckman JE, Whitten B, Sedgley CM, et al. Comparación del archivo autoajustable con la instrumentación rotativa y manual en canales radiculares de forma ovalada larga. J Endod 2013;39: 92–5.
- Siqueira JF Jr, Lima KC, Magalhaes FA, et al. Reducción mecánica de la población bacteriana en el canal radicular por tres técnicas de instrumentación. J Endod 1999;25: 332–5.
- Siqueira JF Jr, Rôças IN, Lopes HP. Patrones de colonización microbiana en infecciones primarias del canal radicular. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002; 93:174–8.
- Ordinola-Zapata R, Bramante CM, Cavenago B, et al. Efecto antimicrobiano de soluciones endodónticas utilizadas como irrigantes finales en un modelo de biofilm de dentina. Int Endod J 2012;45:162–8.
- Alves FR, Siqueira JF Jr, Carmo FL, et al. Perfil de la comunidad bacteriana de muestras molidas criogénicamente de los segmentos radiculares apical y coronal de dientes con periodontitis apical. J Endod 2009;35:486–92.
