Micro-CT con contraste para evaluar el desbridamiento del tejido pulpar dental en conductos radiculares de dientes extraídos: una serie de experimentos en cascada hacia la validación del método.
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Objetivo: Validar un nuevo método para la evaluación del desbridamiento del tejido pulpar en los conductos radiculares de dientes extraídos utilizando un protocolo de impregnación que involucra triyoduro de potasio, una solución radiocontraste conocida como solución de Lugol, combinada con imágenes de microtomografía computarizada (micro-CT).
Metodología: Se evaluó el impacto de NaOCl en la radiopacidad de la solución de Lugol utilizando una serie de diluciones en dos pasos de Lugol en agua destilada y NaOCl al 5.25%, que luego se pipetearon en platos transparentes y se radiografiaron. Para verificar la influencia de Lugol en el efecto proteolítico de NaOCl, se realizó una prueba de disolución utilizando carne bovina fresca. Diez rebanadas no sufrieron ningún procesamiento de tejido, mientras que veinte rebanadas se fijaron en formaldehído durante 24 h. Después de eso, 10 de ellas se sumergieron en Lugol durante otras 24 h. Luego, todos los especímenes se colocaron en NaOCl y se registró el tiempo requerido para una disolución completa del tejido. Para los últimos experimentos (validación histológica y evaluación de micro-CT), 8 premolares mandibulares extraídos con pulpas anteriormente vitales se sumergieron en formalina tamponada, se escanearon en un dispositivo de micro-CT, se accedió, se sumergieron en Lugol durante 7 días y se escanearon nuevamente. Luego, se prepararon y escanearon los conductos radiculares de 5 dientes, y se identificó y cuantificó el volumen de tejido pulpar restante, mientras que 3 dientes fueron procesados histológicamente. Los mismos especímenes se sometieron a evaluación histológica, y las imágenes de las secciones histológicas se registraron con las correspondientes imágenes de micro-CT para verificar si el tejido pulpar en las secciones histológicas coincidía con su contraparte en los tejidos impregnados con Lugol identificados en los cortes de micro-CT.
Resultados: No hubo un efecto discernible en la radiopacidad cuando se mezcló NaOCl con la solución de Lugol. El procesamiento de tejidos no afectó el tiempo requerido para la disolución completa de carne bovina fresca. La evaluación histológica reveló una correlación entre las imágenes de micro-CT y las imágenes histológicas que confirmaron la identificación del tejido pulpar impregnado de Lugol en las imágenes de micro-CT.
Conclusiones: La solución radiocontraste de Lugol no fue afectada por NaOCl y no interfirió con su capacidad de disolución de tejidos blandos. El protocolo de impregnación utilizando la solución de Lugol permitió la visualización del tejido pulpar en las imágenes de micro-CT y la identificación de restos pulpares después de los procedimientos químicos-mecánicos del canal.
Introducción
El análisis convencional de secciones histológicas y el uso de tomografía computarizada de rayos X de micro-computación (micro-CT) se consideran los métodos de referencia para evaluar los procedimientos de limpieza y conformación durante la preparación del canal radicular. Mientras que el micro-CT permite identificar y cuantificar los tejidos mineralizados del canal radicular eliminados por la preparación mecánica, la cantidad de tejido pulpar restante (no mineralizado) generalmente se evalúa en secciones histológicas. Así, a pesar de la utilidad de la tecnología de micro-CT, este método ha estado limitado a la evaluación de cambios a lo largo de las paredes del canal, incluyendo el transporte y la creación de aberraciones, como cremalleras y perforaciones. Debido al poder de penetración de los rayos X, las técnicas de micro-CT proporcionan un mapa de densidad 3D de especímenes y tejidos que absorben fuertemente esta radiación (Alfaro et al. 2015, Cunha et al. 2015). Sin embargo, no es adecuado para la imagenología de tejidos blandos, como la pulpa dental, ya que estos tejidos absorben rayos X en un grado muy limitado (Gignac & Kley 2014).
Recientemente, se empleó un enfoque correlativo utilizando la histología como un método complementario para la evaluación de micro-CT en dos estudios para evaluar varios protocolos quimomecánicos en los conductos radiculares (Lacerda et al. 2017, Siqueira et al. 2018). Ambos estudios demostraron histológicamente la presencia de restos de tejido pulpar adheridos a las paredes del canal no tocadas previamente identificadas por el análisis de micro-CT. Aunque este enfoque correlativo utilizando diferentes métodos puede permitir la asignación de mecanismos de causalidad, el análisis histológico generalmente permite evaluar solo unas pocas secciones por raíz, lo que proporciona datos muy limitados y es inconsistente con la cantidad de información en cientos de imágenes seccionales producidas normalmente por el escaneo de micro-CT de un conducto radicular típico. Además, el corte histológico es un procedimiento que consume mucho tiempo y es costoso, que destruye la muestra.
Es deseable desarrollar un método experimental no destructivo confiable capaz de evaluar simultáneamente la calidad y cantidad de tejidos blandos y duros en una muestra heterogénea como el diente humano. En otras áreas de investigación, esta limitación se ha superado utilizando varios agentes de contraste como osmio, oro, sulfato de bario y tintes a base de yodo (Metscher 2009a, b, Faulwetter et al. 2013, Pauwels et al. 2013). En general, se ha demostrado que una solución acuosa de yodo de Lugol, también llamada yoduro de potasio (I2KI), se encuentra entre los medios más efectivos para diferenciar rápidamente una diversidad de tipos de tejidos blandos. La solución de Lugol es una opción de tinción simple, rentable, no tóxica y rápida para la mejora del contraste de los tejidos blandos. Sin embargo, su uso se ha limitado a estudios anatómicos de una amplia variedad de muestras biológicas utilizando un amplio rango de diferentes concentraciones de yodo y duraciones de tinción, dependiendo del tipo de tejido (Heimel et al. 2019). Actualmente, a pesar de que la impregnación de Lugol es el agente de contraste más utilizado en el estudio anatómico de los tejidos blandos, aún no está claro si esta solución sería adecuada en la evaluación de micro-CT del tejido pulpar después del desbridamiento del conducto radicular ex vivo. Uno de los problemas fundamentales al usar Lugol concierne al hipoclorito de sodio (NaOCl), el principal irrigante endodóntico utilizado para disolver el tejido pulpar necrótico (Zehnder 2006), que reacciona con el yodo (Vogel 1978) y podría interferir con su impregnación y visibilidad en las imágenes radiográficas.
La presente comunicación informa sobre una serie de experimentos en cascada que buscan introducir y explorar el potencial de visualizar el tejido pulpar dental en imágenes de micro-CT utilizando Lugol como solución de mejora de contraste. La cascada de experimentos tenía como objetivo validar el protocolo de impregnación y el método de micro-CT con contraste mejorado (CE-CT) mientras se identificaban las ventajas y limitaciones potenciales de esta novedosa metodología. Los experimentos en cascada fueron diseñados para:
- Evaluar el potencial de NaOCl para reducir el grado de contraste radiográfico asociado con Lugol (prueba de radiopacidad);
- Verificar la posibilidad de que la solución de Lugol afecte el efecto proteolítico de NaOCl (prueba de disolución de tejidos blandos);
- Evaluar la capacidad de la solución de Lugol para impregnar adecuadamente el tejido pulpar mediante imágenes correlativas de micro-CT mejorado con Lugol e histología convencional (validación histológica);
- Medir el volumen restante de tejido pulpar impregnado con Lugol (evaluación volumétrica de micro-CT).
Materiales y métodos
Impacto del NaOCl en la radiopacidad de la solución de Lugol
La solución de Lugol (I2KI) utilizada para todos los experimentos tenía una concentración del 5% de I2 y 10% de KI. Para evaluar el impacto del NaOCl en su radiopacidad, se realizó una serie de diluciones 1:1 en agua destilada y NaOCl al 5.25% (1.5 mL de volumen total). La solución pura y sus diluciones se pipetearon en platos redondos transparentes de poliestireno (Semadeni, Ostermundigen, Suiza) con un diámetro interno de 23.4 mm y una profundidad de 3.5 mm. La radiopacidad se determinó utilizando un conjunto estándar como se describió anteriormente (Hertig et al. 2017). En resumen, se generaron conjuntos de datos electrónicos utilizando una unidad fija (Trophy, París, Francia) a 65 kV, 8 mA y 0.22 s con una distancia de foco a película de 25 cm y sensores electrónicos (Digora; Soredex, Tuusula, Finlandia). Las imágenes se analizaron utilizando ImageJ (Bethesda, MD, EE. UU.). Los valores de gris se normalizaron en cada imagen contra un cuña de escalones de aluminio, con una curva estándar individual para cada imagen. Los experimentos se realizaron en triplicado. La radiopacidad relativa de la solución de Lugol y sus diluciones se expresa como el equivalente de aluminio (en mm) por mm de solución.
Prueba de disolución de tejidos blandos
Treinta rebanadas de carne bovina fresca se ajustaron a un peso similar (2 mg) y dimensiones (4 x 4 mm) utilizando una hoja quirúrgica número 15. Diez rebanadas no fueron sometidas a ningún procesamiento de tejido, mientras que las otras 20 fueron fijadas en formaldehído durante 24 h. Después de eso, 10 de las rebanadas fijadas se sumergieron en la solución de Lugol durante otras 24 h. Luego, todos los especímenes se colocaron individualmente en frascos que contenían 40 mL de NaOCl al 5.25% y se registró el tiempo total requerido para la disolución completa del tejido pulpar (en min). Todos los procedimientos de prueba se realizaron a temperatura ambiente. Esta investigación no se clasificó como un estudio con animales porque no tuvo influencia en el destino premortal o el proceso de sacrificio de los animales. El análisis preliminar de los datos en bruto indicó la adherencia a una distribución gaussiana (prueba de Shapiro–Wilk, P < 0.05). Los datos se compararon entre grupos utilizando ANOVA de una vía seguido de la prueba HSD de Tukey. Se consideró un error alfa del 5%.
Evaluación de micro-CT de restos de tejido pulpar
Después de la aprobación por parte del comité de ética local (protocolo no. 12127319.3.0000.5243), ocho premolares mandibulares de raíz simple no cariosos y un molar mandibular con pulpas vitales, extraídos por razones ortodónticas, fueron sumergidos en formalina tamponada al 10% y almacenados durante hasta 30 días a 15 °C. Posteriormente, los dientes fueron escaneados a un tamaño de píxel de 14.37 lm utilizando un dispositivo de micro-CT (SkyScan 1173; Bruker microCT, Kontich, Bélgica) configurado a 70 kV, 114 mA, rotación de 360° alrededor del eje vertical con un paso de rotación de 0.5°, promedio de cuadro de 5, utilizando un filtro de aluminio de 1.0 mm de grosor. Se utilizó el software NRecon v.1.7.16 (Bruker micro-CT) para reconstruir las proyecciones de micro-CT en secciones transversales axiales utilizando una corrección de artefacto de anillo de 4, límites de contraste que van de 0.006 a 0.05 y corrección de endurecimiento de haz del 40%, resultando en 800–900 imágenes en escala de grises por diente desde la unión cemento-esmalte hasta el ápice. Para verificar la morfología del canal, las imágenes seccionales fueron segmentadas utilizando una rutina automática (De-Deus et al. 2020) en el software FIJI/ImageJ (Fiji v.1.51n; Madison, WI, EE. UU.), y la relación de aspecto del conducto radicular, definida como la relación entre los diámetros mayor y menor, fue medida en cada corte desde el orificio hasta el foramen apical. Luego, el volumen del canal (en mm3) fue calculado como el volumen del conducto radicular binarizado dentro del volumen de interés.
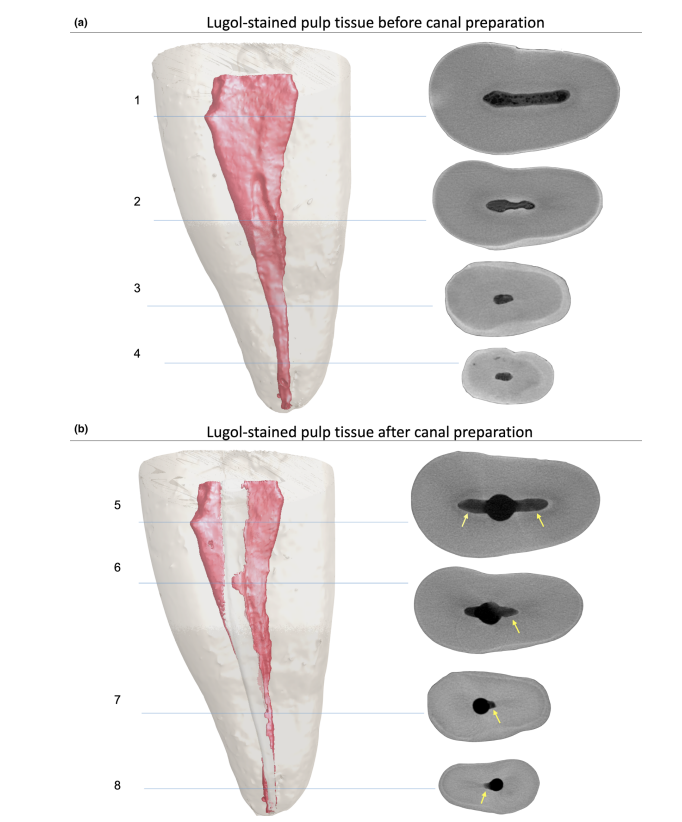
Después de la preparación convencional de la cavidad de acceso, cada diente se sumergió en la solución de Lugol durante 7 días y se sometió a un nuevo escaneo y procedimientos de reconstrucción utilizando los parámetros mencionados anteriormente para evaluar la impregnación de todo el tejido pulpar por la solución de contraste. Este conjunto de imágenes se co-registró con el conjunto de datos no teñidos utilizando el algoritmo afín implementado en el software 3D Slicer 4.6.0 (http://www.slicer.org) (Fedorov et al. 2012), y la dentina radicular del diente tras la inmersión fue eliminada a través de una operación booleana para reducir el ruido generado por la segmentación del tejido pulpar. Así, se observó y cuantificó el tejido pulpar impregnado con la solución de Lugol (en mm3) mediante el proceso de segmentación con un valor de umbral específico, utilizando la herramienta Object Counter disponible en el software FIJI/ ImageJ. Después de eso, los conductos radiculares de 5 de los 8 premolares seleccionados fueron preparados quimio-mecánicamente, mientras que los otros 4 dientes sanos (3 premolares y 1 molar) fueron preparados para seccionamiento histológico para confirmar la presencia de los restos del tejido pulpar (grupo de control).
Preparación del conducto radicular
Los conductos radiculares fueron preparados hasta la longitud de trabajo con el instrumento Reciproc R25 (VDW GmbH, Múnich, Alemania) accionado por un motor VDW Silver (VDW GmbH) en el programa preestablecido ‘RECIPROC ALL’ utilizando una ligera presión apical con un movimiento de picoteo lento de entrada y salida de 3 mm de amplitud. Después de completar tres movimientos de picoteo, se retiró el instrumento del conducto y se limpiaron sus flautas insertándolo en una esponja humedecida con alcohol. Se alcanzó la longitud de trabajo después de 3 olas de instrumentación. La permeabilidad apical se realizó con un K-file de tamaño 15 (Dentsply Sirona Endodontics, Ballaigues, Suiza) durante todo el procedimiento de preparación. La irrigación se realizó con un total de 12 mL de NaOCl al 5.25% dispensado en el conducto radicular con una aguja de doble puerto NaviTip de 31-G (Ultradent Inc., South Jordan, UT, EE. UU.) llevada hasta 1 mm por debajo de la longitud de trabajo durante todo el procedimiento de preparación. Después de la preparación del conducto radicular, las muestras fueron reescaneadas, reconstruidas y co-registradas utilizando los parámetros mencionados anteriormente. Luego, se calculó el volumen de restos de tejido pulpar impregnados con la solución de Lugol (en mm3) y se cuantificó como un valor porcentual basado en el volumen inicial del tejido pulpar.
Evaluación histológica
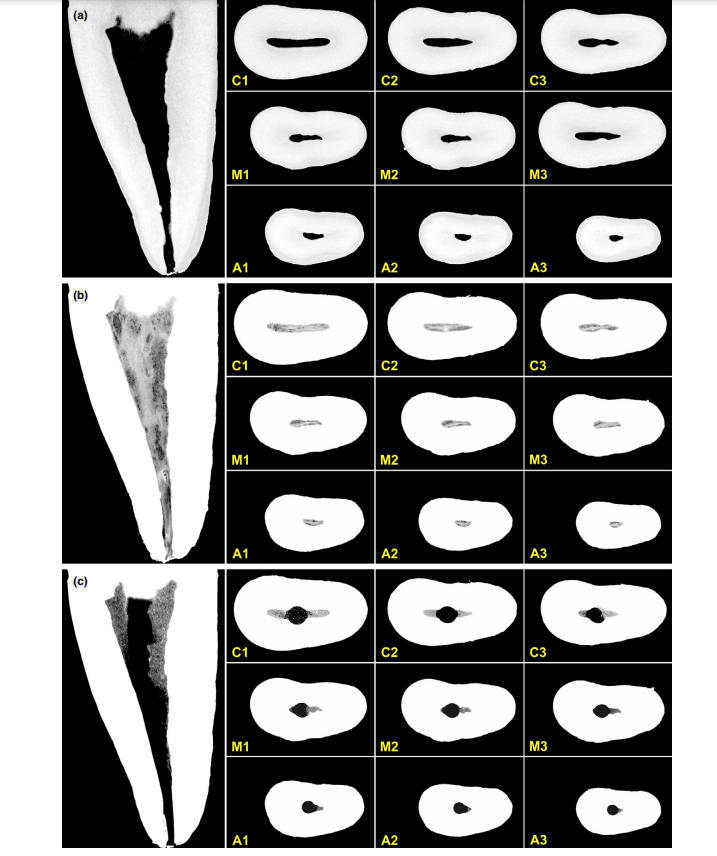
Después de los procedimientos experimentales descritos anteriormente, las muestras fueron desmineralizadas en una solución de ácido fórmico al 22.5% (vol/vol) más 10% (wt/vol) de citrato de sodio durante un período de 2 a 3 semanas. El punto final se monitoreó radiográficamente. Las muestras fueron enjuagadas durante 24 h en agua del grifo, deshidratadas y procesadas para un examen histológico de rutina. Los dientes fueron incrustados en bloques de parafina, y se obtuvieron secciones transversales de 0.6 µm de grosor cada 1 mm desde la unión cemento-esmalte hasta el ápice, resultando en 8 cortes por diente. Las secciones adquiridas fueron montadas en placas de vidrio y teñidas con hematoxilina-eosina. Las imágenes histológicas fueron visualizadas utilizando un microscopio de luz totalmente motorizado Axioplan 2 Imaging (Carl Zeiss Vision, Hallbergmoos, Alemania).
Coincidencia de las imágenes de micro-CT impregnadas con Lugol y las secciones histológicas
Las secciones de micro-CT adquiridas que contenían el tejido pulpar impregnado con Lugol fueron inspeccionadas a lo largo del eje z utilizando un sistema de coordenadas de referencia basado en un algoritmo de registro basado en puntos de referencia (software Analyze; Biomedical Imaging Resource, Mayo Clinic, Rochester, MN, EE. UU.) para alinearlas con las imágenes de micro-radiografía de las secciones histológicas. Después de seleccionar las imágenes correspondientes, se realizó un ajuste de estandarización dimensional que incluía magnificación automática, redimensionamiento y recorte, mediante un procedimiento asistido por computadora. Este paso del procedimiento permitió a los examinadores inspeccionar de manera confiable las raíces en los mismos niveles y, por lo tanto, verificar cualitativamente si el tejido pulpar en la sección histológica coincidía con su contraparte en la sección de micro-CT impregnada con Lugol, confirmando la eficacia del protocolo de impregnación y los parámetros de escaneo. Dos examinadores precalibrados utilizaron un proforma con criterios predefinidos para analizar el grado de coincidencia entre las imágenes impregnadas con Lugol y las histológicas. El procedimiento de análisis de imágenes se realizó en un monitor de computadora de alta calidad de 34’ con la posibilidad de escalar imágenes (hasta 109) y revertir el modo de color. Para validar el proceso analítico, los análisis se repitieron dos veces a intervalos de 10 días para evaluar la reproducibilidad.
Resultados
Impacto de NaOCl en la radiopacidad de la solución de Lugol
La solución de Lugol pura tenía una radiopacidad de 0.70 ± 0.09 mm Al mm—1. La dilución en NaOCl al 5.25% tuvo un efecto similar en la radiopacidad que el procedimiento de control en agua, con las diluciones más altas en NaOCl mostrando una radiopacidad ligeramente mayor (Fig. 1), que se basa en la diferencia en radiopacidad entre la solución pura de NaOCl al 5.25% y el agua de 0.05 mm Al mm—1. No hubo un efecto discernible en la radiopacidad causado por la interacción química entre el NaOCl y la solución de Lugol, que fue visible por el aclaramiento del color marrón en presencia de NaOCl.

Prueba de disolución de tejidos blandos
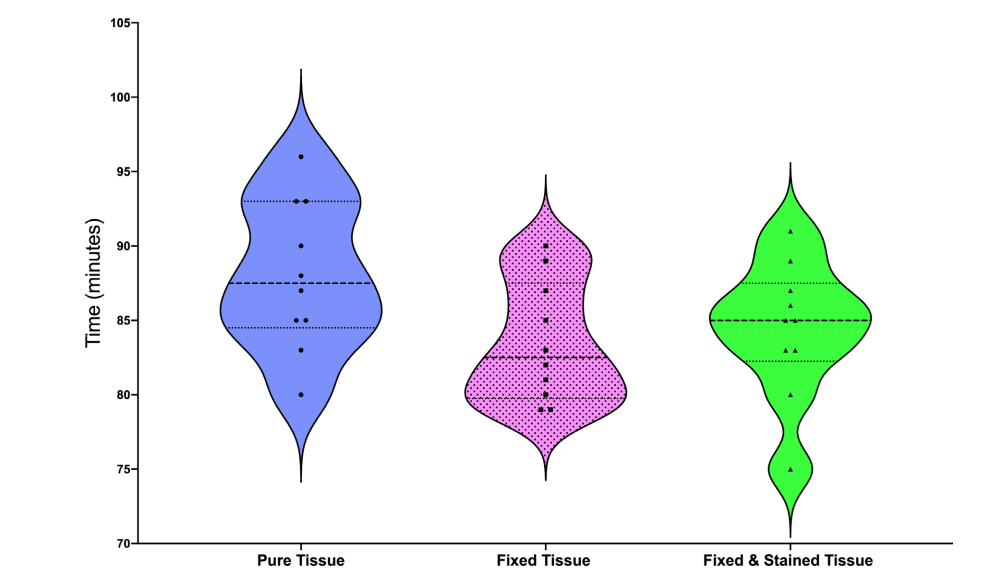
Los gráficos de violín ilustran los valores medios, mínimos y máximos, así como la distribución de datos de la disolución de tejidos entre los especímenes (Fig. 2). El procesamiento de tejidos en formaldehído y solución de Lugol no afectó el tiempo requerido para la disolución de carne bovina fresca (P > 0.05).
Validación histológica
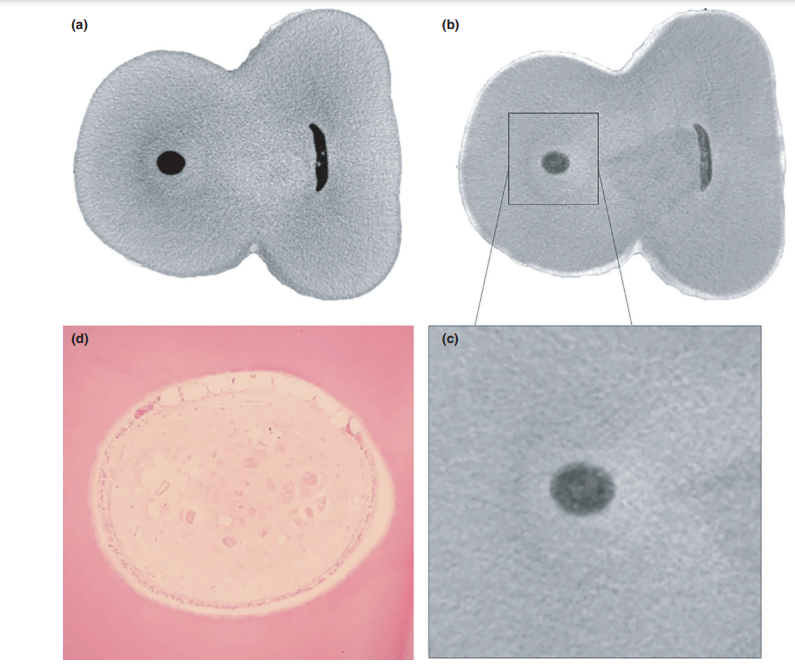
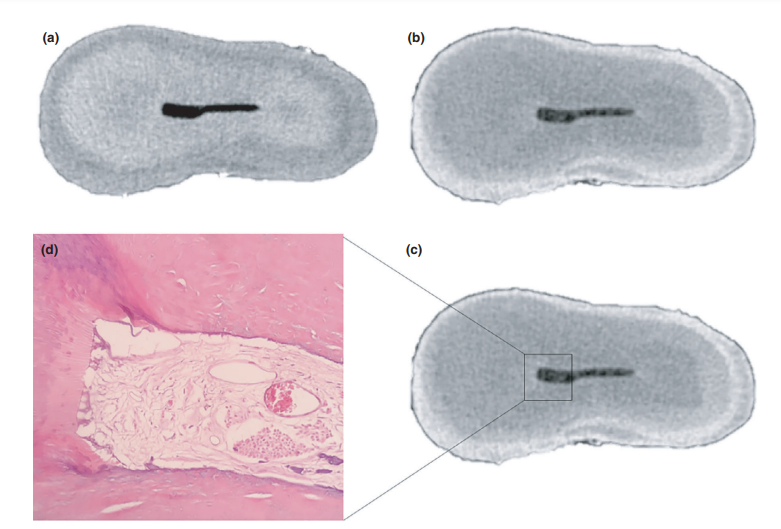
La calidad general del protocolo de tinción utilizado se ilustra en la Figura 3. El análisis correlativo entre imágenes de micro-CT e imágenes histológicas confirmó la identidad del tejido pulpar impregnado con Lugol en las imágenes de micro-CT. Los resultados de las imágenes de micro-CT e imágenes histológicas emparejadas se muestran en las Figuras 4 y 5, confirmando la calidad del protocolo de tinción.

Evaluación micro-CT volumétrica
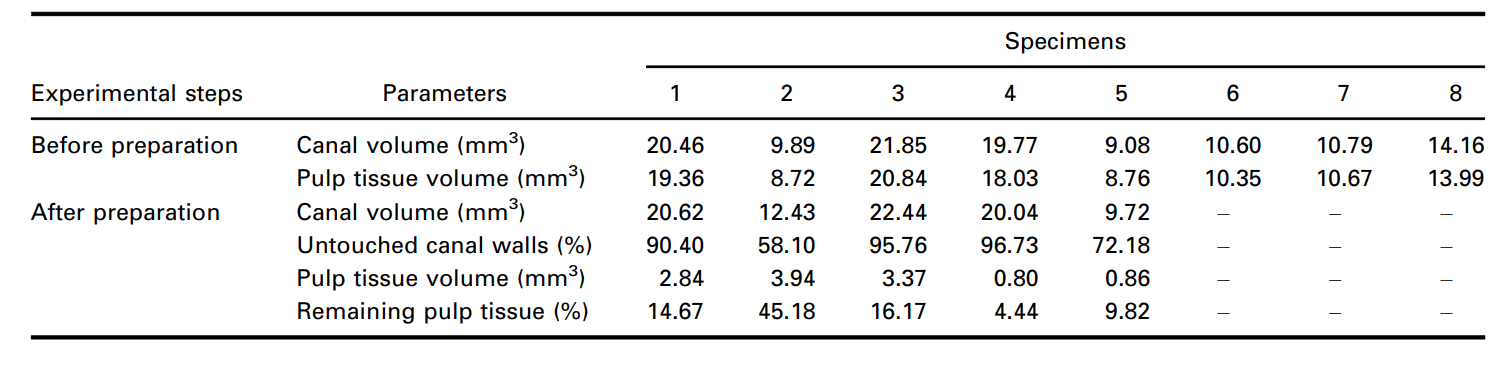
Además, se cuantificaron los restos de pulpa segmentados después de la preparación del conducto radicular y se expresaron como un valor porcentual. El volumen del conducto radicular instrumentado y las áreas de conducto no instrumentadas adquiridas por el método micro-CT también se cuantificaron (Tabla 1) y se ilustraron en las Figuras 6 y 7 y en el Video Suplementario 1. El volumen del conducto radicular y la relación de aspecto influyeron directamente en la eliminación del tejido pulpar durante la instrumentación. Los dientes con valores de relación de aspecto menores a 3.5, expresados por la curva gráfica y altos volúmenes, se asociaron con volúmenes más pequeños de restos de tejido pulpar.
Discusión
Esta comunicación presenta un nuevo método de tinción para el tejido pulpar dental en el contexto de la evaluación micro-CT de la eliminación de debris en los conductos radiculares, con usos beneficiosos obvios para futuras investigaciones en este campo. El método no destructivo propuesto es capaz de proporcionar imágenes de alta resolución e información 3D sobre el tejido pulpar y la dentina simultáneamente, permitiendo así la evaluación longitudinal y cuantitativa del volumen de los procedimientos de limpieza y conformación de los conductos radiculares. Desde que Gysi & Röse (1894) publicaron las primeras fotomicrografías de alta calidad que mostraban detalles de los elementos vasculares, linfáticos y nerviosos del complejo pulpa-dentina de un molar mandibular, y Kölliker (1852) proporcionó la primera descripción de la pulpa dental, que él nombró como Pulpa dentis, en su libro clásico sobre las estructuras minuciosas de los tejidos y órganos del cuerpo, muchos estudios han investigado los dientes utilizando métodos histológicos. Usando esta técnica, Hatton et al. (1928) fueron los primeros en demostrar que el canal solo se limpiaba superficialmente y que gran parte del tejido pulpar no se eliminaba después de la preparación con instrumentos de acero inoxidable. Sin embargo, fue solo después de que Walton (1976) publicara un estudio seminal que evaluaba la cantidad de tejido pulpar restante después de los procedimientos de limpieza y conformación que el corte histológico basado en parafina se convirtió en el método estándar para determinar la eficacia de los procedimientos de eliminación de debris dentro del espacio del conducto radicular.
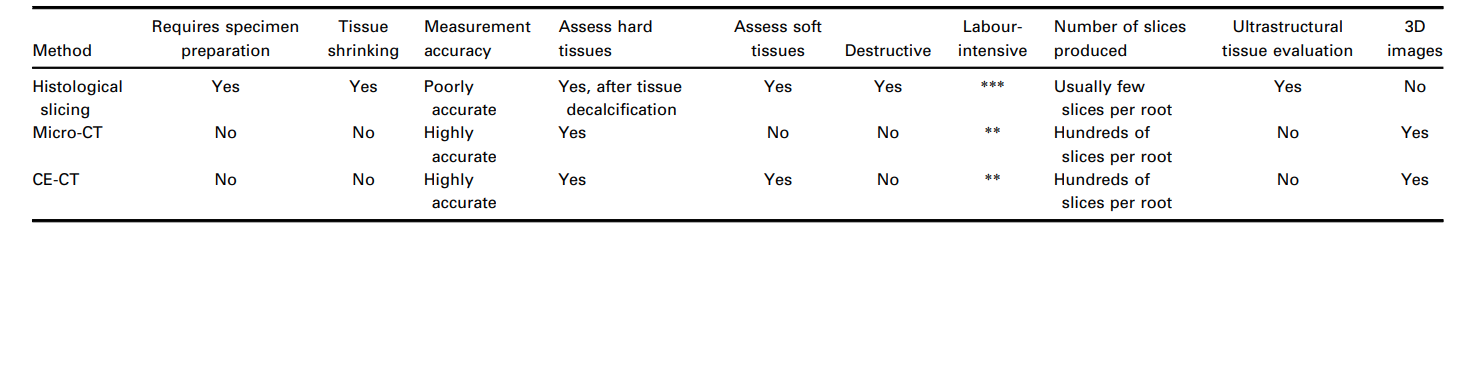
En dientes intactos con pulpas vitales, normalmente utilizados como control en estudios de seccionamiento histológico, el tejido pulpar está adherido a todo el perímetro del conducto radicular (De-Deus et al. 2010, 2011), mientras que los restos de tejido en los grupos experimentales confirman qué áreas a lo largo de las paredes del conducto no fueron desbridadas mecánicamente o donde los protocolos de irrigación fueron ineficaces. Dado que los restos pulpares pueden servir como sustrato para bacterias y podrían afectar negativamente la calidad de los procedimientos de obturación del conducto (Ricucci et al. 2009, Ricucci & Siqueira 2011), teóricamente respalda esta variable experimental, el tejido pulpar restante, como un punto final aceptado para la calidad de los procedimientos de desbridamiento dentro del espacio del conducto radicular. Sin embargo, los procesos y la carga de trabajo resultante para la preparación de muestras que abarca el seccionamiento, tinción, imagenología y la evaluación histológica final integral sigue siendo una técnica engorrosa y laboriosa. Específicamente, en el contexto de la investigación de laboratorio endodóntico, la descalcificación de los tejidos dentales mineralizados es un paso que consume tiempo y es complicado, y es un desafío lograr muestras de alta calidad sin dañar el tejido pulpar. Esto se vuelve aún más importante ya que, en general, el seccionamiento histológico de tejidos duros descalcificados tiende a inducir distorsiones considerables en los tejidos, fallos en el procesamiento y artefactos estructurales. Por ejemplo, la contracción del tejido de hasta un 3% ocurre con tejidos óseos (Lane & Ráliš 1983, Henson et al. 1994), mientras que la deshidratación del tejido blando puede crear una contracción de hasta un 11% (Rown et al. 2002). Así, incluso con los útiles conocimientos disponibles en la literatura sobre este tema, es notable que los datos de microscopía cuantitativa derivados del seccionamiento histológico provienen de tejidos que presumiblemente se encogieron durante la preparación de la muestra. Además, las técnicas de seccionamiento histológico conducen invariablemente a la pérdida de muestras, lo que hace que los experimentos longitudinales a lo largo del tiempo sean imposibles. Por lo tanto, la histología puede considerarse un método arcaico en comparación con el enfoque volumétrico y cuantitativo logrado por métodos de imagen no destructivos (Tabla 2), aunque hasta la fecha sigue siendo el único modelo experimental disponible que permite la evaluación simultánea de tejidos duros y blandos mineralizados de los dientes a su nivel ultrastructural y, en consecuencia, es capaz de arrojar luz sobre esta importante área de investigación (De-Deus et al. 2008, 2010, 2011).
Varios estudios utilizando tecnología de micro-CT no destructiva han demostrado que la preparación de las paredes del conducto radicular mediante instrumentos endodónticos activados en movimiento rotatorio o reciprocante no es ideal (Paqué et al. 2010, Paqué & Peters 2011, Versiani et al. 2013, De-Deus et al. 2015, Zuolo et al. 2018). La preparación mecánica con estos instrumentos es limitada, ya que tienden a preparar solo los aspectos centrales de los conductos radiculares para crear una forma redonda, dejando la mayoría de las extensiones bucales y linguales de estos espacios complejos sin tocar, incluso al intentar movimientos laterales como cuando se utiliza un movimiento de cepillado (Paqué et al. 2010, Paqué & Peters 2011, Versiani et al. 2013, De-Deus et al. 2015, Zuolo et al. 2018). Aunque el micro-CT puede proporcionar mediciones valiosas y precisas sobre la posición y la cantidad de dentina removida durante la preparación del conducto, no proporciona información sobre el tejido pulpar o los biofilms microbianos que pueden permanecer adheridos a las paredes del conducto radicular, particularmente en áreas no alcanzadas por la acción mecánica de los instrumentos, como istmos, aletas, anastomosis y conductos accesorios (Versiani et al. 2013). Esto significa que el micro-CT ha estado esencialmente limitado a la evaluación de los cambios en las paredes dentinales, ya que, en esencia, el micro-CT no es adecuado para imagenar tejidos blandos, ya que son virtualmente 'transparentes' para los rayos X. Esta limitación está relacionada con la incapacidad de este método radiográfico derivado de la investigación ósea, diseñado para representar elementos más densos como el calcio, para detectar tejidos blandos no radiolúcidos (Rüegsegger et al. 1996). Sin embargo, ha habido un progreso significativo en la investigación basada en micro-CT en otras áreas biomédicas, incluyendo diferentes tipos de escáneres de banco, captura de información de contraste de fase, protocolos de adquisición de escaneo más rápidos y efectivos y algoritmos de reconstrucción. Tomados en conjunto, tales desarrollos pueden ser explotados para imagenar tejidos blandos (no calcificados) superando su limitación inherente. Para ello, se puede lograr una mejora específica en la visualización de tejidos blandos utilizando agentes de contraste radioopacos para alcanzar la atenuación de rayos X, la llamada técnica de micro-CT con contraste mejorado (CE-CT). En resumen, CE-CT es adecuado para evaluar tejidos heterogéneos como los dientes.
Los agentes de contraste están compuestos por agentes químicos específicos con un alto peso molecular capaces de unirse naturalmente a los tejidos blandos para crear 'contraste' de manera efectiva. El agente de contraste utilizado en el presente estudio fue el yodo inorgánico de Lugol (I2KI), que fue introducido por primera vez por Metscher (2009a), quien probó varios protocolos de fijación de muestras y el potencial de tinción de varios compuestos accesibles comercialmente para varios tipos de tejidos blandos. Hasta la fecha, se ha demostrado que el yodo de Lugol tiene una alta afinidad por el glucógeno (Fennerty 1999) y se dirige a las células epiteliales y al tejido blando de ratón (Degenhardt et al. 2010, Baverstock et al. 2013). Así, se probó el potencial del yodo de Lugol para lograr imágenes del tejido pulpar con micro-CT en el presente estudio. A través de una serie de ensayos con varios protocolos de impregnación, los dientes con cavidades de acceso convencionales sumergidos en la solución de Lugol durante 7 días permitieron la impregnación efectiva del tejido pulpar (Figuras 3 y 7). Sin embargo, dos aspectos relacionados con el uso del método CE-CT para analizar los restos pulpares longitudinalmente después de la irrigación del conducto radicular con solución de NaOCl pueden ser motivo de preocupación. El primer aspecto se relaciona con la reacción química del NaOCl con el yodo de la solución de Lugol. A pesar de esta interacción, la solución de Lugol no redujo significativamente la capacidad proteolítica del NaOCl en las condiciones actuales. La segunda preocupación fue el potencial del NaOCl para reducir el grado de contraste asociado con el tejido pulpar impregnado de Lugol. La prueba de radiopacidad reveló que la solución de Lugol era adecuada para impregnar el tejido pulpar, ya que el NaOCl no interfería con su radiopacidad. Tomados en conjunto, estos resultados confirmaron que la solución de Lugol puede ser utilizada como un agente de contraste para probar el tejido pulpar como sustrato para el análisis de protocolos de irrigación basados en NaOCl. Un análisis adicional se centró en la validación de la solución de Lugol para identificar correctamente el tejido pulpar. Para ello, se utilizó el corte histológico basado en parafina para confirmar si el tejido pulpar impregnado con la solución de Lugol era visible en las exploraciones de micro-CT. Luego se desarrolló un enfoque experimental para comparar las secciones histológicas con sus imágenes correspondientes adquiridas de los montajes de micro-CT, superando los problemas típicos de alineación en este tipo de análisis correlativo. Los resultados confirmaron la correcta identificación del tejido pulpar en las imágenes de micro-CT impregnadas de Lugol y, por lo tanto, demostraron la calidad del protocolo de impregnación (Figuras 4 y 5).
Es de notar que, particularmente para la investigación endodóntica utilizando el tejido pulpar restante como parámetro de resultado, el enfoque CE-CT tiene la clara ventaja de no centrarse en una evaluación ultrastructural detallada del tejido blando. En cambio, el CE-CT permite fácilmente una evaluación cuantitativa del tejido pulpar restante en su conjunto en experimentos longitudinales (a lo largo del tiempo) (Figuras 6 y 7). Desde un punto de vista cualitativo, cientos de secciones transversales producidas por diente mediante CE-CT pueden proporcionar una mejor comprensión de la estrecha relación entre la anatomía interna de los conductos radiculares y los protocolos de conformación mecánica e irrigación. Esto se debe a que el CE-CT ofrece modelos 3D de alta resolución, que contienen información fiel a la realidad sobre las dimensiones, cuantificación estructural y características anatómicas de tejidos heterogéneos, por ejemplo, la dentina y el tejido pulpar. Al mismo tiempo, este método permite la evaluación de la distribución preoperatoria del tejido pulpar a lo largo del espacio del conducto antes de los procedimientos experimentales incluso después de 7 días sin ningún protocolo de fijación. Este es un punto importante ya que la cantidad y ubicación del tejido pulpar pueden actuar como un factor de confusión, afectando el resultado del experimento. De esta manera, el uso del método CE-CT en dientes con pulpas vitales parece ser válido y reproducible, ya que el tejido pulpar estaba distribuido a lo largo de todo el sistema de conductos radiculares en todos los dientes sanos. Los futuros estudios que utilicen este método innovador deberían incluir la comparación de diferentes soluciones de irrigación (soluciones inertes vs soluciones activas) a lo largo del tiempo y los protocolos de preparación sobre la eficiencia de disolución/eliminación del tejido pulpar de los sistemas de conductos radiculares. Además, las mejoras en este método también permitirían que se aplicara en investigaciones in vivo utilizando CBCT, por ejemplo. En este momento, la metodología presente requiere que el agente de contraste esté en contacto con el tejido pulpar durante al menos 7 días y, en un enfoque in vivo, también requeriría imágenes tomográficas pre y postoperatorias, lo que claramente necesita cumplir con principios éticos aceptables de investigación. Definitivamente, el protocolo presente debería ser validado in vivo utilizando CBCT. Por otro lado, se puede aplicar de manera segura in vivo utilizando dientes no cariados y no restaurados con pulpas vitales programados para extracción sin escaneos pre o postoperatorios. Por ejemplo, después de confirmar la condición vital de la pulpa mediante pruebas convencionales, se puede aplicar el protocolo quimomecánico in situ y la solución de contraste inyectada en el espacio del conducto pulpar y la cavidad de acceso coronal restaurada para asegurar que la solución de Lugol permanezca dentro del espacio del conducto radicular. Luego, el diente puede ser extraído, almacenado y evaluado a través de imágenes de micro-CT después de una semana.
En resumen, el estudio actual se concentra en proporcionar evidencia preliminar pero original para apoyar estudios longitudinales de CE-CT no destructivos utilizando el tejido pulpar restante como parámetro de resultado. Se demostró que la CE-CT combina, en un solo método, las principales ventajas de la tecnología de imagen de micro-CT (evaluación de tejido mineralizado) y los métodos histológicos tradicionales (evaluación de tejido no mineralizado) para estudiar los procedimientos de desbridamiento del conducto radicular, abarcando la posibilidad de evaluar, identificar y medir aquellas áreas del conducto no afectadas ni por la preparación mecánica ni por los protocolos de irrigación. Cabe destacar que la CE-CT permite estudiar la preparación mecánica del conducto y los protocolos de irrigación de manera independiente o el efecto sinérgico combinado de los procedimientos químico-mecánicos.
Conclusiones
La solución de Lugol permitió la visualización del tejido pulpar en imágenes de micro-CT. La solución de Lugol no se vio afectada por el NaOCl en su radiopacidad y no interfirió con la disolución de los tejidos blandos fijos y teñidos. En términos prácticos, la técnica de imagen de micro-CT con contraste mejorado con la solución de Lugol presentada aquí permite evaluar de manera independiente o conjunta el efecto de la disolución química y la eliminación mecánica del tejido pulpar mediante procedimientos de limpieza y conformación, lo que la convierte en una técnica muy útil en la investigación endodóntica basada en laboratorio.
Autores: G. De-Deus, F. G. Belladonna, D. M. Cavalcante, M. Simões-Carvalho, E. J. N. L. Silva, J. C. A. Carvalhal, R. Q. Zamolyi, R. T. Lopes, M. A. Versiani, P. M. H. Dummer, M. Zehnder
Referencias:
- Alfaro DP, Ruse ND, Carvalho RM, Wyatt CC (2015) Evaluación del ajuste interno de coronas de disilicato de litio utilizando micro-CT. Journal of Prosthodontics 24, 381–6.
- Baverstock H, Jeffery NS, Cobb SN (2013) La morfología de la musculatura masticatoria del ratón. Journal of Anatomy 223, 46–60.
- Cunha AC, Marquezan M, Lima I, Lopes RT, Nojima LI, Sant’Anna EF (2015) Influencia de la arquitectura ósea en la estabilidad primaria de diferentes diseños de mini-implantes. American Journal of Orthodontics and Dentofacial Orthopedics 147, 45–51.
- De-Deus G, Reis C, Beznos D, Gruetzmacher-de-Abranches AM, Coutinho-Filho T, Pacionrik S (2008) Capacidad limitada de tres técnicas de gutapercha termoplástica comúnmente utilizadas en el llenado de canales de forma ovalada. Journal of Endodontics 34, 1401–5.
- De-Deus G, Barino B, Quintella Zamolyi R et al. (2010) Calidad de desbridamiento subóptima producida por la técnica de un solo archivo F2 ProTaper en canales de forma ovalada. Journal of Endodontics 36, 1897–900.
- De-Deus G, Souza EM, Barino B et al. (2011) El archivo autoajustable optimiza la calidad de desbridamiento en canales radiculares de forma ovalada. Journal of Endodontics 37, 701–5.
- De-Deus G, Belladonna FG, Silva EJ et al. (2015) Evaluación por micro-CT de áreas de canal no instrumentadas con diferentes ampliaciones realizadas por sistemas de NiTi. Brazilian Dental Journal 26, 624–9.
- De-Deus G, Simões-Carvalho M, Belladonna FG et al. (2020) Creación de grupos experimentales bien equilibrados para estudios comparativos de laboratorio en endodoncia: una nueva propuesta basada en micro-CT y métodos in silico. International Endodontic Journal 53, 974–85.
- Degenhardt K, Wright AC, Horng D, Padmanabhan A, Epstein JA (2010) Fenotipado 3D rápido del desarrollo cardiovascular en embriones de ratón mediante micro-CT con tinción de yodo. Circulation: Cardiovascular Imaging 3, 314–22.
- Faulwetter S, Vasileiadou A, Kouratoras M, Dailianis T, Arvanitidis C (2013) Micro-tomografía computarizada: Introduciendo nuevas dimensiones a la taxonomía. ZooKeys 263, 1–45. Fedorov A, Beichel R, Kalpathy-Cramer J et al. (2012) 3D Slicer como una plataforma de computación de imágenes para la red de imágenes cuantitativas. Magnetic Resonance Imaging 30, 1323–41.
- Fennerty MB (1999) Tinción de tejidos. Gastrointestinal Endoscopy Clinics of North America 4, 297–311.
- Gignac PM, Kley NJ (2014) Imágenes de micro-CT mejoradas con yodo: refinamientos metodológicos para el estudio de la anatomía de tejidos blandos de vertebrados post-embrionarios. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution 322, 166–76.
- Gysi A, Röse C (1894) Sammlung von Mikrophotographien zur Veranschaulichung der mikroscopischen Struktur der Zähne des Menschen. Mikrophotographien der Zahnhistologie. Zúrich: Suiza.
- Hatton EH, Skillen WG, Moen OH (1928) Hallazgos histológicos en dientes con conductos radiculares tratados y llenos. Journal of the American Dental Association 15, 56.
- Henson MM, Henson OW Jr, Gewalt SL, Wilson JL, Johnson GA (1994) Imágenes de la cóclea mediante microscopía por resonancia magnética. Hearing Research 75, 75–80.
- Heimel P, Swiadek NV, Slezak P et al. (2019) Imágenes de micro-CT mejoradas con yodo de tejido blando en el ejemplo de la regeneración del nervio periférico. Contrast Media G Molecular Imaging 2019, 1–15.
- Hertig G, Zehnder M, Woloszyk A, Mitsiadis T, Ivica A, Weber F (2017) Yodixanol como agente de contraste en un hidrogel de fibrina para aplicaciones endodónticas. Frontiers in Physiology 8, 152.
- Kölliker VA (1852) Handbuch der Gewebelehre des Menschen, 1ª ed. Leipzig: W. Engelmann, p 405.
- Lacerda MFLS, Marceliano-Alves MF, Pérez AR et al. (2017) Limpieza y conformación de canales ovalados con 3 sistemas de instrumentación: un estudio correlativo micro-tomográfico e histológico. Journal of Endodontics 43, 1878–84.
- Lane & Ráliš (1983) Cambios en las dimensiones de grandes especímenes de hueso esponjoso durante la preparación histológica medidos en losas de cabezas femorales humanas. Calcified Tissue International 35, 1–4.
- Metscher BD (2009a) Micro-CT para morfología comparativa: métodos de tinción simples permiten imágenes 3D de alto contraste de diversos tejidos animales no mineralizados. BMC Physiology 9, 11.
- Metscher BD (2009b) Micro-CT para biología del desarrollo: una herramienta versátil para imágenes 3D de alto contraste a resoluciones histológicas. Developmental Dynamics 238, 632–40.
- Paqué F, Balmer M, Attin T, Peters OA (2010) Preparación de conductos radiculares de forma ovalada en molares mandibulares utilizando instrumentos rotatorios de níquel-titanio: un estudio de micro-tomografía computarizada. Journal of Endodontics 36, 703–7.
- Paqu´e F, Peters OA (2011) Evaluación por micro-tomografía computarizada de la preparación de conductos radiculares largos y ovalados en molares mandibulares con el archivo autoajustable. Journal of Endodontics 37, 517–21.
- Pauwels E, Van Loo D, Cornillie P, Brabant L, Van Hoorebeke L (2013) Un estudio exploratorio de agentes de contraste para la visualización de tejidos blandos mediante imágenes de tomografía computarizada de rayos X de alta resolución. Journal of Microscopy 250, 21–31.
- Ricucci D, Siqueira JF Jr, Bate AL, Pitt Ford TR (2009) Investigación histológica de dientes tratados en conducto radicular con periodontitis apical: un estudio retrospectivo de veinticuatro pacientes. Journal of Endodontics 35, 493–502.
- Ricucci D, Siqueira JF Jr (2011) Destino del tejido en canales laterales y ramificaciones apicales en respuesta a condiciones patológicas y procedimientos de tratamiento. Journal of Endodontics 36, 1–15.
- Rown MAB, Eed RBR, Enry RWH (2002) Efectos de medios de deshidratación y temperatura en el tiempo total de deshidratación y contracción del tejido. Journal of International Society for Plastination 17, 28–33.
- Rüegsegger P, Koller B, Mu€ller R (1996) Un sistema microtomográfico para la evaluación no destructiva de la arquitectura ósea. Calcified Tissue International 58, 24–9.
- Siqueira JF Jr, Pérez AR, Marceliano-Alves MF et al. (2018) ¿Qué sucede con las paredes del conducto radicular no preparadas?: un análisis correlativo utilizando micro-tomografía computarizada e histología/microscopía electrónica de barrido. International Endodontic Journal 51, 501–8.
- Versiani MA, Leoni GB, Steier L et al. (2013) Estudio de micro-tomografía computarizada de canales de forma ovalada preparados con el archivo autoajustable, Reciproc, WaveOne y sistemas Pro-Taper universales. Journal of Endodontics 39, 1060–6.
- Vogel AI (1978) A textbook of quantitative inorganic analysis including elementary instrumental analysis. 4ª ed. Londres: Longmans, Green and Co., Ltd. p. 925.
- Walton RE (1976) Evaluación histológica de diferentes métodos de ampliación del espacio del conducto pulpar. Journal of Endodontics 2, 304–11.
- Zehnder M (2006) Irrigantes de conducto radicular. Journal of Endodontics 32, 389–98.
- Zuolo ML, Zaia AA, Belladonna FG et al. (2018) Evaluación por micro-CT de la capacidad de conformación de cuatro sistemas de instrumentación de conductos radiculares en canales de forma ovalada. International Endodontic Journal 51, 564–71.
