Eficacia de 3 protocolos de irrigación suplementaria en la eliminación de residuos duros del sistema de conductos radiculares mesiales de molares mandibulares
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Introducción: La instrumentación del sistema de conductos radiculares mesiales de los molares mandibulares puede dificultar la desinfección al empaquetar restos duros de tejido dentro de los isthmus. Se evaluó la eliminación de los restos duros de tejido acumulados (AHTD) mediante 3 sistemas de irrigación suplementarios, 2 activados ultrasonicamente y 1 multisonico, utilizando imágenes de micro–tomografía computarizada.
Métodos: Se seleccionaron veinticuatro molares mandibulares extraídos con 2 conductos mesiales conectados por un istmo y convergiendo a un solo foramen. Después de la preparación de los conductos mesiales con instrumentos WaveOne Gold (Dentsply Maillefer, Ballaigues, Suiza), se asignaron especímenes anatómicamente emparejados a 3 protocolos finales de irrigación (n = 8): ultrasonido intermitente (IU) con un alambre de 200 mm energizado ultrasonicamente (Irrisafe; Satelec, Burdeos, Francia), ultrasonido continuo (CU) con una aguja de irrigación ultrasónica (ProUltra PiezoFlow, Dentsply Maillefer), y el sistema GentleWave (GW) (Sonendo Inc, Laguna Hills, CA). Los especímenes fueron escaneados (SkyScan 1176; Bruker-microCT, Kontich, Bélgica) a un tamaño de píxel de 17.18 mm antes y después de los protocolos de preparación e irrigación. Los conjuntos de datos fueron co-registrados, y se comparó estadísticamente el porcentaje de reducción de AHTD dentro de los conductos y el istmo para cada espécimen utilizando un análisis de varianza de un solo sentido y pruebas post hoc de Tukey con un nivel de significancia del 5%.
Resultados: La reducción porcentual media de AHTD en canales e isthmos fue significativamente mayor para GW (96.4% y 97.9%, respectivamente) que para CU (80.0% y 88.9%, respectivamente) (P ˂ .05). La reducción de AHTD para IU (91.2% y 93.5%, respectivamente) no difirió significativamente de GW y CU (P ˃ .05).
Conclusiones: GW logró una mayor eficacia en la eliminación de AHTD del sistema de conductos radiculares mesiales de los molares mandibulares en comparación con CU, pero no con IU. La eficacia de CU e IU fue comparable. (J Endod 2019;■:1–7.)
La desinfección del conducto radicular, que se realiza rutinariamente utilizando protocolos quimio-mecánicos, puede verse comprometida por la incapacidad de los instrumentos y soluciones antibacterianas para alcanzar áreas del canal inaccesibles. Las ramificaciones apicales, los canales laterales y los isthmos que conectan los conductos radiculares principales han demostrado albergar células bacterianas frecuentemente organizadas en estructuras similares a biofilm. Un isthmo se define como una comunicación estrecha entre 2 canales en la misma raíz que contiene tejido derivado de la pulpa. También se ha descrito como un corredor, una conexión lateral y una anastomosis transversal.
En raíces con isthmos, la instrumentación de los canales principales transporta inadvertidamente desechos de tejido duro hacia los isthmos, donde permanecen compactados a pesar de la abundante irrigación durante y después de la instrumentación. Los desechos de tejido duro acumulados (AHTD) son un efecto secundario indeseable de los procedimientos de desinfección quimio-mecánica porque pueden albergar microorganismos persistentes mientras impiden el acceso a soluciones de irrigación antibacteriana.
Los primeros molares mandibulares son los dientes tratados endodónticamente más frecuentes. Estos dientes presentan frecuentemente configuraciones complejas de conductos radiculares, con comunicaciones de isthmo presentes en el 55% de las raíces mesiales y el 20% de las raíces distales. La incidencia de isthmos es mayor a 3–5 mm del ápice, donde se observó clínicamente durante la cirugía apical en el 83% de las raíces mesiales y el 36% de las raíces distales de los primeros molares mandibulares.
Considerando la alta incidencia de isthmos en el sistema de conductos radiculares y su inaccesibilidad a la instrumentación mecánica, su desinfección depende críticamente de la entrega efectiva de soluciones antibacterianas.
Desde la entrega tradicional con aguja de jeringa hasta los sistemas de agitación asistidos por máquina, los métodos de irrigación se han refinado a lo largo de los años para mejorar la entrega de soluciones de irrigación a áreas mecánicamente inaccesibles del complejo sistema de conductos radiculares. La aplicación de soluciones de irrigación y agitación ultrasónica durante la irrigación activada ultrasónicamente puede ser intermitente o continua.
Mientras que el método de irrigación activada ultrasónicamente continua (CU) se entrega a través de una aguja de irrigación activada ultrasónicamente, la irrigación activada ultrasónicamente intermitente (IU) requiere un instrumento vibrante dentro del conducto y el reabastecimiento de la solución con una jeringa después de cada ciclo de activación.
El sistema GentleWave (GW) (Sonendo Inc, Laguna Hills, CA) es un novedoso dispositivo de desinfección por presión negativa apical que requiere una mínima instrumentación del conducto radicular según el fabricante. El sistema aplica dinámicas de fluidos avanzadas, acústica y química de disolución de tejidos para eliminar tejido, desechos y biopelículas de todo el sistema de conductos radiculares simultáneamente. El dispositivo fue aprobado recientemente para uso clínico en endodoncia, y se justifica una evaluación independiente. Hasta la fecha, solo 1 estudio mostró histológicamente la eficacia del sistema GW en la eliminación de desechos de los istmos de los molares maxilares y mandibulares. Se justifica el uso de métodos de evaluación no destructivos para investigar la capacidad del sistema GW para mejorar la limpieza de los istmos.
Por lo tanto, el objetivo del presente estudio fue evaluar la eficacia del sistema GW en comparación con la irrigación activada ultrasónicamente intermitente y continua en la eliminación de AHTD de los conductos radiculares e isthmos dentro de las raíces mesiales de los molares mandibulares utilizando imágenes de microtomografía computarizada (micro-CT). La hipótesis nula probada fue que no habría diferencia en la reducción de AHTD entre estos 3 protocolos de irrigación suplementarios.
Materiales y métodos
Tamaño de la muestra
El tamaño de la muestra se estimó en base a datos preliminares obtenidos de 5 especímenes. Siguiendo los mismos protocolos de instrumentación e irrigación final que se describen más adelante, 2 especímenes fueron asignados a los grupos GW y CU y 1 espécimen al grupo IU. El tamaño del efecto del grupo IU se estableció a partir del previamente reportado por Leoni et al (1.25). Usando el software G*Power 3.1.9.2
(Heinrich Heine Universität, Düsseldorf, Alemania) para análisis de varianza de un solo sentido y los datos del estudio piloto, una muestra total mínima de 18 especímenes respaldaría el análisis con un poder del 99% y un nivel de significancia del 5% para sustentar estadísticamente las diferencias entre los grupos experimentales. Un total de 24 especímenes fueron incluidos en el análisis final.
Selección de Especímenes
El protocolo del estudio fue aprobado por ambos comités de ética institucional de la Universidad de Toronto y la Universidad de São Paulo (protocolo #35314). Inicialmente, se obtuvieron imágenes de 50 molares mandibulares extraídos con raíces mesiales moderadamente curvadas (10◦–20◦, método de Schneider) en ambas direcciones mesiodistal y buccolingual utilizando un escáner micro-CT (SkyScan 1176; Bruker-microCT, Kontich, Bélgica) a 17.18 mm (tamaño de píxel), 90 kV, 278 mA, rotación de 180◦ alrededor del eje vertical, y un paso de rotación de 0.4◦ utilizando un filtro de aluminio de 0.5 mm de grosor. Las imágenes de proyección adquiridas fueron reconstruidas (NRecon v.1.6.10.4, Bruker-microCT) con una corrección de endurecimiento del haz del 10%, suavizado de 2, corrección de artefactos de anillo de 3, y un coeficiente de atenuación que varía de 0.006 a 0.04, resultando en la adquisición de aproximadamente 550 cortes por raíz. Luego, se seleccionaron 24 dientes que presentaban 2 canales independientes en la raíz mesial conectados por un istmo desde el tercio medio hasta el apical y saliendo en un solo foramen (configuración tipo II de Vertucci). Ninguno de los dientes tenía obturaciones radiculares, caries radiculares, grietas, fracturas, reabsorción interna o externa. Para asegurar una similitud anatómica entre los especímenes, se calcularon la longitud (en mm), el volumen (en mm3), el área de superficie (en mm2), y el Índice de Modelo de Estructura (SMI) de los canales radiculares mesiales antes de los procedimientos experimentales (CTAn v.1.15, Bruker-microCT) (Tabla 1). El volumen de interés se seleccionó extendiéndose desde el nivel de la unión cemento-esmalte hasta el ápice de la raíz mesial establecido por la integración de todas las secciones transversales.
Preparación del Conducto Radicular
Los conductos radiculares mesiales en todos los especímenes fueron preparados por un operador (R.C.) con experiencia en el uso de instrumentos reciprocantes. Después de la preparación de la cavidad de acceso, los conductos mesiales fueron negociados con limas tipo K de tamaño 10 (Dentsply Maillefer, Ballaigues, Suiza), y se verificó la aparición de la punta en el foramen apical bajo un aumento de 10X (Carl Zeiss, Oberkochen, Alemania). La longitud de trabajo (LW) se estableció 0.5 mm antes del foramen. A continuación, el foramen fue sellado cubriendo la punta apical de las raíces mesiales con pegamento caliente para simular un sistema de conducto cerrado. Se estableció un camino de deslizamiento hasta la LW con un instrumento ProGlider (Dentsply Maillefer), y los conductos radiculares se ampliaron secuencialmente con instrumentos WaveOne Gold Small y Primary (Dentsply Maillefer) hasta la LW activados en un movimiento reciprocante (ProMark Endo Motor, Dentsply Maillefer). Para facilitar la acumulación de desechos en el área del istmo, la irrigación y aspiración durante los procedimientos de preparación se realizaron solo a nivel del orificio con un total de 5 mL de agua destilada por conducto utilizando una aguja de irrigación ProRinse Endo de 30-G (Dentsply Maillefer) adaptada a una jeringa de plástico desechable.
Cada canal se secó ligeramente con 1 punto de papel absorbente (WaveOne Small, Dentsply Maillefer), y las muestras se sometieron a un escaneo y análisis adicionales siguiendo los parámetros mencionados anteriormente. Los escaneos postoperatorios se registraron en conjunto con su respectivo conjunto de datos preoperatorios utilizando el módulo de registro afín del software 3D Slicer 4.10 (disponible en http://www.slicer.org), y también se adquirieron parámetros 3D postoperatorios (volumen, área de superficie y SMI) (Tabla 1). Luego, se compararon los modelos de superficie registrados espacialmente de las raíces en cuanto al área no preparada del conducto radicular (Tabla 1) calculada por la fórmula (SAu/SAb)*100, donde SAu representa el área de superficie del canal no preparado y SAb el área de superficie del conducto radicular antes de la preparación, para asegurar la consistencia del protocolo de instrumentación. También se realizó un análisis adicional de las imágenes emparejadas para calcular los desechos de tejido duro acumulados dentro del sistema de conductos radiculares mesiales después de los procedimientos de instrumentación utilizando el software CTAn v.1.15 (Bruker micro-CT).
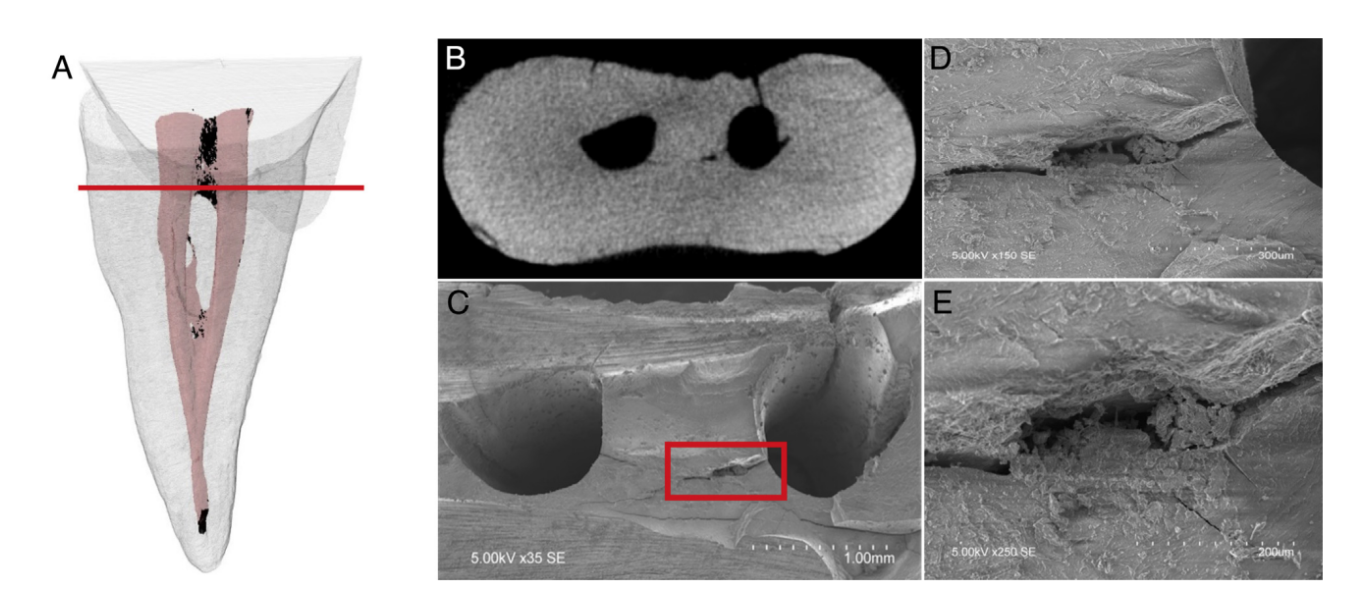
La cuantificación de AHTD se realizó mediante la diferencia entre el espacio del conducto radicular no preparado y el preparado utilizando procedimientos de posprocesamiento. La presencia de un material con densidad similar a la dentina en regiones previamente ocupadas por aire en el espacio del conducto radicular no preparado se consideró escombros y se cuantificó mediante la intersección entre imágenes antes y después de la instrumentación del conducto. El volumen total de AHTD se calculó en milímetros cúbicos (mm3) y se expresó como el porcentaje del volumen total del sistema de conductos y el área del istmo después de la preparación (Tabla 1).
Protocolos de Irrigación Final
Con el objetivo de mejorar la validez interna del experimento, los conductos radiculares mesiales se emparejaron para crear 8 grupos de 3 basados en la morfología del sistema de conductos radiculares (longitud, volumen, área de superficie y SMI), la superficie del conducto no preparado y el volumen porcentual de AHTD después de la preparación. Luego, 1 espécimen de cada grupo se asignó aleatoriamente a 1 de los siguientes 3 grupos experimentales (n = 8) de acuerdo con los protocolos de irrigación final, que siguieron las instrucciones de los fabricantes:
- Grupo 1: IU; un archivo ultrasónico de acero inoxidable de 200 mm sin corte (Irrisafe; Satelec, Burdeos, Francia) accionado por el sistema ultrasónico P5 Newtron (Acteon North America, Mount Laurel, NJ) a una configuración de potencia de 9 se colocó a 2 mm de la longitud de trabajo y se agitó en un movimiento de arriba hacia abajo de 1 a 2 mm. El protocolo final de irrigación comenzó con 6% de NaOCl durante 3 X 20 segundos, seguido de 17% de EDTA durante 3 X 20 segundos y un enjuague final con 6% de hipoclorito de sodio (NaOCl) durante 3 X 20 segundos. La irrigación se realizó a un caudal de 15 mL/min por canal.
- Grupo 2: CU; una aguja de irrigación ultrasónica ProUltra PiezoFlow (ProUltra, Dentsply Maillefer) se conectó al sistema ultrasónico P5 Newtron (Acteon North America) a una configuración de potencia de 9. La aguja de irrigación ultrasónica de 500 mm se posicionó a 1 mm de la unión, no más profunda que el 75% de la longitud de trabajo, y se agitó en un movimiento de arriba hacia abajo de 1 a 2 mm. El protocolo final de irrigación comenzó con 6% de NaOCl, seguido de 17% de EDTA y un enjuague final con 6% de NaOCl. La irrigación se realizó a un caudal de 15 mL/min durante 1 minuto por canal.
- Grupo 3: GW; antes del protocolo final de irrigación, se fabricó una plataforma oclusal de un material de resina (SoundSeal, Sonendo Inc) y una matriz plástica preformada para asegurar un sellado hermético entre la cavidad de acceso y el instrumento de procedimiento. El protocolo final de irrigación comenzó con 3% de NaOCl durante 5 minutos, seguido de agua destilada durante 30 segundos, 8% de EDTA durante 2 minutos y un enjuague final con agua destilada durante 15 segundos a un caudal de 50 mL/min.
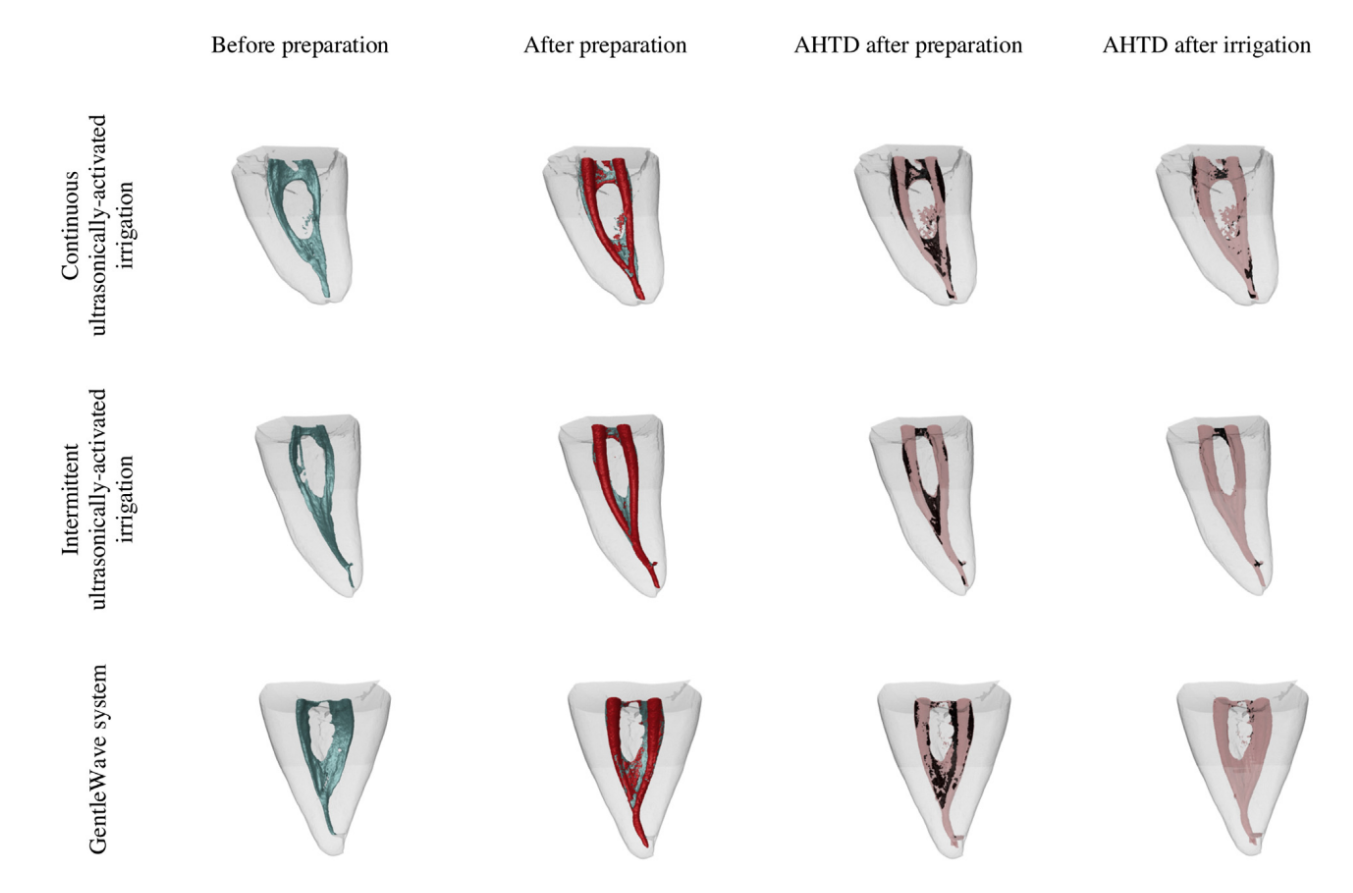
La exploración postirrigación se realizó después de completar los protocolos de irrigación final asignados. Los conjuntos de datos se registraron con sus respectivos contrapartes de postpreparación, y se calculó el porcentaje de reducción de AHTD según la siguiente fórmula: 100 – ([VAF X 100)/VBF), donde VBF y VAF son el volumen de AHTD antes y después del protocolo de irrigación, respectivamente. Un examinador cegado a la asignación del grupo de las muestras realizó todas las mediciones. Modelos de conductos radiculares codificados por colores (colores verde y rojo que indican las superficies del canal pre y postoperatorias, respectivamente) y escombros (en color negro) permitieron la comparación cualitativa de la distribución del AHTD en cada porción de los conductos radiculares antes y después de los procedimientos experimentales.
Microscopía Electrónica de Barrido
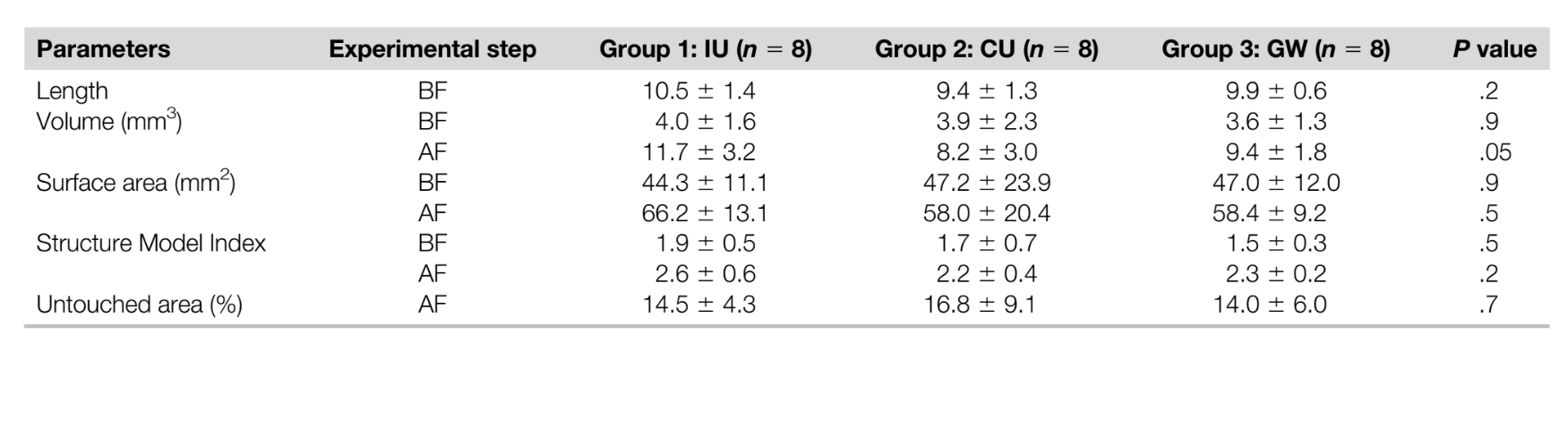
Con el fin de validar el método, después de las exploraciones postirrigación, se examinaron secciones transversales axiales en los tercios coronal, medio y apical de la raíz de 2 muestras seleccionadas al azar bajo microscopía electrónica de barrido ambiental (S-3400N; Hitachi, Tokio, Japón) hasta 420X de magnificación para corroborar la presencia de escombros en las áreas de istmo después del protocolo de irrigación final (Fig. 1A–E). En resumen, después de la remoción de las raíces distales a nivel de la unión cemento-esmalte, se cortaron surcos en las raíces mesiales con un disco recubierto de diamante cerca de, pero sin exponer, los canales y áreas de istmo en niveles predeterminados de las correspondientes exploraciones micro-CT donde estaba presente AHTD residual. Las muestras se dividieron horizontalmente con un cincel afilado y un mazo. Las muestras no procesadas se imagaron a un voltaje de aceleración de 5 kV y a una distancia de trabajo de 15 mm.
Análisis Estadístico
Se evaluó la distribución normal de los datos, y la morfología tridimensional de los conductos radiculares (longitud, volumen, área superficial y SMI), superficie del canal no tocada y porcentaje de AHTD después de los protocolos de preparación e irrigación se expresaron como la media y la desviación estándar y se compararon entre grupos utilizando un análisis de varianza de un solo factor y pruebas post hoc de Tukey con un nivel de significancia del 5%.
Resultados
El grado de homogeneidad de los 3 grupos experimentales se confirmó respecto a los parámetros morfológicos pre y postoperatorios (longitud del canal, volumen, área superficial y SMI), superficie del canal no preparada y el volumen de AHTD después de la preparación del canal (Tabla 1, P . .05). La observación cualitativa de las imágenes de microscopía electrónica de barrido correspondió bien a las áreas radiopacas dentro de los istmos y el AHTD representado en la reconstrucción tridimensional de micro-CT del mismo espécimen (Fig. 1).
Los protocolos de irrigación suplementaria redujeron considerablemente el AHTD en todos los grupos (Tabla 2); sin embargo, el porcentaje medio de reducción de AHTD fue significativamente mayor para GW en los canales (96.4%) y en las áreas del istmo (97.9%) en comparación con CU (80.0% y 88.9%, respectivamente) (P , .05). Por otro lado, la reducción de AHTD para IU en los canales y en las áreas del istmo (91.2% y 93.5%, respectivamente) no difirió significativamente de GW y CU (P . .05) (Tabla 2, Fig. 2). La mayor parte del AHTD residual después de la irrigación final se localizó en los tercios coronal y apical de los conductos radiculares en todos los grupos (Fig. 2).
Discusión
La periodontitis apical es una enfermedad mediada por biofilm, y la incapacidad de impactar en los biofilms dentro de áreas del sistema de conductos radiculares que son inaccesibles a los protocolos convencionales de desinfección quimio-mecánica puede comprometer los resultados del tratamiento. La búsqueda de una mayor eficacia en la desinfección en el complejo sistema de conductos radiculares ha estado enfocándose en los efectos dentro de las áreas del istmo como un posible objetivo para la erradicación de biofilms en los últimos años. Se han identificado bacterias con flora polimicrobiana organizadas como biofilms dentro de las áreas del istmo de los primeros molares mandibulares humanos, tanto inmediatamente después de completar el tratamiento endodóntico en una sola visita como en un diente asociado con periodontitis apical postratamiento. Este estudio evaluó la capacidad de los protocolos de desinfección de conductos radiculares para eliminar restos de tejido duro de irregularidades y istmos de conductos no instrumentados como indicación de posible acceso a biofilms dentro de estas áreas bastante inaccesibles.
El diseño experimental utilizado aquí tuvo como objetivo evaluar las propiedades de irrigación de los dispositivos de irrigación probados bajo condiciones estandarizadas, desestimando así las pautas de aplicación clínica seleccionadas.
En consecuencia, aunque el fabricante de GW recomienda la instrumentación del canal hasta solo el tamaño 20/.06, en este estudio todos los canales mesiales fueron instrumentados hasta el tamaño 25/.07 con una irrigación mínima para estandarizar el volumen y el patrón de distribución de AHTD. Además, de acuerdo con una metodología previamente establecida, se utilizaron en secuencia los instrumentos reciprocantes Small y Primary WaveOne Gold para producir cantidades suficientes de AHTD que permitirán cuantificar su eficacia de eliminación. El volumen de AHTD producido, aproximadamente el 15% del volumen total del canal, fue comparable con el 19% reportado en un estudio anterior en el que se utilizaron los instrumentos reciprocantes WaveOne.
En la presente investigación, la reducción de AHTD difirió significativamente entre los protocolos de irrigación final probados; por lo tanto, se rechazó la hipótesis nula. El sistema GW eliminó AHTD en un 96.4% dentro de los canales radiculares mesiales y en un 97.9% dentro de las áreas del istmo. Estos resultados apoyaron la eficacia de GW en la limpieza del complejo sistema de conductos radiculares en los canales mesiales de los molares. El grupo IU redujo AHTD en un 91.2% y un 93.5% de los canales y áreas del istmo, respectivamente. Su eficacia fue estadísticamente comparable con el sistema GW y pareció superior a la reportada en estudios previos de micro-CT en los que pasos de irrigación secuenciales similares mostraron una reducción del 50.8% y 55.6%, respectivamente. La mayor eficacia de IU reportada en el presente estudio podría atribuirse a la configuración de mayor potencia de activación en este estudio en comparación con los anteriores. En contraste, el grupo CU mostró la menor reducción de AHTD a pesar de su eficacia comparable con IU, lo cual está de acuerdo con informes previos. Sin embargo, fue inferior a la de GW. Una limitación del presente estudio es el uso de una secuencia de solución de irrigación diferente en los grupos experimentales de irrigación activada ultrasonicamente en comparación con el grupo GW.
Aunque su significado clínico aún debe ser elucidado, se ha observado erosión de la dentina in vitro cuando se utiliza NaOCl como solución de irrigación final después de los agentes desmineralizantes. El uso de NaOCl como enjuague final en los grupos de irrigación activados ultrasonicamente podría haber creado potencialmente paredes de conductos radiculares más limpias con menos residuos de dentina al permitir una penetración más profunda de NaOCl en áreas previamente cubiertas por la capa de smear.
Aunque la eficacia de eliminación de AHTD fue comparable para el sistema GW y IU, se sugirió previamente que la mayor penetración de la irrigación proporcionada por el sistema GW en comparación con los sistemas de irrigación activados ultrasonicamente. Los dispositivos de irrigación ultrasónica dependen de la transmisión de energía acústica de un archivo oscilante en el que el movimiento del archivo probablemente se vea obstaculizado a medida que el conducto radicular se estrecha hacia la porción apical. En contraste, el sistema GW utiliza un amplio espectro de ondas sonoras para distribuir fluidos a lo largo de todo el sistema de conductos radiculares. En comparación con la energía ultrasónica que se dispersa a una sola frecuencia, la energía multisonica emitida por el sistema GW permite una entrega efectiva de irrigación energizada en túbulos dentinarios de tamaño micrométrico a una alta tasa de flujo. La interacción entre el flujo continuo de la solución de irrigación y el fluido estacionario dentro de la cámara pulpar crea una fuerte fuerza de corte que induce una nube de cavitación. La implosión de las burbujas de cavitación genera energía multisonica producida por un amplio espectro de ondas acústicas, así como un flujo acústico con un patrón de flujo vórtice. Los efectos hidrodinámicos se ven aún más mejorados por el uso de fluidos de irrigación desgasificados, que pueden minimizar la pérdida de energía y optimizar la entrega de fluidos a lo largo de todo el sistema de conductos radiculares.
Aunque las implicaciones clínicas de AHTD siguen siendo desconocidas, se ha demostrado que los desechos de dentina alteran significativamente la eficacia biológica de los desinfectantes intracanal. Además, los desechos de dentina exhiben efectos inhibitorios sobre las soluciones de irrigación comúnmente utilizadas al disminuir el cloro libre disponible y las propiedades antibacterianas del NaOCl.
Además, AHTD puede proteger a los microorganismos obstruidos en áreas inaccesibles al proporcionar una barrera espacial entre las bacterias y la irrigación antimicrobiana.
AHTD también puede interferir con el sellado proporcionado por el relleno radicular. Las preocupaciones potenciales mencionadas anteriormente destacan la necesidad de desarrollar medidas para prevenir y interrumpir AHTD para mejorar el acceso a los biofilms dentro de áreas inaccesibles del sistema de conductos radiculares en la búsqueda de mejorar el pronóstico a largo plazo. Se justifica una mayor investigación para definir la relación entre los desechos de tejido duro y los biofilms. Con un mayor refinamiento metodológico en la imagenología de micro-CT, los estudios futuros también deberían tener como objetivo la imagen y cuantificación de biofilms dentro del sistema de conductos radiculares.
Conclusión
Dentro de las limitaciones de este estudio in vitro, ninguno de los protocolos de irrigación probados fue capaz de dejar libres de restos de dentina los conductos radiculares mesiales y las áreas de istmo de los molares mandibulares. El sistema GW mostró mejor eficacia en la eliminación de AHTD de los conductos mesiales y las áreas de istmo en comparación con CU, pero no con IU. La eficacia de los sistemas de irrigación IU y CU fue comparable.
Autores: Rebecca Chan, Marco A. Versiani, Shimon Friedman, Gevik Malkhassian, Manoel D. Sousa-Neto, Graziela B. Leoni, Yara T.C. Silva-Sousa, Bettina Basrani
Referencias:
- Byström A, Sundqvist G. Evaluación bacteriológica del efecto del hipoclorito de sodio al 0.5 por ciento en la terapia endodóntica. Oral Surg Oral Med Oral Pathol 1983;55:307–12.
- Nair PN, Henry S, Cano V, Vera J. Estado microbiano del sistema de conductos radiculares apicales de molares mandibulares humanos con periodontitis apical primaria después de un tratamiento endodóntico de "una visita". Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005;99:231–52.
- Ricucci D, Siqueira Jr JF. Biofilms y periodontitis apical: estudio de prevalencia y asociación con hallazgos clínicos e histopatológicos. J Endod 2010;36:1277–88.
- Carr GB, Schwartz RS, Schaudinn C, et al. Examen ultrastructural de la re-tratamiento fallido de molares con periodontitis apical secundaria: un examen de biofilms endodónticos en un fracaso de re-tratamiento endodóntico. J Endod 2009;35:1303–9.
- Weller RN, Niemczyk SP, Kim S. Incidencia y posición del istmo del conducto. Parte 1. Raíz mesiobucal del primer molar maxilar. J Endod 1995;21:380–3.
- Green D. Doble conductos en raíces únicas. Oral Surg Oral Med Oral Pathol 1973;35:689–96.
- Piñeda F, Kuttler Y. Investigación roentgenográfica mesiodistal y bucolingual de 7,275 conductos radiculares. Oral Surg Oral Med Oral Pathol 1972;33:101–10.
- Vertucci FJ. Anatomía del conducto radicular de los dientes permanentes humanos. Oral Surg Oral Med Oral Pathol 1984;58:589–99.
- Paqué F, Laib A, Gautschi H, Zehnder M. Análisis de acumulación de restos de tejido duro mediante escaneos de tomografía computarizada de alta resolución. J Endod 2009;35:1044–7.
- Paqué F, Boessler C, Zehnder M. Niveles acumulados de restos de tejido duro en raíces mesiales de molares mandibulares después de pasos de irrigación secuenciales. Int Endod J 2011;44:148–53.
- Wayman BE, Patten JA, Dazey SE. Frecuencia relativa de dientes que necesitan tratamiento endodóntico en 3350 pacientes endodónticos consecutivos. J Endod 1994;20:399–401.
- de Pablo OV, Estevez R, Peix Sanchez M, et al. Anatomía radicular y configuración del conducto del primer molar mandibular permanente: una revisión sistemática. J Endod 2010;36:1919–31.
- Teixeira FB, Sano CL, Gomes BP, et al. Un estudio preliminar in vitro de la incidencia y posición del istmo del conducto radicular en molares maxilares y mandibulares. Int Endod J 2003;36:276–80.
- von Arx T. Frecuencia y tipo de istmos del conducto en primeros molares detectados por inspección endoscópica durante cirugía perirradicular. Int Endod J 2005;38:160–8.
- Cameron JA. El efecto de la endodoncia ultrasónica en la temperatura de la pared del conducto radicular. J Endod 1988;14:554–9.
- Charara K, Friedman S, Sherman A, et al. Evaluación de la extrusión apical durante la irrigación del conducto radicular con el novedoso sistema GentleWave en un entorno apical simulado. J Endod 2016;42:135–9.
- Haapasalo M, Shen Y, Wang Z, et al. Presión apical creada durante la irrigación con el sistema GentleWave en comparación con la irrigación convencional con jeringa. Clin Oral Investig 2016;20:1525–34.
- Haapasalo M, Wang Z, Shen Y, et al. Disolución de tejido por un novedoso sistema de ultralimpieza multisonico y hipoclorito de sodio. J Endod 2014;40:1178–81.
- Molina B, Glickman G, Vandrangi P, Khakpour M. Evaluación de la limpieza del conducto radicular de molares humanos utilizando el sistema GentleWave. J Endod 2015;41:1701–5.
- Leoni GB, Versiani MA, Silva-Sousa YT, et al. Evaluación ex vivo de cuatro protocolos de irrigación final sobre la eliminación de restos de tejido duro del sistema de conductos radiculares mesiales de los primeros molares mandibulares. Int Endod J 2016;50:398–406.
- Schneider SW. Una comparación de las preparaciones de conductos en conductos radiculares rectos y curvados. Oral Surg Oral Med Oral Pathol 1971;32:271–5.
- Nair PN. Estudios microscópicos de luz y electrones de la flora del conducto radicular y lesiones periapicales. J Endod 1987;13:29–39.
- Robinson JP, Lumley PJ, Cooper PR, et al. La técnica de conducto radicular reciprocante induce una mayor acumulación de restos que una técnica rotativa continua según lo evaluado por tomografía micro-computada tridimensional. J Endod 2013;39:1067–70.
- Freire LG, Iglecias EF, Cunha RS, et al. Evaluación micro-tomográfica computarizada de la eliminación de restos de tejido duro después de diferentes métodos de irrigación y su influencia en el llenado de conductos curvados. J Endod 2015;41:1660–6.
- van der Sluis L, Wu MK, Wesselink P. Comparación de 2 métodos de enjuague utilizados durante la irrigación ultrasónica pasiva del conducto radicular. Quintessence Int 2009;40:875–9.
- Tanomaru FM, Torres FF, Chavez-Andrade GM, et al. Irrigación activada ultrasónicamente intermitente o continua: evaluación micro-tomográfica computarizada de la limpieza del sistema de conductos radiculares. Clin Oral Investig 2016;20:1541–6.
- Vandrangi P. Evaluación de la profundidad de penetración de fluidos de tratamiento en los túbulos dentinarios utilizando el sistema GentleWave. Dentistry 2016;6:366.
- van der Sluis LW, Versluis M, Wu MK, Wesselink PR. Irrigación ultrasónica pasiva del conducto radicular: una revisión de la literatura. Int Endod J 2007;40:415–26.
- Walmsley AD, Williams AR. Efectos de la restricción en el patrón oscilatorio de los archivos endosónicos. J Endod 1989;15:189–94.
- Ahmad M, Pitt Ford TJ, Crum LA. Desbridamiento ultrasónico de conductos radiculares: corriente acústica y su posible papel. J Endod 1987;13:490–9.
- Haapasalo HK, Siren EK, Waltimo TM, et al. Inactivación de medicamentos locales de conducto radicular por la dentina: un estudio in vitro. Int Endod J 2000;33:126–31.
- Portenier I, Haapasalo H, Rye A, et al. Inactivación de medicamentos de conducto radicular por dentina, hidroxiapatita y albúmina de suero bovino. Int Endod J 2001;34:184–8.
- Arias-Moliz MT, Morago A, Ordinola-Zapata R, et al. Efectos de los restos de dentina en las propiedades antimicrobianas del hipoclorito de sodio y el ácido etidrónico. J Endod 2016;42:771–5.
- Paqué F, Rechenberg DK, Zehnder M. Reducción de la acumulación de restos de tejido duro durante la instrumentación rotativa del conducto radicular por ácido etidrónico en un irrigante de hipoclorito de sodio. J Endod 2012;38:692–5.
- Endal U, Shen Y, Knut A, et al. Un estudio tomográfico computarizado de alta resolución de los cambios en el área del istmo del conducto radicular por instrumentación y llenado radicular. J Endod 2011;37:223–7.
