Pasos Adicionales para la Desinfección del Sistema de Conductos Radiculares del Molar Mandibular: Un Enfoque Correlativo de Bacteriología, Microtomografía Computarizada y Criopulverización
Traducción automática
El artículo original está escrito en idioma EN (enlace para leerlo) .
Resumen
Introducción: Este estudio evaluó la capacidad desinfectante de la preparación quimio-mecánica con instrumentos rotatorios de níquel-titanio, seguida de 2 procedimientos adyuvantes distintos en los conductos radiculares de molares mandibulares extraídos mediante un enfoque analítico correlativo.
Métodos: Se seleccionaron veintidós molares mandibulares extraídos y se emparejaron anatómicamente entre grupos sobre la base de un análisis micro-tomográfico computarizado. En la primera fase del experimento, los conductos radiculares fueron contaminados con Enterococcus faecalis y sometidos a preparación quimio-mecánica con instrumentos BT RaCe y riego con NaOCl al 2.5%. Luego, se utilizó el instrumento XP-Endo Finisher o riego ultrasónico pasivo para complementar la desinfección. Se utilizó micro-tomografía computarizada para mostrar si el porcentaje de áreas no preparadas se correlacionaba con los recuentos bacterianos. En la segunda fase, los mismos dientes fueron contaminados una vez más, y se utilizaron los procedimientos adyuvantes. Se obtuvieron muestras del área del istmo de las raíces mesiales y del fragmento apical de 5 mm de las raíces distales mediante criopulverización. Las muestras tomadas antes y después de los pasos de tratamiento en ambas fases fueron evaluadas mediante reacción en cadena de la polimerasa cuantitativa y analizadas estadísticamente.
Resultados: En la fase 1, la preparación en ambos grupos resultó en una disminución sustancial de los recuentos bacterianos (P < .001). Los enfoques adyuvantes llevaron a una reducción bacteriana adicional pequeña, que fue significativa para XP-Endo Finisher (P < .05). No se observaron diferencias significativas entre los grupos para los recuentos bacterianos persistentes. El análisis correlativo no reveló ninguna relación estadísticamente significativa entre la reducción bacteriana y el porcentaje de áreas no preparadas (P > .05). En la fase 2, ambos métodos tuvieron efectos antibacterianos significativos en el canal principal, pero ninguno de ellos pudo desinfectar de manera predecible las áreas del istmo/receso.
Conclusiones: Tanto XP-Endo Finisher como la irrigación ultrasónica pasiva exhibieron efectividad antibacteriana, pero solo el primero causó una reducción significativa en los recuentos bacterianos después de la preparación quimio-mecánica. Ninguno de ellos fue efectivo en desinfectar de manera predecible las áreas del istmo/receso. (J Endod 2016;42:1667–1672).
Independientemente de las técnicas de instrumentación, instrumentos y irrigantes, una limpieza, desinfección y conformación exhaustivas del conducto radicular no se han logrado comúnmente, especialmente en dientes con conductos curvados o anatomías inusuales. Estudios que utilizaron tecnología de imagen de microtomografía computarizada de alta resolución (micro-CT) han demostrado que entre el 11% y el 48% de las áreas principales del conducto radicular permanecen sin tocar después de la instrumentación. Estas áreas pueden ser colonizadas por biofilms que tienen el potencial de permanecer sin afectar y poner en riesgo el resultado del tratamiento. Además, ciertas complejidades anatómicas del sistema de conductos radiculares, como ramificaciones, recesos e istmos, no son comúnmente alcanzadas por instrumentos e irrigantes. Las bacterias ubicadas en estas áreas pueden persistir y llevar a una periodontitis apical persistente. De hecho, estudios bacteriológicos clínicos han demostrado que las bacterias aún se detectan en aproximadamente el 30%–60% de los conductos después de la preparación quimio-mecánica. Las bacterias que persisten en el conducto son el factor de riesgo más importante para la periodontitis apical post-tratamiento. Se han realizado esfuerzos para desarrollar enfoques adyuvantes que mejoren la desinfección del conducto radicular. Esto implica enfoques que dirigen los irrigantes a áreas de difícil acceso o permiten que el instrumento alcance y desbridar mecánicamente regiones no afectadas. Uno de estos enfoques adyuvantes es la irrigación ultrasónica pasiva (PUI), que comprende la activación ultrasónica de un irrigante. Los datos de estudios in vitro e in vivo que evalúan los beneficios en términos de efectos antibacterianos del enfoque adyuvante PUI con NaOCl han sido inconclusos.
El XP-Endo Finisher (FKG Dentaire, La Chaux-de-Fonds, Suiza) fue recientemente introducido con la promesa de mejorar la limpieza y desinfección del conducto radicular. Este es un instrumento de tamaño 25 no cónico hecho de aleación de níquel-titanio (NiTi) MaxWire (Martensita-Austenita Electropolish FleX). A temperatura ambiente, el instrumento es recto en su fase martensita, pero a temperatura corporal cambia a la fase austenita y desarrolla una forma de cuchara; cuando se rota y se mueve hacia arriba y hacia abajo en el canal, esta forma hace que el instrumento se expanda y contraiga para tocar las paredes del canal y agitar la solución irrigante. Un estudio reciente mostró que el XP-Endo Finisher y PUI lograron reducir significativamente los niveles de residuos de tejido duro en el sistema del conducto radicular mesial en comparación con la irrigación convencional y un protocolo modificado del sistema de archivo autoadaptable. Hasta ahora, solo 1 estudio ha investigado los beneficios antibacterianos del uso del XP-Endo Finisher y reportó mejores resultados que la irrigación convencional. Ningún estudio ha evaluado los efectos antibacterianos de este instrumento después de los procedimientos quimio-mecánicos.
El presente estudio tuvo como objetivo evaluar la capacidad desinfectante y de conformación de la preparación quimio-mecánica con instrumentos rotatorios de NiTi, seguida de 2 enfoques adyuvantes distintos en los conductos radiculares de molares mandibulares extraídos mediante un análisis bacteriológico y micro-CT correlativo. Se utilizó un enfoque de criopulverización para evaluar las condiciones bacteriológicas de las áreas del istmo y los recesos después del uso de instrumentos XP-Endo Finisher o procedimientos adyuvantes PUI.
Materiales y Métodos
Selección y Preparación de Dientes
El protocolo del estudio fue aprobado por el Comité de Ética de la Universidad Estácio de Sá, Río de Janeiro, RJ, Brasil. Se seleccionaron veintidós molares mandibulares extraídos con 2 conductos independientes unidos apicalmente por un istmo en la raíz mesial (tipo II de Vertucci) y un único conducto distal (tipo I de Vertucci) de una colección de 185 molares mandibulares, basándose en radiografías tomadas en direcciones bucolingual y mesiodistal, exploración con limas pequeñas después de la preparación de acceso, y imágenes de micro-CT utilizando un escáner SkyScan 1174v2 (Bruker-microCT, Kontich, Bélgica) operado a 50 Kv, 800 mA, resolución isotrópica de 19.86 mm, y rotación de 180◦ alrededor del eje vertical con un paso de rotación de 1.0 utilizando un filtro de aluminio de 0.5 mm de grosor.
Las imágenes de cada espécimen se reconstruyeron con una corrección de artefacto de anillo de 5, una corrección de endurecimiento del haz del 15% y un suavizado de 5 (NRecon v.1.6.9.16; Bruker-microCT). Se utilizó el software CTAn v.1.14.4 (Bruker-microCT) para la evaluación tridimensional (3D) del conducto radicular en cuanto a volumen y área de superficie, y se utilizó el software CTVol v.2.2.1 (Bruker-microCT) para la visualización y evaluación cualitativa de la configuración del sistema de conductos radiculares. Los especímenes se emparejaron en función de los aspectos morfológicos y anatómicos de los sistemas de conductos radiculares mesial y distal, evaluados por micro-CT, y 1 espécimen de cada par se asignó aleatoriamente a 1 de los 2 grupos experimentales.
Los conductos radiculares se exploraron con limas K manuales #15 hasta que la punta del instrumento alcanzó el foramen apical, como se visualizó mediante un estereomicroscopio. Esta medida se registró como la longitud de patencia, y los conductos se ampliaron inicialmente hasta este punto utilizando el instrumento BioRaCe BR2 (25/04) (FKG Dentaire) operado en el motor VDW Gold (VDW, Múnich, Alemania) a 300 rpm, 1.5 N • cm, para estandarizar el diámetro inicial del conducto y crear espacio para la contaminación bacteriana. La capa de lodo se eliminó utilizando irrigación con 17% de EDTA y 2.5% de NaOCl. El NaOCl se inactivó con 5% de tiosulfato de sodio. Los dientes se escanearon nuevamente en micro-CT utilizando los parámetros mencionados anteriormente, y los conjuntos de datos obtenidos se utilizaron como base para la comparación con las imágenes post-preparación.
Fase 1
Para la contaminación, los conductos radiculares se llenaron con caldo de soya tripticasa (Difco, Detroit, MI) utilizando agujas Navitip (Ultradent Products Inc, South Jordan, UT) hasta que el caldo fluyera a través del foramen apical. Los dientes se colocaron en un frasco que contenía 50 mL de caldo de soya tripticasa y se sometieron a ultrasonido durante 1 minuto para liberar el aire atrapado y permitir la penetración del medio de cultivo en las irregularidades del conducto radicular. A continuación, los dientes se esterilizaron en un autoclave. Se utilizó un cultivo fresco de Enterococcus faecalis ATCC 29212 cultivado durante 24 horas a 37◦C como inóculo para la contaminación del conducto radicular. Los dientes se incubaron durante 30 días a 37◦C bajo agitación suave, y el medio de cultivo se reponía cada semana. Más tarde, todos los dientes contaminados tuvieron el exceso de medio de cultivo goteado, y sus superficies radiculares externas se limpiaron con gasas estériles. Dos dientes se fijaron en formalina tamponada al 10% y se procesaron para microscopía electrónica de barrido (SEM) para confirmar la colonización bacteriana como se describió en otros lugares.
Los forámenes apicales de cada raíz fueron sellados con Topdam (FGM, Joinville, SC, Brasil) para prevenir la filtración bacteriana apical y crear un sistema de extremo cerrado. Antes de la preparación del conducto radicular, las superficies externas de la raíz fueron limpiadas con peróxido de hidrógeno al 3% y desinfectadas con NaOCl al 2.5%, seguido de la inactivación de este último con tiosulfato de sodio al 5%. Los dientes fueron montados verticalmente hasta la región cervical en bloques hechos de material de impresión de silicona (President Jet; Coltène AG, Cuyahoga Falls, OH). La corona del diente, incluyendo las paredes de la cámara pulpar, y la superficie de silicona fueron desinfectadas con NaOCl al 2.5%, seguido de la inactivación de esta sustancia con tiosulfato de sodio al 5%. Se tomaron muestras del conducto radicular utilizando puntos de papel antes (P1S1) y después de la preparación quimomecánica (P1S2) y después del enfoque adjunto (P1S3) (Fig. 1A). El conducto radicular fue enjuagado con 1 mL de solución salina estéril al 0.85% para eliminar células no adheridas, y se utilizaron secuencialmente de 3 a 5 puntos de papel estériles a la longitud de trabajo (WL), que se estableció a 0.5 mm de la longitud de patencia. Cada punto de papel permaneció en el canal durante 1 minuto. Los puntos de papel fueron transferidos a tubos que contenían 1 mL de tampón Tris-EDTA (10 mmol/L Tris-HCl, 1 mmol/L EDTA, pH 7.6) y congelados a –20◦C. En la raíz mesial, se tomaron muestras de cada canal, pero se agruparon para análisis bacteriológicos posteriores porque los 2 canales se fusionaron en 1 en la porción apical. Los canales fueron preparados a la WL utilizando el sistema BT RaCe (FKG Dentaire), operado en el motor VDW Gold a 600 rpm, 1.5 N • cm, hasta el instrumento BT3. La irrigación se llevó a cabo utilizando NaOCl al 2.5% administrado por agujas Navitip llevadas hasta 2 mm por debajo de la WL (Fig. 1A). Durante la instrumentación de los canales mesiales, el orificio del canal distal fue sellado con Topdam (y viceversa) para evitar la filtración de irrigantes en él. Después de la preparación apical, el canal fue irrigado con NaOCl, EDTA (para la eliminación de la capa de lodo), y luego NaOCl nuevamente (Fig. 1A). Después de la inactivación de NaOCl con tiosulfato de sodio al 5%, se tomó la muestra P1S2 como se describió anteriormente, y los dientes de cada grupo fueron sometidos a procedimientos adjuntos de PUI o XP-Endo Finisher como sigue.
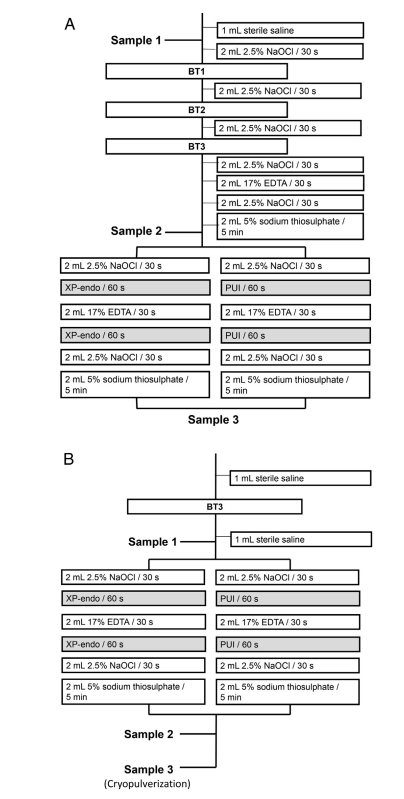
PUI.
Los conductos radiculares fueron irrigados con 2 mL de NaOCl al 2.5%, que fue activado ultrasonicamente en el conducto durante 1 minuto utilizando el dispositivo EndoUltra (Vista Dental Products, Racine, WI), con la punta de la sonda colocada 1 mm por debajo de la longitud de trabajo (WL). Los conductos fueron irrigados con 2 mL de EDTA, que fue activado ultrasonicamente de la misma manera que antes, seguido de un enjuague final con NaOCl al 2.5%. Finalmente, el NaOCl fue inactivado con 2 mL de tiosulfato de sodio al 5%, y se tomó una muestra P1S3.
Instrumento XP-Endo Finisher.
El XP-Endo Finisher se operó hasta el WL durante 1 minuto después de la irrigación con 2 mL de NaOCl al 2.5%. El instrumento se acopló al motor VDW Gold a 800 rpm, 1 N • cm, con movimientos lentos hacia arriba y hacia abajo de 7 a 8 mm de longitud. Luego, los conductos radiculares se irrigaron con EDTA al 17%, y se utilizó nuevamente el XP-Endo. Después de las irrigaciones finales con NaOCl al 2.5% y tiosulfato de sodio, se tomó la muestra P1S3.
Se utilizó el mismo volumen final de irrigantes por grupo, con 14 mL de NaOCl por canal. En ambos grupos, los irrigantes se precalentaron a 37◦C para los procedimientos intracanal, que se llevaron a cabo a 37◦C dentro de un gabinete que contenía un calentador (800-Heater; PlasLabs, Lansing, MI).
Las muestras se esterilizaron en autoclave y se sometieron a una nueva exploración por micro-CT utilizando los parámetros de configuración mencionados. Se generaron modelos 3D codificados por colores de los canales mesiales preoperatorios y postoperatorios (CTVol v.2.2.1; Bruker-microCT) y se co-registraron con sus respectivos conjuntos de datos preoperatorios (verde y rojo indican las superficies de los canales preoperatorios y postoperatorios, respectivamente) utilizando el módulo de registro rígido del software 3D Slicer 4.3.1 (disponible en http://www.slicer.org), con una precisión mayor a 1 voxel. Luego, se examinaron las imágenes emparejadas para calcular el volumen (mm3) y el área de superficie (mm2) del sistema de conductos radiculares mesiales antes y después de la preparación utilizando el software CTAn v.1.14.4 (Bruker micro-CT). El área de la superficie del canal no tocada se determinó calculando el número de voxeles estáticos y se expresó como un porcentaje del número total de voxeles presentes en la superficie del canal.
Fase 2
Los mismos especímenes dentales de la fase 1 se utilizaron en la segunda fase del experimento. Dieciocho dientes aún estaban disponibles. Esta segunda fase se llevó a cabo para aumentar el número de dientes con canales positivos para bacterias antes de la aplicación de los enfoques adyuvantes, lo que permite una comparación estadística más robusta. Además, fue posible probar ambos enfoques contra cargas bacterianas iniciales más controladas. Finalmente, se incluyó la evaluación de los efectos del enfoque adyuvante aislado en las áreas de istmo en este segundo experimento.
Los dientes fueron esterilizados en autoclave, contaminados y montados como se describió en la fase 1. A continuación, los conductos radiculares se enjuagaron con 1 mL de solución salina e instrumentados una vez más con un instrumento BT3 para reducir ligeramente la carga bacteriana inicial. Se tomó P2S1 como en la fase 1. Cada canal se irrigó con 2 mL de NaOCl al 2.5%, y se utilizó el instrumento XP-Endo Finisher o PUI como se describió anteriormente (Fig. 1B). Después de la irrigación con EDTA, se realizaron nuevamente los enfoques adyuvantes, y luego el canal se irrigó con NaOCl y tiosulfato de sodio. Se recogió la muestra P2S2.
Sobre la base de las imágenes de micro-CT de la sección transversal del conducto radicular, se estableció la posición del istmo en la raíz mesial, y las muestras se cortaron utilizando discos de diamante estériles de doble cara para generar fragmentos de raíz que contenían el istmo para su análisis. Las raíces distales tenían un solo canal aplanado que contenía recesos y se seccionaron a 5 mm del ápice. Los fragmentos de raíz correspondientes al área del istmo de la raíz mesial y la parte apical de la raíz distal tuvieron sus superficies externas limpiadas con peróxido de hidrógeno al 3% y desinfectadas con NaOCl al 2.5%, que fue inactivado posteriormente con tiosulfato de sodio. En secuencia, las superficies externas de la raíz fueron muestreadas utilizando un punto de papel estéril #80 humedecido con un tampón de Tris-EDTA. Esta muestra sirvió como control de esterilidad y fue evaluada mediante un ensayo de reacción en cadena de la polimerasa cuantitativa en tiempo real (qPCR). Estos procedimientos de desinfección y muestreo de control se llevaron a cabo bajo un microscopio operativo. Se utilizó un molino de congelación 6750 (Spex, Metuchen, NJ) operado a la temperatura del nitrógeno líquido para moler criogénicamente cada fragmento de raíz como se describió en otro lugar. Después de la molienda, las muestras de polvo de raíz apical (P2S3) se suspendieron en un tampón de Tris-EDTA y se almacenaron a –20◦C.
Extracción de ADN y ensayo de qPCR
Se extrajo ADN de las muestras de ambas fases experimentales y se utilizó como plantilla para la cuantificación de células de E. faecalis mediante un ensayo de qPCR dirigido al gen del ARNr 16S. Los pasos de extracción de ADN y qPCR, controles y condiciones se describieron previamente. Todas las mediciones se realizaron por triplicado.
Análisis Estadístico
Se utilizó la prueba de rangos con pares emparejados de Wilcoxon para comparar la reducción intragrupal en los recuentos bacterianos de P1S1/P2S1 a P1S2/P2S2, de P1S1/P2S1 a P1S3/P2S3, y de P1S2/P2S2 a P1S3/P2S3. Las muestras iniciales (P1S1/P2S1) se compararon entre grupos utilizando la prueba no paramétrica de Mann-Whitney U, que no reveló diferencias significativas entre ellas (P> .05). Por lo tanto, se utilizó la misma prueba para comparar los recuentos en las muestras P1S2/P2S2 y P1S3/P2S3 entre grupos. Inicialmente, se realizaron análisis para las raíces mesiales y distales por separado. Dado que no hubo diferencias significativas entre los canales mesiales y distales, también se recopilaron datos para aumentar la robustez del análisis estadístico. Se utilizó el análisis de correlación de Pearson para verificar las relaciones entre la reducción bacteriana y el porcentaje de áreas no preparadas. Los análisis estadísticos se realizaron con STATISTICA versión 8 (StatSoft, Tulsa, OK) con un nivel de significancia establecido en el 5%.
Resultados
El análisis SEM reveló que E. faecalis colonizó las paredes del conducto radicular, formando generalmente estructuras similares a biofilm (datos no mostrados). La colonización del conducto radicular fue confirmada adicionalmente por resultados positivos de qPCR en muestras P1S1/P2S1 de todos los dientes.
Fase 1
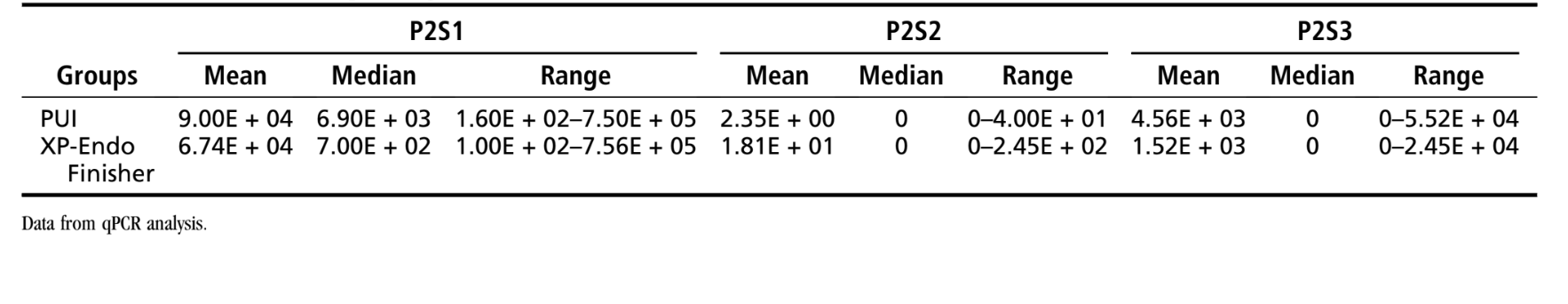
Tabla 1 muestra la media, mediana y rango de los recuentos de E. faecalis observados para los grupos de prueba. En el grupo XP-Endo Finisher, los recuentos de E. faecalis se redujeron sustancialmente de P1S1 a P1S2 (P < .001). Después de usar el instrumento XP-Endo (P1S3), hubo una reducción adicional significativa (P < .05). Todas las 20 muestras fueron positivas para E. faecalis en P1S1, 6 en P1S2 y 6 en P1S3. En el grupo PUI, los recuentos bacterianos iniciales (P1S1) también se redujeron significativamente después de la preparación (P1S2) (P < .001). Aunque los recuentos bacterianos se redujeron aún más en P1S3, no fueron significativamente diferentes de P1S2 (P > .05). Todas las 20 muestras fueron positivas en P1S1, 10 en P1S2 y 7 en P1S3. No se observaron diferencias significativas al comparar P1S3 entre los grupos XP-Endo y PUI (P > .05).

El análisis estadístico de los datos mesiales y distales por separado mostró ausencia de significancia para todas las comparaciones entre P1S2 y P1S3 (P > .05) excepto para los canales mesiales en el grupo XP-Endo Finisher (P < .05). Los datos de las raíces mesiales y distales por separado se muestran en la Tabla Suplementaria S1.
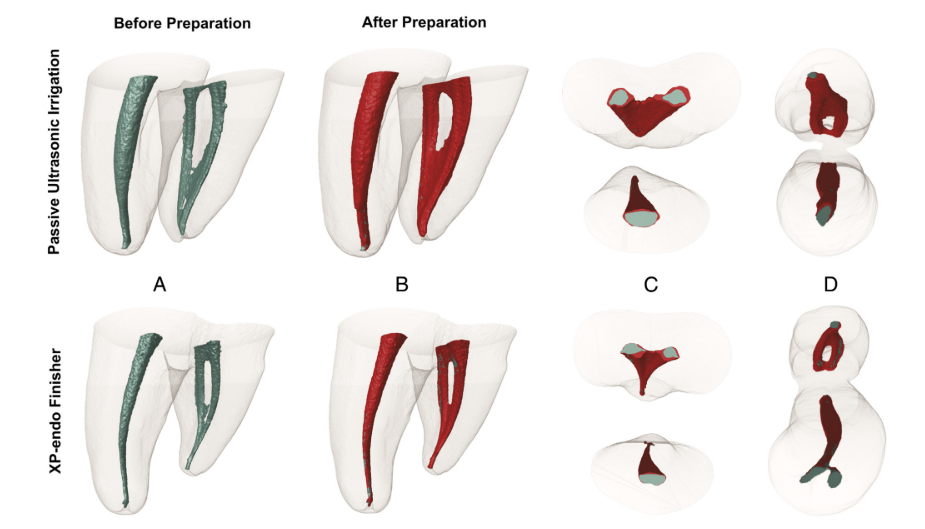
El análisis de Micro-CT no mostró diferencias significativas en los volúmenes iniciales de los canales entre los grupos (P > .05). En cuanto a las áreas no preparadas, se observó un valor porcentual medio de voxeles estáticos del 4.5% (mediana, 4.3%) para el grupo XP-Endo Finisher y 4.3% (mediana, 5.4%) para el grupo PUI (P > .05) (Fig. 2). El análisis correlativo no reveló una relación estadísticamente significativa entre la reducción bacteriana y el porcentaje de áreas no preparadas (P > .05).
Fase 2
Tabla 2 representa los datos cuantitativos de la fase 2. En el grupo XP-Endo Finisher, los recuentos de E. faecalis en P2S1 se redujeron significativamente después de usar este instrumento (P< .001). Todas las 18 muestras fueron positivas para bacterias en P2S1, 2 en P2S2 y 4 en P2S3 (muestras pulverizadas). El procedimiento PUI también fue altamente efectivo en la reducción de los recuentos bacterianos en el canal principal (P< .001). Todas las 18 muestras fueron positivas para bacterias en P2S1, 1 en P2S2 y 6 en P2S3 (muestras pulverizadas). No se observaron diferencias significativas al comparar los efectos de XP-Endo y PUI en P2S2 (canales principales) o P2S3 (isthmi/recesos) (P> .05). El análisis estadístico de los datos mesiales y distales por separado no mostró diferencias significativas entre los grupos tampoco (P> .05) (Tabla Suplementaria S2).
Discusión
Este estudio correlacionó diferentes herramientas analíticas para evaluar, en 2 fases experimentales, los efectos antibacterianos de enfoques adyuvantes en el sistema de conductos radiculares de los molares mandibulares. En la primera fase, se evaluaron los efectos de los 2 procedimientos utilizados inmediatamente después de la preparación quimio-mecánica con instrumentación rotativa de NiTi y riego con NaOCl. Este análisis se restringió a los efectos antibacterianos en el conducto radicular principal según lo determinado por muestreo con puntos de papel. Dado que el 50% (grupo PUI) y el 70% (grupo XP-Endo Finisher) de los casos mostraron resultados negativos para bacterias en P1S2, se redujo el tamaño de la muestra para el análisis intergrupal de P1S3, y se ideó una segunda fase para aumentar el número de conductos sometidos a ambos enfoques e incluir el análisis de sus efectos no solo en los conductos principales, sino también en las áreas de istmo y receso mediante la molienda criogénica de la raíz para la toma de muestras.
En la primera fase, la instrumentación quimio-mecánica con BT RaCe y riego con NaOCl promovió una eliminación bacteriana sustancial en ambos grupos, lo que concuerda con estudios previos. Mientras que el paso adicional del procedimiento con PUI no logró reducir significativamente los recuentos bacterianos, los recuentos intracanal de E. faecalis después de usar XP-Endo Finisher fueron significativamente más bajos que los obtenidos inmediatamente después de la preparación. Los resultados significativamente mejores para XP-Endo ocurrieron en las raíces mesiales. En la segunda fase, las muestras iniciales consistieron en una carga bacteriana inicial más baja para permitir la comparación de ambos enfoques contra números bacterianos compatibles con lo que se espera que enfrenten los procedimientos adyuvantes en la situación clínica. En esta fase, los enfoques PUI y XP-Endo Finisher fueron similares y altamente efectivos en la reducción de los recuentos bacterianos en el conducto principal.
En cuanto a las áreas del istmo/receso, la naturaleza destructiva del enfoque de criopulverización no permitió realizar un análisis longitudinal. Por lo tanto, no es posible inferir si los resultados negativos se debieron a los efectos de los enfoques adyuvantes o a una contaminación bacteriana no exitosa en esas áreas. Sin embargo, no hubo diferencias significativas en los recuentos bacterianos entre los grupos. Los recuentos en el área del istmo (P2S3) fueron efectivamente más altos que en el canal principal (P2S2), lo que sugiere que los efectos de PUI y XP-Endo Finisher en esa región no son predecibles. Esto, junto con los hallazgos de varios dientes con muestras negativas en el canal y positivas en el istmo, resalta la limitación del enfoque de punto de papel en la toma de muestras del sistema de conductos radiculares.
Los resultados generales para el instrumento XP-Endo Finisher fueron alentadores porque generalmente se desempeñó de manera comparable con PUI, un enfoque adyuvante ampliamente recomendado. En un estudio reciente, el instrumento XP-Endo Finisher fue más eficiente que otras técnicas en la desinfección del espacio del canal principal. El diseño y el movimiento helicoidal del instrumento pueden haberle permitido alcanzar áreas previamente no tocadas y desplazar biopelículas bacterianas. El aumento de áreas tocadas no fue evaluado por micro-CT debido a la mínima, si es que hay, capacidad de corte del instrumento XP-Endo Finisher.
Nuestros hallazgos con PUI están de acuerdo con varios estudios que informaron que no hubo una mejora significativa en la desinfección después de la preparación. Se sugiere que los efectos antibacterianos de PUI están relacionados con la cavitación, el flujo acústico y el calentamiento del irrigante, pero si estos fenómenos realmente ocurren en el conducto radicular, no parecen ser suficientes para mejorar significativamente la eliminación de bacterias.
No hubo correlación entre el porcentaje de áreas no preparadas y los niveles bacterianos en P1S3, lo cual está en consonancia con un estudio previo. Existe la posibilidad de que en algunos especímenes las áreas no tocadas del canal principal no hayan sido colonizadas por bacterias. Además, es posible que las áreas no instrumentadas hayan sido efectivamente desinfectadas por irrigación con NaOCl. Las limitaciones del procedimiento de muestreo por puntos también pueden haber contribuido a esta falta de correlación.
El diseño experimental presente tiene algunos aspectos notables. Se utilizaron escaneos de micro-CT para seleccionar y emparejar los dientes de acuerdo con similitudes anatómicas antes de la distribución entre grupos, minimizando las variables inherentes a la anatomía. Además, se utilizaron irrigantes calentados a lo largo de los experimentos. Esto tuvo que hacerse porque el instrumento XP-Endo Finisher sufre una transformación de fase a temperatura corporal. Luego decidimos incluir soluciones calentadas en todas las fases del experimento, que también se realizó dentro de un gabinete con la temperatura mantenida a 37◦C. La mayoría de los estudios previos en dientes extraídos se llevaron a cabo a temperatura ambiente. Dado que la temperatura puede afectar la actividad antibacteriana de NaOCl, se recomienda realizar pruebas antibacterianas a una temperatura similar a la temperatura corporal. Otra ventaja de este estudio fue el uso de qPCR para la cuantificación bacteriana. Este enfoque es muy sensible y podría usarse de manera confiable en muestras criopulverizadas (los estudios piloto que utilizaron cultivo mostraron pérdida de recuentos bacterianos debido al enfoque de molienda). El uso de criopulverización, a su vez, fue esencial para permitir el análisis de los efectos antibacterianos de los enfoques probados en áreas como istmos y recesos, que pueden no ser muestreados adecuadamente por puntos de papel.
Aunque este estudio es innovador al combinar diferentes enfoques analíticos, también tiene limitaciones. La toma de muestras con puntos de papel suele estar restringida al canal principal, y algunas áreas como irregularidades, isthmos y recesos pueden no ser muestreadas. La limitación de la técnica del punto de papel fue evidente en la fase 2, cuando más canales fueron positivos para bacterias en P2S3 que en P2S2; también se mostraron recuentos medios más altos para P2S3. Además, dado que el muestreo con puntos de papel no distingue el segmento del canal principal, sigue siendo desconocido en qué parte permanecieron las bacterias. La criopulverización puede eludir estas limitaciones, pero es un método destructivo y solo puede ser utilizado para análisis transversales. Otra limitación puede referirse al uso de qPCR para la detección bacteriana. Existe la preocupación de que el ADN de células que recientemente murieron como consecuencia del tratamiento antibacteriano también pueda ser detectado por este método. Sin embargo, un estudio previo que utilizó un protocolo in vitro similar no mostró diferencias significativas en los recuentos bacterianos entre cultivo y qPCR en muestras post-tratamiento. Esto, junto con la alta ocurrencia de resultados negativos de qPCR en muestras post-tratamiento, sugiere fuertemente que el ADN de células muertas puede no haber sido un problema significativo en el presente estudio. El ADN libre puede ser degradado por NaOCl o puede haber sido lavado durante la irrigación.
En conclusión, este estudio demostró que ambos enfoques adyuvantes causaron una pequeña reducción en los recuentos bacterianos después de la preparación quimio-mecánica, que fue significativa solo para XP-Endo Finisher. Ni XP-Endo ni PUI fueron efectivos en desinfectar de manera predecible las áreas de istmo/receso de los molares mandibulares.
Autores: Flavio R.F. Alves, Carlos V. Andrade-Junior, Marílía F. Marceliano-Alves, Alejandro R. Pérez, Isabela N. Rôças, Marco A. Versiani, Manoel D. Sousa-Neto, José C. Provenzano, José F. Siqueira
Referencias:
- Siqueira JF Jr, Araujo MC, Garcia PF, et al. Evaluación histológica de la efectividad de cinco técnicas de instrumentación para limpiar el tercio apical de los conductos radiculares. J Endod 1997;23:499–502.
- Peters OA, Schönenberger K, Laib A. Efectos de cuatro técnicas de preparación de Ni-Ti en la geometría del conducto radicular evaluados por microtomografía computarizada. Int Endod J 2001;34: 221–30.
- Vera J, Siqueira JF Jr, Ricucci D, et al. Tratamiento endodóntico en una o dos visitas de dientes con periodontitis apical: un estudio histobacteriológico. J Endod 2012;38: 1040–52.
- Paqué F, Zehnder M, De-Deus G. Comparación basada en microtomografía de la técnica de archivo único reciprocante F2 ProTaper versus secuencia rotativa completa. J Endod 2011; 37:1394–7.
- Markvart M, Darvann TA, Larsen P, et al. Análisis de micro-CT de la ampliación apical y la complejidad del conducto radicular de molares. Int Endod J 2012;45:273–81.
- Siqueira JF Jr, Alves FR, Versiani MA, et al. Análisis bacteriológico y micro-tomográfico correlativo de los canales mesiales de molares mandibulares preparados por archivo autoajustable, Reciproc y sistemas de archivo torcido. J Endod 2013;39:1044–50.
- Peters OA, Arias A, Paque F. Evaluación micro-tomográfica de la preparación del conducto radicular con un nuevo instrumento, TRUShape, en raíces mesiales de molares mandibulares. J Endod 2015;41:1545–50.
- Ricucci D, Siqueira JF Jr. Biofilms y periodontitis apical: estudio de prevalencia y asociación con hallazgos clínicos e histopatológicos. J Endod 2010;36:1277–88.
- Ricucci D, Siqueira JF Jr, Bate AL, Pitt Ford TR. Investigación histológica de dientes tratados con conducto radicular con periodontitis apical: un estudio retrospectivo de veinticuatro pacientes. J Endod 2009;35:493–502.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Suplementando los efectos antimicrobianos del desbridamiento quimio-mecánico con irrigación ultrasónica pasiva o un enjuague final con clorhexidina: un estudio clínico. J Endod 2012;38:1202–6.
- Byström A. Evaluación del tratamiento endodóntico de dientes con periodontitis apical [disertación odontológica no. 27]. Umea, Suecia: Universidad de Umea; 1986.
- Vianna ME, Horz HP, Gomes BP, Conrads G. Evaluación in vivo de la reducción microbiana después de la preparación quimio-mecánica de conductos radiculares humanos que contienen tejido pulpar necrótico. Int Endod J 2006;39:484–92.
- Sjögren U. Éxito y fracaso en endodoncia [disertación odontológica no. 60]. Umea, Suecia: Universidad de Umea; 1996.
- Neves MA, Provenzano JC, Rôças IN, Siqueira JF Jr. Efectividad antibacteriana clínica de la preparación del conducto radicular con sistemas de instrumento único reciprocante o de múltiples instrumentos rotativos continuos. J Endod 2016;42:25–9.
- Siqueira JF Jr, Rôças IN. Implicaciones clínicas y microbiología de la persistencia bacteriana después de los procedimientos de tratamiento. J Endod 2008;34:1291–13013.
- Siqueira JF Jr, Rôças IN. Optimización de la desinfección en una sola visita con enfoques suplementarios: una búsqueda de predictibilidad. Aust Endod J 2011;37:92–8.
- Alves FR, Almeida BM, Neves MA, et al. Desinfección de conductos radiculares en forma ovalada: efectividad de diferentes enfoques suplementarios. J Endod 2011;37:496–501.
- Tardivo D, Pommel L, La Scola B, et al. Eficiencia antibacteriana de la irrigación ultrasónica pasiva versus la irrigación sónica: irrigación ultrasónica del conducto radicular. Odontostomatol Trop 2010;33:29–35.
- Carver K, Nusstein J, Reader A, Beck M. Eficacia antibacteriana in vivo de los ultrasonidos después de la instrumentación manual y rotativa en molares mandibulares humanos. J Endod 2007; 33:1038–43.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Evaluación microbiológica molecular de la activación ultrasónica pasiva como un paso suplementario de desinfección: un estudio clínico. J Endod 2013;39:190–4.
- Debelian G, Trope M. Limpiando la tercera dimensión. Práctica Endodóntica 2015;8: 22–4.
- Leoni GB, Versiani MA, Silva-Sousa YT, et al. Evaluación ex vivo de cuatro protocolos de irrigación final sobre la eliminación de desechos de tejido duro del sistema de conductos radiculares mesiales de molares mandibulares. Int Endod J 2016 Mar 18. http://dx.doi.org/ 10.1111/iej.12630. [Epub ahead of print].
- Azim AA, Aksel H, Zhuang T, et al. Eficacia de 4 protocolos de irrigación en la eliminación de bacterias colonizadas en los túbulos dentinarios examinados mediante un análisis de un nuevo microscopio de escaneo láser confocal. J Endod 2016;42:928–34.
- Siqueira JF Jr, Alves FR, Almeida BM, et al. Capacidad de la preparación quimio-mecánica con instrumentos rotativos o archivo autoajustable para desinfectar conductos radiculares en forma ovalada. J Endod 2010;36:1860–5.
- Alves FR, Siqueira JF Jr, Carmo FL, et al. Perfil de la comunidad bacteriana de muestras molidas criogénicamente de los segmentos radiculares apical y coronal de dientes con periodontitis apical. J Endod 2009;35:486–92.
- Antunes HS, Rôças IN, Alves FR, Siqueira JF Jr. Niveles bacterianos totales y específicos en el sistema de conducto radicular apical de dientes con periodontitis apical post-tratamiento. J Endod 2015;41:1037–42.
- Alves FR, Rôças IN, Almeida BM, et al. Análisis cuantitativo molecular y de cultivo de la eliminación bacteriana en conductos radiculares en forma ovalada mediante una técnica de instrumentación de archivo único. Int Endod J 2012;45:871–7.
- van der Sluis LW, Versluis M, Wu MK, Wesselink PR. Irrigación ultrasónica pasiva del conducto radicular: una revisión de la literatura. Int Endod J 2007;40:415–26.
- Martin H. Desinfección ultrasónica del conducto radicular. Oral Surg Oral Med Oral Pathol 1976;42:92–9.
- Ahmad M, Pitt Ford TR, Crum LA. Desbridamiento ultrasónico de conductos radiculares: una visión de los mecanismos involucrados. J Endod 1987;13:93–101.
- Sirtes G, Waltimo T, Schaetzle M, Zehnder M. Los efectos de la temperatura en la estabilidad a corto plazo del hipoclorito de sodio, la capacidad de disolución de la pulpa y la eficacia antimicrobiana. J Endod 2005;31:669–71.
- Siqueira JF Jr, Rôças IN. Explotando métodos moleculares para explorar infecciones endodónticas: parte 1—tecnologías moleculares actuales para el diagnóstico microbiológico. J Endod 2005;31:411–23.
- McCarty SC, Atlas RM. Efecto del tamaño del amplicón en la detección de PCR de bacterias expuestas al cloro. PCR Methods Appl 1993;3:181–5.
- Fouad AF, Barry J. El efecto de los antibióticos y antimicrobianos endodónticos en la reacción en cadena de la polimerasa. J Endod 2005;31:510–3.

/public-service/media/default/155/6W28P_653119ffc3e1d.jpg)
/public-service/media/default/462/VWSPu_671a20d937860.png)
/public-service/media/default/153/0sjeR_653119d5e19e4.jpg)